VEGF165在恒河猴骨髓间充质干细胞中的表达及鉴定
2016-11-12郭再玉张合亮水涛张国哲赵卫华陈谦侯延伟
郭再玉,张合亮,水涛,张国哲,赵卫华,陈谦,侯延伟
VEGF165在恒河猴骨髓间充质干细胞中的表达及鉴定
郭再玉,张合亮,水涛,张国哲,赵卫华,陈谦,侯延伟
目的探讨血管内皮生长因子(VEGF165)转染恒河猴间充质干细胞(MSCs)后的表达情况,以及转染后对MSCs功能的影响。方法通过Ficoll法分离并培养恒河猴骨髓MSCs,进行细胞表型鉴定。转染pcDNA-eGFPVEGF165至MSCs,荧光显微镜观察增强型绿色荧光蛋白(eGFP)表达情况,同时流式细胞技术对转染成功的细胞进行细胞表型及eGFP表达鉴定,RT-PCR法检测转染后VEGF165表达情况。结果成功分离到纯度较高的MSCs,转染后的MSCs及子代细胞均有eGFP和VEGF165的表达,且保留了MSCs的特性。结论VEGF165基因转染MSCs后可以稳定表达外源基因,且可以维持MSCs的特性。
间质干细胞;血管内皮生长因子;恒河猴;转基因;间质干细胞移植;绿色荧光蛋白质类
间充质干细胞(mesenchymal stem cells,MSCs)是源于中胚层的干细胞,不仅有保持自我更新的能力,而且还具有多向分化潜能。MSCs主要存在于骨髓、脐带、胎盘或者脂肪细胞,其中骨髓间充质干细胞(BMSCs)含量最为丰富[1]。烟雾病(moyamoya disease,MMD)是一种慢性脑血管闭塞性疾病,于1957年首次报道[2],可导致脑缺血或脑梗死,且儿童发病率高于成人[3]。血管内皮生长因子(VEGF)是机体生理活动的关键调节器,主要影响骨骼生长和生殖功能。有研究将VEGF基因转染到神经干细胞中,可减少缺血所导致的内皮细胞凋亡,并促进新生血管的形成,降低缺血早期的血管和神经结构损害[4]。目前研究已发现移植MSCs可保护脑卒中模型大鼠的神经系统[5]。因此,本研究拟通过观察转染VEGF165对恒河猴BMSCs的影响,为后续转基因技术治疗MMD提供思路。
1 材料与方法
1.1 材料
1.1.1 实验动物普通级健康雄性恒河猴3只,3岁龄,体质量3~4 kg,购自成都平安动物繁育中心。
1.1.2 试剂和仪器MSCs培养基购自Osiris Therapeutics公司。DMEM培养基、山羊血清(NGS)、0.25%胰酶、双抗、表皮细胞生长因子(EGF)、TRIzol、lipofectamine 2000、反转录试剂盒购自Life Technologies公司。胎牛血清(FBS)购自Hyclone公司。APC标记抗人CD29,FITC标记的抗人CD34,PE标记的抗人CD45均购自美国BD Biosciences Pharmingen公司,已验证可与恒河猴存在交叉反应。细胞密度梯度分离液(Ficoll)购自Sigma公司。pcDNA-eGFP-VEGF165载体购自天津天思特生物科技有限公司。超微量分光光度计(NanoDrop2000C型)、PCR仪(AppliedBiosystems®GeneAmp®9700型)购自赛默飞世尔公司,Ti-U倒置荧光显微镜购自尼康公司。
1.1.3 引物设计从GenBank获取VEGF的基因序列,根据其编码区的碱基序列,设计引物。β-actin为管家基因,所有引物由华大基因公司合成,各引物序列见表1。

Tab.1Primer sequence of genes that were amplified by RT-PCR表1 RT-PCR检测的基因引物序列
1.2 方法
1.2.1 MSCs的分离用3%的戊巴比妥钠以25 mg/kg静脉给药和1%的异氟烷气体全身麻醉动物[6]。备皮后用骨穿针行髂后上棘髂骨穿刺,穿刺成功后,用20 mL注射器抽取5~10 mL骨髓,迅速转移到含有5 U肝素的无菌离心管内混匀[7]。对抽取的骨髓先用1倍体积的PBS重悬,然后加入1倍体积的Ficoll(1.077 g/mL)进行密度梯度离心,用含10% FBS的DMEM低糖培养基悬浮骨髓单个核细胞,调整密度至1×106/mL,按每瓶5 mL接种于75 cm2培养瓶中,37℃、5% CO2条件下培养[8]。48 h后半量换液,观察细胞贴壁情况并隔天全量换液。待细胞融合度达到70%后,用含EDTA的0.25%胰酶消化传代,逐日观察细胞生长情况和形态特征。
1.2.2 MSCs的细胞表型鉴定收集第4代MSCs,1 mL PBS重悬浮细胞,1 000 r/min离心5 min,PBS洗涤3次,最后用100 μL PBS重悬细胞。分别加入10 μL荧光标记的CD29、CD34和CD45抗体,室温避光孵育30 min。加PBS至1 mL,1 000 r/min离心5 min,以同型抗体作为阴性对照,使用流式细胞仪检测细胞表面抗原类型。
1.2.3 VEGF165的转染及鉴定将分离的MSCs进行计数,取4×105个细胞接种于6孔培养板。细胞融合度达到60%时,按照说明书将4 μg的pcDNA-eGFP-VEGF165与10 μL lipofectamine 2000混匀,室温孵育25 min,加入6孔板的细胞中,37℃孵育6 h后换液,荧光显微镜下观察增强型绿色荧光蛋白(eGFP)的表达。为了获得稳定表达的细胞,利用lipofectamine 2000再次转染。将转染后细胞传代培养,经过3次细胞培养传代后,通过流式鉴定获取eGFP表达阳性细胞,将其命名为VM-MSCs。
1.2.4 VM-MSCs细胞表型鉴定取对数生长期的P5代VM-MSCs,0.25%胰酶消化后,按照1.2.2的方法进行细胞表型鉴定。
1.2.5 RT-PCR检测VM-MSCs中VEGF165的表达分别取未转染的细胞、转染后的VM-MSCs P1代细胞及P5代细胞,TRIzol法提取总RNA并测定RNA浓度和纯度。逆转录为cDNA后进行PCR反应。反应体系20 μL:10 μL的2×PCR master mix,上、下游引物各1 μL,cDNA 1 μL,无菌水7 μL,反应条件:95℃5 min;95℃30 s,60℃30 s,72℃30 s,35个循环;72℃7 min。PCR扩增产物用1.5%琼脂糖凝胶电泳,全自动凝胶成像系统观察结果。
2 结果
2.1 MSCs的培养镜下观察结果显示,分离的MSCs接种后6 h逐渐贴壁,呈圆形的小亮点,为骨髓单核细胞。约24 h后细胞完成贴壁,细胞出现突起;48 h后,细胞数目增多,排列成集落,见图1。1周后细胞呈细长梭形,可进行传代。
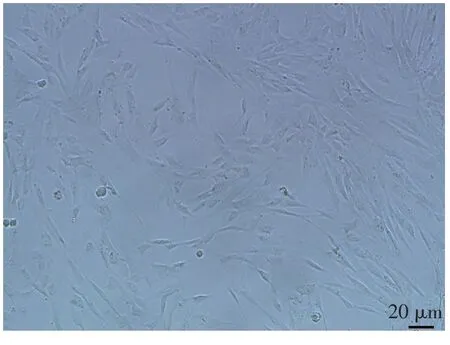
Fig.1Primary culture of MSCs(×100)图1 原代培养的MSCs(×100)
2.2 MSCs的表面抗原鉴定流式结果显示,分离的MSCs CD29表达阳性,CD34和CD45表达阴性,其中CD29+为99.7%,CD34-为99.5%,CD45-为99.7%,与MSCs的特征相一致[9],同时结合细胞形态可确定所分离细胞为MSCs,且纯度较高,见图2。

Fig.2Results of MSCs detected by flow cytometry图2 MSCs表面抗原流式鉴定结果
2.3 VEGF165的表达鉴定pcDNA-eGFP-VEGF165转染后24 h,可观察到eGFP的表达。经过再次转染、传代培养后,VM-MSCs中可观察到eGFP的表达,见图3。因为表达载体中VEGF与eGFP是融合表达,所以VM-MSCs可稳定表达外源基因VEGF。同时流式结果显示,VM-MSCs中既表达eGFP,同时又保留了MSCs的细胞特征,见图4。
2.4 RT-PCR结果与未转染的MSCs细胞相比,VEGF165在P1代及P5代的VM-MSCs中稳定表达,见图5。
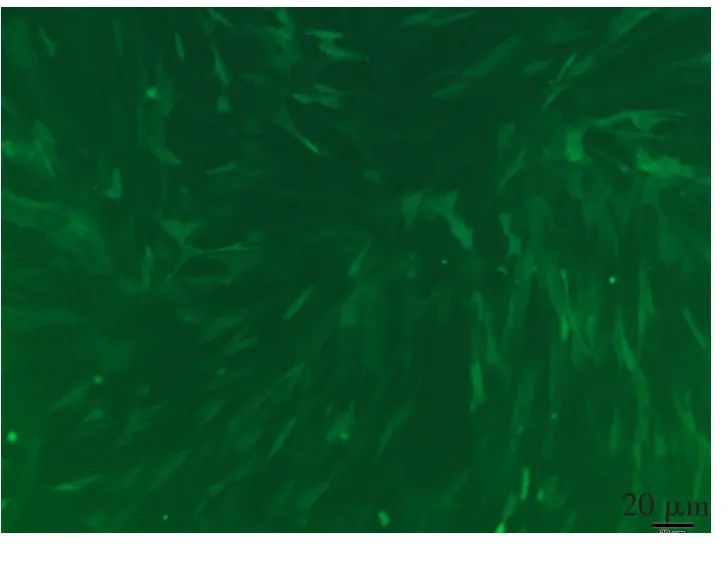
Fig.3The expression of eGFP in the transfected MSCs图3 eGFP在转染后的MSCs中的表达
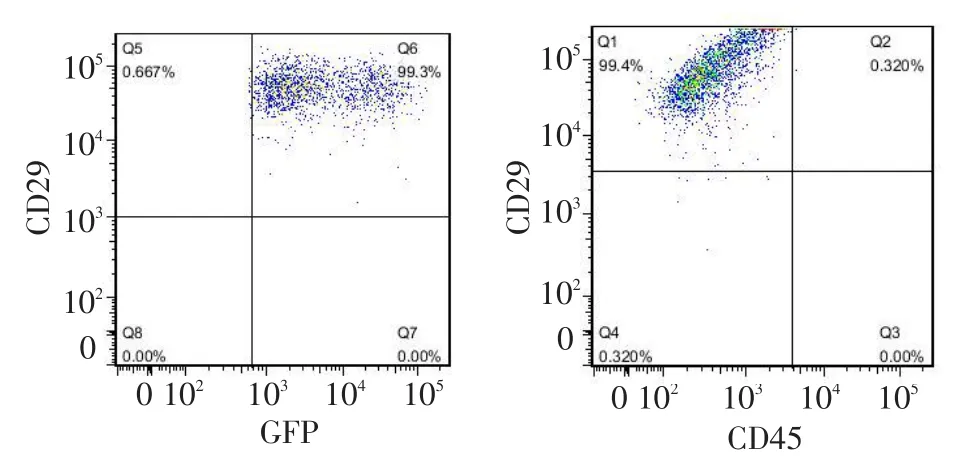
Fig.4Rh MSCs cells that were over-expressed VEGF165detected by flow cytometry图4 过表达VEGF165基因的Rh MSCs细胞表型流式检测结果

Fig.5The transfected VEGF165expressions in different stages图5 转染后不同时段VEGF165的表达
3 讨论
骨髓来源的MSCs有强大的自我更新和增殖能力,可诱导分化成软移植骨细胞、神经元及星形胶质细胞等[10]。既往研究显示,从大龄恒河猴分离出的MSCs增殖速度较缓慢,倍增时间为5~7 d,增殖能力不强[11]。为了获得增殖能力较强的MSCs,在本实验中选用3岁龄恒河猴。MSCs的表面标记分子主要是CD19、CD29、CD34、CD44、CD90和CD105[12]。结合以往研究[13],本实验中选了CD29、CD34和CD45这3个标记分子进行检测,结果证实所分离的细胞为MSCs。
VEGF是由两个相同分子量亚基以二硫键结合形成的二羟聚体。由于VEGF mRNA在外显子6和外显子7的剪接方式不同,可得到VEGF121、VEGF121b、VEGF145、VEGF165、VEGF165b、VEGF189、VEGF2067种同种异构体,且各异构体具有相同的生物学特性[14]。目前研究比较成熟的是VEGF165。VEGF165是一种分泌型可溶性蛋白,可与游离的肝素和类肝素蛋白多糖结合,能直接作用于血管内皮细胞,促进血管内皮细胞增殖,增加血管通透性[15]。已有研究证明在脑缺血早期使用VEGF,能有效改善缺血区的血液供应状况,减少神经组织的破坏[16]。同时VEGF能促进血管生长,抗内皮细胞凋亡,这对诱导间质细胞维持神经干细胞的特性,促使其发挥生物潜能,具有积极意义[14]。
本研究结果显示,共转染后的MSCs能高效地表达eGFP。RT-PCR结果表明VEGF成功转入MSCs内,并能持续表达,且VEGF与eGFP共转染对eGFP的表达没有影响,对MSCs的生长和诱导分化也无明显影响。虽然脂质体介导法转染的基因多数为瞬时表达,转染效率不及病毒介导法,但其具有安全性好、细胞毒性小、不存在免疫源性、操作相对简便的优点。脑缺血后内皮细胞表面VEGF受体的表达高峰局限于缺血早期的1~2周内,瞬时表达的VEGF只可以暂时达到治疗目的。为了保证稳定治疗,本实验利用脂质体介导法转染MSCs后筛选的稳定表达的细胞作为后期研究的细胞源。如果移植永久表达VEGF的细胞,则脑缺血后期VEGF能否起到基因治疗的目的尚存疑问。因为VEGF可增加血管通透性,可能会促进脑水肿的进展。最为理想的方法是在过表达载体的启动子选择中使用与MMD进程正相关的基因的启动子,可以调控VEGF的表达与MMD进展一致,但该方法需进一步的实验验证。本研究成功获得了稳定表达VEGF的MSCs,运用骨髓基质细胞作为载体,为进行转基因移植治疗提供了可能。
[1]Gutierrez-Fernandez M,Rodriguez-Frutos B,Ramos-Cejudo J,etal.Effects of intravenous administration of allogenic bone marrowand adipose tissue-derived mesenchymal stem cells on functional recovery and brain repair markers in experimental ischemic stroke[J].Stem Cell Res Ther,2013,4(1):11.doi:10.1186/scrt159.
[2]Kono S,Oka K,Sueishi K.Histopathologic and morphometric studies of leptomeningeal vessels in moyamoya disease[J].Stroke,1990,21(7):1044-1050.
[3]Chen X,Li Y,Wang L,et al.Ischemic rat brain extracts induce humanmarrowstromalcellgrowthfactorproduction[J]. Neuropathology,2002,22(4):275-279.
[4]Lai T,Li M,Zheng L,et al.Over-expression of VEGF in marrow stromal cells promotes angiogenesis in rats with cerebral infarction via the synergistic effects of VEGF and Ang-2[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(5):724-731.doi:10.1007/ s11596-012-1025-3.
[5]Oh SH,Choi C,Chang DJ,et al.Early neuroprotective effect with lack of long-term cell replacement effect on experimental stroke after intra-arterial transplantation of adipose-derived mesenchymal stromal cells[J].Cytotherapy,2015,17(8):1090-1103.doi: 10.1016/j.jcyt.2015.04.007.
[6]Babenko VA,Silachev DN,Zorova LD,et al.Improving the poststroke therapeutic potency of mesenchymal multipotent stromal cells by cocultivation with cortical neurons:the role of crosstalk between cells[J].Stem Cells Transl Med,2015,4(9):1011-1020. doi:10.5966/sctm.2015-0010.
[7]Gao K,Lu YR,Li SF,et al.Isolation,culturing and growth characteristics of mesenchymal stem cells from bone marrow of rhesus monkey,macaca mulatta[J].J Biomed Eng,2007,24(6)∶1343-1347.[高昆,陆燕蓉,李胜富,等.恒河猴骨髓间充质干细胞分离培养及其生长特性[J].生物医学工程学杂志,2007,24(6):1343-1347].
[8]Li N,Wang P,Ma XL,et al.Effect of bone marrow stromal cell transplantation on neurologic function and expression of VEGF in rats with focal cerebral ischemia[J].Mol Med Rep,2014,10(5): 2299-2305.doi:10.3892/mmr.2014.2502.
[9]AhnSY,ChangYS,ParkWS.Mesenchymalstemcells transplantation for neuroprotection in preterm infants with severe intraventricular hemorrhage[J].Korean J Pediatr,2014,57(6): 251-256.doi:10.3345/kjp.2014.57.6.251.
[10]Jiang WH,Ma AQ.Stem cell cycle and its potential application[J]. Natl Med J China,2003,83(21):1923-1925.[蒋文慧,马爱群.干细胞循环及其潜在应用前景[J].中华医学杂志,2003,83(21):1923-1925].doi:10.3760/j:issn:0376-2491.2003.21.025.
[11]Tanna T,Sachan V.Mesenchymal stem cells:potential in treatment of neurodegenerative diseases[J].Curr Stem Cell Res Ther,2014,9(6):513-521.
[12]Ge J,Guo L,Wang S,et al.The size of mesenchymal stem cells is a significant cause of vascular obstructions and stroke[J].Stem Cell Rev,2014,10(2):295-303.doi:10.1007/s12015-013-9492-x.
[13]Boltze J,Lukomska B,Jolkkonen J.Mesenchymal stromal cells in stroke:improvement of motor recovery or functional compensation?[J].J Cereb Blood Flow Metab,2014,34(8):1420-1421.doi: 10.1038/jcbfm.2014.94.
[14]Miki Y,Nonoguchi N,Ikeda N,et al.Vascular endothelial growth factor gene-transferred bone marrow stromal cells engineered with a herpes simplex virus type 1 vector can improve neurological deficits and reduce infarction volume in rat brain ischemia[J]. Neurosurgery,2007,61(3):586-594:discussion 594-585.doi: 10.1227/01.neu.0000290907.30814.42.
[15]Tang H,Xiang Y,Jiang X,et al.Dual expression of hTERT and VEGF prolongs life span and enhances angiogenic ability of aged BMSCs[J].Biochem Biophys Res Commun,2013,440(4):502-508.doi:10.1016/j.bbrc.2013.09.053.
[16]Zhu W,Mao Y,Zhou LF,et al.Repair of cerebral ischemic injury in rats by transplantation of vascular endothelial growth factor gene neural stem cells[J].Chin J Organ Transplant,2006,27(5):305-308.[朱巍,毛颖,周良辅,等.转染血管内皮生长因子基因神经干细胞移植对大鼠脑缺血损伤的修复作用[J].中华器官移植杂志,2006,27(5):305-308].doi:10.3760/cma.j.issn.0254-1785.2006.05.016.
(2016-05-20收稿2016-08-30修回)
(本文编辑胡小宁)
Expression and identification of VEGF165in bone marrow mesenchymal stem cells of rhesus
GUO Zaiyu,ZHANG Heliang,SHUI Tao,ZHANG Guozhe,ZHAO Weihua,CHEN Qian,HOU Yanwei
Department of Neurosurgery,Teda Hospital of Tianjin,Tianjin 300456,China
ObjectiveTo detect the transferred vascular endothelial growth factor(VEGF)165gene expression in rhesus autologous bone marrow mesenchymal stem cells(MSCs),and to explore the functional viability of transgenic MSCs. MethodsMSCs from rhesus bone were isolated by Ficoll,which were used to detect the phenotype.After the culturing,the expression vector pcDNA-eGFP-VEGF165was transfected into bone marrow MSCs.Fluorescence microscope and flow cytometry were used to detect the enhanced green fluorescent protein(eGFP)expression.At the same time,the phenotype in transfected MSCs was also indentified.The VEGF165expression level was detected by RT-PCR.ResultsThe highly purified MSCs were collected successfully.The transfected MSCs and daughter cells showed expressions of eGFP and VEGF165,which also remained the characteristics of MSCs.ConclusionThe VEGF165gene that is transfected into MSCs can maintain characteristics of MSCs,and stably express foreign genes.
mesenchymal stem cells;vascular endothelial growth factor;macaca mulatta;transgenes;mesenchymal stem cell transplantation;green fluorescent proteins
R743.3
A
10.11958/20160444
滨海新区卫生局科技项目(2011BHKZ007)
天津市泰达医院神经外科(邮编300456)
郭再玉(1969),男,副主任医师,博士(后),主要从事神经外科研究
