针对人DNAH2蛋白的鼠源单克隆抗体的制备
2016-11-12常丽贤章婧嫽任媛媛孙聪聪万扬安文彬张英驰袁卫平竺晓凡
常丽贤,章婧嫽,任媛媛,孙聪聪,万扬,安文彬,张英驰,袁卫平,竺晓凡
针对人DNAH2蛋白的鼠源单克隆抗体的制备
常丽贤,章婧嫽,任媛媛,孙聪聪,万扬,安文彬,张英驰,袁卫平,竺晓凡△
目的制备特异性的鼠源单克隆抗DNAH2(Homo sapiens dynein,axonemal,heavy chain 2)抗体。方法首先针对人DNAH2蛋白N端1~300 aa序列,构建可表达His标签的免疫原融合表达质粒,在大肠杆菌内以IPTG诱导His-免疫原的表达并纯化;然后免疫BALB/c小鼠,分离出脾淋巴细胞,并与骨髓瘤细胞融合,形成杂交瘤细胞;最后以酶联免疫吸附测定(ELISA)、蛋白免疫印迹法(Western blot)筛选阳性杂交瘤细胞。结果利用IPTG有效诱导了大肠杆菌内DNAH2免疫原的表达;筛选的阳性杂交瘤细胞检测出DNAH2蛋白条带。结论成功制备针对人DNAH2蛋白的鼠源单克隆抗体。
抗体,单克隆;杂交瘤;质粒;重组,遗传;DNAH2
DNAH2(Homo sapiens dynein,axonemal,heavy chain 2)蛋白是由定位于17p13.1的DNAH2基因编码的蛋白质,包括4 427个氨基酸,分子质量约为500 ku,是组成内侧动力臂的主要成分,可通过三磷酸腺苷(ATP)水解酶的作用参与细胞纤毛的运动[1-3]。然而,学者们对于DNAH2基因的研究非常有限,目前尚无针对DNAH2蛋白的单克隆抗体。本研究旨在通过单克隆技术制备抗人DNAH2蛋白的鼠源单克隆抗体,为DNAH2蛋白的功能研究提供蛋白工具。
1 材料与方法
1.1 材料
1.1.1 细胞及实验动物U2OS细胞、骨髓瘤细胞(SP2/0)为本实验室冻存;SPF级近交系BALB/c小鼠,雌性,4~6周龄,体质量12~16 g,购自天津科仪嘉欣科技有限公司,饲养于实验室SPF环境中。
1.1.2 试剂与仪器PEG4000购自德国MERCK公司;HAT培养基添加剂、RPMI 1640、胎牛血清(FBS)购自GIBCO公司;BCA蛋白测定试剂盒购自Pierce公司;血蓝蛋白(KHL)、弗氏(不)完全佐剂、单克隆鼠源抗β-actin一抗购自Sigma公司;鼠源抗His抗体购自MBL公司;辣根过氧化物酶标记的抗鼠源IgG二抗购自KPL公司;酶联免疫吸附测定(ELISA)试剂盒购自Invitrogen公司;BeyoECL Plus(超敏ECL化学发光试剂盒)购自碧云天公司;牛血清白蛋白(BSA)、异丙基-β-D-硫代半乳糖苷(IPTG)、考马斯亮兰染色液、SDS上样缓冲液购自天津科仪嘉欣科技有限公司;AKTA蛋白纯化系统购自GE公司。
1.2 方法
1.2.1 免疫原的获取利用MBL抗原检索系统对人源DNAH2的功能区域进行二级结构预测,分析其抗原性,确定多肽候选氨基酸序列,再由北京博尔迈生物技术有限公司针对此序列通过基因工程方式将其连接入带有His标签的原核表达质粒pET-28a(+)。在大肠杆菌内通过IPTG诱导His-免疫原的表达,然后进行考马斯亮兰染色和蛋白免疫印迹法(Western blot)检测。以LB培养基摇菌扩增有His标签的免疫原融合表达质粒(37℃,100 r/min过夜培养);加入IPTG(24 g/L)诱导蛋白表达,28℃,120 r/min继续培养2 h;4℃、15 000 r/min,离心5 min;同时以IPTG诱导表达的阴性对照组,再分别以细菌裂解缓冲液(1×PBS、2%TritonX-100)重悬菌体沉淀;超声裂解细菌2次后4℃静置10 min,13 000 r/min离心10 min,转移上清至1.5 mL离心管中。分别获取IPTG(-)未诱导组全液、IPTG(+)诱导组全液、IPTG(+)诱导组上清、IPTG(+)诱导组沉淀样品,加入SDS上样缓冲液,99℃热变性10min,分别进行考马斯亮兰染色和6%SDS-PAGE电泳。同时取0.5 μg、1.0 μg、2.0 μg的BSA样品作为考马斯亮兰染色后条带纯度及位置的阳性参考。SDS-PAGE电泳结束后,以湿转法将凝胶上蛋白转移至PVDF膜,用含5%脱脂奶粉的TBST溶液室温封闭2 h,加入鼠源抗His标签抗体(1∶1 000),4℃孵育过夜。TBST溶液洗膜3次,10 min/次,加入辣根过氧化物酶标记的抗鼠源IgG二抗(1∶15 000)室温孵育1 h。TBST溶液洗膜后加入BeyoECL Plus(超敏ECL化学发光试剂盒)后暗室曝光。检测合格后,利用上述方法大量诱导携带His标签的免疫原,再通过His标签,利用Ni Sepharose™6 Fast Flow-AKTA蛋白纯化系统进行免疫原的纯化。纯化后以考马斯亮兰染色进行鉴定。
1.2.2 动物免疫将200 μg免疫原与弗氏完全佐剂混合,对BALB/c小鼠进行腹腔注射,每只小鼠免疫量为50 μg。初次免疫后,将200 μg免疫原与弗氏不完全佐剂混合,进行2~3次免疫。
1.2.3 细胞融合首先从免疫后BALB/c雌性小鼠的脾脏组织中分离脾淋巴细胞,同时以10%FBS-RPMI培养基培养骨髓瘤细胞(SP2/0);然后将骨髓瘤细胞与脾淋巴细胞按2∶1~10∶1的比例混合后离心,加入等量50%PEG,进行3次细胞融合,以形成多个杂交瘤,以10%FBS-RPMI培养基培养细胞,并进行编号,再分离收集上清液为“单克隆前抗体液”,以ELISA进行效价检测。酶标板每孔加入50 μL以PBS稀释的免疫原(1 mg/L),4℃静置包被过夜;弃去各孔液体后加入封闭液处理1 h;甩干后加入不同稀释比例的多克隆抗体液,37℃孵育1 h;洗涤后加入POD标记的抗小鼠源IgG二抗,37℃孵育1 h;洗涤后TMB显色,反应终止,检测光密度(OD)值。当OD>0.2时进一步行Western blot检测,其中所采用的样品为U2OS全细胞裂解液。在500 ku附近出现条带视为阳性杂交瘤细胞。
1.2.4 单克隆杂交瘤细胞的筛选在96孔板中以含15% FBS的HAT培养基培养上述经过ELISA、Western blot初步鉴定的阳性杂交瘤细胞,采用有限稀释法稀释细胞,再采用半量换液法,每隔3 d更换HAT培养基1次,第10天吸取少量上清液为“单克隆抗体液”,再依次以ELISA、Western blot进行筛选。2周后更换培养基为HT培养基。将阳性孔细胞陆续转移至24孔、12孔、6孔板中扩大培养。陆续收集上清,再以Western blot进行效价鉴定。合格者即为制备的单克隆鼠源抗DNAH2抗体。
2 结果
2.1 DNAH2免疫原位点的分析通过MBL抗原检索系统对人源DNAH2的功能区域进行二级结构预测,分析其抗原性。从溶解度(accessibility)、柔韧性(flexibility)、露在分子表面的难易度(surface probability)、抗原性(antigenecity)、亲水性(hydrophilicity)、极性(dipole)等因素发现人DNAH2蛋白(NP_065928.2)N端1~300 aa序列的综合抗原性分数(total antigenic score)较高,露在分子表面的概率较大。另外,此段序列为人DNAH2蛋白1~3亚型的共有片段,与小鼠DNAH2相比差异很大、特异性较高,故选择人DNAH2蛋白N端1~300 aa序列来表达重组蛋白抗原,作为免疫BALB/c小鼠的免疫原,见图1。
2.2 DNAH2免疫原的鉴定针对人DNAH2蛋白N端1~300 aa序列,构建可表达His标签的免疫原融合表达质粒,然后在大肠杆菌内通过IPTG诱导His-免疫原的表达,以考马斯亮兰染色和Western blot实验进行纯化前的初步鉴定。在分子质量37 ku附近有重组蛋白目的条带出现,而在IPTG(+)诱导组沉淀中目的蛋白表达量最多,故对沉淀部分进行纯化获取目的蛋白,见图2。经过纯化处理后,再次进行考马斯亮兰染色鉴定。在分子质量约37 ku附近检测到目的蛋白条带,且纯度较高。纯化获取的重组蛋白总量为3 mg,见图3。
2.3 单克隆抗DNAH2抗体的Western blot分析以纯化后的免疫原免疫BALB/c小鼠后,从脾脏中分离脾淋巴细胞,并与骨髓瘤细胞融合,形成杂交瘤细胞;挑选单克隆后获得3个单克隆鼠源抗DNAH2抗体,再进行Western blot实验,分析DNAH2抗体的有效性,以及U2OS细胞中DNAH2蛋白的表达。在分子质量约500 ku附近检测到目的蛋白条带,表明制备的3个抗体均有效,U2OS细胞可表达DNAH2蛋白,见图4。
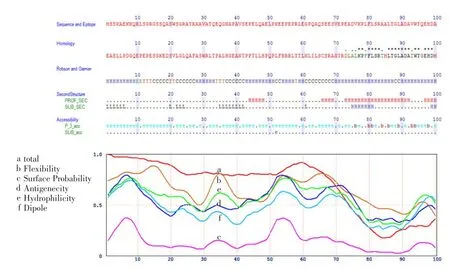
Fig.1Analysis of DNAH2 immunogen site图1 DNAH2免疫原位点的分析
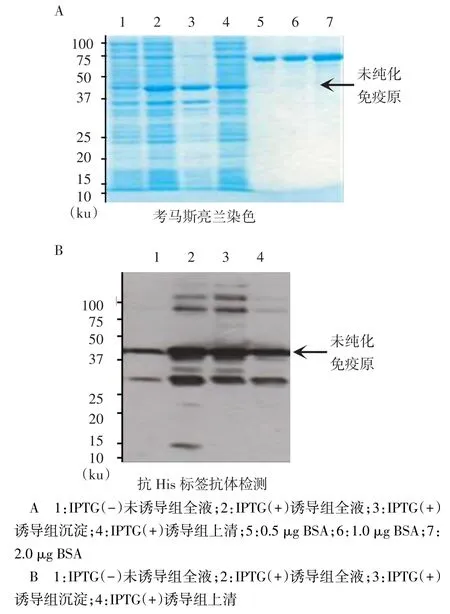
Fig.2Coomassie blue staining and Western blot assay in unpurified immunogen图2 未纯化免疫原的考马斯亮兰染色和Western blot检测

Fig.3Coomassie blue staining of purified immunogen图3 纯化后免疫原的考马斯亮兰染色
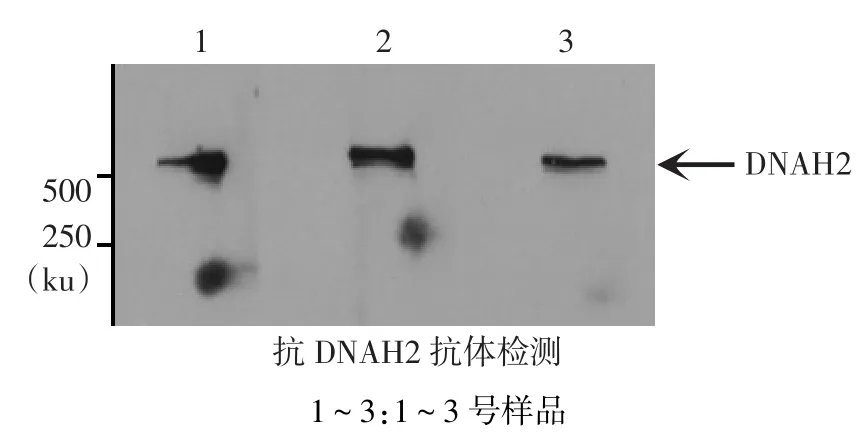
Fig.4Western blot assay showing monoclonal mouse anti-DNAH2 antibody图4 单克隆鼠源抗DNAH2的Western blot检测
3 讨论
作为细胞表面的骨架蛋白特化结构,纤毛是广泛存在于动、植物细胞中的“运动器官”[3-4]。纤毛的基本结构包括纤毛膜、纤毛基质及轴丝。轴丝是纤毛的骨架结构,由位于中央的中央微管、周围9排环形排列的二联微管及其附属蛋白构成。二联微管包含A管和B管,两者紧密连接,从A管伸出两条短臂,分别称为外侧动力臂和内侧动力臂。其中,内侧动力臂具有ATP酶活性,可将化学能转变为机械能,促进AB微管之间的相对滑动和纤毛的弯曲,导致纤毛运动[3-4]。
DNAH2蛋白从N端至C端所包含的区域依次为:(1)动力蛋白的茎干Stem(包含DHC N1和DHC N2)。(2)AAA-6(包含AAA1与P-loop-NTPase)。(3)AAA2(包含1个P-loop-NTPase)。(4)AAA3(包含2个AAA超家族)。(5)TPR2。(6)AAA4。(7)P-loop-NTPase。(8)Stalk。(9)MT(动力蛋白微管结合茎)。(10)AAA5(包括AAA-9)。(11)重链和动力蛋白区D6(包括AAA-6、TRP4及TRP5)11个区域[1-3]。另外,位于蛋白质结构中的最后一个P环往往与C端的区域呈伸展的“线圈”,该结构可能是与其他蛋白质相互作用的位点[1-3]。目前对于DNAH2蛋白的研究数据十分有限,针对DNAH2蛋白的商品化抗体也均为多克隆抗体。本实验是以基因工程手段人工表达DNAH2蛋白N端1~300 aa片段,并以其为免疫原免疫小鼠,通过细胞融合-杂交瘤细胞筛选制备抗人DNAH2的小鼠源单克隆抗体。
在形成大分子蛋白质严密的空间结构中,特定位点氨基酸的种类、电荷量、极性等属性与蛋白质分子空间结构的形成和生理功能的发挥密切相关。当DNAH2蛋白发生特定位点的点突变时,可能会改变氨基酸所在部位与水的亲和力,干扰DNAH2的ATP水解酶活性,从而影响DNAH2的蛋白结合作用。前期的全外显子组测序表明DNAH2蛋白的点突变与范可尼贫血(Fanconi anemia,FA)之前存在潜在的关联[5]。范可尼贫血是一种常染色体或X连锁隐性遗传性疾病,以造血衰竭为主要临床表现,常并发多种先天躯体畸形或实体肿瘤[6-8]。本实验室将利用制备的小鼠单克隆抗人DNAH2抗体进行免疫共沉淀、质谱分析等相关蛋白组学研究,探讨DNAH2蛋白与范可尼贫血的相关性。本实验也为DNAH2的功能研究提供了更好的蛋白工具,具有一定的实用意义。
[1]Jones RT,Abedalthagafi MS,Brahmandam M,et al.Cross-reactivity of the BRAF VE1 antibody with epitopes in axonemal dynein leads to staining of cilia[J].Mod Pathol,2015,28(4):596-606.doi: 10.1038/modpathol.2014.150.
[2]Chapelin C,Duriez B,Magnino F,et al.Isolation of several human axonemal dynein heavy chain genes:genomic structure of the catalytic site,phylogenetic analysis and chromosomal assignment[J].FEBS Lett,1997,412(2):325-330.
[3]Pazour GJ,Agrin N,Walker BL,et al.Identification of predicted human outer dynein arm genes:candidates for primary ciliary dyskinesia genes[J].J Med Genet,2006,43(1):62-73.doi: 10.1136/jmg.2005.033001.
[4]Falk N,Losl M,Schroder N,et al.Specialized Cilia in Mammalian Sensory Systems[J].Cells,2015,4(3):500-519.doi:10.3390/ cells4030500.
[5]Chang L,Yuan W,Zeng H,et al.Whole exome sequencing reveals concomitant mutations of multiple FA genes in individual Fanconi anemia patients[J].BMC Med Genomics,2014,7:24.doi:10.1186/ 1755-8794-7-24.
[6]Duxin JP,Walter JC.What is the DNA repair defect underlying Fanconi anemia?[J].Curr Opin Cell Biol,2015,37:49-60.doi: 10.1016/j.ceb.2015.09.002.
[7]Bogliolo M,Surralles J.Fanconi anemia:a model disease for studies on human genetics and advanced therapeutics[J].Curr Opin Genet Dev,2015,33:32-40.doi:10.1016/j.gde.2015.07.002.
[8]Longerich S,Li J,Xiong Y,et al.Stress and DNA repair biology of the Fanconi anemia pathway[J].Blood,2014,124(18):2812-2819.doi:10.1182/blood-2014-04-526293.
(2016-04-09收稿2016-07-08修回)
(本文编辑魏杰)
The preparation of the mouse monoclonal antibodies specific for the DNAH2 protein
CHANG Lixian,ZHANG Jingliao,REN Yuanyuan,SUN Congcong,WAN Yang,AN Wenbin,
ZHANG Yingchi,YUAN Weiping,ZHU Xiaofan△State Key Laboratory of Experimental Hematology,Institute of Hematology and Blood Diseases Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Tianjin 300020,China△
ObjectiveTo prepare specific mouse monoclonal antibodies against Homo sapiens dynein,axonemal,heavy chain 2(DNAH2).MethodsFirstly,recombinant plasmid encoding His tagged immunogen,targeting N-terminal sequence of DNAH2 protein(1-300 aa),in E.coli was constructed.IPTG was used to induce the expression of Hisimmunogen,which was then purified and immunized in BALB/c mice.Hybridoma cells were obtained through the fusion between myeloma cells and splenocytes isolated from BALB/c mice.Finally,ELISA and Western blot assays were performed to screen the positive hybridoma.ResultsIPTG was used efficiently to induce the expression of DNAH2 immunogen in E.coli.DNAH2 protein bands were detected in screened positive hybridoma.ConclusionMouse monoclonal anti-DNAH2 antibody is prepared successfully.
antibodies,monoclonal;hybridomas;plasmids;recombination,genetic;DNAH2
R341.1,R349.83
A
10.11958/20160317
国家自然科学基金资助项目(81500156,81170470)
天津,中国医学科学院血液病医院血液学研究所(邮编300020)
常丽贤(1984),女,医师,博士,主要从事范可尼贫血的相关机制研究
△通讯作者E-mail:xfzhu@ihcams.ac.cn
