红葡萄酒呈涩物质的化学分析
2016-11-11袁春龙苏鹏飞闫小宇西北农林科技大学葡萄酒学院陕西杨凌712100
马 婧,袁春龙,杨 丽,马 涛,苏鹏飞,闫小宇(西北农林科技大学葡萄酒学院,陕西 杨凌 712100)
红葡萄酒呈涩物质的化学分析
马 婧,袁春龙*,杨 丽,马 涛,苏鹏飞,闫小宇
(西北农林科技大学葡萄酒学院,陕西 杨凌 712100)
利用明胶指数法、卵清蛋白沉淀法、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、福林-肖卡法、蛋白沉淀法测定24 个红葡萄酒酒样中呈涩物质的含量,并与感官评价的涩感强度进行对比分析。结果表明,蛋白沉淀测定单宁的方法与感官评价结果的涩感强度相关性最好,且该方法操作简单,适合在酒厂进行推广。
红葡萄酒;涩感强度;评价;呈涩物质
单宁所产生的涩感,构成了葡萄酒的“骨架”,或者被称之为“酒体”[1]。涩感指口腔中的干燥和起皱的感觉,是干红葡萄酒很重要的特征之一[2-6]。葡萄酒单宁的质量由口感的最大强度、达到最大强度所需的时间[7],以及口腔中干燥感和粗糙感的延续时间所决定[1,8-9]。当葡萄酒的涩感与其他口感如酒精体积分数和含糖量相平衡的时候,可以被认为是愉悦的。与含糖量相比,如果葡萄酒中的单宁和酸度较高的话,这个葡萄酒被认为是“粗糙的、不成熟的、生青的”;与此相反,如果含糖量较高的话,葡萄酒会被认为是“单薄的、松散的”[10]。涩感影响着葡萄酒的质量,因此对于葡萄酒中涩味化合物的结构以及不同结构对感官品质的影响方面的研究对酿酒是很重要的[11]。
在最近的研究中,国外的学者采用了不同的化学方法分析葡萄酒中的呈涩物质[3,12-13]。明胶指数(gelatin index,GI)法是最早的方法[14-15],利用明胶的蛋白质特性,来模拟口腔中的唾液蛋白。其与葡萄酒中的单宁结合,通过检测反应前后酒样中单宁浓度的变化,来间接反映葡萄酒的涩感。与GI法相比,卵清蛋白沉淀法所选用蛋白的特异性有着明显的提高[16]。卵清蛋白是一种糖蛋白,含有微量的磷,是卵清中蛋白质的主要成分。其和唾液相似,都富含脯氨酸。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)法,是根据蛋白分子质量不同对蛋白多肽进行分离,蛋白在稳定的环境中按其分子质量的大小移动。根据文献[17-18],对葡萄酒涩感起主要作用的蛋白是富脯氨酸蛋白和α-淀粉酶,这2 类蛋白的大小分别在15 kD和62~59 kD附近,在早期研究中,常用这2 种蛋白代表全部的人类唾液蛋白,可见其重要性。通过电泳结果,比较这2 种蛋白的含量变化,间接反映酒样的涩感。此外,通过测量酒样中单宁和总酚的含量,也可以反映酒样的涩感强度[19]。
对于不同的化学分析方法,哪种或哪些方法的测量结果与真实口腔中的涩感强度更为一致,目前还没有一个明确的结论。因此,本实验采用不同的化学分析方法,对干红葡萄酒样中呈涩物质的含量进行测定,并比较与感官评价小组评价结果之间的联系和差异,从而筛选出一种或几种科学客观的方法,不仅为后续研究提供理论基础,还具有一定的生产实践推广意义。
1 材料与方法
1.1 材料与试剂
从山西戎子酒庄、昌黎朗格思酒庄、宁夏西夏王酒庄、宁夏御马酒庄和内蒙古汉森酒庄,共选择了24 个酒样,具体年份和品种如表1所示。

表1 酒样列表Table 1 List of wine samples
商业单宁 意大利Laffort公司;卵清蛋白、牛血清蛋白(bovine serum albumin,BSA) 美国Sigma-Aldrich公司;明胶 天津市博迪化工有限公司。
1.2 仪器与设备
NanoDrop ND1000超微量分光光度计 美国赛默飞世尔科技公司;UV-2450紫外-可见分光光度计日本岛津公司;KH-250DE型数控超声波清洗器 昆山合创超声仪器有限公司;DYY-5型稳流稳压电泳仪、SDS-PAGE mini gel电泳槽 北京六一仪器公司;SYNGENE G∶BOX凝胶成像系统 英国基因有限公司。1.3 方法
1.3.1 模拟酒的配制
模拟酒溶液中含有体积分数12%乙醇溶液和4 g/L酒石酸溶液,并用1 mol/L NaOH溶液将pH值调至3.6。在真空条件下,用0.45 μm滤膜过滤。在配制好的模拟酒中按所需质量浓度加入单宁[20]。
1.3.2 GI法
用锥形瓶取25 mL酒样,加入2.5 mL 35 g/L明胶溶液,用蒸馏水作对照。3 d后,将酒样用10 000×g离心10 min,取上清液测量单宁含量。GI用参加明胶蛋白沉淀反应的单宁含量用儿茶素(catechin equivalent,CE)当量(mg/mL CE)表示[15]。
1.3.3 卵清蛋白沉淀法(卵清蛋白指数)
标准曲线的制作:配制不同质量浓度(0.0~4.0 g/L)的卵清蛋白溶液,在该质量浓度范围内平均设置8 个梯度。分别配制单宁质量浓度为0.2、0.4、0.6、0.8 g/L的模拟酒,所添加的单宁为商业单宁。取同一质量浓度的模拟酒750 μL,置于1.5 mL离心管中,分别加入750 μL不同质量浓度梯度的卵清蛋白溶液。将离心管振荡10 min后,用11 700×g离心10 min。将上清液稀释适当倍数,用NanoDrop分光光度计在波长280 nm处测量吸光度,根据单宁质量浓度和吸光度拟合出曲线y =-alnx+b。根据不同单宁质量浓度和所得到的曲线方程的a值,得到标准曲线y=kx+c。
酒样的测定:同标准曲线中的处理方法,得到对数曲线后,将a值带入标准曲线,得到对应的单宁含量,用(mg/mL单宁)表示[16]。
1.3.4 总酚含量测定
采用福林肖-卡法测总酚[21],结果用没食子酸(gallic acid equivalent,GAE)当量(mg/mL GAE)表示。
1.3.5 单宁含量测定
用蛋白沉淀法[22]测单宁含量。
1.3.6 SDS-PAGE
1.3.6.1 人体唾液(human saliva,HS)的收集
由于不同个体间唾液蛋白的差异,典型的HS为不同个体的混合物。选取6 名(3 男3 女)不吸烟的志愿者,于上午10~11时收集唾液,且前2 h不能进食。将唾液收集于冰冻过的大离心管内,混合后于10 000×g离心10 min除去不溶物质,所得的上清液即为人类全唾液。并将样品以500 μL小体积分装于-20 ℃保存。
1.3.6.2 结合实验
结合反应前,酒样用模拟酒体积比1∶2稀释。混合物(最终体积150 μL)包括100 μL唾液和50 μL酒样。结合过程在离心管中进行,反应时间为5 min,反应温度为37 ℃。将混合物于10 000×g离心10 min,取上清液进行分析。做2 个重复。
1.3.6.3 电泳实验
每个样品做2 个重复电泳。利用SYNGENE G∶BOX凝胶成像系统进行拍照分析,利用软件Quantity One,Version 4.5(Bio-Rad)进行数据分析。
1.3.6.4 唾液蛋白沉降指数(saliva precipitation index,SPI)计算
根据62~59 kD和15 kD 2 个条带的光密度减少值来计算SPI[20]。
1.3.7 感官评价
1.3.7.1 评价小组培训
招募感官评价小组志愿者,并根据其感官能力、兴趣进行选拔。小组人员通过每次1 h、共计10 次的培训过程,熟悉测试样品和过程。培训内容包括涩感的相关理论知识,再分别利用3.0 g/L单宁、0.1 g/L奎宁和4.0 g/L酒石酸溶液来辨别涩感与苦味和酸味之间的区别。并且分别在水溶液加入不同的混合物(酸、甜、苦、涩)要求成员进行辨别。之后,利用线性标度法(即在一条100 mm的带刻度线段上,规定不添加物质的溶液强度为最小值0、5.0 g/L单宁酸溶液强度为最大值10.0,根据品尝感受标出强度,根据所标记值定义强度大小,精确到0.1),对成员进行涩感强度的排序训练。对质量浓度范围为1.0、2.0、3.0、4.0、5.0 g/L的单宁模拟酒溶液进行反复定位。培训环境为室温(18±2)℃,小组成员将全部酒样(10 mL)倒入口腔,保持8 s后吐出,等待约4 min后根据感受标记涩感强度。之后用去离子水清洁口腔2 次,并咀嚼苏打饼干使味觉得到恢复,且在对下一酒样进行评价前至少等待30 s。每个酒样的评价在5 min内完成,感受到的最大强度即为涩感。所得的数据用于评价小组成员的可靠性和一致性,对相同样品的评价置信水平大于95%(P<0.05)。
1.3.7.2 酒样评价
利用上述质量浓度的标准溶液作为参照。在室温条件下(18±2)℃,每次评价4 个酒样(10 mL),每个酒样做2 个重复,样品随机编号,感官评价环节与培训环节的过程相同。
2 结果与分析
2.1 酒样的呈涩物质含量和涩感的感官评价
分别利用上述5 种化学方法对24 个酒样呈涩物质的含量进行测定。同时对组建好的感官评价小组进行培训,达到要求之后(P<0.05),对同酒样评价其涩感强度。将结果进行汇总,如表2所示。
结果表明,所用的2 4 个酒样的G I范围为0.016~0.236 mg/mL CE,酒样2的测定结果最小,酒样10的测定结果最大;卵清蛋白指数的范围为0.151~0.773 mg/mL单宁,酒样8的测定结果最小,酒样6的测定结果最大;总酚含量的范围为1.237~3.551 mg/mL GAE,酒样5的测定结果最小,酒样19的测定结果最大;单宁含量的范围为0.038~0.208 mg/mL CE,酒样2的测定结果最小,酒样10的测定结果最大;SPI范围为12.044~78.249,酒样5的测定结果最小,酒样10的测定结果最大。感官评价小组的评价结果中,涩感强度范围为4.0~7.0,酒样1的评价 结果最小,酒样3的评价结果最大。
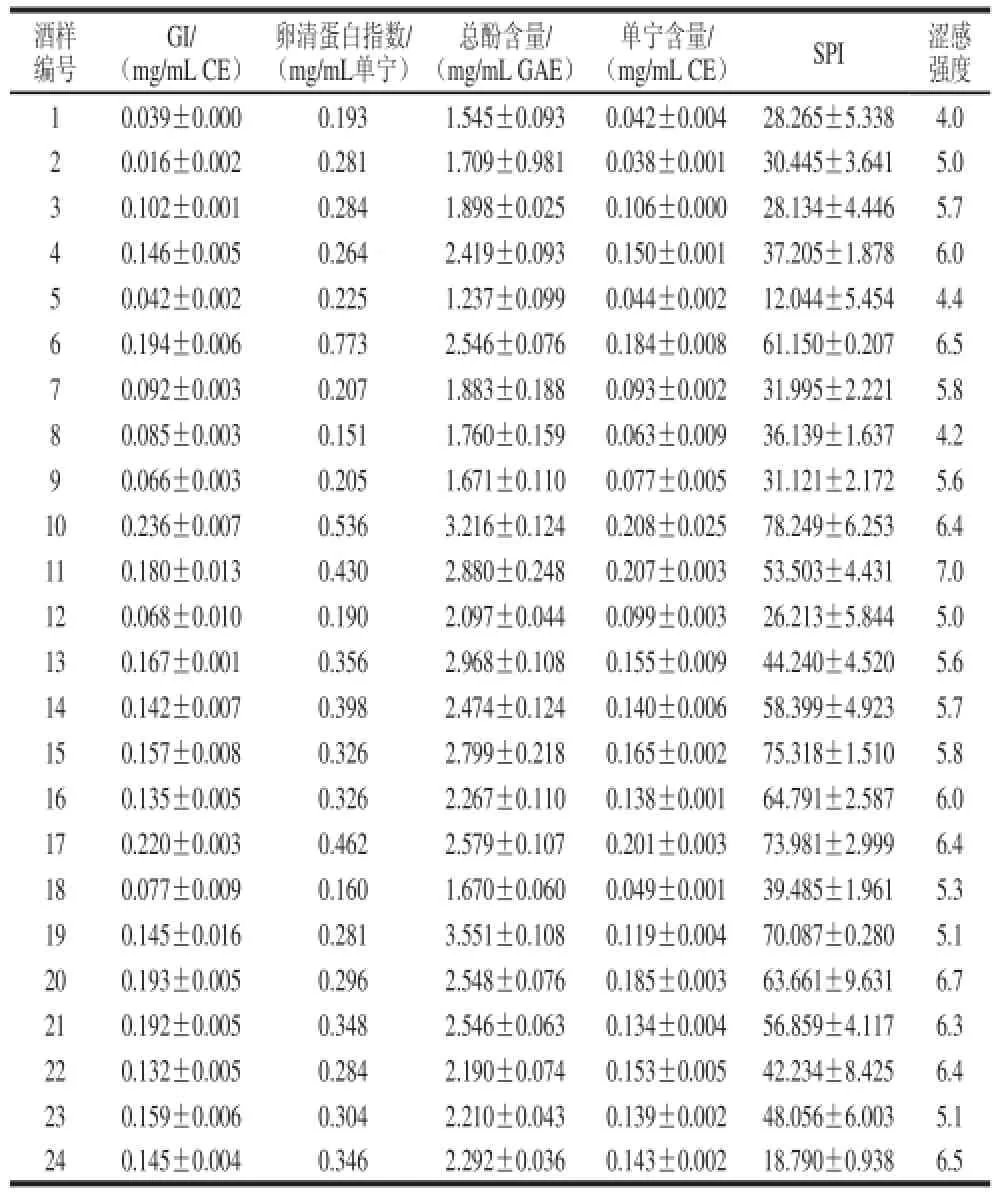
表2 化学测定及感官评价结果Table 2 Results of chemical measurement and sensory perception
2.2 呈涩物质含量与涩感的关系
2.2.1 GI与涩感的关系

图1 GI与涩感强度的相关性Fig.1 Relationship between GI and astringency intensity
由图1可以看出,GI与涩感的相关性较好,相关系数r为0.761 7,基本呈线性关系。所选酒样的涩感强度位于4.0~7.0之间,在该涩感范围内,GI可以较好地反映涩感。
2.2.2 卵清蛋白指数与涩感的关系
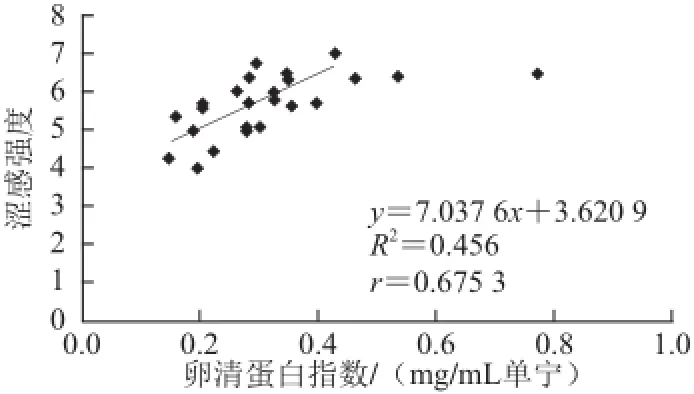
图2 卵清蛋白指数与涩感强度的相关性Fig.2 Relationship between ovalbumin index and astringency intensity
从图2可以看出,除点(0.462,6.4)、(0.536,6.4)、(0.773,6.5)外,卵清蛋白指数可以较好地反映酒样的涩感强度。但是区分度不是很好,表现在图中的结果是点的分布过于密集,数据的离散型不好,线性关系不够明显(R2=0.456),导致如果仅从数据结果分析,不同酒样间差异的显著性会降低。
2.2.3 单宁含量与涩感的关系
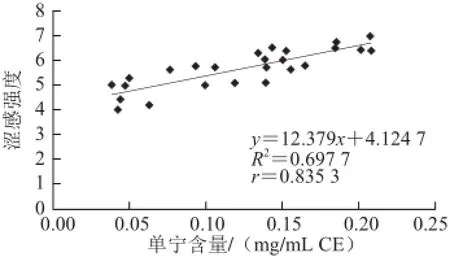
图3 单宁含量与涩感强度的相关性Fig.3 Relationship between tannin content and astringency intensity
从图3可以看出,与GI和卵清蛋白指数相比,单宁含量可以更好地反映酒样的涩感强度。所测得的单宁含量在0.038~0.208 mg/mL CE离散分布,且与涩感的相关度很好r为0.835 3。
2.2.4 总酚含量与涩感的关系
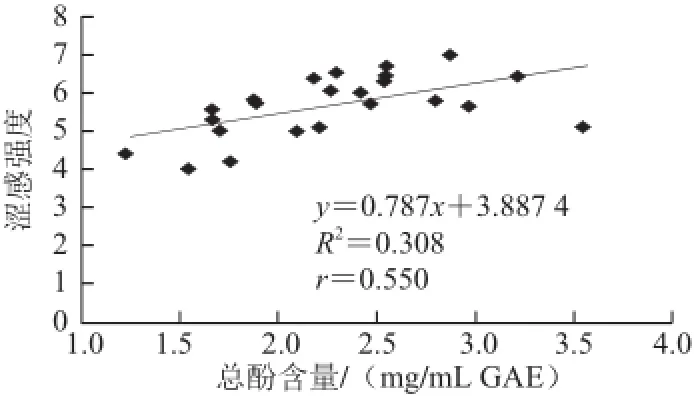
图4 总酚含量与涩感强度的相关性Fig.4 Relationship between total polyphenol content and astringency intensity
由图4可知,与单宁相比,总酚含量和涩感之间虽然存在一定的线性关系,但是相关性较弱r为0.550。不同的酒样所得的总酚含量相近,但在实际感官评价中涩感差异还是较为明显的,如点(0.209 7,5.0)、(0.219 0,6.4)二者总酚含量相近,但是涩感强度的差异较大。
2.2.5 SPI与涩感的关系

图5 SPI与涩感强度的相关性Fig.5 Relationship between SPI and astringency intensity
从图5可以看出,SPI值与涩感间存在一定的线性关系,可以较好地反映涩感的强弱r为0.641 6。酒样的涩感范围为4.0~7.0,该主观实验所设置的涩感强度范围为0~10;其对应的SPI变化范围为12.044~78.249,而SPI的理论范围为0~100。可以看出SPI可以放大酒样之间的差异,能更为直观地区别不同酒样。
综合以上图表可以看出,在对葡萄酒样的测定中,不同的化学分析方法间r(总酚含量)<r(卵清蛋白指数)<r(SPI)<r(GI)<r(单宁含量)。总酚是指葡萄酒中各种酚类物质的总和,而不同的酚类物质,如一些小分子的酚酸类化合物和大分子的单宁,通过品尝不同的酚类物质化合物的溶液可以发现,其涩感强度是有显著差别的。因此仅仅用总酚的含量来表征葡萄酒涩感是片面的。卵清蛋白指数的结果集中度较高,测定结果大部分集中在0.151~0.462 mg/mL单宁。该方法与总酚含量的测定类似,其测量值为波长280 nm的吸光度,波长280 nm为酚类物质的特征吸收峰。此方法的核心,是通过酚类物质的含量来反映涩感的强度,因此该方法与总酚含量测定法存在同样的弊端。SPI的测定摆脱较为传统的比色法,采用凝胶色谱的光密度分析,通过模拟葡萄酒样在口腔中反应前后蛋白质的含量变化,来间接衡量酒样的涩感。该方法对于传统的比色法,在测定方法上是一种创新。与其他比色法相比,电泳法的操作相对要复杂很多,因此所得的自然误差会比其他方法大。此外电泳法属于分子实验方法,对操作的准确度和仪器的精密度要求也相对较高。GI和单宁法从根本上而言,都是依赖于对葡萄酒样中单宁含量的测定,而单宁是葡萄酒中主要的呈涩物质。因此与其他方法相比,蛋白沉淀测单宁法的准确度较高。
2.3 不同化学测定方法间的对比
根据葡萄酒样利用不同化学测定方法所得到的数据,对比不同方法间的相关性。在5 种测定方法中,两两之间进行比较,所得到的线性关系如图6所示。
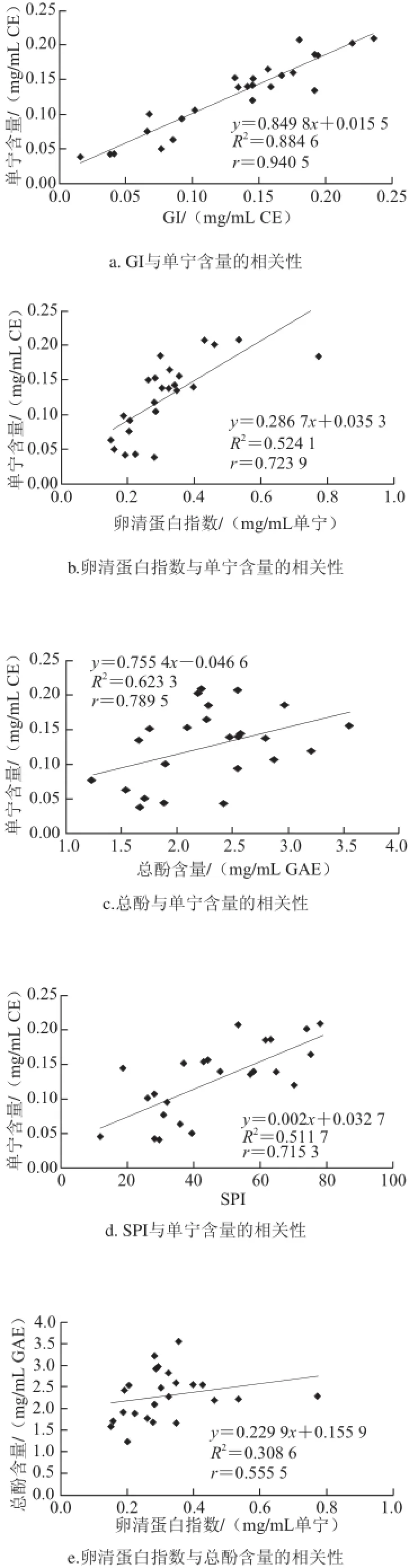
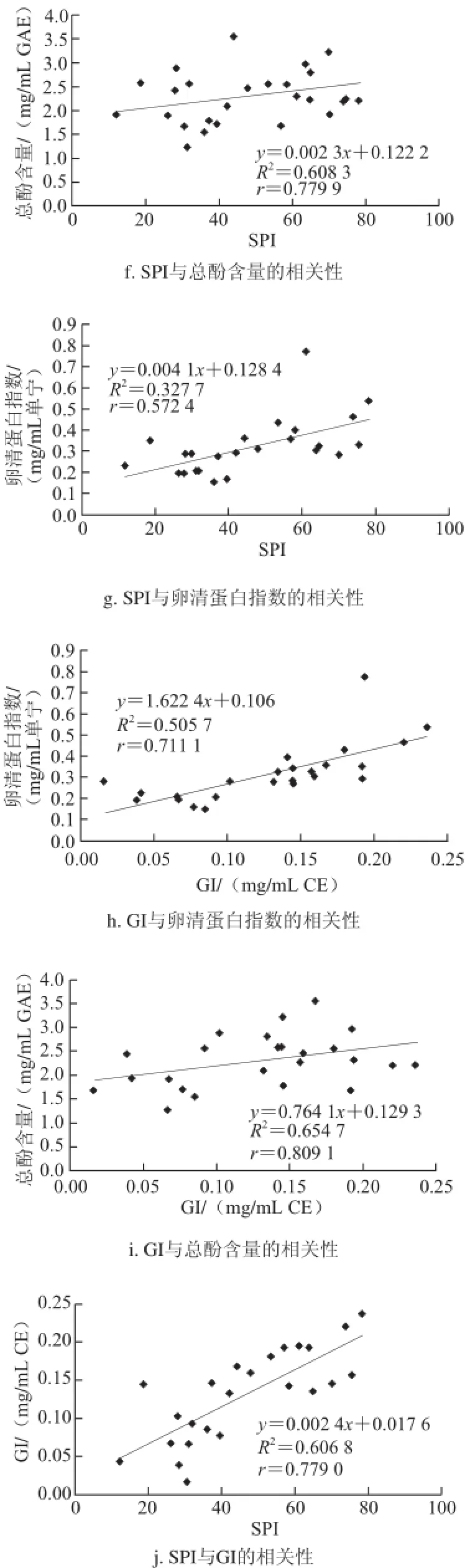
图6 不同化学测定方法间的相关性Fig.6 Relationships among different chemical methods
由图6可知,不同测定方法之间的相关性r(总酚含量/卵清蛋白指数)<r(卵清蛋白指数/SPI)<r(卵清蛋白指数/GI)<r(单宁含量/SPI)<r(单宁含量/卵清蛋白指数)<r(GI/SPI)<r(总酚含量/SPI)<r(单宁含量/总酚含量)<r(总酚含量/GI)<r(单宁含量/GI)。
从相关性的结果可以看出,2 个方法间的原理越相近,所得到结果的相关性也会越高。如单宁含量/总酚含量、总酚含量/GI、单宁含量/GI三对方法中两两间的相关性均大于0.78,而这3 种方法的本质都是将某一类特定的物质(酚类或者单宁)与一种特殊的物质发生结合反应,并能在特定的波长处产生吸收峰,从而实现对该类物质的定量分析。
卵清蛋白指数与其他方法间的相关性最弱。虽然本质上卵清蛋白指数也是比色法,但是与传统的比色法原理不同的是,利用不同量的卵清蛋白与酒样中的单宁类物质反应,从酚类物质总量的减少趋势来判断酒样中单宁物质的多少。其中缺乏对特定物质的定量过程,牺牲了精确性获得了操作上的简易性。
SPI与其他方法相比,具有一定的相关性,0.57<r(SPI/其他方法)<0.79。该结果也表明,SPI具有一定的可靠性,除去使用传统的比色法,利用色谱法也能对葡萄酒里的单宁含量进行定量分析,从而表征葡萄酒的涩感强度。
3 讨 论
涩感对葡萄酒的质量有着非常重要的影响,因此近年来关于呈涩物质的研究一直很多,学者们都试图找出一种可以替代感官评价的方法。根据测量方法的不同,大概可以分为以下几类:分光光度法、浊度法、黏度法、光谱法、电泳法等。
GI法是最早化学测定方法,最近的研究也证明GI能较好地表征葡萄酒的涩感R2为0.563[15],这与本实验得到的结果R2为0.580 2是相近的。证明GI法是一种稳定的化学测定方法,该方法的再现性很好。在该研究中,同时比较了总酚含量表征涩感的方法R2为0.684,这与本实验所得到的结果R2为0.308仍有一定的差距。利用酚类物质的总量表征涩感强度,不同酒样中酚类物质的构成不同,而不同酚类物质的涩感强度是不一样的,这可能是造成本实验结果与其他研究者结果存在差异的原因。总酚含量并不是一个较好地表征涩感强度的数据。
卵清蛋白指数法被提出之后,鲜有应用该方法的其他研究。与该方法的作者所得出的结论r(卵清蛋白指数/涩感强度)=0.773 7,本实验所得出的结论r(卵清蛋白指数/涩感强度)=0.675 3相对较低,与GI法相比,该方法的再现性一般[16]。
SDS-PAGE法是一个比较新颖的表征涩感强度的方法,本实验所得到的结果r为0.641 6与先前的研究所得到的结果r为0.984相比,存在一定的差异[20]。在同等条件下此方法的的再现性不好,且对实验操作方面拥有着较高的要求,整个实验流程需要较长的时间。该方法适合资源水平相对较高的实验室使用,而对于需要快速给出实验结果酿酒基地,该方法不适合推广。
之前也有一些研究对于不同的呈涩物质化学测定方法做出了比较,利用测定波长280 nm处吸光度、凝胶色谱法以及蛋白沉淀单宁法测定了不同的美乐和西拉葡萄酒的呈涩物质含量,结果表明蛋白沉淀法与其他两者相比,与涩感之间有着更好的相关度[23],这和本实验的研究结果是一致的。蛋白沉淀法与其他的吸光度法相比,所测得的单宁含量较低,但是在与涩感的相关性研究方面,均表明该方法能很好地反映葡萄酒的涩感强度[24]。
4 结 论
对24 个不同葡萄酒成品酒样,分别利用5 种不同化学方法测定其呈涩物质含量,并将结果与感官评价的结果进行比较。结果表明不同的化学方法与主观评价的涩感间的相关系数r(总酚含量)<r(卵清蛋白指数)<r(SPI)<r(GI)<r(单宁含量),说明蛋白沉淀法能较好地反映葡萄酒中的涩感强度。蛋白沉淀法操作简单,对仪器以及操作技能要求较低,适合在葡萄酒生产车间进行推广,虽然不能完全替代感官评价,但对于表征葡萄酒的涩感有很好的参考价值。
[1] LEE C B, LAWLESS H T. Time-course of astringent sensations[J]. Chemical Senses, 1991, 16(3): 225-238. DOI:10.1093/ chemse/16.3.225.
[2] KENNEDY J A, SAUCIER C, GLORIES Y. Grape and wine phenolics: history and perspective[J]. American Journal of Enology and Viticulture, 2006, 57(3): 239-248.
[3] MERCURIO M D, DAMBERGS R G, COZZOLINO D, et al. Relationship between red wine grades and phenolics. 1. Tannin and total phenolics concentrations[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23): 12313-12319. DOI:10.1021/jf103230b.
[4] MERCURIO M D, SMITH P A. Tannin quantification in red grapes and wine: comparison of polysaccharide- and protein-based tannin precipitation techniques and their ability to model wine astringency[J]. Journal of Agricultural and Food Chemistry, 2008, 56(14): 5528-5537. DOI:10.1021/jf8008266.
[5] GAWEL R, ILAND P, FRANCIS I. Characterizing the astringency of red wine: a case study[J]. Food Quality and Preference, 2001, 12(1): 83-94. DOI:10.1016/s0950-3293(00)00033-1.
[6] PAYNE C, BOWYER P K, HERDERICH M, et al. Interaction of astringent grape seed procyanidins with oral epithelial cells[J]. Food Chemistry, 2009, 115(2): 551-557. DOI:10.1016/ j.foodchem.2008.12.061.
[7] KALLITHRAKA S, BAKKER J, CLIFFORD M, et al. Correlations between saliva protein composition and some T-Ⅰ parameters of astringency[J]. Food Quality and Preference, 2001, 12(2): 145-152. DOI:10.1016/s0950-3293(00)00040-9.
[8] KALLITHRAKA S, BAKKER J, CLIFFORD M. Evaluation of bitterness and astringency of (+)-catechin and (-)-epicatechin in red wine and in model solution[J]. Journal of Sensory Studies, 1997, 12(1): 25-37. DOI:10.1111/j.1745-459x.1997.tb00051.x.
[9] DEMIGLIO P, PICKERING G J. The influence of ethanol and pH on the taste and mouthfeel sensations elicited by red wine[J]. Journal of Food Agriculture and Environment, 2008, 6(3/4): 143-150.
[10] KENNEDY J A. Grape and wine phenolics: observations and recent findings[J]. Ciencia e Investigación Agraria, 2008, 35(2): 107-120. DOI:10.4067/s0718-16202008000200001.
[11] MCRAE J M, KENNEDY J A. Wine and grape tannin interactions with salivary proteins and their impact on astringency: a review of current research[J]. Molecules, 2011, 16(3): 2348-2364. DOI:10.5962/ bhl.title.26097.
[12] FERRER-GALLEGO R, GONALVES R, RIVAS-GONZALO J C, et al. Interaction of phenolic compounds with bovine serum albumin (BSA) and α-amylase and their relationship to astringency perception[J]. Food Chemistry, 2012, 135(2): 651-658. DOI:10.1016/ j.foodchem.2012.04.123.
[13] ICHIKAWA M, ONO K, HISAMOTO M, et al. Concentrations of BSA-binding proanthocyanidins in red wines produced in Japan[J]. Food Science and Technology Research, 2011, 17(4): 335-339. DOI:10.3136/fstr.17.335.
[14] RIBÉREAU-GAYON P, GLORIES Y. Phenolics in grapes and wines[C]//Proceedings of the Sixth Australian Wine Industry Technical Conference, Adelaide, Australian Winetitles, Adelaide, 1986: 247-256. [15] GOLDNER M C, ZAMORA M C. Effect of polyphenol concentrations on astringency perception and its correlation with gelatin index of red wine[J]. Journal of Sensory Studies, 2010, 25(5): 761-777. DOI:10.1111/j.1745-459x.2010.00304.x.
[16] LLAUDY M C, CANALS R, CANALS J M, et al. New method for evaluating astringency in red wine[J]. Journal of Agricultural and Food Chemistry, 2004, 52(4): 742-746. DOI:10.1021/jf034795f.
[17] GAMBUTI A, RINALDI A, PESSINA R, et al. Evaluation of aglianico grape skin and seed polyphenol astringency by SDSPAGE electrophoresis of salivary proteins after the binding reaction[J]. Food Chemistry, 2006, 97(4): 614-620. DOI:10.1016/ j.foodchem.2005.05.038.
[18] RINALDI A, GAMBUTI A, MOINE-LEDOUX V, et al. Evaluation of the astringency of commercial tannins by means of the SDSPAGE-based method[J]. Food Chemistry, 2010, 122(4): 951-956. DOI:10.1016/j.foodchem.2010.03.105.
[19] 杨晓雁, 袁春龙, 张晖, 等. 酒度、总酸、pH值以及饮用温度对干红葡萄酒涩味的影响[J]. 食品科学, 2014, 35(21): 118-123. DOI:10.7506/spkx1002-6630-201421023.
[20] RINALDI A, GAMBUTI A, MOIO L. Application of the SPI (saliva precipitation index) to the evaluation of red wine astringency[J]. Food Chemistry, 2012, 135(4): 2498-2504. DOI:10.1016/ j.foodchem.2012.07.031.
[21] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTŁS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J]. Methods in Enzymology, 1999, 299c: 152-178. DOI:10.1016/s0076-6879(99)99017-1.
[22] HARBERTSON J F, KENNEDY J A, ADAMS D O. Tannin in skins and seeds of Cabernet Sauvignon, Syrah, and Pinot noir berries during ripening[J]. American Journal of Enology and Viticulture, 2002, 53(1): 54-59.
[23] KENNEDY J A, FERRIER J, HARBERTSON J F, et al. Analysis of tannins in red wine using multiple methods: correlation with perceived astringency[J]. American Journal of Enology and Viticulture, 2006, 57(4): 481-485.
[24] CERES-MELLA A, PEA-NEIRA ˘, NARVEZ-BASTIAS J, et al. Comparison of analytical methods for measuring proanthocyanidins in wines and their relationship with perceived astringency[J]. International Journal of Food Science and Technology, 2013, 48(12): 2588-2594. DOI:10.1111/ijfs.12253.
Comparative Evaluation of Chemical Methods for Analyzing Astringent Taste Compounds of Red Wine
MA Jing, YUAN Chunlong*, YANG Li, MA Tao, SU Pengfei, YAN Xiaoyu
(College of Enology, Northwest A&F University, Yangling 712100, China)
A total of 24 red wine samples were analyzed by gelatin index, ovalbumin index, sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE), Folin-Ciocalteau, and protein precipitation methods, respectively. The results obtained with these methods were compared with the perceived astringency. The protein precipitation assay showed a strong correlation with the perceived astringency, which was convenient and suitable for extensive applications in wineries. Key words: red wine; astringency intensity; evaluation; astringent taste compound
10.7506/spkx1002-6630-201604024
TS262.6
A
1002-6630(2016)04-0132-07
马婧, 袁春龙, 杨丽, 等. 红葡萄酒呈涩物质的化学分析[J]. 食品科学, 2016, 37(4): 132-138. DOI:10.7506/spkx1002-6630-201604024. http://www.spkx.net.cn
MA Jing, YUAN Chunlong, YANG Li, et al. Comparative evaluation of chemical methods for analyzing astringent taste compounds of red wine[J]. Food Science, 2016, 37(4): 132-138. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604024. http://www.spkx.net.cn
2015-05-13
陕西省农业攻关项目(2015NY131);西北农林科技大学科技创新重点项目(Z109021301)
马婧(1989—),女,硕士研究生,研究方向为葡萄酒化学。E-mail:celia-89@163.com
*通信作者:袁春龙(1969—),男,副教授,博士,研究方向为葡萄酒化学。E-mail:yuanchl69@nwsuaf.edu.cn
