独行菜LaMCT基因的克隆、序列分析与原核表达
2016-11-11马利刚李晓阳冯卫生郑晓珂
赵 乐,马利刚,李晓阳,冯卫生,郑晓珂*
( 1. 河南中医学院 药学院,郑州 450046;2. 呼吸疾病诊疗与新药研发河南省协同创新中心,郑州 450046 )
独行菜LaMCT基因的克隆、序列分析与原核表达
赵乐1,2,马利刚1,2,李晓阳1,冯卫生1,2,郑晓珂1,2*
( 1. 河南中医学院 药学院,郑州 450046;2. 呼吸疾病诊疗与新药研发河南省协同创新中心,郑州 450046 )
强心苷作为药用植物独行菜(Lepidiumapetalum)的活性成分,其化学和药理学研究已有良好的基础,但其生物合成途径目前仍不清楚。该研究以独行菜幼苗为材料,通过分析独行菜转录组数据,设计特异性引物,PCR扩增得到了强心苷生物合成MEP途径的关键酶2-C-甲基赤藓醇-4-磷酸胞苷酰转移酶(MCT)基因的开放阅读框(ORF),命名为LaMCT(Genbank注册号KT832554),并进行序列分析和原核表达。序列分析结果表明:LaMCT基因ORF全长为912 bp,编码304个氨基酸。亚细胞定位和保守结构域分析结果表明:LaMCT蛋白位于叶绿体中,不含信号肽,没有跨膜区,含有类异戊二烯合成酶保守结构域(isoprenoid synthase domain)。系统进化树结果表明:LaMCT蛋白与拟南芥的MCT蛋白具有94%的序列相似性,亲缘关系较近。通过构建pET-32a-LaMCT原核表达载体,成功在大肠杆菌BL21(DE3)菌株中诱导表达LaMCT重组蛋白,并得到了纯化的LaMCT重组蛋白。该研究首次从独行菜中克隆了LaMCT基因,建立其稳定的原核表达体系,为LaMCT蛋白抗体的制备以及研究LaMCT基因在独行菜强心苷类化合物生物合成途径中的功能奠定了基础。
独行菜, MCT, 基因克隆, 序列分析, 原核表达
独行菜(Lepidiumapetalum)是十字花科独行菜属植物,其干燥成熟种子是我国传统中药北葶苈子,具有泻肺平喘、利水消肿的功效(李红伟等,2013)。目前,已从独行菜中分离得到多种化合物如强心苷类、硫苷类、黄酮类、生物碱类等,其中强心苷类化合物具有强心、保护心肌和改善心血管功能等作用,是独行菜重要的药效物质基础之一(周喜丹等,2014)。对独行菜强心苷类化合物在化学和药理学方面的研究已有良好的基础,但对其生物合成途径及相关功能基因的研究目前较少,所以开展强心苷类化合物生物合成途径的研究具有重要意义。
对独行菜中分离得到的强心苷类化合进行结构分析,发现其属于植物甾醇类,植物甾醇和三萜结构类似,在生物体内是由鲨烯通过不同方式环化而成,即通过甲羟戊酸途径(mevalonate pathway,MVA pathway)和甲基赤藓醇磷酸途径(methylerythritol phosphate pathway,MEP pathway)衍生而来(张长波等,2007)。在植物中,MVA途径存在于细胞质中,MEP途径存在于质体中(Eisenreich et al,2004),异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)是沟通两条代谢途径的中间体,IPP在异戊烯基焦磷酸异构酶的作用下可以部分转化为二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP),DMAPP是IPP的双键异构体,IPP和DMAPP再经过催化可以生成各种复杂的萜类化合物和植物甾醇(Capell and Christou 2004)。IPP和DMAPP可以在酶催化下生成法呢基焦磷酸(FPP),FPP是三萜类化合物生物合成的前体物,FPP在鲨烯合成酶作用下生成鲨烯,经鲨烯环氧酶催化生成环氧化鲨烯,形成三萜类化合物和植物甾醇的骨架(陈建,赵德刚,2005)。MEP途径中,2-C-甲基赤藓醇-4-磷酸胞苷转移酶(2-C-methylerythritol-4-phosphate cytidylyltransferase,MCT),在CTP的参与下催化底物2-C-甲基赤藓醇-4-磷酸(2-C-methylerythritol-4- phosphate,MEP)生成4-焦磷酸胞苷-2-C-甲基赤藓醇(4-diphosphocytidyl-2C-methylerythritol,CDP- ME),MCT是强心苷类化合物生物合成MEP途径的第3个关键酶(Ma et al,2012; Rohdich et al,2000)。
通过分析本实验室前期获得的独行菜转录组数据,发现多个参与MEP途径的基因。本研究首次从独行菜中克隆了MEP途径第三步反应的关键酶MCT基因的ORF,命名为LaMCT,然后对LaMCT基因编码的蛋白质进行生物信息学分析,构建了pET-32a-LaMCT原核表达载体,在大肠杆菌BL21(DE3)菌株中成功表达了LaMCT重组蛋白,通过Ni2+亲和层析得到了纯化的LaMCT重组蛋白,这为进一步研究LaMCT基因在独行菜强心苷类化合物生物合成途径中的功能奠定了基础。
1 材料与方法
1.1 材料与试剂
独行菜种子采自河南省伏牛山区,经河南中医学院药学院董诚明教授和谢小龙博士鉴定为十字花科独行菜属独行菜(Lepidiumapetalum)的成熟种子,种植于植物培养箱中,光照强度为3 000 lx,在16 h、23 ℃光照,8 h、20 ℃黑暗,70%相对湿度条件下培养。种子萌发长出4片真叶后,转移到液体培养罐中,用Hoagland营养液培养,每个培养罐中培养4颗独行菜幼苗,每隔3 d更换1次营养液,培养60 d后,采其幼苗叶片作为供试材料。
植物总RNA提取试剂盒、RNase-Free DNase I、质粒小提试剂盒、DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒均购自北京天根公司;反转录试剂盒TransScript II Reverse Transcriptase和大肠杆菌感受态细胞DH5α和BL21 (DE3) 菌株购自北京全式金公司;ExTaq酶、限制性核酸内切酶(EcoR I、XhoI)、T4DNA连接酶、pMD19-T vector购自Takara公司;引物合成、样品测序由北京三博远志公司完成。
1.2 LaMCT基因的克隆
取100 mg独行菜幼苗叶片在液氮中迅速研磨成粉末,按照植物总RNA提取试剂盒说明书,提取得到独行菜叶片的总RNA,用1%琼脂糖凝胶电泳检测总RNA完整性,用NanoDrop 2000在260 nm/280 nm波长下测定总RNA的纯度和浓度。以提取的总RNA为模板,以oligo (dT)18primer为反转录引物,按照反转录试剂盒说明书,反转录合成cDNA。
根据本实验室前期获得的独行菜转录组数据中LaMCT基因的序列信息,用Primer 5设计一对LaMCT基因编码区的特异性引物,正向引物:LaMCT-Exp-F (5′- CGGAATTCATGGCTATGCTTC AA-3′,下划线部分为EcoR I酶切位点);反向引物:LaMCT-Exp-R (5′- CCGCTCGAGTCATGAGTCCAT GCT -3′,下划线部分为XhoI酶切位点)。以反转录合成的cDNA为模板进行PCR反应,PCR反应条件:95 ℃、2 min;95 ℃、10 s,52.4 ℃、15 s,72 ℃、1 min,30个循环;72 ℃延伸8 min。PCR产物经1%琼脂糖凝胶电泳检测后,用DNA产物纯化试剂盒纯化回收,纯化的PCR产物与pMD19-T vector连接,然后转化大肠杆菌DH5α菌株,经菌液PCR和电泳检测后,挑取阳性克隆送北京三博公司测序。
1.3 LaMCT基因编码蛋白的序列分析
用DNAMAN软件对LaMCT基因编码蛋白质的氨基酸序列进行预测,使用ExPASy Protemics Server提供的在线工具ProtParam (http://web.expasy.org/ protparam/)预测其相对分子量与理论等电点,使用InterPro Scan (http://www.ebi.ac.uk/ interpro/)进行LaMCT蛋白的保守结构域预测,使用SWISS-MODEL (http://swissmodel.expasy.org/)进行三维同源建模,使用TargetP 1.1 Server (http://www.cbs.dtu.dk/services/TargetP/) 分析LaMCT蛋白的亚细胞定位,SignalP 4.1 server (http://www.cbs.dtu.dk/services/SignalP/)分析LaMCT蛋白是否含有信号肽,使用TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜区预测,用ClustalW 软件与其他植物MCT蛋白的氨基酸序列进行比对后,使用MEGA 4软件的相邻连接法(neighbor-joining)和泊松模型(poission model)构建系统进化树,bootstrap检验的重复次数为1 000次(Tamura et al,2007)。
1.4 LaMCT原核表达载体的构建与诱导表达
用EcoR I和XhoI分别对原核表达载体pET-32a和测序正确的pMD19-T-LaMCT质粒进行双酶切,切胶回收载体片段和目的基因片段,用T4DNA连接酶将载体片段和目的基因片段在16 ℃过夜连接。连接产物转化大肠杆菌BL21 (DE3)菌株,均匀涂布在LB平板上(含氨苄青霉素)进行筛选,挑取单克隆经菌落PCR和双酶切鉴定后,挑选阳性克隆送北京三博公司测序。将测序正确的单克隆接种于LB液体培养基中(含氨苄青霉素),在37 ℃、220 rpm条件下培养过夜,第二天按照1∶100接种于LB液体培养基中(含氨苄青霉素),继续在37 ℃、220 r·min-1条件下培养,当OD600达到0.6时,加入IPTG,IPTG终浓度为0.4 mmol·L-1,继续在28 ℃、150 r·min-1条件下培养8 h,诱导LaMCT重组蛋白的表达,然后用SDS-PAGE进行检测。
1.5 LaMCT重组蛋白的纯化
根据LaMCT重组蛋白的诱导表达条件,扩大培养体积,在大肠杆菌BL21 (DE3)菌株中大量表达LaMCT重组蛋白,通过离心获得菌体,用PBS (pH 7.4)重悬菌体,然后用超声裂解菌体直到菌液变清,大肠杆菌裂解液在4 ℃,12 000 ×g离心20 min,离心完成后,取上清用0.45 μm滤膜过滤,利用Ni2+亲和层析,采用Ni Sepharose 6 Fast Flow (GE Healthcare)树脂进行纯化,然后用含有不同咪唑浓度的洗脱缓冲液进行梯度洗脱(咪唑浓度为50、100、200、300和500 mmol·L-1),洗脱得到的样品用SDS-PAGE电泳进行检测,收集只有单一目的条带的洗脱样品,用透析袋透析收集的洗脱样品,透析后用超滤管浓缩样品,采用Bradford法对样品溶液的蛋白含量进行测定,样品经真空冷冻干燥后,保存于-70 ℃。
2 结果与分析
2.1 LaMCT基因的克隆
通过分析本实验室前期获得的独行菜转录组数据,发现多个参与MEP途径的基因,其中有一个注释为MCT的转录本,长度为1 111 bp,将基因序列提交到NCBI ORF Finder分析,发现其包含一个完整的ORF,长度为912 bp,根据该基因ORF序列设计特异性引物LaMCT-Exp-F和LaMCT-Exp-R,PCR扩增得到1条900 bp左右的片段,电泳结果如图1所示,与预期大小相符,进行测序后得到独行菜LaMCT基因的编码序列,大小为912 bp,编码304个氨基酸(图2),序列信息已提交到NCBI Genbank,登录号为KT832554。
2.2 LaMCT基因编码蛋白的序列分析
利用DNAMAN软件预测LaMCT基因编码304个氨基酸(图2),利用ExPASy Proteomics Server的在线工具Protparam对其编码蛋白的理化性质进行预测分析,推测LaMCT蛋白的分子式为C1518H2456N398O450S12,分子量:33.87 kD,等电点pI:9.15;正电残基(Arg+Lys):40,负电残基(Asp+Glu):38,不稳定指数为40.37。这说明LaMCT蛋白属于不稳定蛋白。

图 1 PCR扩增LaMCT基因 M. DL2000 DNA marker;1. LaMCT基因PCR扩增产物。Fig. 1 PCR amplification of LaMCT gene M. DL2000 DNA marker; 1. PCR product of LaMCT gene.
利用InterPro Scan分析LaMCT蛋白的保守结构域,结果显示LaMCT蛋白含有类异戊二烯合成酶(isoprenoid synthase domain)保守结构域,分别位于氨基酸序列的81~299位(2-C-甲基赤藓醇-4-磷酸胞苷转移酶,IPR001228)和79~299位(核苷酸-二磷酸-糖转移酶,IPR029044),属于MCT蛋白家族成员。
根据SignalP 4.1预测,LaMCT蛋白不含信号肽,TargetP 1.1预测,显示LaMCT蛋白可能定位于叶绿体,TMHMM预测该蛋白不含跨膜域。用PredictProtein对LaMCT蛋白的二级结构进行预测,结果显示在该蛋白中α-螺旋占25.41%,β-折叠占18.81%,无规则卷曲占55.78%。以拟南芥位于叶绿体的2-C-甲基赤藓醇-4-磷酸胞苷转移酶(AtMCT,PDB ID:2yc3)为模板,用SWISS-MODEL预测LaMCT蛋白的三维结构,LaMCT蛋白与AtMCT蛋白的序列相似度为93.83%,在第77~301位氨基酸建模,模型覆盖率为75%,从预测的三维模型中可以看出,LaMCT蛋白可能以同源二聚体的形式发挥作用(图3)。
将LaMCT蛋白的氨基酸序列提交到NCBI网站,通过blastp对非冗余蛋白数据库(nr)进行比对。结果表明:LaMCT蛋白与拟南芥的定位于叶绿体的MCT蛋白(1W77A)序列相似性最高,达94%。从blastp的比对结果中选取与LaMCT蛋白质相似性较高、来源于其他植物的20条MCT蛋白质序列,包括药用植物丹参、黄芪、银杏等,模式植物拟南芥、水稻、玉米等,以及苔藓植物和蕨类植物中完成基因组测序的小立碗藓和卷柏等绘制系统进化树(图4)。从图4可以看出,LaMCT蛋白与同为十字花科植物的拟南芥(Arabidopsisthaliana)AtMCT蛋白处于同一分支上,亲缘关系较近,与长春花、丹参、黄芪、亚洲棉、葡萄、大豆等植物聚为一类,都属于被子植物中的双子叶植物;水稻、小米、玉米和高粱等禾本科植物聚为一类,属于被子植物中的单子叶植物;银杏、北美云杉和产生紫杉醇的曼地亚红豆杉,聚为一类,属于裸子植物;小立碗藓和江南卷柏在生物进化上较为原始,聚为一类,分别属于苔藓植物和蕨类植物。
2.3 LaMCT原核表达载体的构建
用EcoR I和XhoI分别对原核表达载体pET-32a和测序正确的pMD19-T-LaMCT质粒进行双酶切,切胶回收载体片段和目的基因片段,利用重组DNA技术,构建LaMCT基因的原核表达载体pET-32a-LaMCT,然后转化大肠杆菌BL21(DE3)菌株,挑取单克隆经菌落PCR鉴定无误后,提取质粒,用EcoR I和XhoI对重组质粒pET-32a-LaMCT进行双酶切检测,酶切结果显示有900 bp左右的目的基因条带和6 000 bp左右的载体条带(图5),说明LaMCT基因片段已插入到原核表达载体pET-32a中。将菌落PCR和双酶切鉴定正确的单克隆送公司测序,测序结果显示重组质粒pET-32a-LaMCT中LaMCT基因的序列与目的基因LaMCT序列一致,未发生碱基突变或移码突变,表明已成功构建了LaMCT基因的原核表达载体。
2.4 LaMCT重组蛋白的原核表达与纯化
挑取测序正确的大肠杆菌BL21(DE3)单克隆,振荡培养,当大肠杆菌生长至OD600到0.6时,在0.4 mmol·L-1IPTG、28 ℃、150 r·min-1条件下培养8 h,诱导LaMCT重组蛋白的表达,诱导完成后提取大肠杆菌总蛋白进行SDS-PAGE分析。pET-32a-LaMCT重组质粒在大肠杆菌BL21(DE3)中表达时,表达的LaMCT重组蛋白包含pET-32a载体的标签序列(Trx-Tag,His-Tag和S-Tag),总分子量为50.42 kDa。SDS-PAGE结果显示,在约50 kDa处出现目的蛋白条带,与预测的LaMCT重组蛋白分子量符合,而含有空载体pET-32a的大肠杆菌对照样品,在50 kDa处没有目的条带出现(图6)。结果表明LaMCT重组蛋白成功在大肠杆菌BL21(DE3)中表达。

图 2 LaMCT基因开放阅读框序列及对应的氨基酸序列Fig. 2 Open reading frame of LaMCT gene cDNA

图 3 LaMCT蛋白质三级结构预测Fig. 3 Prediction of three-dimensional structure of LaMCT protein
根据LaMCT重组蛋白的诱导条件,将LaMCT重组蛋白在大肠杆菌BL21(DE3)中大量表达,收集菌体,用超声裂解菌体,裂解液经离心取上清,利用Ni2+亲和层析,采用Ni Sepharose 6 Fast Flow树脂纯化目的蛋白,最终得到纯化的LaMCT重组蛋白(图6),用Bradford法测得纯化蛋白的浓度为1.25 mg·mL-1。
3 讨论
独行菜作为中医临床常用的重要中药,其所含的强心苷类化合物在化学和药理学方面的研究已有良好的基础,而关于强心苷类化合物生物合成途径及相关功能基因方面的研究较少,马利刚等(2015)首次从独行菜中克隆得到了二萜类化合物生物合成途径的关键酶牻牛儿基牻牛儿基焦磷酸合成酶(geranylgeranyl pyrophosphate synthase,GGPS)基因,并对LaGGPS基因进行了生物信息学分析和原核表达。本研究从独行菜幼苗的叶片中克隆得到了LaMCT基因,通过保守结构域预测发现该基因编码蛋白的氨基酸序列含有类异戊二烯合成酶(isoprenoid synthase domain)保守结构域(Rohdich et al,2000),通过氨基酸序列比对结果发现LaMCT蛋白与其他植物MEP途径中MCT蛋白的序列高度同源,属于MCT蛋白家族成员,表明LaMCT为独行菜强心苷类化合物生物合成MEP途径的关键酶,具有重要的研究意义(Gabrielsen et al,2006)。在植物中,第一个MCT基因是从拟南芥中克隆得到,利用RNAi技术,通过构建AtMCT基因的RNAi载体,降低拟南芥中AtMCT基因的表达量,结果导致转基因拟南芥中光合色素和贝壳杉烯(赤霉素的前体物)的含量都显著下降(李莉等,2008; Rohdich et al,2000),后来MCT基因陆续在药用植物杜仲(刘慧敏等,2014)、曼地亚红豆杉 (刘力宏等,2009)、丹参(Ma et al,2012)中被克隆,研究了MCT基因在不同组织中的表达情况,并初步进行了功能研究。

图 4 LaMCT蛋白与其他物种MCT蛋白的系统进化树分析 登录号在物种名称后,节点上的数值为通过bootstrap检验次数的百分数。Fig. 4 Phylogenetic tree of LaMCT protein and MCT proteins from other species Accession numbers are showed after the name of species, bootstrap values of the nodes represent the percentage drawn from the bootstrap test.
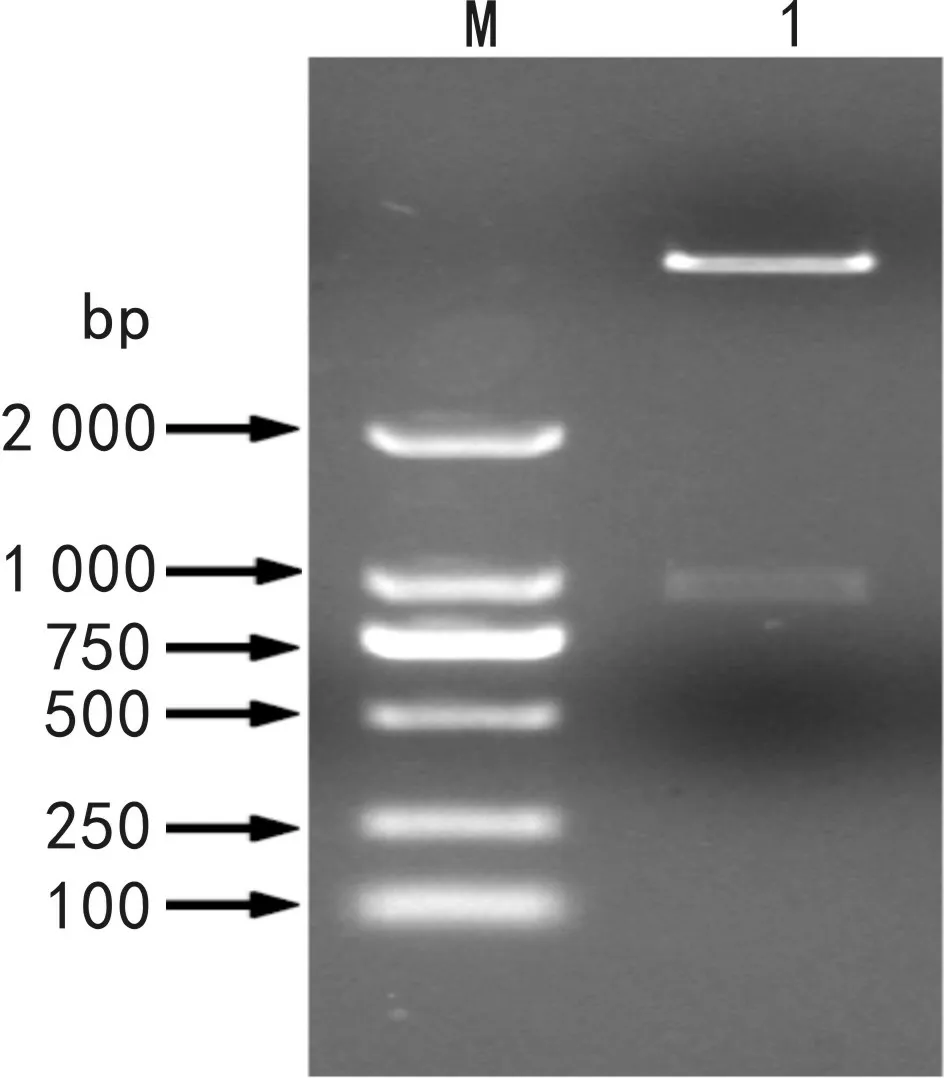
图 5 原核表达载体pET-32a-LaMCT的双酶切鉴定M. DL2000 DNA marker;1. EcoR I和Xho I双酶切。Fig. 5 Identification of prokaryotic expression vector pET-32a-LaMCT with double digestion M. DL2000 DNA marker; 1. Double digestion results by EcoR I and Xho I.

图 6 重组LaMCT蛋白的原核表达与纯化 M. 蛋白分子量标准;C. 含pET-32a空载体的E. coli菌株作为对照;1. IPTG诱导的含pET- 32a- LaMCT质粒的E. coli菌株;2. 纯化的LaMCT重组蛋白。箭头显示为LaMCT重组蛋白。Fig. 6 Prokaryotic expression and purification of recombinant LaMCT protein M. Protein marker; C. E. coli containing pET-32a used as control; 1. E. coli containg pET-32a- LaMCT under IPTG inducement; 2. The purified recombinant LaMCT protein. The arrows show the recombinant LaMCT proteins.
强心苷类化合物作为植物甾醇的一种,具有强心、保护心肌和改善心血管功能等作用,但是在独行菜中强心苷类化合物的含量很低,不能满足临床需求,所以如何提高独行菜中强心苷类化合物的含量具有重要的研究意义。近年来随着对植物次生代谢途径(如甾醇类化合物、丹参酮和紫杉醇等生物合成途径)及其关键酶基因研究的深入,越来越多关键酶基因被克隆,功能被阐明,通过基因工程和合成生物学的方式对药用植物进行遗传改良,提高药用植物体内甾醇类化合物、丹参酮和紫杉醇的产量,已成为最有发展潜力的产业之一。本研究首次从独行菜幼苗的叶片中克隆了MCT基因,通过构建原核表达载体pET-32a-LaMCT,成功在大肠杆菌BL21(DE3)菌株中诱导表达出LaMCT重组蛋白,并且目的蛋白表达量较高,pET-32a载体(含有Trx-Tag、S-Tag标签)以及大肠杆菌BL21(DE3)菌株可以增加细胞质中表达的外源重组蛋白质二硫键的形成,帮助蛋白质的折叠,提高外源重组蛋白的可溶性,利用pET-32a载体表达的外源重组蛋白N端带有6个His-Tag标签,方便纯化重组蛋白(Rosano and Ceccarelli,2014),所以采用Ni2+亲和层析的方法得到纯化的LaMCT重组蛋白,为下一步LaMCT蛋白抗体的制备以及研究LaMCT基因在独行菜强心苷类化合物生物合成途径中的功能奠定了基础,研究结果将有助于深入认识独行菜强心苷类化合物生物合成途径及其调控机制,填补独行菜在功能基因研究方面的空白,有助于加速药用植物优良品种选育,为今后对独行菜进行遗传改良提供候选基因。
CAPELL T, CHRISTOU P, 2004. Progress in plant metabolic engineering [J]. Curr Opin Biotechnol, 15(2): 148-154.
CHEN J, ZHAO DG, 2005. Research advances on the enzymes and their coding gene involved in plant terpene biosynthesis [J]. Mol Plant Breed, 2(6): 757-764. [陈建,赵德刚,2005.植物萜类生物合成相关酶类及其编码基因的研究进展 [J].分子植物育种,2(6):757-764.]
EISENREICH W, BACHER A, ARIGONI D, et al, 2004. Biosynthesis of isoprenoids via the non-mevalonate pathway [J]. Cell Mol Life Sci, 61(12): 1401-1426.
GABRIELSEN M, KAISER J, ROHDICH F, et al, 2006. The crystal structure of a plant 2C-methyl-D-erythritol 4-phosphate cytidylyltransferase exhibits a distinct quaternary structure compared to bacterial homologues and a possible role in feedback regulation for cytidine monophosphate [J]. FEBS J, 273(5): 1065-1073.
LI HW, ZHENG XK, GONG JH, et al, 2013. Research progress in chemical constituents ofLepidiumapetalumandDescurainiasophiaand their pharmacological activities [J]. Drug Eval Res, 36(3): 235-240. [李红伟,郑晓珂,弓建红,等,2013.独行菜和播娘蒿化学成分及药理作用研究进展 [J].药物评价研究,36(3):235-240.]LI L, GAO LY, DONG Y, et al, 2008. Advances of enzymes and its genes in plant isoprenoids biosynthesis pathway [J]. J Zhejiang Norm Univ: Nat Sci Ed, 31(4): 461-466. [李莉,高凌云,董越,等,2008.植物类异戊二烯生物合成相关酶基因研究进展 [J].浙江师范大学学报·自然科学版,31(4):461-466.]
LIU HM, WANG L, XU JS, et al, 2014. Expression differences of several genes inEucommiaMEP pathway [J]. J Cent S Univ For Technol, 34(2): 26-33. [刘慧敏,王淋,许靖诗,等,2014.杜仲MEP途径系列基因表达差异的研究 [J].中南林业科技大学学报,34(2):26-33.]
LIU WH, YAO B, ZHU SQ, et al, 2009. Advances in studies on biosynthetic pathway of taxol precursor and its correlative biotechnology [J]. Chin Trad Herb Drugs, 40(8): 1327-1331. [刘万宏,姚波,祝顺琴,等,2009.紫杉醇前体生物合成途径及生物技术研究进展 [J].中草药,40(8):1327-1331.]MA Y, YUAN L, WU B, et al, 2012. Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis inSalviamiltiorrhiza[J]. J Exp Bot, 63(7): 2809-2823.
MANG LG, ZHAO L, LI YC, et al, 2015. Cloning, sequence analysis and prokaryotic expression of GGPS gene fromLepidiumapetalum[J]. World Sci Technol/Modern Trad Chin Med Mat Med, 17(3): 485-491. [马利刚,赵乐,李英超,等,2015.北葶苈子GGPS基因的克隆,序列分析与原核表达 [J]. 世界科学技术:中医药现代化,17(3):485-491.]
ROHDICH F, WUNGSINTAWEEKUL J, EISENREICH W, et al, 2000. Biosynthesis of terpenoids: 4-diphosphocytidyl-2C- methyl-D-erythritol synthase ofArabidopsisthaliana[J]. Proc Nat Acad Sci USA, 97(12): 6451-6456.
ROSANO GL, CECCARELLI EA, 2014. Recombinant protein expression inEscherichiacoli: advances and challenges [J]. Front Microbiol, 5: 172.
TAMURA K, DUDLEY J, NEI M, et al, 2007. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Mol Biol Evol, 24(8): 1596-1599.
ZHANG CB, SUN HX, GONG ZJ, et al, 2007. Plant terpenoid natural metabolism pathway and their synthesis [J]. Plant Physiol J, 43(4): 779-786. [张长波,孙红霞,巩中军,等,2007.植物萜类化合物的天然合成途径及其相关合酶 [J].植物生理学报,43(4): 779-786.]ZHOU XD, TANG LY, ZHOU GH, et al, 2014. Advances onLepidiiSemenandDescurainiaeSemen[J]. Chin J Chin Mat Med, 39(24): 4699-4708. [周喜丹,唐力英,周国洪,等,2014.南北葶苈子的最新研究进展 [J].中国中药杂志,39(24):4699-4708.]
Cloning, sequence analysis and prokaryotic expression ofLaMCTgene fromLepidiumapetalum
ZHAO Le1,2, MA Li-Gang1,2, Li Xiao-Yang1, FENG Wei-Sheng1,2, ZHENG Xiao-Ke1,2*
( 1. School of Pharmacy, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China; 2. CollaborativeInnovationCenterforRespiratoryDiseaseDiagnosisandTreatment&ChineseMedicineDevelopmentofHenanProvince, Zhengzhou 450046, China )
The active components ofLepidiumapetalum, cardiac glycosides have been well studied both chemically and pharmacologically, but little is known about the cardiac glycosides biosynthesis pathway. Using cultivated seedlings as material, the transcriptome data ofLepidiumapetalum, designing specific primers and using PCR method, an open reading frame(ORF) of key enzyme 2-C-methylerythritol-4-phosphate cytidylyltransferase (MCT) gene which involved in MEP pathway was isolated and named asLaMCT(GenBank accession no. KT832554). The sequence analysis and prokaryotic expression were also performed. Sequence analysis showed thatLaMCThas an ORF of 912 bp, which encoded a protein of 304 amino acid residues. Subcelluar localization and conserved domain analysis indicated that LaMCT protein located in chloroplast had no signal peptide and transmembrane domain, but had a isoprenoid synthase conserved domain. Phylogenetic analysis revealed that LaMCT protein showed the highest homology, 94% similarity, with MCT protein fromArabidopsisthaliana. Through the construction of pET-32a-LaMCTvector, the recombinant LaMCT protein was successfully expressed inEscherichiacoliBL21 (DE3) cells. Finally, the recombinant LaMCT protein was purified through Ni2+affinity chromatography. TheLaMCTgene was cloned fromL.apetalum, and the stable prokaryotic expression system of pET-32a-LaMCTwas constructed. This study will provide some basic information for the further antibody preparation of LaMCT protein and would be helpful in functional research ofLaMCTgene involved in cardiac glycosides biosynthesis pathway.
Lepidiumapetalum, MCT, gene cloning, sequence analysis, prokaryotic expression
10.11931/guihaia.gxzw201510007
2015-11-29
2016-03-14
国家重点基础研究发展计划“973”项目(2013CB531802);河南中医学院博士科研基金(BSJJ2011-07)[Supported by National Program on Key Basic Research Project (2013CB531802); Doctoral Research Fund of Henan Chinese Medicine (BSJJ2011-07)]。
赵乐(1983-),男,河南周口人,博士,讲师,主要从事药用植物分子生物学研究,(E-mail) zhaole1983@126.com。
郑晓珂,博士,教授,博士生导师,主要从事中药活性成分及作用机制研究,(E-mail) zhengxk.2006@163.com。
Q943.2
A
1000-3142(2016)10-1225-08
赵乐,马利刚,李晓阳,等. 独行菜LaMCT基因的克隆、序列分析与原核表达 [J]. 广西植物,2016,36(10):1225-1231
ZHAO L, MA LG, Li XY,et al. Cloning, sequence analysis and prokaryotic expression ofLaMCTgene fromLepidiumapetalum[J]. Guihaia,2016,36(10):1225-1231
