SO2胁迫对红花檵木光合速率和叶绿素荧光参数的影响
2016-11-11侯利钦周兰英蒲光兰戴晓会
侯利钦,周兰英,蒲光兰,戴晓会
(四川农业大学 林学院,四川 雅安 625014)
SO2胁迫对红花檵木光合速率和叶绿素荧光参数的影响
侯利钦,周兰英,蒲光兰,戴晓会
(四川农业大学 林学院,四川 雅安 625014)
【目的】 了解不同质量浓度SO2对红花檵木光合速率及叶绿素荧光参数的影响,为园林植物的栽培与利用提供理论依据。【方法】 采用人工模拟熏气法,以0(对照),2.86,5.71和14.28 mg/m34个SO2质量浓度对红花檵木进行密闭熏气3 d,1周后利用LI-6400光合仪和PAM-2500便携式荧光仪分别测定叶片光合参数及叶绿素荧光参数,研究SO2胁迫对红花檵木光合特性的影响。【结果】 随着SO2质量浓度的增加,红花檵木叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)下降,胞间CO2浓度(Ci)上升;初始荧光(Fo)增加,其中14.28 mg/m3SO2处理比对照显著增加23.71%;最大荧光产量(Fm)、PSⅡ的最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)降低,其中14.28 mg/m3SO2处理下Fv/Fo较对照下降51.75%。不同SO2质量浓度下各叶绿素荧光参数的光响应结果表明,随着光强的增加,PSⅡ实际光合量子产量Y(Ⅱ)、光化学淬灭系数qP下降,非光化学淬灭系数qN、PSⅡ光合电子传递速率ETR上升。【结论】 5.71 和14.28 mg/m3SO2处理会引发红花檵木PSⅡ反应中心比例降低,光合电子传递受阻,PSⅡ色素吸收的光能用于光化学电子传递的份额减少,光能转化效率和潜在活性降低,进而影响植株的正常光合作用。
SO2胁迫;红花檵木;光合速率;叶绿素荧光
近年来,我国各大城市空气质量状况持续下降,反映出我国当前最严重的问题就是环境污染。在各种环境问题中,大气污染是亟需解决的首要问题[1]。SO2是大气污染物的主要成分之一,其在大气中分布广泛、排放量大,有“大气污染的元凶”之称[2],在一些发达的工业城市污染尤其严重,对生态系统有明显的影响。SO2所含的硫元素是植物生长的必需元素,但过量的SO2则会对植物造成胁迫。研究表明过量的SO2会影响植物的新陈代谢[3]、生长发育[4]、相关基因的表达[5]等。对植物生长发育有重要作用的光合系统对SO2胁迫更为敏感,如过量的SO2会引起植物叶片净光合速率、气孔导度、蒸腾速率等的变化,改变叶绿体类囊体膜上光系统反应中心色素和聚光色素的组成比例[6],同时会改变PSⅠ和PSⅡ的能量分配,妨碍光合作用的碳同化,降低电子传递速率[7],最终导致PSⅡ反应中心部分失活[3]。叶绿素荧光参数包含着光合作用过程的重要信息,在探测逆境对光合作用影响方面具有独特的作用,能够反映光合系统的“内在性”特点[8-9],被视为研究植物光合作用与环境关系的内在探针,目前已广泛应用于植物生态[10]、逆境生理[11]等方面。越来越多的研究都把光合系统的变化作为判断植物响应环境变化的重要指标。
红花檵木(Loropetalumchinensevar.rubrum)为金缕梅科(Hamamelidaceae)檵木属常绿灌木,主要分布在长江流域及以南地区。由于其较高的观赏价值和较强的生态适应性,被作为城市园林绿化的重要树种,一度成为研究的热点。目前关于红花檵木的研究主要集中在扦插繁殖、遗传多样性[12]、叶色变化[13]、组织培养技术[14]、高温和重金属胁迫[15]等方面,而关于SO2胁迫下红花檵木光合系统方面的内容少见报道。本试验选用盆栽红花檵木为试验材料,研究其在SO2胁迫下的光合作用参数及叶绿素荧光参数变化,分析SO2胁迫下红花檵木叶片光合能力和PSⅡ光能利用与能量分配以及电子传递效率的变化,为揭示其叶片光合机构对 SO2的生理代谢响应机制和抗硫植物的筛选提供参考。
1 材料与方法
1.1材料
供试材料为3年生红花檵木,由四川省成都市温江花卉园艺公司提供。将其种植于直径为15 cm、装有3 kg土壤的黑色塑料盆中。培养盆放置于四川农业大学熏气室中,每隔 2 d 浇1次水,选取生长状况一致的红花檵木苗作为本研究的试验材料。
1.2SO2处理方法
试验按SO2质量浓度分为0(对照),2.86,5.71和14.28 mg/m34个处理,每处理3次重复,每重复15株植株。熏香由碎木屑和硫磺粉均匀混合制成。经SO2测定仪(Z-1300,USA)测量,空气中平均每支熏香燃放后释放的SO2质量浓度约为0.71 mg/m3,因此各处理SO2质量浓度分别约为每支熏香释放SO2质量浓度的0,4,8和20倍。
试验前1周,将试验材料置于27 m3(3 m×3 m×3 m)的熏气室内。2014年7月1-3日每天08:00-20:00,按照各处理设计的SO2质量浓度,点燃熏香进行密闭熏气处理,熏香燃放的高度离地面0.5 m,每天熏气12 h结束后打开熏气室和顶棚。
1.3指标测定
2014-07-10,从每个处理中随机选3棵植株,每棵植株选取由顶端开始第3-4片叶,测定光合特性指标及叶绿素荧光参数,结果取平均值。
1.3.1光合特性指标采用LI-6400光合仪(LI-COR,美国)测定叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。
1.3.2叶绿素荧光参数采用PAM-2500(Walz,德国)测定叶绿素荧光参数。荧光参数光响应曲线根据 White等[16]的方法进行测绘。测定前,叶片暗适应20 min,然后开启检测光(0.15 μmol/(m2·s))得到叶绿素荧光参数初始荧光(Fo),再由饱和脉冲光(4 000 μmol/(m2·s),0.8 s)测得最大荧光Fm。计算出可变荧光Fv(Fv=Fm-Fo)、PSⅡ最大光化学效率Fv/Fm和PSⅡ潜在光化学效率Fv/Fo。利用PAM-2500测定叶片的快速光响应曲线,将叶片暴露于连续光强(PAR)梯度(0,10,20,50,100,150,200,250,350,500,650,800,1 250和1 500 μmol/(m2·s))下,测定PSⅡ的实际光合量子产量[Y(Ⅱ)]、光化学淬灭系数(qP)、非光化学淬灭系数(qN)、表观电子传递速率(ETR)等参数值,上述参数均由选定模式下的系统自动生成。
1.4数据分析
用Excel 2013进行数据整理、计算、作图,使用SPSS 20.0软件对不同质量浓度SO2胁迫下红花檵木叶片光合特性指标进行相关性分析,对叶绿素荧光参数进行单因素方差分析,并采用LSD法进行多重比较分析。
2 结果与分析
2.1不同质量浓度SO2对红花檵木叶片光合速率的影响
由表1可知,不同质量浓度SO2对红花檵木叶片光合参数的影响各不相同。随着SO2质量浓度的增加,叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)的变化均表现为先增加后降低。低质量浓度SO2处理(2.86 mg/m3)下各指标值与对照无显著差异;高质量浓度SO2处理(14.28 mg/m3)下Pn、Gs、Tr分别比对照显著降低55.97%,41.07%和48.49%,Ci比对照增加6.51%。相关性分析显示,Pn与Gs(r=0.968*)和Tr(r=0.967*)均呈显著的正相关关系,而与Ci呈负相关关系(r=-0.555)。

表 1 不同质量浓度SO2处理下红花檵木叶片光合特性的比较Table 1 Effects of different SO2 mass concentrations on photosynthetic characteristics of Loropetalum chinense var.rubrum
注:同列数据后标不同英文字母者表示差异显著(P<0.05)。表2同。
Note:Different letters in each column show significant difference(P<0.05).The same for Table 2.
2.2SO2胁迫对红花檵木叶片Fo、Fm、Fv/Fm和Fv/Fo的影响
初始荧光Fo与PSⅡ反应中心活性有关[13]。由表2可知,充分暗适应下,与对照相比,红花檵木叶片初始荧光Fo除2.86 mg/m3SO2处理下降外,5.71和14.28 mg/m3SO2处理的红花檵木Fo均显著(P<0.05)增加,其中14.28 mg/m3SO2处理的Fo较对照增加了23.71%,最为显著。

表 2 不同质量浓度SO2处理下红花檵木叶片叶绿素荧光参数的比较Table 2 Effects of different SO2 mass concentrations on chlorophyll fluorescence parameters ofLoropetalum chinense var.rubrum
最大荧光产量(Fm)是PSⅡ反应中心处于完全关闭时的荧光产量,可以反映通过PSⅡ的电子传递情况。由表2可知,随着SO2质量浓度的增加,各处理Fm值均较对照显著降低,5.71 mg/m3与 14.28 mg/m3SO2处理之间无显著性差异,14.28 mg/m3SO2处理的Fm较对照显著降低了 28.48%。
荧光参数最大光化学效率(Fv/Fm)和潜在活性(Fv/Fo),常用于度量植物叶片PSⅡ反应中心捕获激发能的效率和PSⅡ潜在活性,是光化学反应的2个重要参数[17]。由表2可知,与对照相比,各处理的Fv/Fm和Fv/Fo均降低,其中5.71和14.28 mg/m3SO2处理的Fv/Fm、Fv/Fo均显著降低,14.28 mg/m3SO2处理的Fv/Fm较对照下降了16.73%,Fv/Fo较对照下降了51.75%。这表明在2.86 mg/m3SO2处理下,红花檵木叶片PSⅡ反应中心仍然具有捕获激发能的效率及潜在活性,可以经过一段时间的恢复来维持自身暗反应,而14.28 mg/m3SO2处理则降低了红花檵木PSⅡ的潜在光能转化效率。
2.3SO2胁迫下红花檵木叶片Y(Ⅱ)、qP、qN与ETR的光响应
Y(Ⅱ)是PSⅡ实际光合量子产量,指示植物在一段时间内持续地对光能的有效转化能力[18],该值越大表明PSⅡ光能转化率越高,则PSⅡ活性越强。由表3可知,各处理的Y(Ⅱ)随着光强的增加总体呈降低的趋势,2.86和 0 mg/m3SO2处理下Y(Ⅱ)总体水平高于5.71和14.28 mg/m3SO2处理;在光强大于500 μmol/(m2·s)时,14.28 mg/m3SO2处理下的Y(Ⅱ)小于5.71 mg/m3SO2处理,说明14.28 mg/m3SO2胁迫后的红花檵木在光强大于500 μmol/(m2·s)的环境下对光能的有效转化能力降低。
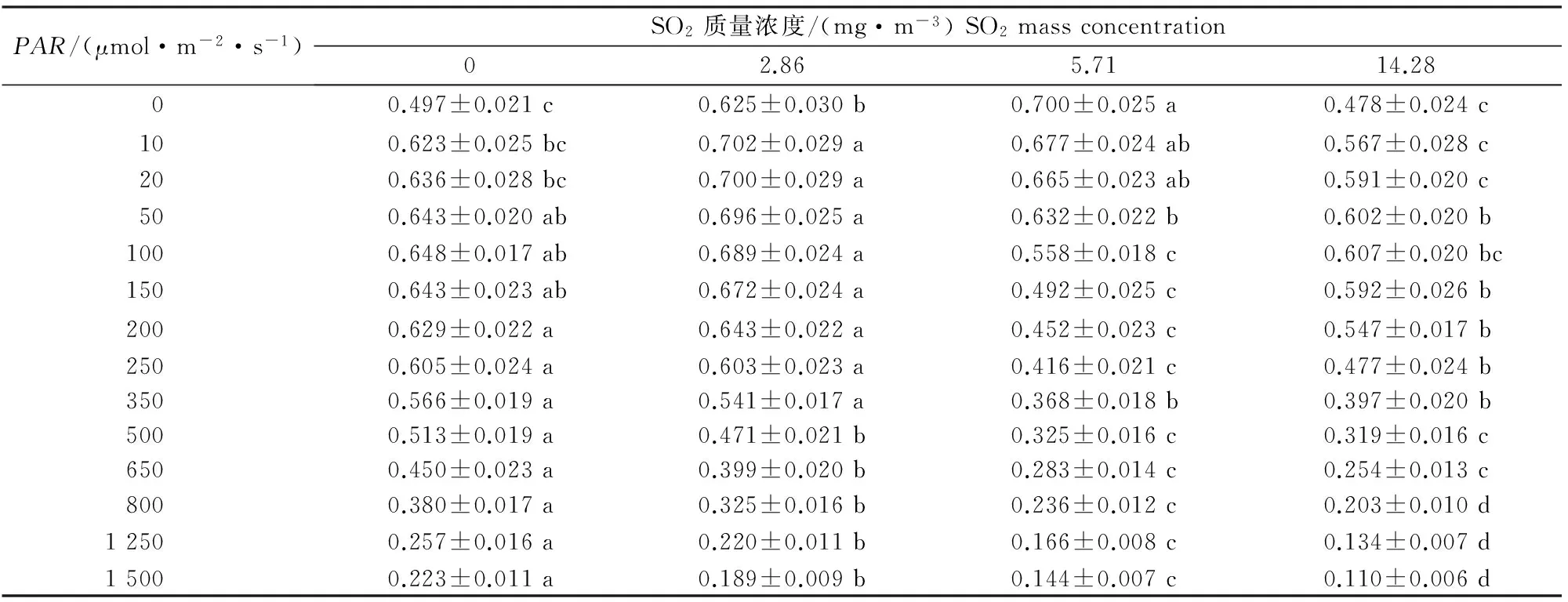
表 3 不同质量浓度SO2处理下红花檵木Y(Ⅱ)的快速光响应变化Table 3 Rapid light-response of Y(Ⅱ) of Loropetalum chinense var.rubrum to different SO2 mass concentrations
注:同行数据后标不同英文字母者表示差异显著(P<0.05)。表4-6同。
Note:Different letters in each row show significant difference (P<0.05).The same for Tables 4-6.
荧光光化学淬灭系数qP指PSⅡ天线色素吸收光能后,用于光合作用电子传递的份额,反映了PSⅡ天线色素吸收的光能用于光化学电子传递的比例[19]。由表4可知,同一光强下,随着SO2质量浓度的增加,红花檵木的qP总体呈现降低的趋势,这反映了高质量浓度的SO2对红花檵木光合作用的电子传递有抑制作用。
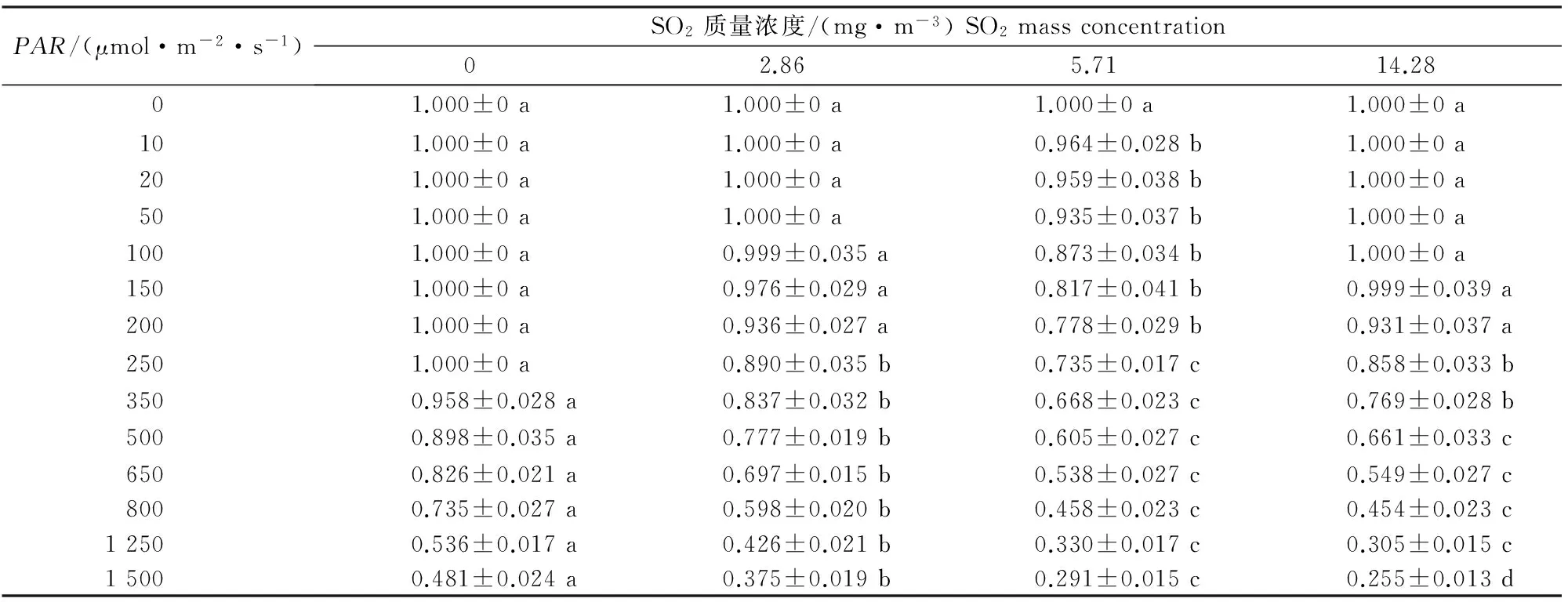
表 4 不同质量浓度SO2处理下红花檵木qP的快速光响应变化Table 4 Rapid light-response of qP of Loropetalum chinense var.rubrum to different SO2 mass concentrations
荧光非光化学淬灭系数qN反映PSⅡ反应中心对天线色素吸收过量光能后以热能形式耗散掉的光能部分[20]。非光化学淬灭过程是植物的一种自我保护机制,能对处于逆境胁迫的植物光合机构起到一定的保护作用[21]。本研究中,qN的变化与qP相反(表5),即qN随着光强的增加而上升。最大光强下,14.28 mg/m3SO2处理下qN较对照显著升高了36.78%,2.86 mg/m3SO2处理下qN值与对照差异不显著。说明2.86 mg/m3SO2处理对红花檵木 PS Ⅱ 光合作用的电子传递份额无明显影响,而14.28 mg/m3SO2处理的植物吸收过量光能后不能及时以热能的形式耗散,从而造成光合机构失活或破坏。
PSⅡ光合电子传递速率ETR反映实际光强下的表观电子传递效率,用于度量光化学反应用于碳固定的电子传递情况[21-22]。由表6可知,各处理随光强的增加ETR均呈上升趋势;在光强超过500 μmol/(m2·s)后,随SO2质量浓度升高ETR降低。在最大光强下,14.28 mg/m3SO2处理的ETR显著低于对照,相比对照下降了50.88%,这表明PSⅡ光合电子传递受阻,意味着此质量浓度SO2处理下光合作用中心结构可能有所受损。
3 讨论与结论
光合作用是植物生长和物质积累的基础,在植物的生长发育过程中具有重要意义。光合作用的强弱可作为判断植物生长状况和抗逆性的指标。本研究中,低质量浓度SO2(2.86 mg/m3)处理对红花檵木的Pn、Gs、Ci、Tr均无显著影响,植株表现出较强的光合能力。高质量浓度SO2(14.28 mg/m3)处理使Pn、Gs、Tr显著下降,Ci显著上升,可能是由于在高质量浓度SO2环境下,红花檵木光合系统受到损害,导致CO2固定能力下降。
与表观的光合指标相比,叶绿素荧光参数更能反映植物光合系统的内在特性。叶绿素荧光常用于评价光合机构的功能和环境胁迫对其的影响[23]。植物的荧光参数与SO2污染程度之间具有一定的相关性,不同植物的荧光参数对SO2污染的响应存在显著差别[24]。本研究中,红花檵木Fm、Fv/Fm、Fv/Fo随着SO2胁迫质量浓度的增加而降低,其中Fv/Fm是衡量植物光合性能的重要指标,也是目前使用最多的一个荧光参数。在非胁迫条件下,植物叶片的Fv/Fm较恒定,一般介于 0.80~0.85[25]。本试验中,对照和2.86 mg/m3SO2处理的Fv/Fm都在此范围内,可以认为2.86 mg/m3SO2处理并未对红花檵木的正常生长造成影响,而14.28 mg/m3SO2处理下Fv/Fm则显著低于此区间值,可以推测此高质量浓度SO2会抑制红花檵木的光合作用。
光化学淬灭系数qP和非光化学淬灭系数qN的变化反映了叶片对激发能利用的情况[26]。本研究结果中,qP和qN随光强的增加表现出相反的变化趋势。在光强大于250 μmol/(m2·s)后,同一光强下,5.71和14.28 mg/m3SO2处理下qN显著高于其他处理,表明强光下红花檵木叶片叶黄素循环系统充分启动,用来防止过剩激发能对光合机构的破坏,由此可以认为红花檵木仍然能忍耐这一质量浓度的SO2,具有较强的SO2适应性及自我修复能力。本研究中在光强达到一定值后,Y(Ⅱ)、qP、ETR均随SO2质量浓度增加而下降,说明在高质量浓度SO2胁迫下,红花檵木PSⅡ原初电子受体QA的重新氧化能力减弱,PSⅡ的电子传递活性下降,引起碳同化降低,导致还原态QA所携带的电子难以传递到其后的电子传递体上,使得整个光合电子传递过程受阻。
综上所述,不同质量浓度的SO2处理导致红花檵木Pn、Gs、Tr下降,Ci上升;Fm、Fv/Fm、Fv/Fo下降,Fo上升;Y(Ⅱ)、qP、ETR下降,qN上升。2.86 mg/m3SO2处理对红花檵木PSⅡ的实际光合量子产量及电子传递速率无显著影响,5.71和 14.28 mg/m3SO2处理会引起红花檵木PSⅡ反应中心光合电子传递受阻,PSⅡ色素吸收的光能用于光化学电子传递的份额减少,光能转化效率和潜在活性降低,光合系统受到损害,CO2固定能力降低,进而影响植株的正常光合作用。
[1]边红枫,刘静玲.我国城市大气污染及其生物防治对策研究 [J].东北师大学报(自然科学版),2001(1):79-83.
Bian H F,Liu J L.Air pollution and bio-control study in Chinese city [J].Journal of Northeast Normal University (Natural Science Edition),2001(1):79-83.
[2]曹洪法.我国大气污染及其对植物的影响 [J].生态学报,1990,10(1):7-12.
Cao H F.Air pollution and its effects on plants in China [J].Acta Ecologica Sinica,1990,10(1):7-12.
[3]高吉喜,潘凤云,周兴宝.二氧化硫对植物新陈代谢的影响:Ⅱ.对光合、呼吸与物质代谢的影响 [J].环境科学研究,1997(6):8-12.
Gao J X,Pan F Y,Zhou X B.Effects of SO2on plant metabolism:Ⅱ.Effects on photosynthesis,respiration and nutrient material metabolism [J].Research of Environmental Sciences,1997(6):8-12.
[4]俞飞,殷秀敏,伊力塔,等.酸雨对杉木幼苗叶绿素荧光及生长量的影响 [J].东北林业大学学报,2014,42(1):6-9.
Yu F,Yin X M,Yi L T,et al.Effects of acid rain on chlorophyll fluorescence in leaf and growth of Chinese fir seedlings [J].Journal of Northeast Forestry University,2014,42(1):6-9.
[5]李利红.二氧化硫胁迫下拟南芥防御基因的差异表达及表观遗传调控机制研究 [D].太原:山西大学,2012.
Li L H.Study of differential expression of defense-related genes and epigenetic mechanism ofArabidopsisin response to sulfur dioxide [D].Taiyuan:Shanxi University,2012.
[6]关岚岚,刘楠,韦强,等.华南地区8种藤本植物叶绿素荧光特性对模拟二氧化硫污染的响应 [J].热带亚热带植物学报,2008(2):95-103.
Guan L L,Liu N,Wei Q,et al.Responses of chlorophyll fluorescence to simulated SO2pollution in eight liana species in South China [J].Journal of Tropical and Subtropical Botany,2008(2):95-103.
[7]Okpodu C M,Alscher R G,Grabau E A,et al.Physiological,biochemical and molecular effects of sulfur dioxide [J].Journal of Plant Physiology,1996,148(3):309-316.
[8]林世青,许春辉,张其德,等.叶绿素荧光动力学在植物抗性生理学、生态学和农业现代化中的应用 [J].植物学通报,1992,9(1):1-16.
Lin S Q,Xu C H,Zhang Q D,et al.Some application of chlorophyll fluorescence kinetics to plant stress physiologyphy teocology and agricultural modernization [J].Chinese Bulletin of Botany,1992,9(1):1-16.
[9]李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用 [J].植物生理与分子生物学学报,2005,31(6):559-566.
Li P M,Gao H Y,Strasser R J.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study [J].Journal of Plant Physiology and Molecular Biology,2005,31(6):559-566.
[10]衣艳君,李芳柏,刘家尧.尖叶走灯藓(Plagiomniumcuspidatum)叶绿素荧光对复合重金属胁迫的响应 [J].生态学报,2008(11):5437-5444.
Yi Y J,Li F B,Liu J Y.Physiological response of chlorophyll fluorescence in mossPlagiomniumcuspidatumto mixture heavy metal solution [J].Acta Ecologica Sinica,2008(11):5437-5444.
[11]万雪琴,张帆,夏新莉,等.镉处理对杨树光合作用及叶绿素荧光参数的影响 [J].林业科学,2008(6):73-78.
Wan X Q,Zhang F,Xia X L,et al.Effects of cadmium on photosynthesis and chlorophyll fluorescence parameters of solution-cultured poplar plants [J].Scientia Silvae Sinicae,2008(6):73-78.
[12]唐前瑞.红花檵木遗传多样性及其叶色变化的生理生化研究 [D].长沙:湖南农业大学,2001.
Tang Q R.Study on the genetic diversity amongLoropetalumchinensevar.rubrumintroductions and changes of physiology and biochemistry during its leaf colour transformation [D].Changsha:Hunan Agricultural University,2001.
[13]袁明,万兴智,杜蕾,等.红花檵木叶色变化机理的初步研究 [J].园艺学报,2010,37(6):949-956.
Yuan M,Wan X Z,Du L,et al.Mechanism on leaf color transformation ofLoropetalumchinenseOlive var.rubrum[J].Acta Horticulturae Sinica,2010,37(6):949-956.
[14]李炎林,于晓英,熊兴耀,等.红花檵木花粉单倍体愈伤组织的诱导与培养 [J].湖南农业大学学报(自然科学版),2012,37(6):632-636.
Li Y L,Yu X Y,Xiong X Y,et al.Induction and cultivation of haploid callus ofLoropetalumchinensevar.rubrum[J].Journal of Hunan Agricultural University (Natural Sciences),2012,37(6):632-636.
[15]王妙媛.Pb2+、Cd2+胁迫对红花檵木生长及生理生化特性的影响 [D].长沙:湖南农业大学,2011.
Wang M Y.Effect of Pb2+and Cd2+stress on the growth and physiological and biochemical characteristics ofLoropetalumchinensevar.rubrum[D].Changsha: Hunan Agricultural University,2011.
[16]White A J,Critchley C.Rapid light curve:a new fluorescence method to assess the state of the photosynthetic apparatus [J].Photosynthesis Research,1999,59:63-72.
[17]李志军,罗青红,伍维模,等.干旱胁迫对胡杨和灰叶胡杨光合作用及叶绿素荧光特性的影响 [J].干旱区研究,2009(1):45-52.
Li Z J,Luo Q H,Wu W M,et al.The effects of drought stress on photosynthetic and chlorophyll fluorescence characteristics ofPopuluseuphraticaandP.pruinosa[J].Arid Zone Research,2009(1):45-52.
[18]Kramer D M,Johnson G,Kiirats O,et al.New fluorescence parameters for the determination of QA redox state and excitation energy fluxes [J].Photosynthesis Research,2004,79(2):209-218.
[19]林栋,冯朝阳,吕世海,等.短尾铁线莲叶绿素荧光特性研究 [J].西北植物学报,2008(11):2299-2305.
Lin D,Feng C Y,Lü S H,et al.Chlorophyll fluorescence chracrerisrics ofClematisbrevicaudata[J].Acta Bot Boreal Occident Sin,2008(11):2299-2305.
[20]钱永强,周晓星,韩蕾,等.Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响 [J].生态学报,2011(20):6134-6142.
Qian Y Q,Zhou X X,Han L,et al.Rapid light-response curves of PSⅡchlorophyll fluorescence parameters in leaves ofSalixleucopitheciasubjected to cadmium-ion stress [J].Acta Ecologica Sinica,2011(20):6134-6142.
[21]张守仁. 叶绿素荧光动力学参数的意义及讨论 [J].植物学通报,1999,16(4):444.
Zhang S R.Some application of chlorophyll fluorscence kinetics to plant stress physiologyphy teocology and agricultural modernization [J].Chinese Bulletin of Botany,1999,16(4):444.
[22]陈梅,唐运来.高温胁迫下苋菜的叶绿素荧光特性 [J].生态学杂志,2013(7):1813-1818.
Chen M,Tang Y L.Chlorophyll fluorescence characteristics ofAmaranthustricolorL.under high temperature stress [J].Acta Ecologica Sinica,2013(7):1813-1818.
[23]康博文,李文华,刘建军,等.ALA对红掌叶片光合作用及叶绿素荧光参数的影响 [J].西北农林科技大学学报(自然科学版),2009,37(4):97-102.
Kang B W,Li W H,Liu J J,et al.Effects of ALA treatment on photosynthetic and chlorophyll fluorescence dynamics ofAnthuriumandraeanum[J].Journal of Northwest A&F University(Nat Sci Ed),2009,37(4):97-102.
[24]洪渊,张冬鹏,黄俊华.硫污染对9 种园林植物叶片硫含量与叶绿素荧光参数的影响 [J].生态科学,2008(6):558-560.
Hong Y,Zhang D P,Huang J H.Effect of SO2on leave’s sulfur content and chlorophyll fluorescence of gardens plants in Shenzhen [J].Acta Ecologica Sinica,2008(6):558-560.
[25]Genty B,Briantais J,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].Biochimica et Biophysica Acta (BBA)-General Subjects,1989,990(1):87-92.
[26]鲁艳,李新荣,何明珠,等.不同浓度 Ni、Cu 处理对骆驼蓬光合作用和叶绿素荧光特性的影响 [J].应用生态学报,2011,22(4):936-942.
Lu Y,Li X R,He M Z,et al.Influence of different concentration Ni and Cu on the photosynthesis and chlorophyll fluores-cence characteristics ofPeganumharmala[J].Chinese Journal of Applied Ecology,2011,22(4):936-942.
Effects of SO2stress on photosynthetic rate and chlorophyll fluorescence parameters ofLoropetalumchinensevar.rubrum
HOU Liqin,ZHOU Lanying,PU Guanglan,DAI Xiaohui
(CollegeofForestry,SichuanAgriculturalUniversity,Ya’an,Sichuan625014,China)
【Objective】 This study investigated the effects of SO2stress on photosynthetic rate and chlorophyll fluorescence parameters in leaves ofLoropetalumchinensevar.rubrumto improve its cultivation and utilization.【Method】 The influence of SO2onL.chinensevar.rubrumwas studied by fumigation for 3 d in this experiment.There were four SO2treatments with concentrations of 0(CK),2.86,5.71,14.28 mg/m3,respectively.After one week,LI-6400 photosynthesis system and PAM-2500 portable X-ray fluorescence spectrometer were used to measure leaf photosynthetic parameters and chlorophyll fluorescence parameters ofL.chinensevar.rubrum.【Result】 With the increase of SO2concentration,net photosynthetic rate (Pn),stomatal conductance (Gs) and transpiration rate (Tr) decreased,while intercellular CO2(Ci) increased.Concentration of dark fluorescence yield (Fo) also increased and its highest concentration increased significantly by 23.71% compared to CK.Maximum fluorescence yield (Fm),maximum PSⅡ quantum yield (Fv/Fm),and latent PSⅡ quantum yield (Fv/Fo) decreased.TheFv/Foin treatment of 14.28 mg/m3SO2decreased by 51.75% compared with CK.With the increase of photosynthetic active radiation,PSⅡ actual photosynthetic quantum yieldY(Ⅱ) and coefficient of photochemical quenching (qP) decreased and coefficient of non-photochemical quenching (qN) and electron transport rate (ETR) increased.【Conclusion】 The SO2treatments with concentrations of 5.71 and 14.28 mg/m3decreased PSⅡ reaction center ratio ofL.chinensevar.rubrum,blocked photosynthetic electron transport,decreased the rate of photochemistry electron transfer to total absorbed energy by PSⅡ pigment,and reduced energy conversion efficiency and potential activity,which affected normal photosynthesis.
sulfur dioxide stress;Loropetalumchinensevar.rubrum;photosynthetic rate;chlorophyll fluorescence parameters
时间:2016-09-0709:03DOI:10.13207/j.cnki.jnwafu.2016.10.014
2015-03-27
四川省农作物育种攻关项目(2011NZ0098-10)
侯利钦(1989-),女,四川阆中人,在读硕士,主要从事园林植物逆境生理研究。
周兰英(1960-),女,四川西昌人,教授,博士生导师,主要从事园林植物及林木遗传育种研究。
S687.201
A
1671-9387(2016)10-0100-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0903.028.html
