甘肃鼢鼠适应低氧的肌纤维类型和代谢特征
2016-11-11王文静李金钢何建平
山 萌,王文静,葛 宝,李金钢,何建平
(陕西师范大学 生命科学学院,陕西 西安 710119)
甘肃鼢鼠适应低氧的肌纤维类型和代谢特征
山萌,王文静,葛宝,李金钢,何建平
(陕西师范大学 生命科学学院,陕西 西安 710119)
【目的】 研究甘肃鼢鼠(Myospalaxcansus)骨骼肌肌纤维类型和代谢特征,为动物适应低氧环境的生理机制研究提供理论依据。【方法】 以SD大鼠为对照,应用mATP酶法测定常氧及急、慢性低氧条件下甘肃鼢鼠肌纤维类型及不同类型肌纤维横截面积,用分光光度计法测定甘肃鼢鼠腓肠肌琥珀酸脱氢酶(SDH)、乳酸脱氢酶(LDH)活性和肌红蛋白(Mb)含量。【结果】 与常氧组相比,急、慢性低氧对甘肃鼢鼠肌纤维组成及横截面积无显著影响;与SD大鼠相比,甘肃鼢鼠Ⅰ型肌纤维比例极显著降低(P<0.01),Ⅱa型肌纤维比例极显著升高(P<0.01);急、慢性低氧处理后,甘肃鼢鼠SDH、LDH活性较常氧组无显著性变化,但显著低于SD大鼠(P<0.05);甘肃鼢鼠Mb含量与常氧组相比无显著性变化,但显著高于SD大鼠(P<0.05)。【结论】 与SD大鼠相比,甘肃鼢鼠的肌纤维类型和代谢特征有明显的低氧适应性。
甘肃鼢鼠;低氧;腓肠肌;肌纤维类型
骨骼肌是哺乳动物组织-器官层次最大的组分,是躯体运动的物质基础[1]。骨骼肌肌纤维高度分化,肌纤维类型构成与其功能密切相关,根据其形态、功能和理化特性,肌纤维可分成红肌(Ⅰ型肌纤维)和白肌(Ⅱ型肌纤维),红肌收缩较慢,白肌收缩较快。研究发现,Ⅰ型肌纤维直径较小,收缩力量小且速度慢,属于细胞有氧呼吸供能依赖型肌纤维;Ⅱ型肌纤维直径较大,收缩力量较大且速度快[2-3],根据供能方式不同其又可分为Ⅱa(快速氧化型)和Ⅱb(快速酵解型)型肌纤维,其中Ⅱb型肌纤维缺乏肌红蛋白,与有氧代谢相关的酶活性低,但ATP酶和糖酵解酶系活性高,属于无氧呼吸供能依赖型,Ⅱa型肌纤维则介于Ⅰ型和Ⅱb型之间,有氧和无氧代谢均能供能。骨骼肌肌纤维的组成与分布是阐明骨骼肌供能的重要依据之一。
动物为适应不同环境,肌肉组织的构成和功能也会发生相应调整。有报道显示,地下鼠为适应低氧条件下挖掘活动的特殊生理,全身骨骼肌的组成类型发生了适应性变化,颈部斜方肌及腿部腓肠肌、股四头肌以Ⅱa型肌纤维为主,少见或没有Ⅰ型肌纤维[4-6]。为适应长期耐力需要,麻雀(Passermontanus)翅上肌及树熊(Phascolarctoscinereus)骨骼肌,都缺乏Ⅰ型肌纤维,而以Ⅱa型肌纤维为主[7-8]。
生物机体运动是一个耗能过程,骨骼肌供能方式主要包括有氧代谢和无氧酵解,参与这一过程最重要的2种酶是琥珀酸脱氢酶(Succinate dehydrogenase,SDH)和乳酸脱氢酶(Lactate dehydrogenase,LDH)。SDH是糖有氧代谢的关键催化酶之一,是研究细胞有氧代谢能力变化的常用标记酶,它直接与电子传递链相连,其活性及含量直接影响线粒体电子传递和氧化呼吸,决定三羧酸循环速度,影响动物有氧供能。在低氧条件下,细胞线粒体SDH活性增强,促进组织氧利用和骨骼肌有氧代谢,维持肌组织收缩时的能量供应,有利于保持肌肉工作效率和运动持久力[9]。LDH主要通过促进糖酵解快速地为机体提供能量,参与机体无氧代谢,催化丙酮酸和乳酸互相转换,其活性与组织细胞内氧分压密切相关,是评定糖酵解供能系统能力的重要指标之一[10]。高的氧分压可抑制细胞内LDH的合成速度和酶活性,此时有氧呼吸为主要供能方式;而细胞内低氧分压可加速LDH的合成并提高其活性,加速糖酵解过程,为机体组织细胞提供能量。肌红蛋白(Myoglobin, Mb)是心肌和骨骼肌胞内具有储存和转运氧气作用的蛋白,研究显示,在同等氧分压下,Mb氧结合能力是血红蛋白的6倍,肌细胞内Mb含量直接反应了肌肉组织的氧供应情况[11]。
低氧作为一种环境刺激因子,对动物生命活动有广泛影响,机体在长、短期低氧暴露或低氧训练后会发生一系列应激或适应性变化,如肌纤维类型、有氧代谢和无氧酵解变化等。有研究发现,骨骼肌肌纤维在经历不同低氧适应后,其排列有序的形态结构可能会遭到破坏[12]。黄庆愿等[13]发现在低氧条件下,机体为维持正常生命活动会减少局部氧耗,如骨骼肌肌纤维萎缩等,以保持主要器官的能量代谢。
甘肃鼢鼠(Myospalaxcansus)是我国黄土高原特有的地下啮齿动物,其生存的洞道属于典型的低O2、高CO2环境。本课题组前期对甘肃鼢鼠低氧适应过程中骨骼肌的显微结构和代谢特征做了研究[14],本研究在此基础上对甘肃鼢鼠急、慢性低氧适应后腓肠肌肌纤维类型和横截面积变化、腓肠肌LDH及SDH活性、Mb含量变化进行了研究,探讨低氧条件下甘肃鼢鼠腓肠肌的适应性变化,以期为啮齿类动物对地下特殊生活环境适应机制的研究提供线索。
1 材料与方法
1.1材料
1.1.1试验动物健康成年甘肃鼢鼠48只(体质量150~200 g/只),雌雄各半,捕自陕西延安,饲养于50 cm×40 cm动物饲养笼内,锯末作垫料,普通脱籽棉作巢材,饲以新鲜胡萝卜,单笼避光饲养,室温(21±1) ℃,适应1周后开始试验。健康成年SD大鼠48只(体质量200~280 g/只),雌雄各半,购自西安交通大学实验动物中心,锯末作垫料,饲以鼠粮,供自来水,正常光周期,适应1周后开始试验。
1.1.2仪器冰冻切片机(CM1900,德国徕卡),低氧舱JRC-1020型热磁氧分析仪(北京均方理化科技研究所)。
1.2试验设计
将甘肃鼢鼠和SD大鼠各分为3组,每组16只,即:常氧对照组,自由呼吸室内空气;急性低氧组,动物分别置于低氧舱内,氧气体积分数6.5%,持续低氧4 h;慢性低氧组,先将动物置于氧气体积分数14.1%的低氧舱内,每天6 h,持续7 d(每天低氧结束后自由呼吸室内空气),再置于体积分数10.5%的氧含量下,每天6 h,持续7 d,最后置于体积分数6.5%的氧含量下,持续4 h。用低氧舱JRC-1020型热磁氧分析仪监控舱内氧含量,保持氧含量稳定,低氧时正常供食和供水。
1.3肌纤维类型的检测
1.3.1冰冻切片制备低氧完成后,将3组试验动物用乙醚麻醉,迅速从后肢腓肠肌中部取约5 mm长组织块,剔除肌膜,放入预冷的300 g/L蔗糖溶液,待沉底约3 min后,取出用OCT包埋,放入冰冻切片机,待组织块温度回升至-25 ℃时切片,片厚10 μm,室温晾干,进行肌球蛋白ATP酶(mATPase)组织化学染色。
1.3.2ATP酶染色法根据Guth和Samaha等的方法[15]并稍作改良进行试验。将制好的冰冻切片置于4 ℃固定液(多聚甲醛40 g/L,蔗糖80 g/L,磷酸盐缓冲液0.1 mol/L,调节pH至7.2)固定10 min,双蒸水充分洗净后放入pH 4.3预孵育液(0.2 mol/L的醋酸盐缓冲液)孵育10 min,再经pH 9.4 ATP酶作用液(巴比妥钠0.1 mol/L,氯化钙0.18 mol/L,ATP二钠盐3 g/L,2,4-二硝基苯酚0.6 g/L,加双蒸水调pH至9.4)孵育45 min。10 g/L CaCl2洗3次,每次3 min,20 g/L CoCl 3 min,蒸馏水洗3次,10 g/L (NH4)2S 1 min呈色,最后冲洗、脱水、透明,中性树胶封片。
1.3.3肌纤维分类与计数每组动物随机抽取5~10张切片,在Leica显微照相系统(BH22)下观察并拍照,用LeicaQWIN3彩色图像处理系统分析Ⅰ、Ⅱa、Ⅱb型肌纤维的比例和横截面积。根据着色深浅确定肌纤维类型,Ⅰ型纤维呈褐色,Ⅱa型纤维着色浅,Ⅱb型纤维着色介于Ⅰ与Ⅱa型之间[16]。
1.4肌纤维中 SDH、LDH活性及Mb含量的检测
低氧试验完成后,乙醚麻醉试鼠,迅速取后肢腓肠肌中部组织块,置于冰上,充分剪碎后,加入0.1 mol/L PBS(pH 7.4)于组织匀浆器中充分研磨,制成质量分数为10%和1%的匀浆溶液,取上清液,分别用于测定SDH、LDH活性和肌红蛋白含量。按试剂盒(购自南京建成生物工程研究所)说明,用紫外可见光分光光度计(UV300 型)法测定SDH、LDH活性和Mb含量。
1.5统计方法
试验结果用 SPSS 19.0 分析软件进行多重比较,差异显著性以P<0.05 为标准。
2 结果与分析
2.1不同供氧条件下甘肃鼢鼠与SD大鼠腓肠肌肌纤维类型、横切面积及比例的变化
图1显示,甘肃鼢鼠腓肠肌以Ⅱa型肌纤维为主,无Ⅰ型肌纤维。由表1可知,与常氧组相比,急性低氧组甘肃鼢鼠肌纤维面积增大但差异不显著(P>0.05),肌纤维比例也无显著变化,雌性与雄性肌纤维面积和比例差异不显著;慢性低氧组甘肃鼢鼠各指标变化与急性低氧组基本一致,但Ⅱa型肌纤维比例雄性显著高于雌性(P<0.05)。


图 1 甘肃鼢鼠腓肠肌mATPase组化染色结果(×200) A,D.常氧组,B,E.急性低氧组,C,F.慢性低氧组;A~C为雄性,D~F为雌性;标示Ⅱa型肌纤维,标示Ⅱb型肌纤维Fig.1 Cross-Section in Stained Gastrocnemius of mATPase of Gansu zokors (×200) A&D.Normoxia,B&E.Acute hypoxia,C&F.Chronic hypoxia;A&B&C for male,D&E&F for female,marks type Ⅱa muscle fiber,marks type Ⅱb muscle fiber表 1 不同供氧条件下甘肃鼢鼠与SD大鼠腓肠肌肌纤维类型、比例及横切面积的比较Table 1 Comparison of muscle fiber types,ratios and cross-sectional areas of gastrocnemius under different oxygen conditions among Myospalax cansus and Rattus norvegicus
注:N.常氧;AH.急性低氧;CH.慢性低氧;A.甘肃鼢鼠;B.SD大鼠;♂.雄性;♀.雌性。a表示低氧组与常氧组比较,b表示雄性与雌性比较,c表示甘肃鼢鼠与SD大鼠比较;a,b,c表示差异显著(P<0.05),aa,bb,cc表示差异极显著(P<0.01)。下表同。
Note:N.Normoxia;AH.Acute hypoxia;CH.Chronic hypoxia;A.Myospalaxcansus;B.Rattusnorvegicus;♂.Male;♀.Female.a indicates comparison of hypoxia with normoxia,b indicates comparison of males with females,c indicates comparison ofM.cansuswithR.norvegicus;a,b,and c mean significant difference (P<0.05);aa,bb,and cc mean extremely significant difference (P<0.01).The same below.
SD大鼠腓肠肌中Ⅰ、Ⅱa和Ⅱb型肌纤维均存在,以Ⅱ型肌纤维为主(图2)。
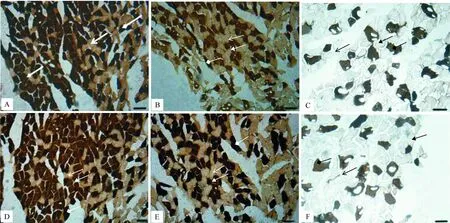
图 2SD大鼠腓肠肌mATPase组化染色结果(×200)

Fig.2Cross-Section in Gastrocnemius Stained for mATPase of SD rats(×200)

由表1可知,与常氧组相比,急性低氧组SD大鼠Ⅱa、Ⅱb型肌纤维面积显著增大(P<0.05),雌雄间肌纤维面积差异不显著;Ⅱb型肌纤维比例显著降低(P<0.05),Ⅰ型和Ⅱa型肌纤维比例无显著性变化,雌雄间肌纤维比例差异不显著。慢性低氧组SD大鼠Ⅱa、Ⅱb型肌纤维面积较常氧组显著增大(P<0.05),Ⅰ型肌纤维面积显著减小(P<0.05);Ⅰ型肌纤维比例极显著减小(P<0.01),Ⅱa型肌纤维比例极显著增大(P<0.01),Ⅱb型肌纤维比例显著减小(P<0.05);雌雄间肌纤维面积和比例差异均不显著。
由表1还可知,常氧条件下,甘肃鼢鼠Ⅱa型肌纤维比例极显著高于SD大鼠(P<0.01),肌纤维面积差异不显著;Ⅱb型肌纤维比例、面积与SD大鼠差异均不显著。急性低氧处理后,甘肃鼢鼠Ⅱa型肌纤维比例极显著高于SD大鼠(P<0.01),两者肌纤维面积差异不显著,Ⅱb型肌纤维比例、面积均与SD大鼠差异不显著。慢性低氧处理后,甘肃鼢鼠Ⅱa型肌纤维比例极显著高于SD大鼠(P<0.01),Ⅱb型肌纤维比例二者间差异不显著。
2.2不同供氧条件下甘肃鼢鼠与SD大鼠腓肠肌SDH、LDH活性及Mb含量的变化
由表2可知,甘肃鼢鼠急、慢性低氧组SDH、LDH活性和Mb含量较常氧组均无显著性变化。慢性低氧处理后,雄性甘肃鼢鼠和SD大鼠SDH、LDH活性均高于雌性,Mb含量低于雌性,但差异均不显著(P>0.05)。SD大鼠急、慢性低氧组较常氧组SDH活性显著升高(P<0.05),LDH活性极显著升高(P<0.01),Mb含量显著下降(P<0.05),雌性与雄性间各指标差异均不显著。
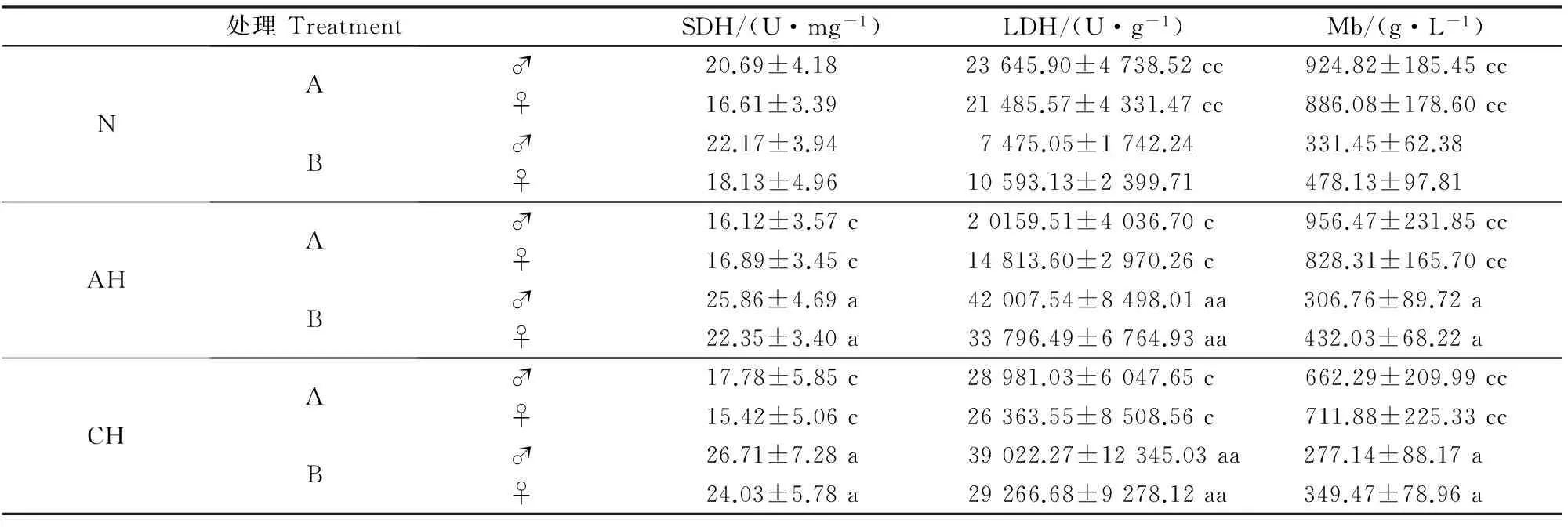
表 2 不同供氧条件下甘肃鼢鼠与SD大鼠腓肠肌的SDH、LDH活性及Mb含量Table 2 Comparison of activities of SDH,LDH and Mb content in gastrocnemius under different oxygen conditions among Myospalax cansus and Rattus norvegicus
由表2还可知,常氧条件下,甘肃鼢鼠SDH 活性与SD大鼠差异不显著(P>0.05),LDH活性和Mb含量均极显著高于SD大鼠(P<0.01)。急性低氧处理后,甘肃鼢鼠SDH和LDH活性均显著低于SD大鼠(P<0.05),Mb含量极显著高于SD大鼠(P<0.01)。慢性低氧处理后,甘肃鼢鼠SDH和LDH活性均显著低于SD大鼠(P<0.05),Mb含量极显著高于SD大鼠(P<0.01)。
3 讨 论
本试验结果表明,甘肃鼢鼠腓肠肌无Ⅰ型肌纤维,以Ⅱa型肌纤维为主,SD大鼠3种肌纤维都有分布,说明甘肃鼢鼠更适应时间相对较短但强度大的耐受性活动,与其严格的地下生活、在低氧环境下不停地挖掘洞道的生理需求相一致。在急、慢性低氧处理后,甘肃鼢鼠肌纤维类型没有明显变化,可见甘肃鼢鼠骨骼肌肌纤维构成稳定,不受低氧环境变化的影响。有研究显示,鼹形鼠(Spalaxehrenbergi)骨骼肌以Ⅱa型肌纤维为主,在实验室常氧环境下生活2年后,与刚捕获的个体相比,其肌纤维类型并没有发生显著性变化[4]。说明地下鼠骨骼肌在长期进化过程中已经形成了稳定的适应地下特殊环境的适应性结构,不会随着环境的变化发生变化。
有研究表明,地下鼠骨骼肌通过提高氧气运输和增加血管密度适应低氧[17-18]。甘肃鼢鼠腓肠肌肌纤维面积在急、慢性低氧处理后变化不明显,这是因为甘肃鼢鼠主要以Ⅱa型肌纤维为主,同时具有较高的血管密度,使其虽然生活在低氧环境下,但机体缺氧不显著,低氧对其影响有限。SD大鼠在急、慢性低氧处理后,雌雄个体均发生Ⅰ型肌纤维萎缩,比例降低;Ⅱa型肌纤维平均面积增大,比例升高;Ⅱb型肌纤维面积增大,但比例降低,肌纤维结构明显紊乱,呈细丝状,不规则,界限不清。说明SD大鼠骨骼肌由于氧含量下降,使得Ⅰ型肌纤维无法获得足够氧导致肌纤维萎缩,面积减少,比例下降,为满足其活动需求,Ⅱ型肌纤维面积和比例增加。
许多研究证明,当细胞内供氧充足时,LDH的活性与合成会受到抑制[19],SDH活性直接影响细胞有氧供能。在低氧条件下,机体可通过增加Mb来提高氧气运输效率,延迟细胞死亡[20-21]。本试验结果显示,常氧条件下甘肃鼢鼠SDH活性与SD大鼠无显著差异(P>0.05),LDH活性和Mb含量均极显著高于SD大鼠(P>0.01),说明无氧代谢也是甘肃鼢鼠肌肉组织供能的主要方式之一,高Mb含量提高了组织氧气的储存与利用,这对甘肃鼢鼠长期的低氧生活适应至关重要。
在急、慢性低氧处理后,甘肃鼢鼠骨骼肌SDH、LDH活性和Mb含量与常氧条件下相比均无显著变化(P>0.05),这与高媛等[14]的研究结果一致,说明在低氧条件下,甘肃鼢鼠骨骼肌的氧代谢能力并没受到显著影响,SDH和LDH水平恒定,有利于有氧和无氧代谢的共同调节,并可通过高水平的Mb含量保持组织较充分的氧供应,以减少或避免低氧对机体造成的损伤。另外,骨骼肌中高含量的Mb不仅为甘肃鼢鼠高强度的地下挖掘活动提供了足够的氧,还减轻了心脏的负担,避免了由于剧烈活动产生的大量乳酸对其机体的损伤[22]。所以在本试验的低氧刺激后,甘肃鼢鼠SDH、LDH活性和Mb含量变化不大,较为稳定。
与甘肃鼢鼠不同的是SD大鼠骨骼肌在急、慢性低氧条件下SDH活性较常氧组显著升高(P<0.05),LDH活性较常氧组极显著升高(P<0.01),Mb含量显著下降(P<0.05),所以相同氧含量下,甘肃鼢鼠骨骼肌SDH、LDH活性明显小于SD大鼠,而Mb含量高于SD大鼠。说明SD大鼠在低氧环境下肌红蛋白携氧能力逐渐丧失,由于不能获得足够多的氧,导致机体缺氧,迫使机体同时加速体内无氧酵解及有氧代谢过程来迅速为组织细胞提供能量,以维持机体正常生命活动的进行,导致骨骼肌SDH、LDH活性升高,Mb含量下降[23-24]。
另外,本试验发现慢性低氧处理后,雄性甘肃鼢鼠Ⅱa型肌纤维比例显著高于雌性(P<0.05),同时雄性SDH、LDH活性也均高于雌性,而Mb含量低于雌性,但差异均不显著(P>0.05)。这可能是由于甘肃鼢鼠在进行社会分工(如雌鼠怀孕分娩哺乳等)时,雌鼠需要哺乳幼鼠,洞内耗氧量升高,而此时正值试验动物采集地降雨量增加之际[25],从而使洞道内氧浓度随降雨量增加和幼鼠数量增加而迅速降低,使得雌鼠处于氧浓度极低的环境中,而雄鼠无此分工,所以雄鼠与雌鼠相比,对低氧的耐受性不如雌鼠强。
综上,甘肃鼢鼠急、慢性低氧处理后,腓肠肌肌纤维面积和比例、SDH和LDH活性、Mb含量与常氧对照组相比均无显著性变化,而SD大鼠各指标则在低氧应激达一定程度时发生了显著变化,与甘肃鼢鼠形成明显的差异。这样的结果表明,甘肃鼢鼠在多种生理生化机制上都不同于SD大鼠,长期的地下低氧生活,使甘肃鼢鼠对低氧刺激不再敏感,遗传基因结构也发生了改变,引起表达形式、表达水平和产物结构发生变化,在低氧过程中可能会顺利启动自身整体协调的低氧适应机制,从而在各个器官稳定的情况下,能够维持在低氧条件下的生存。
[1]王自勉.人体骨骼肌含量测定方法综述 [J].体育科研,2009,30(3):1-9.
Wang Z M.Methods for measuring body skeletal muscle mass [J].Sport Science Research,2009,30(3):1-9.
[2]Macedo F,Goren A,Vaz F,et al.Photothermal characterization of thin films and coatings [J].Vacuum,2008,82:1461-1465.
[3]Demko M T,Hostler S R,Abramson A R.The numerical mirage method for photothermal characterization of materials [J].Review of Scientific Instruments,2008,79 (4):044902-1-044902-7.
[4]Avivi A,Band M,Joel A,et al.Adaptive features of skeletal muscles of mole rats (Spalaxehrenbergi) to intensive activity under subterranean hypoxic conditions [J].Acta Histochemica,2008,111(5):415-419.
[5]Band M,Shams I,Joel A,et al.Cloning andinvivoexpression of vascular endothelial growth factor receptor 2 (Flk1) in the naturally hypoxiatolerant subterranean mole rat [J].FASEB Journal,2008,22(1):105-112.
[6]Avivi A,Shams I,Joel A,et al.Increased blood vessel density provides the mole rat physiological tolerance to its hypoxic subterranean habitat [J].FASEB Journal,2005,19(10):1314-1316.
[7]Suzuki A.Composition of myofiber types in limb muscles of the house shrew (Suncusmurinus):lack of type Ⅰ myofibers [J].The Anatomical Record,1990,228(1):23-30.
[8]Maltais F,Sullivan M J,LeBlanc P,et al.Altered expression of myosin heavy chain in the vastus lateralis muscle in patients with COPD [J].European Respiratory Journal,1999,13(4):850-854.
[9]崔建华,杨海军,张西洲,等.富氧对缺氧大鼠心肌琥珀酸脱氢酶及超微结构的影响 [J].西南国防医药,2005,15(2):129-131.
Cui J H,Yang H J,Zhang X Z,et al.Effects of oxygen-enrichment on myocardial succinate dehydrogenase and ultrastructure in hypoxic rats [J].China Academic Journal Electronic Publishing House,2005,15(2):129-131.
[10]Coqulle N,Fioravanti E,Weik M,et al.Activity,stability and structural studies of lactate dehydrogenases adapted to extreme thermal environments [J].Journal of Molecular Biology,2007,347(2):547-562.
[11]柴旦,周兆年.急性低氧对体外培养乳鼠心肌细胞肌红蛋白的影响 [J].生理学报,1997,49(5):497.
Chai D,Zhou Z N.Acute hypoxia oninvitrorat myocardial cells of myoglobin [J].Acta Physiologica Sinica,1997,49(5):497.
[12]Salminen A,Vihko V.Autophagic response to strenuous exercise in mouse skeletal muscle fibers [J].Virchows Archiv B:Cell Pathology Zell-Pathologie,1984,45(1):97-106.
[13]黄庆愿,高钰琪,史景泉,等.低氧习服大鼠骨骼肌毛细血管密度和血流供应的变化特点 [J].中国应用生理学杂志,2001(17):220-223.
Huang Q Y,Gao Y Q,Shi J Q,et al.Hypoxic acclimatization of rat skeletal muscle capillary density and change characteristics of blood supply [J].Chinese Journal Applied Physiology,2001(17):220-223.
[14]高媛,熊晓毅,谢惠春,等.甘肃鼢鼠与SD大鼠骨骼肌低氧适应的比较 [J].动物学杂志,2012,47(3):122-128.
Gao Y,Xiong X Y,Xie H C,et al.Comparison of skeletal muscle hypoxia adaptation between gansuzokor (Myospalaxcansus) and SD rat [J].Chinese Journal of Zoology,2012,47(3):122-128.
[15]Gosker H R,van Mameren H,van Dijk P J,et al.Skeletal muscle fibre-type shifting and metabolic profile in patients with chronic obstructive pulmonary disease [J].European Respiratory Journal,2002,19(4):617-625.
[16]Havenith M G,Visser R,Schrijvers van Schendel J M,et al.Muscle fiber typing in routinely processed skeletal muscle with monoclonal antibodies [J].Histochemistry,1990,93(5):497-499.
[17]Widmer H R,Hoppeler H,Nevo E,et al.Working undergrou-nd:respiratory adaptations in the blind mole rat [J].Proc Natl Acad Sci USA,1997,94:2062-2067.
[18]Avivi A,Resnick M B,Nevo E,et al.Adaptive hypoxic tolerance in the subterranean mole ratSpalaxehrenbergi:the role of vascular endothelial growth factor [J].FEBS Let,1999,452:133-140.
[19]魏登邦,马建宾.高原鼢鼠和小白鼠心肌及骨肌肌红蛋白含量与乳酸脱氢酶活性的比较研究 [J].青海大学学报,2001,19(2):20-21.
Wei D B,Ma J B.The investigation of comparison between contents of myoglobin and activity of lactate dehydrogenase in heart muscle and skeletal muscle of plateau zokor and mouse [J].Journal of Qinghai University,2001,19(2):20-21.
[20]Braulin E A,Wahler G M,Swagze C R,et al.Myoglobin in facilitated oxygen diffusion maintains mechanical unction of mammalian cardiac muscle [J].Cardiovasc Res,1986,20:627-636.
[21]Kennedy F G,Jones D P.Oxygen dependence of mitochondrial function in isolated rat cardiac myocytes [J].Am J Physiol,1986,50:374-384.
[22]魏登邦,魏莲.高原鼢鼠的红细胞、血红蛋白及肌红蛋白的测定结果 [J].青海大学学报,2001,19(4):1-2,12.
Wei D B,Wei L.The mensuration results of the number of red cell,the density of hemoglobin and the contents of myoglobin in plateau zokor [J].Journal of Qinghai University,2001,19(4):1-2,12.
[23]毛杉杉,潘同斌,王瑞元.高住低训对大鼠骨骼肌SDH与LDH活性的影响 [J].中国运动医学杂志,2005,24(5):551-554.
Mao S S,Pan T B,Wang R Y.Effects of living at high altitude and training at low altitude on SDH and LDH activities in skeletal muscle of rats [J].Chinese Journal of Sports Medicine,2005,24(5):551-554.
[24]王荣辉,刘桂华,胡琪,等.低氧训练对大鼠骨骼肌乳酸脱氢酶和苹果酸脱氢酶活性的影响 [J].北京体育大学学报,1998,21(3):31-33.
Wang R H,Liu G H,Hu Q,et al.Effects of hypoxic training on LDH and MDH activities of skeletal muscles in rats [J].Journal of Beijing University of Physical Education,1998,21(3):31-33.
[25]魏登邦,魏莲,张建梅,等.地下鼠对洞道环境适应机制的研究进展 [J].青海大学学报,2007,25(5):54-57.
Wei D B,Wei L,Zhang J M,et al.Research progress in adaptive mechanisms of subterranean rodents to burrow environment [J].Journal of Qinghai University,2007,25(5):54-57.
Muscle fiber types and metabolic characteristics of Gansu zokor (Myospalaxcansus) in adaptation to hypoxia
SHAN Meng,WANG Wenjing,GE Bao,LI Jingang,HE Jianping
(CollegeofLifeScience,ShaanxiNormalUniversity,Xi’an,Shaanxi710119,China)
【Objective】 The paper studied the hypoxia adaptation of muscle fiber types and metabolic characteristics of Gansu zokor to provide theoretical basis for physiological mechanism of animals to adapt hypoxia environment.【Method】 Using SD rats as control,mATPase reaction was used to determine the composition and change of cross-sectional area of different muscle fibers.Spectrophotometry was used to determine the gastrocnemius activity of succinate dehydrogenase (SDH),lactate dehydrogenase (LDH) and content of myoglobin (Mb).【Result】 Acute and chronic hypoxia had insignificant effects on composition of zokors muscle fibers and cross sectional area. Compared with SD rats,the ratio of muscle fiber type Ⅰ of zokors was significantly reduced (P<0.01),while that of muscle fiber type Ⅱa was significantly increased (P<0.01).After acute and chronic hypoxia,activities of SDH and LDH showed insignificant change and were significantly lower than those of SD rats (P<0.05).Myoglobin content of zokors had no significant change and was significantly higher than that of SD rats (P<0.05).【Conclusion】 The muscle fiber types and metabolic characteristics of zokors adapted better to hypoxia than SD rats.
Gansu zokor;hypoxia;gastrocnemius muscle;muscle fiber types
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.004
2015-03-27
国家自然科学基金项目(30670360)
山萌(1989-),女,河南洛阳人,在读硕士,主要从事比较神经生物学研究。E-mail:532102419@qq.com
何建平(1965-),女,陕西西安人,副教授,硕士生导师,主要从事比较动物生理学研究。
E-mail:hejianping@snnu.edu.cn
Q445
A
1671-9387(2016)10-0018-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.008.html
