鸭瘟病毒gB蛋白单克隆抗体的制备
2016-11-11赵丹丹刁有祥杨国平提金凤
赵丹丹,刁有祥,杨国平,陈 浩,提金凤,张 璐
(山东农业大学 动物科技学院,山东 泰安 271018)
鸭瘟病毒gB蛋白单克隆抗体的制备
赵丹丹,刁有祥,杨国平,陈浩,提金凤,张璐
(山东农业大学 动物科技学院,山东 泰安 271018)
【目的】 制备鸭瘟病毒(DPV)gB蛋白单克隆抗体,为建立DPV快速诊断方法及进一步鉴定DPV的抗原表位奠定基础。【方法】 克隆DPVgB基因,构建其表达载体并进行原核表达,纯化DPV gB蛋白,以其作为抗原免疫8周龄BALB/c小鼠,取其脾细胞与SP2/0骨髓瘤细胞进行融合,进行间接ELISA及亚克隆筛选,并对单抗亚类及抗原性进行鉴定。【结果】 PCR扩增出915 bp的目的基因,成功连接于pET-28a载体,并转化大肠杆菌Rosetta进行诱导表达,获得4株稳定分泌抗DPV gB蛋白的杂交瘤细胞株,分别命名为A8D7、E6C3、H11F8、H6F6,间接ELISA检测其腹水效价分别为1∶103、1∶103、1∶105、1∶103,亚类鉴定结果分别为IgG2b、IgG2a、IgG2b、IgG1,轻链均为kappa链。Western blot结果显示4株单抗均能与DPV gB蛋白特异性结合,IFA结果表明4株单抗是针对DPV产生的。【结论】 成功获得了特异性针对DPV gB蛋白的单克隆抗体。
鸭瘟病毒;gB蛋白;单克隆抗体
鸭瘟由Baudet于 1923 年首次在荷兰发现,随后陆续在许多养鸭国家暴发和流行,给养鸭业带来严重的经济损失[1]。鸭瘟病毒(Duck Plague Virus,DPV)又名鸭病毒性肠炎病毒(Duck Enteritis Virus,DEV),是引起鸭、鹅、天鹅等雁形目动物急性、热性、败血性传染病的病原[2]。近年来,鸭瘟时有发生,迫切需要提供有效的诊断方法。目前针对该病毒建立的检测方法很多,如PCR、ELISA、间接免疫荧光技术、微量中和试验等[3],均为该病的诊断和防治奠定了基础。单克隆抗体具有性质均一稳定、特异性高等特点[4],可以作为病毒诊断方法的一个很好的工具。作为鸭瘟病毒的高度保守性蛋白之一,gB蛋白的免疫原性良好,高度的特异性和保守性决定了该蛋白能够为检测方法的建立提供优良的材料。本研究制备针对鸭瘟病毒gB蛋白的单克隆抗体,旨在为建立具有强特异性、高敏感性的DPV诊断方法提供工具。
1 材料与方法
1.1材料
1.1.1毒株、细胞株和实验动物SP2/0骨髓瘤细胞、鸭瘟病毒(SD-Y)、鸭呼肠孤病毒(DRV)、减蛋下降综合征病毒(EDS-76V)、H9亚型禽流感病毒(AIV-H9N2)、坦布苏病毒(TMUV)及原核表达载体 pET-28a、大肠杆菌DH5α和Rosetta,均由山东农业大学禽病学实验室保存。6~8周龄SPF级BALB/c雌性小鼠购自山东省实验动物中心。
1.1.2主要试剂DNA 凝胶回收提取试剂盒、T4 DNA连接酶、IPTG、pMD18-T 载体等,购自宝生物工程(大连)有限公司;弗氏完全佐剂、弗氏不完全佐剂、HAT、HT、PEG4000,购自Sigma公司;辣根过氧化物酶(HRP)标记的羊抗鼠IgG、DMEM培养基、胎牛血清,购自全式金生物技术(北京)有限公司;Rapid Mouse Isotyping Kit-Gold Series,购自RayBiotech。
1.2抗原的制备
1.2.1gB基因的扩增根据GenBank发表的DPVgB基因序列(GenBank登录号为:JF999965),通过Protean软件分析,选择其抗原表位较多的一段序列,利用Primer premier 5软件设计引物,上游引物gB-f :5′-CCGGAATTCTGGGATTGGATG-CCTAA-3′,下划线部分为EcoRⅠ酶切位点;下游引物gB-r :5′-CCGCTCGAGTATTGTACCGCCG-TCTTT-3′,下划线部分为XhoLⅠ酶切位点。
采用酚氯仿法提取病毒DNA[5],并以此为模板进行PCR扩增,反应体系为:10×PCR Buffer 2.5 μL,2.5 mmol/L dNTP Mixture 4 μL,上、下游引物 P1、P2 各 1 μL (25 μmol/L),HiFi DNA Polymerase 0.3 μL,模板 2 μL,ddH2O 14.2 μL。反应条件为:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。扩增产物于10 g/L琼脂糖凝胶中进行电泳分析,利用凝胶回收试剂盒回收PCR产物。
1.2.2目的蛋白的表达及纯化利用EcoRⅠ和XhoLⅠ限制性内切酶对PCR产物和pET-28a分别进行双酶切,酶切产物经琼脂糖凝胶电泳后回收目的片段,T4 DNA 连接酶连接,构建重组质粒pET-28a-gB,进行EcoRⅠ和XhoLⅠ双酶切鉴定。将重组质粒pET-28a-gB转化大肠杆菌Rosetta感受态细胞,加入IPTG至终浓度为0.8 mmol/L,诱导表达6 h后构建重组表达载体pET-28a-gB。按照包涵体纯化法对表达的蛋白进行纯化[6],备用。
1.2.3目的蛋白的鉴定将纯化的gB蛋白进行 SDS-PAGE 电泳后,转印至硝酸纤维素膜上,50 g/L 脱脂乳封闭过夜,以鸭瘟阳性血清为一抗,以 HRP 标记的羊抗鸭IgG(1∶5 000)为二抗,用DAB 试剂盒显色,进行Western blot鉴定。
1.3动物免疫
将纯化好的gB蛋白用灭菌生理盐水稀释至 0.5 mg/mL,加入等量的弗氏完全佐剂,乳化完全后腹腔注射7周龄BALB/c小鼠,0.2 mL/只;2周后,用同样方法稀释gB蛋白,加入等量的弗氏不完全佐剂,腹腔注射进行第2次免疫,0.2 mL/只;再过2周进行第3次免疫,方法同第2次免疫;10 d后,尾静脉采血,分离血清,测定其抗体效价。选取抗体效价高的小鼠进行加强免疫,0.6 mL/只,3 d后取小鼠脾细胞进行细胞融合。
1.4细胞融合及阳性杂交瘤细胞的筛选
取免疫鼠脾细胞与培养至对数生长期的SP2/0骨髓瘤细胞在融合剂PEG4000作用下,以5∶1~10∶1的比例按照常规方法进行细胞融合[7]。融合细胞经HAT及HT选择培养基培养至长满培养孔孔底面积1/10时,用间接ELISA对杂交瘤细胞上清进行筛选。筛选出的阳性孔再经过3次有限稀释法进行亚克隆[8],待阳性率达到100%时扩大培养留待制备腹水并保存于液氮。
1.5腹水的制备与纯化
取10周龄BALB/c小鼠,腹腔注射灭菌液体石蜡0.5 mL/只,7~10 d后腹腔注射杂交瘤细胞1×106~3×106个/只,待小鼠腹部膨大抽取腹水,离心取上清,采用辛酸-硫酸铵法对腹水进行纯化[9]。
1.6单抗的鉴定
1.6.1效价的测定将制备的腹水从1∶100开始倍比稀释,采用间接ELISA方法检测腹水效价。
1.6.2亚类的鉴定按照Rapid Mouse Isotyping Kit-Gold Series说明书对单抗的亚类进行鉴定。
1.6.3Western blot 鉴定将纯化的gB蛋白进行 SDS-PAGE 电泳后,转印至硝酸纤维素膜上,50 g/L脱脂乳封闭过夜,以阳性单克隆细胞上清为一抗,以 HRP 标记的羊抗鼠IgG(1∶5 000)为二抗,用DAB 试剂盒显色,进行Western blot鉴定。
1.6.4间接免疫荧光(IFA)鉴定按照常规方法制备鸭胚成纤维细胞(DEF),传代后将其转到24孔细胞培养板上继续培养。待细胞长成单层且面积为底部面积的70%~80%时,用DPV感染DEF细胞,并设未加病毒的空白对照。待出现细胞病变后,用丙酮-甲醇(体积比1∶1)固定,以鉴定为阳性的杂交瘤细胞上清为一抗,1∶200稀释的FITC标记的羊抗鼠IgG抗体为二抗,荧光显微镜下观察结果。
1.6.5单抗的稳定性分别在杂交瘤细胞冻存后3个月和6个月时,取出冻存的细胞进行复苏,并对细胞培养上清进行间接ELISA检测,以确定阳性杂交瘤细胞是否丢失。
1.6.6单抗的特异性分别用DPV、TMUV、AIV-H9N2、EDS-76V、DRV作为抗原包被酶标板,以杂交瘤细胞上清液为一抗,HRP标记的羊抗鼠IgG(1∶5 000稀释)为二抗,利用间接ELISA方法检测单克隆抗体细胞上清。
2 结果与分析
2.1gB基因的PCR扩增
提取鸭瘟病毒DNA,PCR扩增其gB基因,凝胶电泳结果(图1)显示,在约915 bp处可见到特异性条带。
2.2重组表达载体pET-28a-gB的鉴定
重组质粒经EcoRⅠ、XhoLⅠ双酶切,经琼脂糖凝胶电泳后可见到约915 bp的目的片段及大于5 000 bp的载体片段(图2)。

图 1 DPV gB基因的PCR鉴定M.DL2000 Marker;1.阴性对照;2.gB基因Fig.1 PCR identification of gB gene of DPVM.DL2000 Marker;1.Negative control;2.The gB gene图 2 重组质粒pET-28a-gB的双酶切鉴定M.DL5000 Marker;1.pET-28a-gBFig.2 Restriction enzyme analysis of pET-28a-gBM.DL5000 Marker;1.pET-28a-gB
2.3gB蛋白的鉴定
将表达及纯化后的蛋白经 SDS-PAGE 电泳后,转印到硝酸纤维素膜上,用鸭瘟阳性血清进行 Western blot 鉴定。结果(图3)显示,表达的蛋白在约34 ku处可见特异性条带,而阴性对照无条带,表明表达的蛋白具有良好的反应性。
2.4阳性杂交瘤细胞的筛选
对融合后的细胞进行观察可知,细胞融合率达90%以上;经间接ELISA检测后,对阳性孔进行有限稀释法克隆,阳性率达100%时,共获得4株稳定分泌抗gB蛋白的杂交瘤细胞株,分别命名为A8D7、E6C3、H11F8和H6F6。
2.5单抗效价的测定及亚类鉴定
用间接ELISA方法测定腹水的效价,结果A8D7为1∶103,E6C3为1∶103,H11F8为1∶105,H6F6为1∶103。
用Rapid Mouse Isotyping Kit-Gold Series测定4株单抗的亚类,结果显示A8D7(IgG2b)、E6C3(IgG2a)、H11F8(IgG2b)、H6F6(IgG1)的轻链均为kappa链。
2.6单抗的Western blot 检测
图4显示,4株单抗均可特异性识别gB蛋白,在约34 ku处出现特异性条带,而不与含空质粒的菌体蛋白反应,表明4株单抗均具有良好的反应性。

图 3诱导表达DPV gB蛋白的SDS-PAGE(A)及Western blot (B)分析
M.蛋白Marker;1,2.纯化的DPV gB蛋白;3.DPV gB蛋白的Western blot分析结果;4.阴性对照
Fig.3SDS-PAGE(A)and Western blot(B) analysis of DPV gB protein
M.Protein Marker;1,2.purified DPV gB protein;3.Western blot analysis of DPV gB protein;4.Negative control
图 4DPV gB蛋白4株单抗的Western blot 分析
M.蛋白Marker;1.A8D7单抗;2.E6C3单抗;3.H11F8单抗;4.H6F6单抗;5.阴性对照
Fig.4Western blot analysis of four monoclonal antibodies against gB protein of DPV
M.Protein Marker;1.Monoclonal antibody of A8D7;2.Monoclonal antibody of E6C3;3.Monoclonal antibody of H11F8;4.Monoclonal antibody of H6F6;5.Negative control
2.7单抗的IFA鉴定
DPV感染DEF细胞出现病变后,对4株单抗进行IFA检测,结果(图5)显示,4株单抗均可显现特异性的绿色荧光,未感染的细胞不显现绿色荧光。表明这4株单抗均可以与DPV发生反应。
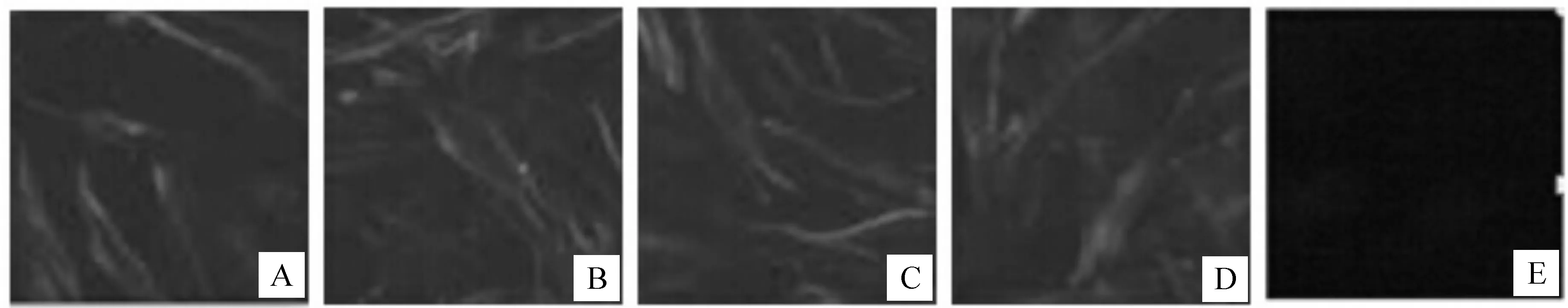
图 5 DPV gB蛋白单抗与感染DPV的DEF细胞的IFA试验结果 A.A8D7单抗;B.H6F6单抗;C.E6C3单抗;D.H11F8单抗;E.阴性对照Fig.5 Indirect immunofluorescence assay of DPV in DEF cells with the four monoclonal antibodies against gB protein of DPV A.Monoclonal antibody of A8D7;B.Monoclonal antibody of H6F6; C.Monoclonal antibody of E6C3;D.Monoclonal antibody of H11F8;E.Negative control
2.8单抗的稳定性和特异性检测
在杂交瘤细胞冻存后3个月和6个月时,取出冻存的细胞进行复苏,并对细胞培养上清进行间接ELISA检测,结果显示,冻存后的杂交瘤细胞仍能稳定地分泌抗体。
分别以DPV、TMUV、AIV-H9N2、EDS-76V、DRV为抗原对杂交瘤细胞上清进行检测,结果表明,本试验制备的单抗仅与DPV反应,而不与TMUV、AIV-H9N2、EDS-76V、DRV发生反应。
3 讨 论
本研究成功制备了4株针对DPV gB蛋白的特异性单克隆抗体,为DPV快速检测方法的建立奠定了基础。DPV gB蛋白是病毒表达的最为保守的囊膜蛋白之一,具有良好的免疫原性及免疫保护性[10]。单克隆抗体具有高度均一、生物活性单一和与抗原结合的特异性强等优点[11],可以为建立更加快速、特异性强的检测方法提供有力的工具。因此,制备针对DPV gB蛋白的单克隆抗体,在临床诊断、疾病预防、快速检测方法建立等方面具有重要意义,也为进一步鉴定DPV的抗原表位奠定了基础。
董广阔[12]利用质粒pGEX-6Pl作为载体,对DPV gB和gC主要抗原域的编码区进行了克隆与原核表达,研制了针对gB和gC的单克隆抗体。本研究将DPVgB基因连接到原核表达载体pET-28a上,并转入大肠杆菌E.coliRosetta(DE3)进行原核表达,通过对诱导时间及IPTG浓度的摸索,成功表达出了DPV-gB蛋白。
本研究采用原核表达系统RosettaE.coli表达DPV gB蛋白,原核表达系统相对于真核表达系统具有成本低、操作简便、表达量高等优点[13],并且省去了传统方法中的繁琐步骤,可大大节省时间。在载体的选择上,本试验采用了原核表达载体pET-28a,该载体由T7启动子、lac结构基因和卡那霉素抗性基因等构成,能够表达融合蛋白,性质更加稳定,且能保持表达产物的免疫学活性,使其具备抗原性[14],为单抗的制备提供了便利。因此,本研究中,先利用生物学软件分析gB蛋白氨基酸残基的抗原性、亲水性等,选择了一段抗原性强的区域进行克隆表达,以期得到具有诊断价值的免疫原,结果显示,制备的单克隆抗体具有较好的反应性。
本研究以原核表达的DPV gB蛋白作为抗原,制备DPV的单克隆抗体,腹水效价在1∶103~1∶105,其与以全毒免疫小鼠产生的效价[15]相比较低,可能是全毒引起的免疫应答反应较全面,但是用蛋白进行免疫能够提高反应的特异性。
[1]Baudet A E.Mortality in ducks in the Netherlands caused by a filterable virus fowl plague [J].Tijdschr Diergeneeskd,1923,50:455-459.
[2]Aravind S,Nitin M K,Satish S G,et al.Adaptation and growth kinetics study of an Indian isolate of virulent duck enteritis virus in Vero cells [J].Microbial Pathogenesis,2015,78:14-19.
[3]徐晓娟,郭霄峰.鸭瘟病毒研究进展 [J].养禽与禽病防治,2012,10: 8-12.
Xu X J,Guo X F.The research progress of duck plague virus [J].Poultry Husbandry and Disease Control,2012,10:8-12.
[4]He J L,Hsieh M S,Chiu Y C.Preparation of monoclonal antibodies against poor immunogenic avian influenza virus proteins [J].Journal of Immunological Methods,2013,387:43-50.
[5]Li H X,Liu S W,Kong X G.Characterization of the genes encoding UL24,TK and gH proteins from duck enteritis virus (DEV):a proof for the classification of DEV [J].Virus Genes,2006,33(2):221-227.
[6]汪家政.蛋白质技术手册 [M].北京:科学出版社,2001.
Wang J Z.The technical manuals of protein [M].Beijing:Science Press,2001.
[7]王洪海,苏敬良,曹振,等.鸭肠炎病毒单克隆抗体的制备 [J].中国兽医科技,2004,34(11):13-17.
Wang H H,Su J L,Cao Z,et al.Preparation of monoclonal antibodies against duck enteritis virus [J].Chinese Journal of Veterinary Science and Technology,2004,34(11):13-17.
[8]周艳君,华荣虹,王云峰,等.SARS-CoV单克隆抗体的制备及抗原表位的初步鉴定 [J].生物工程学报,2005,21(2):211-215.
Zhou Y J,Hua R H,Wang Y F,et al.Development of monoclonal antibodies against SARS-CoV and identification of antigenic epitopes [J].Chinese Journal of Biotechnology,2005,21(2):211-215.
[9]张智慧.鸭肠炎病毒糖蛋白B单克隆抗体的制备与鉴定 [D].哈尔滨:东北农业大学,2009.
Zhang Z H.Preparation and identification of monoclonal antibodies against glycoprotein B of duck enteritis virus [D].Harbin:Dongbei Agricultural University,2009.
[10]Griffin A M.The nucleotide sequence of the glycoproteingBgene of infectious laryngotracheitis virus:analysis and evolutionary relationship to the homologous gene from other herpesviruses [J].J Gen Virol,1991,72(2):393-398.
[11]Zhang A X,Cao B.Generation and characterization of an anti-GP73 monoclonal antibody for immune blotting and sandwich ELISA [J].Journal of Biomedical Research,2012,26(6):467-473.
[12]董广阔.鸭肠炎病毒囊膜蛋白gB和gC主要抗原域的原核表达和单克隆抗体的研制 [D].浙江扬州:扬州大学,2012.
Dong G K.Prokaryotic expression and preparation of monoclonal antibodies against envelope protein gB and gC of duck enteritis virus [D].Yangzhou,Zhejiang:Yangzhou University,2012.
[13]贠炳岭,李德龙,胡晓亮,等.禽白血病病毒群特异性抗原单克隆抗体的制备与鉴定 [J].中国预防兽医学报,2012,34(10):782-785.
Yun B L,Li D L,Hu X L,et al.Preparation and identification of monoclonal antibodies against the group specific antigen of avian leucosis virus [J].Chinese Journal of Preventive Veterinary Medicine,2012,34(10):782-785.
[14]程彦丽.鸭新城疫病毒核衣壳蛋白单克隆抗体的制备及应用 [D].山东泰安:山东农业大学,2012.
Cheng Y L.Preparation and application of monoclonal antibodies against nucleocapsid protein of duck newcastle disease virus [J].Taian,Shandong:Shandong Agricultural University,2012.
[15]Wang M,Lin D,Zhang S,et al.Prokaryotic expression of the truncated duck enteritis virus UL27 gene and characteristics of UL27 gene and its truncated product [J].Acta Virol,2012,56:323-328.
Preparation and identification of monoclonal antibodies against gB protein of duck plague virus
ZHAO Dandan,DIAO Youxiang,YANG Guoping,CHEN Hao,TI Jinfeng, ZHANG Lu
(CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an,Shandong271018,China)
【Objective】 This study prepared monoclonal antibodies against gB protein of duck plague virus to provide basis for establishing diagnosis method of DPV infection and identifying antigen epitope of DPV.【Method】 The DPVgBgene was cloned to establish its expression vector and conduct prokaryotic expression.DPV gB protein was purified and used to immunize 8 weeks old BALB/c mice,whose splenocytes were fused with SP2/0 myeloma cells for indirect ELISA and sub-clone screening. 【Result】 PCR amplification obtained the aim gene of 915 bp and it was connected to pET-28a vector before being transformed to Rosetta for expression.Four hybridoma cell lines that stably secreted monoclonal antibody against gB protein of DPV named A8D7,E6C3,H11F8,and H6F6 were obtained with indirect ELISA determined ascitic fluid titers of 1∶103,1∶103,1∶105,and 1∶103,respectively.The immunoglobulin subtypes of the monoclonal antibodies were IgG2b,IgG2a,IgG2b,and IgG1,with the light chain of kappa. Western blot showed the four monoclonal antibodies were able to specifically recognize gB protein of DPV and IFA showed that the four monoclonal antibodies were specific to DPV.【Conclusion】 Specific monoclonal antibodies against gB protein of duck plague virus were obtained.
duck plague virus;gB protein;monoclonal antibody
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.002
2015-04-20
国家现代农业产业技术体系项目(CARS-43)
赵丹丹(1989-),女,山东乳山人,硕士,主要从事禽病学研究。E-mail:zhaodandan_0925@163.com
刁有祥(1962-),男,山东胶州人,教授,博士,主要从事禽病学研究。E-mail:yxdiao@126.com
S852.65+7
A
1671-9387(2016)10-0007-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.004.html
