经桡动脉入径行准分子激光冠状动脉斑块消融术在冠状动脉钙化病变及慢性完全闭塞病变中的应用:中国最初应用经验分享
2016-11-11刘巍周玉杰赵迎新史冬梅刘宇扬周志明郭永和成万钧葛海龙
刘巍 周玉杰 赵迎新 史冬梅 刘宇扬 周志明 郭永和 成万钧 葛海龙
王建龙 胡宾 刘晓丽
·临床研究·
经桡动脉入径行准分子激光冠状动脉斑块消融术在冠状动脉钙化病变及慢性完全闭塞病变中的应用:中国最初应用经验分享
刘巍周玉杰赵迎新史冬梅刘宇扬周志明郭永和成万钧葛海龙
王建龙胡宾刘晓丽
目的介绍准分子激光冠状动脉斑块消融术(ELCA)在钙化病变及慢性完全闭塞病变(CTO)等复杂冠状动脉病变中的应用及经验分享。方法纳入2015年3月至2016年4月首都医科大学附属北京安贞医院15例复杂冠状动脉病变患者,共15处病变行ELCA辅助治疗。观察终点为手术即刻成功和临床成功。结果15处病变血管均应用0.9 mm导管进行消融,所有病变均成功通过激光导管,最后行球囊扩张。9例(60.0%)患者球囊不能通过病变,6例(40.0%)球囊不能扩张病变。13例(86.7%)患者置入药物洗脱支架,2例(13.3%)患者行药物球囊扩张。 手术即刻成功率为100%,临床成功率为100%。平均随访(6.2±3.3)个月未见主要不良心血管事件及ELCA相关并发症发生。结论本研究所选择患者的钙化病变及CTO中,ELCA成功率较高,尚未见并发症发生,可以在复杂冠状动脉病变中进一步推广。
准分子激光冠状动脉斑块消融术;经桡动脉;复杂冠状动脉病变
在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)中,慢性完全闭塞病变(chronic total occlusion,CTO)、钙化病变及支架内再狭窄(in-stent restenosis,ISR)等仍然是治疗的难点。手术失败的原因主要是病变组织坚硬,球囊难以通过或难以扩张[1]。目前,经桡动脉入径是PCI最常用的入径,但相对于以往的经股动脉入径,指引导管的支撑力较差,失败率更高。现有的治疗方法如高压球囊、切割球囊有一定限制,冠状动脉旋磨术也存在一定风险。因此,迫切需要一种更为有效的治疗手段。
激光治疗冠状动脉病变诞生于20世纪80年代,但因早期并发症较多,以及药物洗脱支架(drug eluting stent,DES)的出现,激光治疗冠状动脉病变逐渐被淘汰[2]。近些年,一种新型的准分子激光冠状动脉斑块消融术(Excimer laser coronary atherectomy,ELCA)问世[3]。 由于其应用波长更短的紫外线光源,导管细,并采用脉冲性发射,为冷光源,故安全性较高。在欧美及日本已经开始应用在钙化病变、CTO、ISR及桥血管病变等高难度冠状动脉病变中,其有效性、安全性得到了进一步验证[4]。目前,国内对ELCA还未见应用报道,北京安贞医院率先在国内应用ELCA 经桡动脉入径治疗15例复杂冠状动脉病变患者,现将应用经验分享如下。
1 对象与方法
1.1研究对象
纳入2015年3月至2016年 4月在首都医科大学附属北京安贞医院行ELCA的复杂冠状动脉病变(球囊不能通过或不能扩张的冠状动脉钙化病变及CTO等)患者15例,其中11例为既往PCI术失败患者。术前患者均签署手术知情同意书。本研究经北京安贞医院伦理委员会批准。
1.2研究方法
1.2.1手术过程术前给予患者足量的阿司匹林(负荷剂量300 mg,100 mg、每日1次维持)及氯吡格雷(负荷剂量300 mg,75 mg、每日1次维持)或替格瑞洛(负荷剂量180 mg,90 mg、每日2次维持)进行抗血小板药物治疗。经桡动脉入径送入6~7 F鞘管进行介入操作。术中普通肝素抗凝,维持活化凝血时间(activated clotting time,ACT)>250 s,不常规应用血小板糖蛋白Ⅱb/Ⅲa受体拮抗药。当导丝通过后,给予球囊难以通过或难以扩张的CTO、ISR及钙化病变考虑应用ELCA。 术中成功消融后,均根据标准手术方案行经皮穿刺冠状动脉腔内成形术(percutaneous transluminal coronary angioplasty,PTCA)以完成治疗过程。进行常规球囊扩张,根据病情需要选择置入支架或应用药物球囊。术者决定是否行血管内超声(intravascular ultrasonography,IVUS )或光学相干断层成像(optical coherence tomography,OCT) 检查。术后即刻拔除鞘管。
1.2.2ELCA步骤采用型号为CVX-300d的ELCA激光机(CVX -300 Spectranetics,科罗拉多斯普林斯公司) ,激光导管为球囊快速交换型,经6 F指引导管可以应用直径为0.9 mm、1.4 mm的激光导管。激光仪需在使用前预热5 min,术前将导管内腔经肝素化冲洗,将末端连接至激光操纵台,进行导管校准。指引导管到位,导丝通过病变后,将激光导管沿导丝缓慢向靶病变部位推进。接近靶病变时,设定能量,初始能量密度为30 mJ/mm2,初始脉冲为 25 Hz,根据病变的坚硬程度、通过性,增加能量及脉冲频率。最大能量密度为80 mJ/mm2,最大脉冲频率为80 Hz。在球囊不可通过或不可扩张的病变部位,由近及远推送激光导管,为增加斑块消融效果,推进的速度要控制在1 mm/s以下。在消融过程中,助手要同时向冠状动脉内推注盐水对激光导管进行冷却。全程透视观察导管前进过程、压力及心电图变化。每次消融时间为10 s,冷却5 s。激光导管撤出后,再根据标准术式行球囊扩张,置入支架。如球囊通过或扩张仍困难可考虑增加能量或频率再次消融。
1.3观察终点
ELCA手术即刻成功定义为:术中由血管造影证实导管通过病变部位,术后靶病变残余狭窄<50%。临床成功定义为:手术即刻成功及术后1个月无主要不良心血管事件(major adverse cardiovascular events,MACE)发生。MACE包括死亡、非Q波和Q波心肌梗死、早期(术后1个月内)靶血管再次血运重建、心脏压塞。
1.4并发症相关定义
ELCA的并发症包括冠状动脉夹层、冠状动脉痉挛、血栓形成、无复流现象、栓塞、冠状动脉穿孔、主要侧支的闭塞和冠状动脉急性闭塞。冠状动脉痉挛定义为因血管平滑肌异常收缩、口径急剧减小导致短暂的血流减少,通常能自发或通过服用硝酸甘油而缓解。血栓形成是指冠状动脉内出现新的充盈缺损,硝酸甘油应用后未见明显变化。无复流现象是指心肌得不到充足的有效灌注,但并没有明确的血管造影证据证明存在血管阻塞。冠状动脉穿孔是根据血管外对比剂的漏出而诊断的。冠状动脉急性闭塞是指因靶病变阻塞,TIMI血流评级由Ⅲ级变为0~Ⅰ级。
1.5术后用药及随访
术后常规给予低分子肝素0.4~0.6 mg/12 h,维持2~3 d。患者出院后需行12个月的双联抗血小板药物治疗(阿司匹林100 mg、每日1次及氯吡格雷75 mg、每日1次)及长期阿司匹林(100 mg,每日1次)治疗,冠心病二级预防。
1.6统计学分析
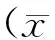
2 结果
2.1患者基线资料情况
15例患者共有15处病变行ELCA, 其中男12例(80.0%),平均年龄63 (53,75)岁。15例患者中糖尿病患者8例(53.3%);不稳定型心绞痛11例(73.3%),稳定型心绞痛4例(26.7%);左心室射血分数<40%患者3例(20.0%);陈旧性心肌梗死3例(20.0%);既往冠状动脉旁路移植术1例(6.7%);既往冠状动脉支架术4例(26.7%);估算的肾小球滤过率<60%患者3例(20.0%)。
2.2ELCA结果
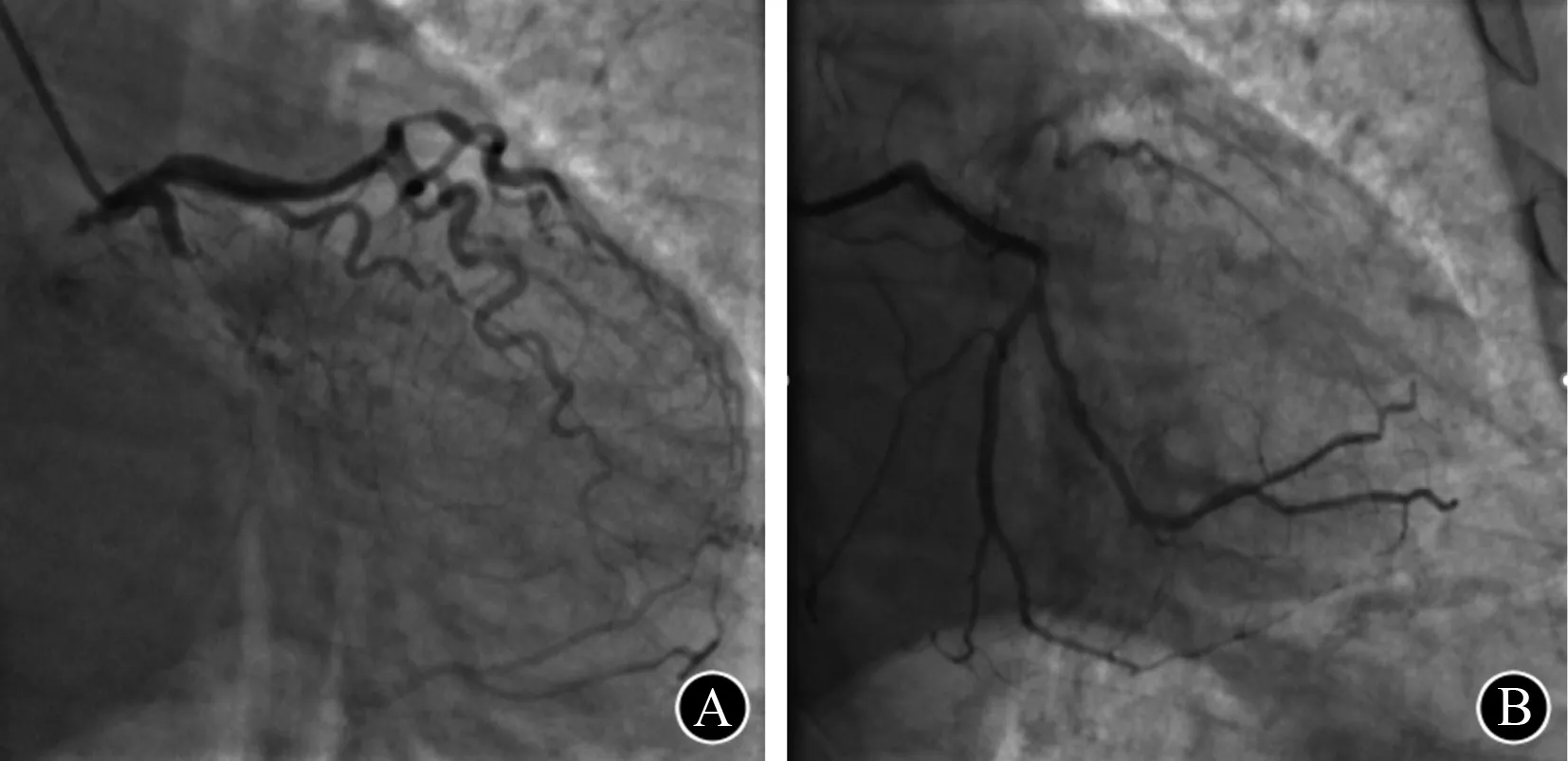
图1 病例1 A.左回旋支慢性完全闭塞病变,以1.25 mm球囊难以通过病变;B.应用0.9 mm激光导管,以能量密度45 mJ/mm2, 25 Hz进行消融后成功通过2.0 mm球囊,置入2.5 mm×12 mm、3.5 mm×30 mm 支架
行ELCA患者的病变类型及介入特点见表1。15例患者均应用0.9 mm导管进行消融,所有病变均成功通过激光导管,最后行球囊扩张。15例患者中钙化病变11例(73.3%),其中1例既往行冠状动脉旁路移植术的患者处理血管为原发血管右冠状动脉(right coronary artery,RCA)远段;5例(33.3%)为CTO(图1为其中1例患者的造影图)。9例(60.0%)患者因中、重度钙化球囊不能通过病变(图2为其中1例患者的造影图),6例(40.0%)球囊不能扩张病变。13例(86.7%)患者置入DES,2例(13.3%)行药物球囊扩张。 手术过程中,应用最大能量密度为45.0~60.0(52.0±7.5)mJ/mm2,最大频率为25.0~80.0(49.0±21.3)Hz,平均消融次数为(3.0 ±1.6)次, 手术即刻成功率为100% , 临床成功率为100%,平均随访(6.2±3.3)个月,随访期间未见MACE及ELCA并发症发生。
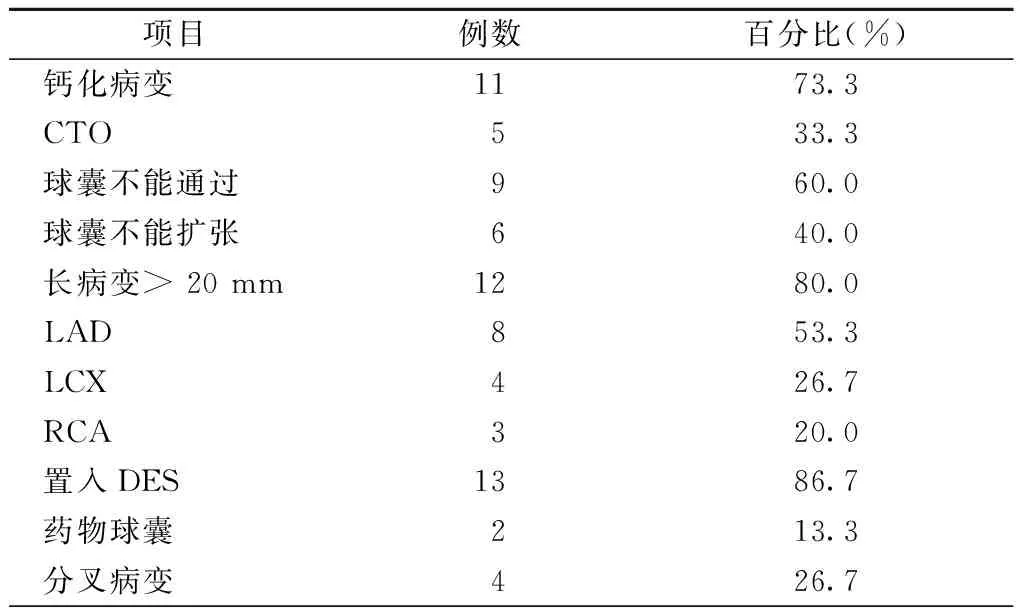
表1 15例患者行准分子激光冠状动脉消融病变类型及介入特点
注:CTO,冠状动脉完全闭塞病变,LAD,左前降支;LCX,左回旋支;RCA,右冠状动脉;DES,药物洗脱支架
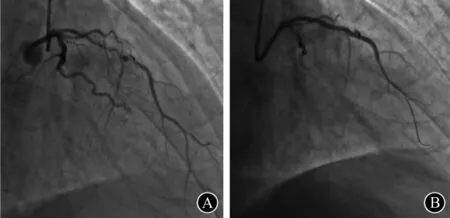
图2 病例2 A.左前降支重度钙化狭窄,以1.5 mm球囊反复尝试,不能通过病变;B.应用0.9 mm激光导管,经过(45 mJ/mm2,25 Hz;45 mJ/mm2, 40 Hz;45 mJ/mm2,60 Hz) 3次激光消融后,成功通过1.5 mm、2.0 mm球囊,并置入2.5 mm×32.0 mm、2.75 mm×21.00 mm药物洗脱支架
3 讨论
随着经桡动脉入径介入治疗的普及,PCI的适应证和难度也在增加,需要行PCI的患者中有12%存在严重钙化病变,10%存在CTO,以及1.5%患者的病变存在球囊不能通过或不能扩张的风险[5-6]。本研究证实,ELCA为经桡动脉入径治疗严重狭窄或钙化病变提供了一种安全有效的辅助方法。
ELCA以惰性卤化物为激光介质,发射出波长为309 nm的高强度单向紫外线光波,其吸收深度仅为50 μm,产生较少的热效应,且对非靶病变的损伤达到最小化。ELCA产生作用主要通过光化学效应、光热效应和光机械效应三种作用机制。紫外线作用于血管内组织和血栓处,使细胞的碳键断裂、结构弱化,同时会使细胞内水分温度升高而产生水蒸气,使细胞破裂。导管末端水蒸气的产生使组织损伤变为可控的,并且组织汽化产生的压力能对血管内栓塞物质产生更强的破坏作用。消融产生的副产品是水、气体和微小物质(超过91%的物质直径小于10 μm)。由于避免了血管内栓塞, 所以相对于旋磨,ELCA更不易引起无复流及围术期心肌梗死等并发症。
ELCA导管可以联用口径0.014 in(1 in=2.54 cm)的导丝,其导管有四种型号:0.9 mm、1.4 mm、1.7 mm和2.0 mm。前两者可以应用于桡动脉6 F导管,0.9 mm导管最常运用于CTO中,1.4 mm常应用于冠状动脉支架再狭窄的病变中。对于支架置入后膨胀不良引起的再狭窄,需要更大直径的导管,以有助于支架下面纤维组织的消融,从而使支架达到完全扩张的目的[7]。ELCA在消融动脉粥样硬化斑块的同时有促进血栓溶解作用,所以不仅有瓦解病变组织的作用,还有消除血栓、减少血小板聚集的效应。所以ELCA治疗还可以应用于急性冠状动脉综合征、急性心肌梗死的血栓性病变以及大隐静脉桥血管介入[8]。国外报道显示,119例接受ELCA治疗的冠状动脉疾病患者中,CTO 26.9%,钙化病变 21.0%,大隐静脉桥血管33.6%, ISR 12.6%,急性心肌梗死5.9%[4]。
既往研究的ELCA手术成功率为95.5%[3]。本研究中的激光导管在钙化病变及CTO中的手术成功率为100%,这可能与病变选择有关。ELCA对于严重钙化病变的效果劣于旋磨(79%比96%,P<0.05),但ELCA相对于旋磨治疗具有更短的学习曲线[3]。ELCA较旋磨的优势是激光导管应用常规的0.014 in PTCA导丝;而旋磨导丝的超控力较差,对于严重狭窄的钙化病变可能难以通过,所以国外有联合激光导管及旋磨进行消融的病例报道[9-10]。
ELCA除了无保护左主干病变为相对禁忌证外,无特殊的绝对禁忌证,并发症与普通的PCI相似。ELCA操作的原则是选择导管的直径小于血管直径的2/3,缓慢前进的速度为1 mm/s,助手同时用盐水进行冷却。在操作的过程中,如果助手配合盐水输注中断或消融过程中混杂对比剂,可能增加冠状动脉穿孔风险。另外,如果选择导管直径过大,病变的消融部位为支架边缘,或为非对称病变,成角也可以增加穿孔的风险。随着手术例数的增加与病变的选择,此类并发症可以避免。激光能起到消融作用与激光的能量和脉冲频率有关,同时能量与脉冲频率的增加也能增加冠状动脉穿孔及并发症的风险。如果病变难以通过需要增加能量及脉冲频率时,以先增加脉冲频率后增加能量为宜。国外研究显示,应用高能量密度的ELCA(80 mJ/mm2,80 Hz)可以提高通过病变能力,而且并不增加并发症的发生[11]。
本研究的缺陷在于样本量较小,且随访时间较短,其长期疗效有待进一步验证。本研究结果显示,在球囊不能通过的钙化病变或CTO中,ELCA成功率较高,并发症较低,可以进一步临床推广。
[1] Olivari Z, Rubartelli P, Piscione F, et al. Immediate results and one-year clinical outcome after percutaneous coronary interventions in chronic total occlusions: data from a multicenter, prospective, observational study (TOAST-GISE). J Am Coll Cardiol, 2003,41(10):1672-1678.
[2] Topaz O. Whose fault is it? Notes on “true” versus “pseudo” laser failure. Cathet Cardiovasc Diagn, 1995,36(1):1-4.
[3] Bilodeau L, Fretz EB, Taeymans Y, et al. Novel use of a high-energy excimer laser catheter for calcified and complex coronary artery lesions. Catheter Cardiovasc Interv, 2004,62(2):155-161.
[4] Badr S, Ben-Dor I, Dvir D, et al. The state of the excimer laser for coronary intervention in the drug-eluting stent era. Cardiovasc Revasc Med, 2013,14(2):93-98.
[5] 王伟民,霍勇,葛均波,等.冠状动脉钙化病变诊治中国专家共识.中国介入心脏病学杂志,2014,22(22):69-73.
[6] 张慧平,孙福成.冠状动脉慢性完全闭塞病变的介入治疗现状.中国介入心脏病学杂志,2013,21(21):251-255.
[7] Lam SC, Bertog S, Sievert H. Excimer laser in management of underexpansion of a newly deployed coronary stent. Catheter Cardiovasc Interv, 2014,83(1):E64-E68.
[8] Giugliano GR, Falcone MW, Mego D, et al. A prospective multicenter registry of laser therapy for degenerated saphenous vein graft stenosis: the COronary graft Results following Atherectomy with Laser (CORAL) trial. Cardiovasc Revasc Med, 2012,13(2):84-89.
[9] Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon: excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and non-expansible coronary lesions. EuroIntervention,2013,9(2):243-250.
[10] McKenzie DB, Talwar S, Jokhi PP, et al. How should I treat severe coronary artery calcification when it is not possible to dilate a balloon or deliver a RotaWireTM? EuroIntervention,2011,6(6):779-783.
[11] Ambrosini V, Sorropago G, Laurenzano E, et al. Early outcome of high energy Laser (Excimer) facilitated coronary angioplasty ON hARD and complex calcified and balloon-resistant coronary lesions: LEONARDO Study. Cardiovasc Revasc Med, 2015,16(3):141-146.
Treatment of complex coronary lesions by excimer laser coronary atherectomy:the initial experiences in China
LIUWei,ZHOUYu-jie,ZHAOYing-xin,SHIDong-mei,LIUYu-yang,ZHOUZhi-ming,GUOYong-he,CHENGWan-jun,GEHai-long,WANGJian-long,HUBin,LIUXiao-li.
DepartmentofCardiology,BeijingAnzhenHospital,CapitalMedicalUniversity,Beijing100029,China
ZHOUYu-jie,Email:azzyj12@163.com
ObjectiveExcimer laser coronary atherecomy (ELCA) has been recently used for the treatment of complex coronary lesions including calcified stenosis, chronic total occlusions and in-stent restenosis. Such complex lesions are difficult to adequately treat with balloon angioplasty and/or intracoronary stenting. The aim of this study was to introduce our early experiences in using ELCA in China. MethodsFifteen patients were enrolled through our center from March 2015 to April 2016, and excimer laser coronary angioplasty was performed on 15 lesions. Eleven patients were previously failed cases either from uncrossable balloon (9 lesions) or expandable balloon (6 lesions). The procedure and clinical endpoints were recorded. ResultsLaser catheter with 0.9 mm diameters were used in all 15 coronary lesions. All the lesions were successfully crossed with laser catheter and finally dilated with balloon. The procedural success rate was 100%. Drug eluting stents (DES) were implanted in 86.7% lesions and 2 cases were treated with drug eluting balloon. Clinical success was obtained in all patients (100%). There was no dissection, major side branch occlusion, spasm, no-reflow phenomenon nor acute vessel closure. ConclusionsThis study shows that laser-facilitated coronary angioplasty is a simple, safe and effective device for the management of complex coronary lesions.
Excimer laser coronary atherectomy;Transradial;Complex coronary lesions
10.3969/j.issn.1004-8812.2016.09.007
100029北京,首都医科大学附属北京安贞医院心内科
周玉杰,Email:azzyj12@163.com
R543.3
2016-04-27)
