正常及肝纤维化小鼠大范围肝切除后的肝再生研究
2016-11-10张迪刘子荣陈峰崔子林张雅敏天津医科大学一中心临床学院天津300070天津市第一中心医院肝胆外科天津3009
张迪,刘子荣,陈峰,崔子林,张雅敏(.天津医科大学一中心临床学院,天津300070;.天津市第一中心医院肝胆外科,天津 3009)
我国肝癌患者多合并肝硬化或肝纤维化等基础肝病,合并有基础病变的肝脏如进行大范围切除会引起残肝再生不足,导致患者出现急性肝衰竭[1]。因此,比较正常肝脏和合并有基础肝病的肝脏在行大范围肝切除后的肝再生情况,研究纤维化病变在肝大部分切除后对肝脏损伤和肝再生的影响对于临床治疗具有重要意义。与大鼠不同,小鼠具有胆囊结构[2],更接近于人的生理解剖,与人类具有较高的同源性,因此,小鼠模型更适合该研究。本研究主要对比肝纤维化病变小鼠和正常小鼠在大范围肝切除后残肝损伤和肝再生的差异,研究肝纤维化对肝切除后肝损伤和肝再生的影响。
1 材料与方法
1.1 实验动物及分组:选取120只健康成年雄性C57/BL6小鼠,体重为20~25 g,由北京华阜康生物科技股份有限公司提供。采用随机数字表法分为对照组和实验组,每组60只小鼠。实验组诱导肝纤维化,成模后两组随机分为3小时、6小时、12小时、24小时、48小时和72小时6个时间点组,每组10只小鼠。
1.2 动物模型制备
1.2.1 小鼠肝纤维化模型:采用背部皮下注射40 %CCl4玉米油溶液构建小鼠肝纤维化模型[3-5],每2天注射1次,前2周剂量为0.003 ml/g,后4周剂量为0.002 ml/g,维持6周可成模。造模期间注意小鼠饮食及生活环境清洁,以免引起感染。
1.2.2 肝纤维化小鼠肝再生模型:术前小鼠自由饮食。采用动物麻醉机对小鼠进行吸入麻醉,腹部备皮消毒,延腹中线切开皮肤肌肉进入腹腔。自制拉钩暴露手术视野,游离肝脏,动作轻柔。结扎支配肝左叶和中叶的肝动脉及门静脉分支,待两个肝叶变色后结扎摘除胆囊和两叶[6-7]。清洗腹腔后,分两层关腹,撤除麻醉机,等待小鼠苏醒。
1.3 标本采集:分别于术后3小时、6小时、12小时、24小时、48小时和72小时处死两组小鼠,采取血液和肝脏组织标本,离心后收集血清于-80℃保存, 用于检测血清中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平;取肝脏组织标本,固定于10%甲醛水溶液,经脱水、石蜡包埋、切片后,检测肝脏病理和增殖细胞核抗原(PCNA)表达。
1.4 观察指标:① 苦味酸天狼猩红染色观察肝纤维化的造模情况;② 全自动生化分析仪检测小鼠血清ALT、AST水平,了解小鼠肝功能变化;③ 肝脏组织病理切片苏木精-伊红(HE)染色观察小鼠肝损伤程度; ④ 分别在6个时间点处死小鼠,秤量小鼠体重和残肝重量,计算肝体重比,以观察两组小鼠的肝再生状况;⑤ 免疫组化检测残肝组织切片PCNA阳性表达细胞数目,观察术后两组肝细胞的增殖状态。
1.5 统计学分析:采用SPSS 19.0进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 肝纤维化模型的鉴定情况(图1):肝组织切片苦味酸天狼猩红染色可见实验组正常肝小叶结构破坏,汇管区及中央静脉周围纤维组织增生形成假小叶,肝细胞索排列紊乱,中央静脉周围可见大量炎性浸润,肝细胞出现脂肪变性及坏死,而对照组肝小叶结构清晰,未见纤维增生,肝索呈放射状排列,细胞形态正常。肝纤维化模型构建成功,可用于下一步实验的研究。
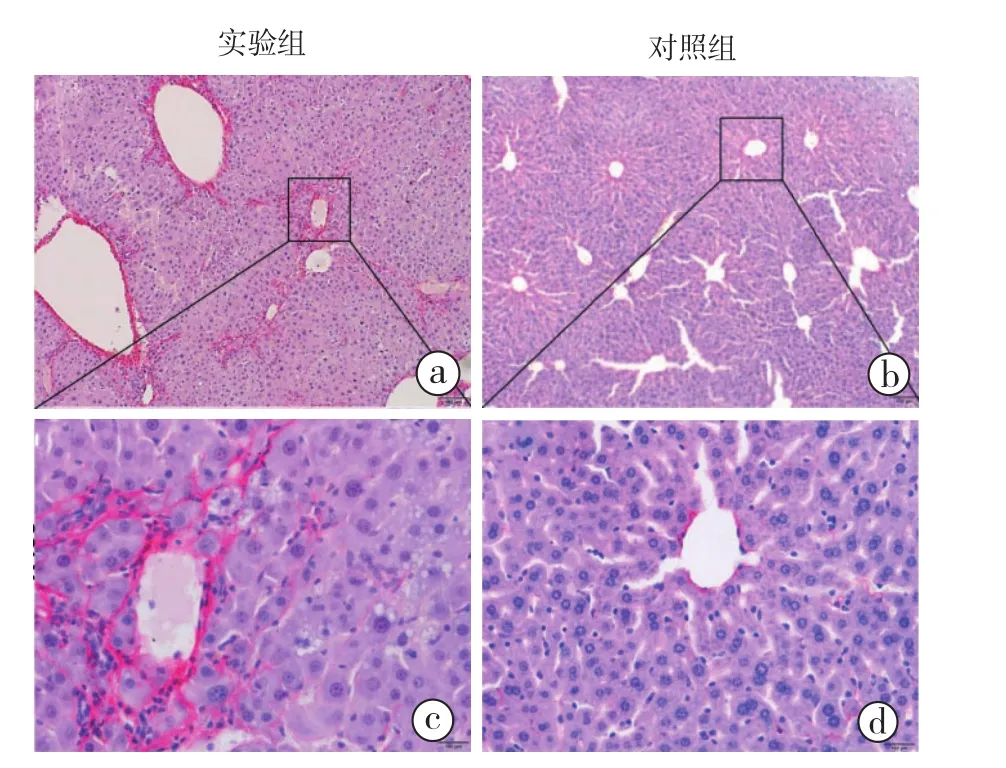
图1 两组肝组织切片天狼猩红染色a、b为HE×100;c、d为HE×400
2.2 肝脏组织学变化(图2):肝组织HE染色结果显示,两组在术后24小时肝损伤最严重,实验组肝细胞轮廓不清,排列杂乱,伴大量脂肪变性和坏死,对照组仅见大量气球样变。48小时见两组肝再生旺盛,对照组肝损伤修复较好,实验组肝损伤仍然较为严重。
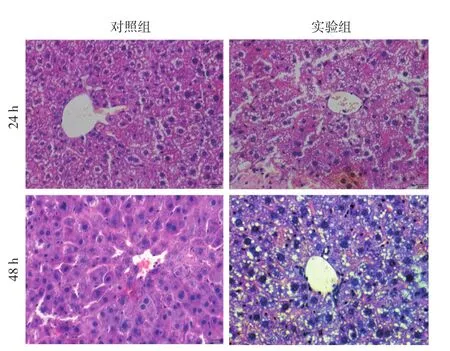
图2 肝组织切片(HE×400)
2.3 肝切除术后肝功能变化(图3):对两组小鼠行肝左叶、中叶切除术,术后两组小鼠血清中ALT和AST水平均出现先升高后下降的变化趋势,并 且均在12小时达到峰值。实验组下降较对照组缓慢,各时间点ALT、AST水平明显高于对照组,在3小时、6小时、12小时、24小时、48小时和72小时两组比较具有统计学意义。
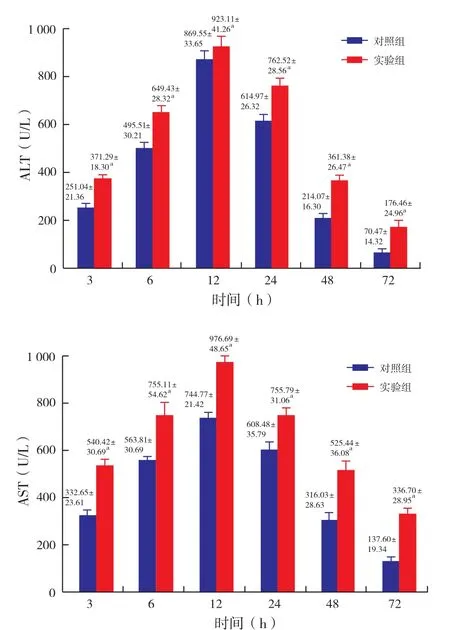
图3 术后各时间点ALT、AST表达水平与对照组相比,aP<0.05
2.4 肝体重比结果(图4):肝切除术后,两组均出现肝再生趋势,在24~48小时肝再生迅速。与对照组相比,实验组肝再生缓慢或延迟,在24小时、48小时和72小时,与对照组相比具有统计学意义。
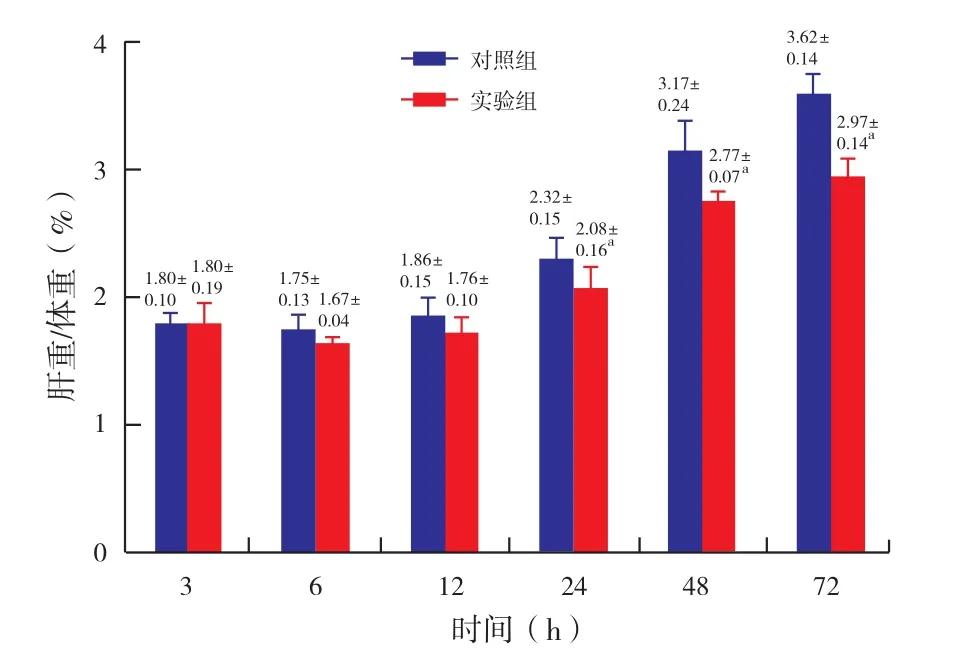
图4 肝切除术后不同时间肝脏/体重比值与对照组相比,aP<0.05
2.5 PCNA阳性细胞计数(图5和图6):免疫组化结果显示,两组肝脏组织PCNA阳性表达细胞数于肝切除后开始升高,在48小时达到峰值后下降。在24小时前实验组PCNA阳性细胞数高于对照组,24小时开始对照组PCNA阳性细胞数增加,并且高于实验组。各时间点两组比较均具有统计学意义。
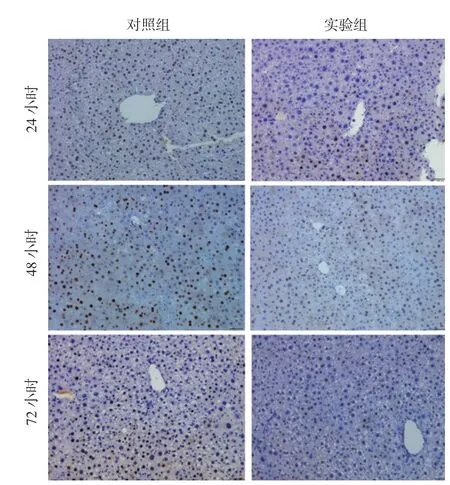
图5 肝脏切片免疫组化(PCNA×200)
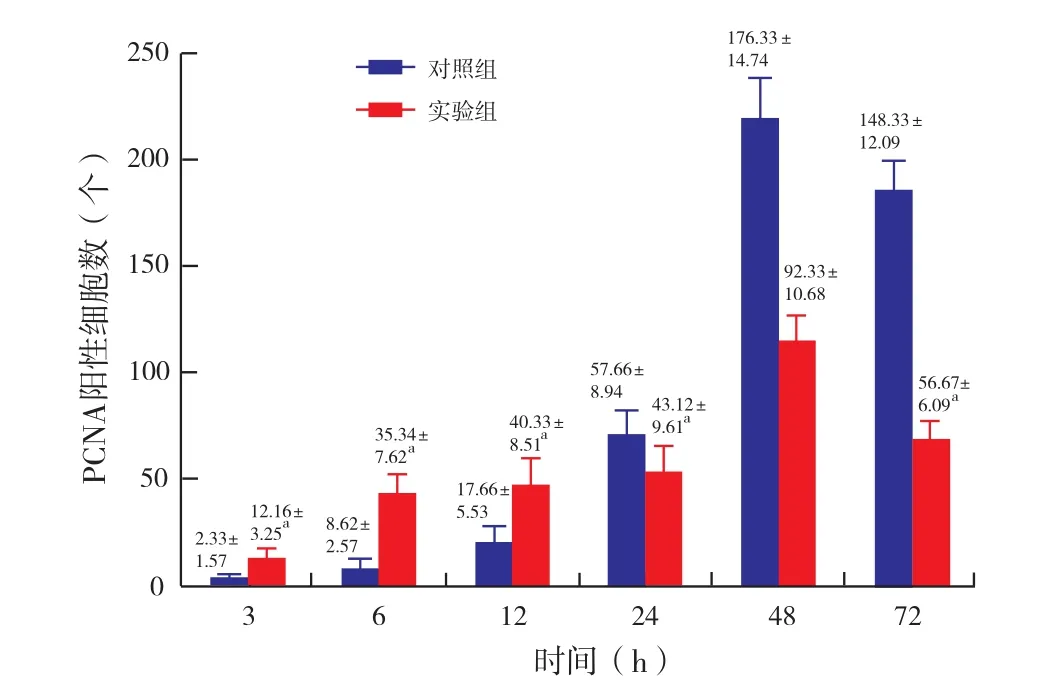
图6 PCNA阳性细胞数趋势图与对照组相比,aP<0.05
3 讨 论
肝纤维化模型制作方法有很多,如化学药物损伤,免疫诱导,胆道结扎等[8-9],其中以CCl4法最常用,且与临床肝纤维化疾病具有相似性。在此基础上进行大范围肝切除能够模拟临床有肝纤维化基础肝病行肝切除术后的状态,对于评价和筛选抗纤维化药物及促进肝再生治疗措施具有重要意义。
本研究表明,肝纤维化状态可影响肝切除后的肝损伤、再生程度,主要表现为加重肝损伤,延缓肝再生进程。ALT、AST是反映肝脏功能的常用指标,两组小鼠在肝切除后ALT和AST水平都表现出先升高后降低的趋势,说明肝切除本身可以造成肝细胞的损伤,与对照组相比,实验组在各时间点ALT、AST均明显升高,表明肝脏的纤维化状态可引起肝切除后肝脏损伤增加。对两组术后各时间点肝脏的HE染色结果进行比较,同样发现纤维化组损伤严重;肝重体重比值可以消除个体体重差异的影响,PCNA能够很好的反映肝再生率的趋势,也是反映细胞增殖阶段的重要指标。两组在术后6小时即开始升高,24~48小时再生迅速,并在48小时达到峰值。但是与对照组相比,纤维化组肝脏再生缓慢,这说明肝脏纤维化状态在肝再生过程中起了抑制作用。
肝再生是在肝脏受到损伤后,由多种细胞因子和信号转导通路协同作用的过程[10],表现为肝细胞代偿性增生,以满足机体正常的代谢需求。然而具有肝纤维化基础病变的肝脏与正常肝脏的肝再生机制并不完全相同[11-13],其具体机制目前尚不清楚。本研究通过成功构建肝纤维化小鼠大范围肝切除模型,观察肝纤维化对肝切除后肝脏损伤和再生的影响,发现在行大范围肝切除后肝纤维化病变可使小鼠肝脏损伤加重,肝再生延迟。
