吡格列酮对链脲佐菌素诱导的糖尿病大鼠骨形态计量学的影响
2016-11-10邱明才
邸 倩, 邱明才, 张 鑫, 杨 静
(1山西医科大学第一临床医学院内分泌科,太原 030001; 2天津医科大学总医院内分泌科)
吡格列酮对链脲佐菌素诱导的糖尿病大鼠骨形态计量学的影响
邸倩1, 邱明才2, 张鑫2, 杨静1
(1山西医科大学第一临床医学院内分泌科,太原030001;2天津医科大学总医院内分泌科)
目的探讨不同剂量吡格列酮(PIO)对链脲佐菌素诱导的糖尿病大鼠骨形态计量学的影响。 方法大鼠尾静脉1次注射STZ(45 mg/kg)建立糖尿病大鼠模型,28只造模成功的大鼠被随机分为PIO低剂量组[4 mg/(kg·d),n=10]、PIO高剂量组[20 mg/(kg·d),n=10]和模型组(n=8)。10只未造模大鼠为对照组。PIO治疗组每日吡格列酮混悬液灌胃服用干预16周,股动脉放血方法处死大鼠,取左侧胫骨近端2/3制作大鼠不脱钙骨切片,测量骨组织形态计量学参数。结果与对照组相比,模型组及各PIO治疗组骨小梁体积占全部骨组织体积的百分比(TBV/TTV)、平均骨小梁板厚度(Tb.Th)、平均骨小梁接点数(Tb.N)、四环素单标表面(sLS/S)、四环素双标表面(dLS/S)、骨矿化表面(MS/BS)、组织水平的骨形成速率(Svf)、骨形成表面(O S/BS)均不同程度的减少(P<0.01),平均骨小梁板间隙(Tb.Sp)均不同程度的增加(P<0.01)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组TBV/TTV、dLS/S、Svf减少(P<0.05),Tb.Th、Tb.N、sLS/S、MS/BS、OS/BS减少(P<0.01),Tb.Sp增加(P<0.01)。结论低剂量PIO[4 mg/(kg·d)]对于糖尿病大鼠骨计量没有影响,高剂量PIO[20 mg/(kg·d)]可能通过使糖尿病大鼠骨形成速率减低引起糖尿病大鼠骨量减少,建议PIO宜小剂量使用。
吡格列酮;链脲佐菌素;糖尿病;骨计量学
噻唑烷二酮类药物(TZDs)主要通过激活过氧化物酶酶体增殖受体(PPAR-γ),增加多种基因编码蛋白的表达,从而提高胰岛素敏感性,降低血糖。吡格列酮是噻唑烷二酮类的主要药物之一。既往研究表明,PPARγ可导致骨量减少,增加骨折的风险[1]。也有研究认为,骨髓干细胞膜上的PPARγ被配体激活后可在骨髓微环境中阻断破骨细胞的生成[2]。目前,对于PPARγ影响糖尿病大鼠骨代谢和骨转换的机制还不是十分清楚。在之前的文章[3]中已经讨论了PIO干预影响糖尿病大鼠骨密度及骨转换的状况,发现低剂量PIO干预糖尿病大鼠骨密度无变化,高剂量PIO干预可使糖尿病大鼠骨密度减低。本文将进一步探讨不同剂量PIO干预影响糖尿病大鼠骨形态计量学的状况。
1 材料与方法
1.1实验动物
8周龄雄性SD大鼠38只[清洁级,体重(240±13 g)],由军事医学科学院卫生学环境医学研究所实验动物中心提供。实验动物质量合格证编号:SGCK(京)2008-0001。标准颗粒饲料喂养,自然照明,室内室温20-25 ℃,相对湿度40%-70%。实验期间动物自由采食和饮水。
1.2主要试剂和仪器
链脲佐菌素(美国Sigma公司)、微量血糖试纸(罗氏诊断有限公司)、PIO(北京太洋有限公司)、盐酸四环素(上海制药厂)、 Villaneuva骨染色剂,乙醇,丙酮,甲基丙稀酸甲酯,聚甲基丙稀酸甲酯,过氧化苯甲酰(均购自天津化学试剂一厂)。ACCT-CHECK Active 血糖仪(罗氏诊断有限公司)、Roger Polycut Ⅲ切片机(德国Leica公司)、OLYMPUS IX70 倒置显微镜(日本OLYMPUS 公司)。
1.3糖尿病大鼠模型建立与PIO治疗
28只造模成功的大鼠被随机分为PIO低剂量组[4 mg/(kg·d),n=10]、PIO高剂量组[20 mg/(kg·d),n=10]和模型组(n=8)。另选10只未造模大鼠为对照组。造模前夜,大鼠自由进食水。造模方法为将大鼠置于鼠盒,尾静脉1次注射STZ 45 mg/kg。给药后72 h后和7 d后测定大鼠尾静脉血糖,两次测定血糖均大于16.7 mmol/L判定为糖尿病造模成功。尾静脉注射STZ大鼠糖尿病成模率为96.4%,全部动物于成模后干预16周,股动脉放血处死。干预期间未应用吡格列酮之外的降糖药物。干预方法为每日上午9时给药,吡格列酮混悬液灌胃服用。干预期间无因血糖原因死亡大鼠。
1.4四环素双标记法
利用四环素能与骨特异结合并沉积在骨矿化前沿的特性,把时间因素标记在骨的重建过程中,四环素标记反映骨重建活性,表明骨小梁表面的激活频率。两种标记线增多,均是骨再建活跃的指标,可直观地反映骨形成和新骨生长情况。
在处死动物前14 d进行第1次标记,方法为:盐酸四环素按每日50 mg/kg体重,每日1次灌胃,标记2 d。停药后11 d,进行第2次标记,方法同前。在第2次灌胃后3 d,处死动物。
1.5大鼠不脱钙骨切片的制备
取左侧胫骨近端2/3为所用标本,去除软组织,将骨标本两侧沿纵向用水砂纸磨平,暴露骨髓腔。0.5%的Villaneuva骨染色剂中染色4 d。按下列顺序脱水脱脂:75%乙醇2 h,2次→80%乙醇2 h,2次→95%乙醇1 h,2次→100%乙醇40 min,2次→100%乙醇和丙酮1∶1混合液5 h→丙酮2 h,2次→丙酮和甲酯1∶1混合液4 h→甲酯24 h,脱水脱脂好的标本可置于甲酯中保存。配置包埋剂:甲基丙稀酸甲酯250 ml,过氧化苯甲酰2.5 g,聚甲基丙烯酸甲酯75 g混合后,用磁力搅拌器搅拌至清亮透明,4 ℃冰箱保存。将标本放入包埋盒,用包埋剂包埋标本,置真空干燥箱中干燥,温度25-30 ℃,约1周,包埋块变硬取出。用德国POLYCUT硬质骨切片机切成20 μm厚的切片,光学树脂封胶片。
1.6骨形态计量学参数分析
将骨切片置于光学显微镜和荧光显微镜下,用KONTRON-IBA2.0全自动图像处理系统测量自骺板线远端1-5 mm范围内骨组织形态计量学参数。
骨形态学参数:全部骨组织体积(TTV,mm3),海绵骨体积(SBV,mm3),骨小梁体积(TBV,mm3),骨小梁体积(TBV)占全部骨组织体积(TTV)的百分比(TBV/TTV,%),平均骨小梁板厚度(Tb.Th,μm),平均骨小梁板间隙(Tb.Sp,μm),平均骨小梁接点数(Tb.N,个/视野)。骨动力学参数:四环素单标表面(sL.S/TBS,%),四环素双标表面(dL.S/TBS,%),骨矿化表面(MS/BS,%),骨形成表面(OS/BS,%),矿化沉积率(MAR,μm/d),矿化延迟时间(MLT,d),组织水平的骨形成速率(Svf,μm/d)。
1.7统计学分析
2 结果
2.1各组大鼠骨形态学参数比较
与对照组相比,STZ诱导的糖尿病大鼠模型组及各PIO治疗组TBV/TTV、Tb.Th、Tb.N均不同程度地减少,Tb.Sp不同程度地增加(均P<0.01)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组TBV/TTV减少(P<0.05),Tb.Th、Tb.N减少,Tb.Sp增加(均P<0.01)。与低剂量组相比,高剂量组TBV/TTV、Tb.Th减少(P<0.05),Tb.N减少(P<0.01),Tb.Sp增加(P>0.05)。
2.2各组大鼠骨动力学参数比较
与对照组相比,STZ诱导的糖尿病大鼠模型组及各PIO治疗组sLS/S、dLS/S、MS/BS、Svf、OS/BS均不同程度地减少(均P<0.01)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组sLS/S、MS/BS、OS/BS减少(P<0.01),dLS/S、Svf减少(P<0.05),而MAR、MLT差异无统计学意义。与低剂量组相比,高剂量组sLS/S、dLS/S、MS/BS、Svf均减少(均P<0.01),而MAR、MLT差异无统计学意义。

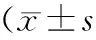

组别nTBV/TTV(%)Tb.Th(μm)Tb.Sp(μm)Tb.N(个/视野)低剂量组1013.95±2.26△94.21±12.33△428.78±13.54△2.78±0.65△高剂量组1013.76±1.22△#*92.95±15.71△##*430.84±23.99△##2.73±0.51△##**模型组814.11±2.48△94.46±12.00△427.25±27.17△2.81±1.39△对照组1017.26±1.16122.23±6.79187.73±41.055.22±0.58
与对照组相比,△P<0.01;与模型组相比,#P<0.05,##P<0.01;与低剂量组相比,*P<0.05,**P<0.01

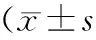

组别nsLS/S(%)dLS/S(%)MS/BS(%)MAR(μm/d)MLT(d)Svf(μm/d)OS/BS(%)低剂量组109.28±1.26△2.23±0.33△5.34±0.54△0.41±0.055.61±0.230.44±0.07△1.35±0.34△高剂量组109.24±0.85△##**2.19±0.25△#**5.29±0.99△##**0.36±0.095.02±0.510.42±0.04△#**1.32±0.05△##模型组89.31±1.49△2.25±0.10△5.35±0.17△0.42±0.035.73±0.40.45±0.01△1.36±0.02△对照组1012.47±4.974.04±0.247.24±0.050.45±0.065.81±0.520.86±0.024.02±0.03
与对照组相比,△P<0.01;与模型组相比,#P<0.05,##P<0.01;与低剂量组相比,**P<0.01
3 讨论
骨组织形态计量学(bone histomorphometry)简称骨计量学,以形态学观察到的骨组织结构改变为基础,用定性、定量的计量方法求得骨体积密度、骨小梁表面积、皮质骨厚、骨小梁间距、骨小梁厚的平均值等,还能对类骨质进行分析,求得平均类骨质体积、平均类骨质表面、平均类骨质宽、成骨细胞活跃表面、破骨细胞活跃表面和平均骨壁厚等指标,并且还能通过活体四环素双标记的方法,测定多组骨动力学组织参数[4]。
本研究中,TBV/TTV代表骨小梁体积(TBV)占全部骨组织体积(TTV)的百分比,反映骨小梁的骨量。结果表明,与模型组相比,低剂量组骨量没有明显变化,而高剂量组则骨量明显减少。Tb.Th反映平均骨小梁板厚度,Tb.Sp反映平均骨小梁板间隙,Tb.N反映平均骨小梁接点数,反映骨小梁连接性。Tb.Th、Tb.Sp及Tb.N反映骨小梁的空间结构。与模型组相比,高剂量组骨小梁板厚度减低,间隙增加,骨小梁连接性减低,从而使其阻抗外力的作用减低,而低剂量组则无明显变化。sL.S/TBS代表沿骨小梁表面走行的四环素单标记线长度占骨小梁表面长度的百分比,dL.S/TBS代表两次标记的四环素沉积于骨表面所形成的双标记线长度占骨小梁表面长度的百分比,MS/BS代表四环素单标记线的1/2与双标记线之和占骨小梁表面的百分比,OS/BS代表骨小梁类骨质表面占骨小梁表面的百分比。sL.S/TBS、dL.S/TBS、MS/BS及OS/BS都是形成参数,反映骨重建的活跃程度。Svf表示组织水平的骨形成速率,表明单位面积骨小梁表面每天新生成的矿化骨的多少。高剂量组较模型组骨小梁标记表面减低,骨形成速率减低,提示高剂量PIO可能通过使糖尿病大鼠骨形成速率减低造成骨量减少,而低剂量组上述动力学指标则无明显变化,这与形态学参数变化相一致。
综上所述,实验提示低剂量PIO[4 mg/(kg·d)]对于STZ诱导的糖尿病大鼠骨形态计量学无显著影响。这个结果与之前的实验结果是一致的[3]。也有一项研究显示,小剂量吡格列酮[3 mg/(kg·d)]干预链脲佐菌素诱导的糖尿病大鼠,不影响骨密度,骨吸收及骨代谢,与本实验结果一致[5]。而高剂量组干预16周可使糖尿病大鼠已有的骨量减少进一步加重,骨形态学示骨小梁骨量进一步减少,而骨动力学参数显示骨小梁标记表面减低,骨形成速率减低,提示高剂量PIO可能通过使糖尿病大鼠骨形成速率进一步减低造成骨量减少。既往研究结果不尽相同。Lecka-Czernik等[6]的骨髓干细胞培养与罗格列酮[20 mg/(kg·d)] 干预C57BL/6J(B6)鼠体内实验显示,大鼠骨小梁体积减少,通过骨形成速率减低造成骨量减少,本实验结果与此基本一致。另一项临床研究也显示,吡格列酮抑制骨形成,似乎并不影响骨吸收[7],本实验结果与此一致。也有研究显示不同的结果。Syversen等[8]给予未去除卵巢的完整雌鼠(Fischer-344)吡格列酮35 mg/(kg·d)治疗4个月发现大鼠骨小梁体积减少,该实验中细胞培养也未能显示任何与罗格列酮类似的影响前成骨细胞分化的作用,而仅表现为血清OPG减低,推测PPARγ激动剂可能主要对骨吸收起作用。一项临床研究显示,30 mg/d的吡格列酮用于治疗2型糖尿病或IGT患者一年,未看到骨密度及骨转换方面的变化[9],吡格列酮增加2型糖尿病患者骨折风险的机制尚未可知。有研究表明,这种结果差异可能与TZDs激活PPARγ的活性不同有关[10]。当然,还需大规模的实验进一步证实。
总之,上述结果提示PIO可能减低骨量,宜小剂量使用。
[1]Zhu ZN,Jiang YF,Ding T. Risk of fracture with thiazolidinediones:an updated meta-analysis of randomized clinical trials[J].Bone,2014,68:115-123.
[2]Christie MR,Molvig J,Hawkes CJ,etal.IA-2 antibody-negative status predicts remission and recovery of C-peptide levels in type 1 diabetic patients treated with cyclosporin[J].Diabetes Care,2002,25(7):1192-1197.
[3]邸倩,邱明才,张鑫,等.吡格列酮对链脲佐菌素诱导的糖尿病大鼠骨代谢指标及骨密度的影响[J].山西医科大学学报,2015,46(9):870-873.
[4]刘忠厚.骨矿与临床[M].北京:中国科学技术出版社.2006:353-356.
[5]Tsirella E1,Mavrakanas T,Rager O,etal.Low dose pioglitazone does not affect bone formation and resorption markers or bone mineral density in streptozocin-induced diabetic rats[J].J Physiol Pharmacol,2012,63(2):201-204.
[6]Lecka-Czernik B,Gubrij I,Moerman EJ,etal.Inhibition of Osf2/Cbfa1 expression and terminal osteoblast differentiation by PPARgamma2[J].J Cell Biochem,1999,74(7):357-371.
[7]Xiao WH,Wang YR,Hou WF,etal.The effects of pioglitazone on biochemical markers of bone turnover in the patients with type 2 diabetes[J].Int J Endocrinol,2013,2013:290734.
[8]Syversen U,Stunes AK,Gustafsson BI,etal.Different skeletal effects of the peroxisome proliferator activated receptor(PPAR)α agonist fenofibrate and the PPARγ agonist pioglitazone[J].BMC Endocr Disord,2009,9(6):10.
[9]Grey A,Bolland M,Fenwick S,etal.The skeletal effects of pioglitazone in type 2 diabetes or impaired glucose tolerance:a randomized controlled trial[J].Eur J Endocrinol,2014,170(2):255-262.
[10]Quesada-Gomez JM,Serrano-Alferez I.Nonhypoglycemic effects of thiazolidinediones[J].An Int Med,2001,135:1007-1008.
Effects of pioglitazone on bone histomorphometry in STZ-induced diabetic rats
DI Qian1, QIU Mingcai2, ZHANG Xin2, YANG Jing1
(1DepartmentofEndocrinology,FirstClinicalMedicalCollege,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofEndocrinology,GeneralHospitalofTianjinMedicalUniversity)
ObjectiveTo explore the effect of pioglitazone on bone histomorphometry in streptozocin(STZ)-induced diabetic rats.MethodsThe DM rat models were established by intravenous injection of STZ(45 mg/kg) and then were randomly divided into low-dose group[4 mg/(kg·d),n=10],high-dose group[20 mg/(kg·d),n=10] and model group(n=8).Another ten normal rats were chosen as control group.The rats in PIO groups were gavaged with PIO liquid every day for 16 weeks.Then the rats were killed,and the left tibia was dissected immediately for bone histomorphometry analysis.ResultsCompared with control group,the ratio of trabecula bone volume to total tissue volume(TBV/TTV),mean trabecula plate thickness(Tb.Th),numbers of trabecula(Tb.N),single labeled surfaces(sLS/S),double labeled surfaces(dLS/S),trabecular osteoid surface/total trabecular surface(OS/BS),MS/BS,bone formation velocity at tissue level(Svf) all decreased(P<0.01),while Tb.Sp increased in the other groups(P<0.01).Compared with model group,all indexes showed no significant change in low-dose group,while TBV/TTV,dLS/S,Svf,Tb.Th,Tb.N,sLS/S,MS/BS,OS/BS all decreased in high-dose group(P<0.05 or<0.01),but Tb.Sp increased(P<0.01).ConclusionThe low-dose PIO may not affect bone histomorphometry in diabetic rats,but high-dose PIO may induce osteopenia by decreasing osteoblastic forming rate.So PIO should be used with a low dose.
pioglitazone;streptozocin;diabetes;bone histomorphometry
邸倩,女,1975-08生,博士,副主任医师,E-mail:diqian2008@126.com
2016-05-09
R587.1
A
1007-6611(2016)10-0901-04DOI:10.13753/j.issn.1007-6611.2016.10.005
