寡霉素处理下细胞外ATP和细胞内ATP的关系及其对细胞死亡调节作用的研究
2016-11-10王庆文白晶月石岱龙贾凌云冯汉青
王庆文 白晶月 石岱龙 贾凌云 冯汉青
(西北师范大学 生命科学学院,兰州 730070)
寡霉素处理下细胞外ATP和细胞内ATP的关系及其对细胞死亡调节作用的研究
王庆文 白晶月 石岱龙 贾凌云*冯汉青
(西北师范大学 生命科学学院,兰州 730070)
以烟草悬浮细胞BY-2为材料,利用FoF1-ATP合成酶(FoF1-ATPase)抑制剂寡霉素研究了细胞内ATP(iATP)对胞外ATP(eATP)水平的影响,以及施加外源ATP对iATP水平和细胞死亡的调节作用。结果表明,随着寡霉素浓度的增加(5、10、25、50 μmol·L-1),烟草悬浮细胞的iATP含量逐渐下降,eATP含量也随之减少,且细胞死亡水平在较高寡霉素处理浓度下有明显上升。同时,随着寡霉素处理时间的增加(0.5、1、3、5 h),烟草悬浮细胞的iATP含量和eATP含量也呈现出不同程度的下降,而细胞死亡水平则有所增加。施加外源ATP能够缓解寡霉素引起的细胞iATP水平的下降和细胞死亡水平的上升。上述结果表明,eATP水平受到了iATP水平的影响,而eATP也在线粒体ATP合成受到抑制时调控iATP和细胞死亡的发生。
胞内ATP;胞外ATP;寡霉素;细胞死亡
三磷酸腺苷(adenosine-5′-triphosphate,ATP)是生物体中的一种高能量化合物,主要由线粒体产生,通常存在于细胞内部,并作为能量货币分子去支持细胞的各种代谢活动。线粒体ATP是细胞内ATP(iATP)最主要的来源,决定着iATP的水平[1~2]。同时,在动、植物细胞外基质中也存在着胞外ATP(eATP)[3]。研究表明,eATP可作为一种信使分子,通过特定信号转导机制调控细胞代谢和生长发育过程[4~6]。eATP一定水平的上升可刺激胞内游离的Ca2+、一氧化氮(NO)、活性氧(ROS)等第二信使分子含量的增加,从而影响植物细胞的生长发育[7~8],而eATP一定水平的下降可诱导植物病程相关蛋白(PR蛋白)的表达,并且增强了植物对于病毒和病原菌的抗性[9];eATP更大程度的下降则会引起植物细胞死亡[10]。
由于植物细胞在膜外不存在ATP合成酶,因此我们推测,eATP主要来源于iATP,并受iATP含量的影响,但是这一推论尚缺少直接的实验证据。此外,细胞死亡的重要机制之一是iATP的下降,而eATP的下降也能够引起细胞死亡[11]。这意味着eATP也很可能参与了iATP下降所引起的细胞死亡,但也尚无工作来对这一重要问题进行探讨。
基于此,本文以BY-2烟草悬浮细胞培养物(不含叶绿体,不会由光合作用影响ATP的水平,故而线粒体ATP的水平是iATP水平的决定性因素)为材料,利用FoF1-ATPase抑制剂—寡霉素(oligomycin,可通过抑制FoF1-ATPase中Fo亚基从而使细胞内ATP合成受到抑制)[12]研究了iATP的产生对eATP水平的影响,以及通过施加外源ATP研究eATP对iATP水平和细胞死亡的调节作用。本研究对明确iATP与eATP的关系以及细胞死亡的机制提供一定的参考和理论依据。
1 材料和方法
1.1 实验材料的培养
实验所用BY-2烟草悬浮细胞(NicotianatabacumL. cv. Bright Yellow-2)由姜里文教授(中国香港大学)馈赠,在MS[13]液体培养基(Sigma-Aldrich公司)[补充了3%(质量百分数)的蔗糖和0.4 mg·L-1的2,4-二氯苯氧乙酸,调pH值至5.8]中25℃黑暗的条件下恒温振荡培养(振荡速率为130 r·min-1)。每过7天,吸取细胞培养液加入到新鲜液体培养基中进行传代培养。
1.2 悬浮细胞的处理
取一定体积的传代培养5 d后的烟草悬浮细胞,使用前以1∶5的体积比用新鲜培养基稀释并摇匀后进行如下处理:
(1)分别用0,5,10,25和50 μmol·L-1的寡霉素溶液(无水乙醇配制)处理细胞3 h(在25℃黑暗条件下恒温震荡,下同);
(2)用50 μmol·L-1的寡霉素溶液处理细胞悬液,0.5、1、3和5 h后用于后续检测;
(3)50 μmol·L-1寡霉素溶液、50 μmol·L-1外源ATP、50 μmol·L-1寡霉素+50 μmol·L-1外源ATP均处理3 h,以上均用体积分数2%的乙醇代替50 μmol·L-1寡霉素溶液进行如上处理的细胞作为对照。
1.3 悬浮细胞细胞死亡水平的测定
取处理后1 mL的细胞悬液,加入100 μL 0.025%(质量百分数)的伊文思蓝染液染色8 min(死细胞因细胞膜通透性增大被伊文思蓝着色)。之后,3 000 r·min-1离心3 min,弃上清,再加入1 mL的磷酸缓冲液冲洗细胞,于3 000 r·min-1离心3 min后弃上清,反复多次以洗去未与细胞结合的染料。然后向细胞中加入1 mL 1%(质量百分数)的十二烷基磺酸钠溶液(SDS,用50%甲醇配制而成),混匀后在50℃下水浴30 min,使细胞裂解。于10 000 r·min-1条件下离心10 min,取500 μL上清液,用蒸馏水稀释至3 mL,在595 nm处检测其吸光值,以此表示细胞的死亡程度[14]。
1.4细胞内ATP(iATP)和胞外ATP(eATP)含量的测定
取处理后的细胞悬液1 mL,于4 000 r·min-1下4℃离心4 min,上清液用于测定eATP含量;吸尽上清液,向剩下的细胞中加入100 μL ATP检测裂解液(Sigma-Aldrich)破碎细胞释放出细胞内ATP,于12 000 r·min-1下4℃离心5 min,上清液用于iATP含量测定。ATP含量检测使用萤火虫尾部提取物(Sigma-Aldrich)测定。萤火虫尾部提取物的主要成分为虫荧光素和荧光素酶,ATP可与虫荧光素经荧光素酶催化反应,并释放荧光。通过测定发光强弱,可测定ATP的含量[15]。测量方法依照制造商说明书进行。
1.5 统计学分析
以上测量取4次的独立实验结果的平均值,并将数值表示为平均值±标准偏差。数据采用双总体t检验,检验在P<0.05水平上的差异显著性。
2 结果及分析
2.1不同浓度寡霉素处理下细胞iATP和eATP变化关系
悬浮细胞中分别加入5、10、25或50 μmol·L-1的寡霉素中处理3 h,结果显示,随着寡霉素胁迫浓度的增大,细胞iATP和eATP含量都不同程度减少。5 μmol·L-1寡霉素作用下,iATP含量开始显著性下降,而eATP含量在10 μmol·L-1寡霉素作用下开始显著性下降。相较于对照,5、10、25、50 μmol·L-1的寡霉素分别使iATP含量降低了13.02%、33.51%、42.79%、48.19%(图1A),eATP含量降低了4.06%、13.23%、22.17%、27.19%(图1B)。

图1 不同浓度寡霉素处理下细胞iATP(A)和eATP(B)含量变化 不同字母表示在P<0.05水平上差异显著,下同。Fig.1 The level of iATP(A) and eATP(B) under treatment with different oligomycin concentrations Different letters denote significant differences(P<0.05),the same as below.
上述结果表明,寡霉素处理同时诱导了细胞iATP和eATP含量的减少,并且eATP含量随着iATP减少呈线性下降(图2)。表明细胞iATP含量变化直接影响到eATP的含量。
2.2不同时间寡霉素处理下细胞iATP和eATP变化关系
50 μmol·L-1的寡霉素处理0.5 h即引起iATP含量的显著下降,并在处理1 h时达到最低,随后随着处理时间的延长而不发生变化(图3A)。而eATP含量则在寡霉素作用1 h后显著性下降,并于处理3 h达到最低,随后处理5 h有所上升(图3B)。
根据上述结果做出iATP与eATP随寡霉素处理时间变化的关系图,同样可发现,eATP含量随着iATP含量的减少而下降(图4)。
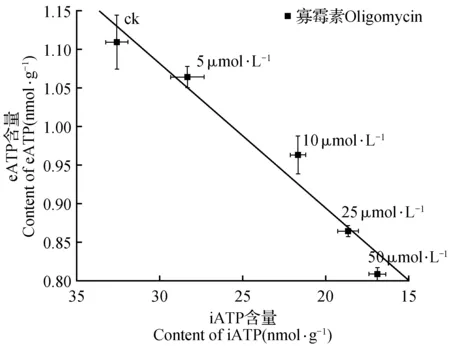
图2 寡霉素浓度变化下,eATP与iATP含量变化关系Fig.2 Relationship between iATP and eATP under treatment with different oligomycin concentrations

图3 不同时间寡霉素处理下细胞iATP(A)和eATP(B)含量变化Fig.3 The level of iATP (A) and eATP (B) under oligomycin treatment with different times

图4 寡霉素处理时间变化下,eATP与iATP含量变化关系Fig.4 Relationship between iATP and eATP under oligomycin treatment with different times
2.3 寡霉素处理下细胞死亡的变化
同时本研究对上述不同处理下的烟草悬浮细胞的死亡程度进行了研究。结果表明,当细胞被不同浓度寡霉素作用3 h后,与对照组相比,低浓度5和10 μmol·L-1下细胞死亡水平无明显增加;较高浓度25和50 μmol·L-1下,细胞死亡水平有显著性上升,分别增加了1.11和1.27倍(图5)。

图5 不同浓度寡霉素处理下细胞死亡水平变化 以无寡霉素处理的细胞作为对照并将对照值设为1.0,下同。Fig.5 The level of cell death under treatment with different oligomycin concentrations The cells without oligomycin treatment were used as control and the values in the control were set to 1.0,the same as below.
随着寡霉素处理时间的增加,细胞死亡水平也在不断加剧。50 μmol·L-1的寡霉素作用下,与对照相比,0.5 h时,细胞死亡无显著性变化;1 h后,细胞死亡明显增加并不断升高。寡霉素处理0.5、1、3、5 h后与对照相比细胞死亡值增加了1.06、1.12、1.26、1.30倍(图6)。
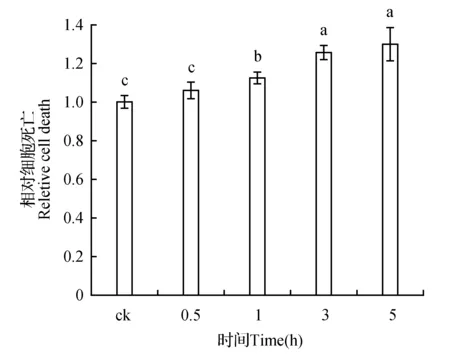
图6 不同时间寡霉素处理下细胞死亡水平变化Fig.6 The level of cell death under oligomycin treatment with different times
2.4外源ATP对寡霉素处理下细胞iATP含量和细胞死亡水平的影响
综上结果,选择50 μmol·L-1寡霉素作用悬浮细胞3 h为处理条件,探索外源ATP对寡霉素胁迫下细胞iATP水平的影响。由结果可知,单独对细胞进行50 μmol·L-1外源ATP处理,并未引起细胞iATP水平的显著变化。而50 μmol·L-1寡霉素与50 μmol·L-1外源ATP同时处理细胞,与寡霉素单独处理细胞相比,iATP水平有所上升(图7)。

图7 不同处理下的iATP含量变化Fig.7 The effects of different treatments on the levels of iATP
本实验继续研究了外源ATP对寡霉素处理引起的细胞死亡的调节。结果表明,单独使用50 μmol·L-1外源ATP处理细胞,细胞死亡水平无显著变化。而与50 μmol·L-1寡霉素处理的细胞相比,50 μmol·L-1寡霉素与50 μmol·L-1外源ATP共同处理细胞,则细胞死亡水平明显降低(图8)。以上实验结果表明,外源ATP对寡霉素引起的细胞死亡有缓解作用。

图8 不同处理下的细胞死亡水平的变化Fig.8 The effects of different treatments on the levels of cell death
3 讨论
寡霉素能够阻断H+向ATPase传递,从而有效降低细胞iATP水平[16~17]。本实验发现,随着寡霉素处理浓度的增加,细胞iATP水平逐渐降低(图1A);随着寡霉素处理时间的增加,细胞iATP水平也呈现出不同程度的下降(图3A)。相似于细胞iATP的变化,细胞eATP水平也因寡霉素(在不同浓度或不同处理时间)的处理而有所降低(图1B,图3B);并且,在不同寡霉素处理浓度或不同处理时间下,eATP与iATP含量变化呈正相关关系(图2,图4)。上述观察表明,在寡霉素作用下,iATP水平很大程度上影响着eATP水平。
以前的研究发现,细胞可以通过ATP结合转运载体蛋白或膜泡运输等方式将细胞内的ATP运输到细胞外,从而形成了细胞外ATP[18~19];同时,由于植物细胞在膜外并不具有ATP合成酶,故而iATP是植物细胞eATP的唯一来源。因此,尽管并不清楚烟草悬浮细胞是通过哪种方式将细胞内的ATP运输到细胞外,但寡霉素很可能是通过影响了细胞内iATP的合成而影响了eATP的水平。
随着寡霉素浓度或时间的增加,不仅iATP与eATP的含量下降,细胞死亡水平也不断加剧(图5、图6)。许多研究发现,iATP下降是引起一些类型植物细胞死亡的重要原因[20~21]。因此,寡霉素引起的细胞死亡水平的上升可能和iATP水平的下降有关。
本文也观察到寡霉素也导致了eATP含量的下降(图1B,图3B),而Chivasa等[10~11]发现,eATP的下降也会引发植物细胞的死亡,因此本研究进一步探讨了寡霉素引起的细胞死亡水平的上升是否也受到了eATP水平的影响。结果显示,单独施加50 μmol·L-1外源ATP时,细胞死亡量无明显变化,而对寡霉素处理的细胞中施加该浓度的外源ATP,与单独寡霉素处理细胞相比,细胞死亡有明显缓解(图8),表明了当寡霉素导致细胞死亡水平上升时,eATP浓度的变化也能够影响细胞死亡的水平。
细胞死亡水平的变化是一个细胞内部多种生理学变化的综合结果。ATP由于具有较高的极性,无法自由穿过细胞膜[22],因此,从理论上推断,外源ATP对寡霉素诱导的细胞死亡水平上升的缓解作用应是外源ATP引起了细胞内的变化所致。本研究的进一步观察表明,50 μmol·L-1外源ATP单独作用对细胞iATP无影响,但当寡霉素处理细胞引起iATP水平不足时,施加该浓度外源ATP会对iATP下降有缓解作用(图7),表明在寡霉素导致iATP水平不足时,eATP能促进iATP的合成。有研究表明,外源ATP的施加,可以使得动物细胞和植物细胞内Ca2+的含量的增加[23~25]。Burkeen等[25]发现,胞外ATP的水平和线粒体钙离子的水平呈现出高度的一致性;而线粒体钙离子水平可正向调节着线粒体ATP的产生[26]。由此我们推测可能存在机制:在寡霉素处理下,iATP的减少引起了细胞死亡水平的上升,并引起了eATP的降低;在此情况下,外施ATP可能通过引起胞内Ca2+含量增加而使得线粒体ATP的产生有所增加,从而缓解了iATP水平的下降,并缓解了细胞死亡水平的上升。但具体机制尚需进一步研究。
1.Winkler H H,Neuhaus H E.Non-mitochondrial ATP transport[J].Trends in Biochemical Sciences,1999,24(2):64-68.
2.Goh C H,Jung K H,Roberts S K,et al.Mitochondria provide the main source of cytosolic ATP for activation of outward-rectifying K+channels in mesophyll protoplast of chlorophyll-deficient mutant rice(OsCHLH) Seedlings[J].The Journal of Biological Chemistry,2004,279(8):6874-6882.
3.Khakh B S,Burnstock G.The double life of ATP[J].Scientific American,2009,301(6):84-92.
4.Choi J,Tanaka K,Cao Y,et al.Identification of a plant receptor for extracellular ATP[J].Science,2014,343(6168):290-294.
5.Chivasa S,Simon W J,Murphy A M,et al.The effects of extracellular adenosine 5′-triphosphate on the tobacco proteome[J].Proteomics,2010,10(2):235-244.
6.Sun J,Zhang C L,Deng S R,et al.An ATP signalling pathway in plant cells:extracellular ATP triggers programmed cell death inPopuluseuphratica[J].Plant,Cell & Environment,2012,35(5):893-916.
7.Dichmann S,Idzko M,Zimpfer U,et al.Adenosine triphosphate-induced oxygen radical production and CD11b up-regulation:Ca++mobilization and actin reorganization in human eosinophils[J].Blood,2000,95(3):973-978.
8.Silva G,Beierwaltes W H,Garvin J L.Extracellular ATP stimulates NO production in rat thick ascending limb[J].Hypertension,2006,47(3):563-567.
9.Chivasa S,Murphy A M,Hamilton J M,et al.Extracellular ATP is a regulator of pathogen defence in plants[J].The Plant Journal,2009,60(3):436-448.
10.Chivasa S,Tome D F,Murphy A M,et al.Extracellular ATP:a modulator of cell death and pathogen defense in plants[J].Journal Plant Signaling & Behavior,2009,4(11):1078-1080.
11.Chivasa S,Ndimba B K,Simon W J,et al.Extracellular ATP functions as an endogenous external metabolite regulating plant cell viability[J].The Plant Cell,2005,17(11):3019-3034.
12.Ramirez F,Marecek J F,Kantor T V,et al.Effects of borohydride-treated oligomycins on processes of energy transduction in mitochondria[J].European Journal of Biochemistry,1982,121(2):275-279.
13.Murashige T,Skoog F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J].Physiologia Plantarum,1962,15(3):473-497.
14.Yang S W,Kim S K,Kim W T.Perturbation of NgTRF1 expression induces apoptosis-like cell death in tobacco BY-2 cells and implicates NgTRF1 in the control of telomere length and stability[J].The Plant Cell,2004,16(12):3370-3385.
15.Mcelroy W D.The energy source for bioluminescence in an isolated system[J].Proceedings of the National Academy of Sciences of the United States of America,1947,33(33):342-345.
16.Yokota A,Henmi M,Takaokao N,et al.Enhancement of glucose metabolism in a pyruvic acid-hyperproducingE.colimutant defective in F1-ATPase activity[J].Journal of Fermentation and Bioengineering,1997,83(2):132-138.
17.Keobmann B J,Westerhoff H V,Snoep J L,et al.The glycolytic flux inE.coliis controlled by the demand for ATP[J].Journal of Bacteriology,2002,184(14):3909-3916.
18.Kim S Y,Sivaguru M,Stacey G.Extracellular ATP in plants.Visualization,localization,and analysis of physiological significance in growth and signaling[J].Plant Physiology,2006,142(3):984-992.
19.Thomas C,Rajagopal A,Windsor B,et al.A role for ectophosphatase in xenobiotic resistance[J].The Plant Cell,2000,12(4):519-533.
20.Azad A K,Ishikawa T,Ishikawa T,et al.Intracellular energy depletion triggers programmed cell death during petal senescence in tulip[J].Journal of Experimental Botany,2008,59(8):2085-2095.
21.Comelli M,Pancrazio F D,Mavelli I.Apoptosis is induced by decline of mitochondrial ATP synthesis in erythroleukemia cells[J].Free Radical Biology and Medicine,2003,34(9):1190-1199.
22.Foresi N P,Laxalt A M,Tonn C V,et al.Extracellular ATP induces nitric oxide production in tomato cell suspensions[J].Plant Physiology,2007,145(3):589-592.
23.Demidchik V,Nichols C,Oliynyk M,et al.Is ATP a signaling agent in plants[J].Plant Physiology,2003,133(2):456-461.
24.Burkeen J F,Womac A D,Earnest D J,et al.Mitochondrial calcium signaling mediates rhythmic extracellular ATP accumulation in suprachiasmatic nucleus astrocytes[J].Journal of Neuroscience,2011,31(23):8432-8440.
25.Jeter C R,Tang W Q,Henaff E,et al.Evidence of a novel cell signaling role for extracellular adenosine triphosphates and diphosphates inArabidopsis[J].The Plant Cell,2004,16(10):2652-2664.
26.Griffiths E J,Rutter G A.Mitochondrial calcium as a key regulator of mitochondrial ATP production in mammalian cells[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,2009,1787(11):1324-1333.
The National Natural Science Foundation of China(No.31260059,31560070);Gansu University Basic Research Service Fee
introduction:WANG Qing-Wen(1992—),female,senior engineer,mainly engaged in plantphysiology research work.
date:2016-07-03
RelationshipbetweenExtracellularATPandIntracellularATPandItsRoleinRegulatingtheCellDeathunderOligomycinTreatment
WANG Qing-Wen BAI Jing-Yue SHI Dai-Long JIA Ling-Yun*FENG Han-Qing
(College of Life Science,Northwest Normal University,Lanzhou 730070)
In BY-2 tobacco suspension cells, the effect of intracellular ATP(iATP) production on extracellular ATP(eATP) levels was studied by using oligomycin(Inhibitors of FoF1-ATPase). The results showed that with the increase of the concentrations of oligomycin(from 5-50 μmol·L-1), the level of iATP and eATP were decreased, and the level of cell death were increased under higher concentration of oligomycin. With the increase of the times of oligomycin treatment(0.5, 1, 3 and 5 h), the levels of both iATP and eATP were decreased in different extents, while the level of cell death were increased. Treatment with exogenous ATP alleviated the decrease in iATP and the increase in cell death level that were caused by oligomycin, The level of eATP can be affected by iATP, and eATP can regulate the iATP production and cell death under the condition of mitochondrial oxidative phosphorylation being inhibited.
intracellular ATP;extracellular ATP;oligomycin;cell death
国家自然科学基金(31260059,31560070);甘肃高校基本科研业务费
王庆文(1992—),女,硕士研究生,主要从事植物生理生态方面研究工作。
* 通信作者:E-mail:lingyunjia1982@126.com
2016-07-03
* Corresponding author:E-mail:lingyunjia1982@126.com
Q945.79
A
10.7525/j.issn.1673-5102.2016.06.017
