5种木兰科植物的DNA-C值及倍性分析
2016-11-10方炎明
赵 青 张 强 周 鹏 林 峰 方炎明*
(1.南京林业大学南方现代林业协同创新中心,生物与环境学院,南京 210037; 2.江苏省林业科学研究院,南京 211153; 3.南京林业大学现代分析测试中心,南京 210037)
5种木兰科植物的DNA-C值及倍性分析
赵 青1张 强1周 鹏2林 峰3方炎明1*
(1.南京林业大学南方现代林业协同创新中心,生物与环境学院,南京 210037;2.江苏省林业科学研究院,南京 211153;3.南京林业大学现代分析测试中心,南京 210037)
以紫玉兰为内标或外标,利用流式细胞术测定了杂交马褂木(Liriodendronchinense×tulipifera)、深山含笑(Micheliamaudiae)、长蕊含笑(Michelialongistamina)、广玉兰(Magnoliagrandiflora)和二乔玉兰(Magnoliasoulangeana)5种木兰科植物的DNA-C值及倍性。结果表明,两种含笑属植物及杂交马褂木均为二倍体,广玉兰为六倍体,二乔玉兰为四倍体,5种植物的C值各不相同,最大的是广玉兰,最小的是杂交马褂木,它们的C值大小属于小到中等水平。
流式细胞术;DNA-C值;倍性;木兰科
木兰科(Magnoliaceae)大多是第三纪古热带植物区系的古老孑遗植物,被认为是现存被子植物中较原始的类群,对研究被子植物的起源和系统发育具有重要意义[1]。狭义的木兰科分为15属250种,分布于亚洲的热带和亚热带地区,少数在北美南部和中美洲,我国现存12属136种,集中分布在西南部、南部及中南半岛[2]。木兰科植物树姿优美多态、花大而美丽、花色清新高洁、芳香浓郁宜人,叶、果皆具有独特的观赏价值。由于人为影响和自身繁殖能力的限制,木兰科植物不少种已处于濒危或极危状态,现有39种被列为国家重点保护树种[3]。研究木兰科植物的C值及其倍性,可以为木兰科植物的杂交育种、种质资源保护、园林造景及合理的开发利用提供理论依据。
核DNA-C值(基因组大小)的概念最早由Swift提出,指未复制的单倍体基因组的DNA含量[4]。对此定义的不同理解导致了之后应用上的混淆,比如在计算芭蕉属三倍体植物的C值时,Lysák等[5]用测得的2C值除以3得到1C值,并特指一个核基因组拷贝的DNA含量;而Arumuganathan等[6]用2C值除以2计算1C值,特指未复制的单倍体基因组的DNA总量。Greilhuber等[7]更正、统一了C值这一术语,将其定义为全倍体基因组(Holoploid Genome,染色体数n)的DNA含量。为避免混淆且加以区分,又引入Cx值的概念,特指单倍体基因组(Monoploid Genome,染色体数x)的DNA含量。因此二倍体(2n=2x)的C值与Cx值相等,四倍体(2n=4x)的C值为Cx值的二倍,以此类推。
C值是植物的一项重要特征参数,与植物的种群进化、物种分类与分布、遗传信息总量等有密切关系[8]。C值在不同分类学水平上的变异对研究物种的亲缘关系以及系统发育具有重要意义,同时结合倍性水平分析也可用来鉴定杂交物种[9~11]。每年对已经测定出的C值进行统计并收录到数据库中是一项很有价值的工作。从2001年9月第一个被子植物DNA C-值数据库出版以来,新测定出核DNA C-值的种数以每年高达10倍的速度不断增加,至今该版本已更新至8.0(http://data.kew.org/cvalues/)。DNA C-值数据库目前包含8 510种植物的数据。它结合了被子植物DNA C-值数据库(8.0,2012年12月)、裸子植物DNA C-值数据库(5.0,2012年12月),蕨类植物DNA C-值数据库(5.0,2012年12月),苔藓植物DNA C-值数据库(3.0,2010年12月),以及藻类DNA C-值数据库(1.0,2004)中所有的C值数据,方便科研工作者查询与分析。
测定C值的方法主要有Feulgen显微密度法,流式细胞术(FCM),化学提取法、复性动力学法、脉冲场凝胶电泳以及全基因组测序等8种[12~13]。流式细胞术以其操作简单、结果可信等优点被越来越多的学者应用到植物C值测定中[14]。由于G0/G1期的DNA含量(2C值)可反映该细胞的倍性水平,因此利用流式细胞术测得植物C值的同时可以获得其倍性结果。在被子植物C值数据库中,仅收录了5种木兰科植物的C值,包括北美鹅掌楸(Liriodendrontulipifera),日本玉兰(Magnoliakobus),广玉兰(M.grandiflora),紫玉兰(M.liliiflora)和二乔玉兰(M.soulangiana)。其中广玉兰和紫玉兰的C值通过流式细胞术测定,其他3种植物的C值由显微密度法测定。目前对木兰科植物倍性分析主要依靠染色体计数法。王亚玲等[15]对木兰科13个分类群和12个杂交组合的染色体数目进行了研究,其中落叶木莲(Manglietiadecidua)、香港木兰(Magnoliachampionii)、馨香玉兰(M.odoratissima)、香玉兰(M.guangnanensis)等12个种的染色体数目为首次报道。龚洵等[16]研究了木兰属和含笑属间两个杂交组合后代的染色体,发现四倍体紫玉兰(M.liliiflora)和二倍体云南含笑(Micheliayunnanensis)的杂交后代染色体数目为2n=3x=57,从而支持含笑属与木兰属玉兰亚属具有较近亲缘关系的观点。孟爱平等[17]对中国木兰科11属40种进行了核型研究,所研究的20种木莲属(Manglietia)植物均为二倍体,已观察的含笑属均为二倍体。现在木兰科植物染色体计数约达13属106种[15]。进行木兰科植物的C值和倍性鉴定对木兰科的系统分类学、系统发育学、生态与环境、基因组学、物种保护、细胞分子生物学以及生理学等各学科领域都具有十分重要的指导意义。本研究以紫玉兰为内标或外标,利用流式细胞术测定了杂交马褂木(Liriodendronchinense×tulipifera)、深山含笑(Micheliamaudiae)、长蕊含笑(M.longistamina)、广玉兰(Magnoliagrandiflora)以及二乔玉兰(M.soulangeana)5种木兰科植物的C值及倍性。
1 材料与方法
1.1 材料
以四倍体紫玉兰为标样,以杂交马褂木、深山含笑、长蕊含笑、广玉兰以及二乔玉兰为研究对象,采用芽内未展开的幼叶为供试材料,采样后立即进行流式细胞术分析。样品均采自南京林业大学校园内。
1.2 方法
1.2.1 细胞核悬液制备
待测样品和标样的芽内幼叶各取0.05 g放入预冷的培养皿里,加入预冷的LB01解离液[18](15 mmol·L-1Tris,2 mmol·L-1EDTA-Na2,0.5 mmol·L-1四盐酸精胺,80 mmol·L-1KCl,20 mmol·L-1NaCl,15 mmol·L-1β-巯基乙醇,0.1%(v/v)TritonX-100,pH 7.5)1 mL,用锋利刀片将组织切碎,用40 μm的滤网过滤,即得细胞核悬液。整个过程在冰上完成。
另取5个待测样品和一个标样的芽内幼叶各0.05 g,以同样的方法制备细胞核悬液作为空白对照;以紫玉兰作内标时,分别取5个待测样品各0.05 g以上述方法制备细胞核悬液后与紫玉兰细胞核悬液混合进行流式细胞术分析。
1.2.2 DNA染色
将得到的细胞核悬液于4℃,1 000 r·min-1,离心5 min,弃上清液。在沉淀中加入500 μL预冷的PI-RNase染液[19],置于4℃冰箱避光染色15~30 min;空白对照组在沉淀中加入500 μL预冷的RNA酶液,置于4℃冰箱避光放置15~30 min。
1.2.3 流式细胞仪检测
利用BD InfluxTM流式细胞仪对经染色后的细胞核悬液样品上机检测,采用488 nm蓝光激发,收集5 000~10 000个颗粒。使用BD FACSTMSortware 1.0.0.650分析软件作图分析。待测样品的DNA-C值和倍性按照以下公式[20]计算:

2 结果与分析
2.1 目标样品峰的确定
将空白对照组与样品组在相同仪器状态下上机检测,以排除细胞自发荧光的干扰。如图1所示,左图为紫玉兰空白对照,右图为染色后的紫玉兰。由图可见,对照只有碎片峰而没有目标样品峰,染色后的紫玉兰出现清晰的G0/G1期峰图,而且S期及G2/M期细胞分布状态均可以观察到。流式分析的准确性一般以变异系数(CV)来表示,CV值越小,峰图结果分析就越准确。一般来说CV值小于5%,实验结果才可信,但由于植物组织的样品制备难度较大,CV值可控制在8%以内[21]。待测样品的目标峰图确定方法同上。
2.2 5种木兰科植物的C值及倍性
图2为5种木兰科植物的流式细胞术测定结果,分别比较各样品与紫玉兰的G0/G1期峰值相对位置,可以得出它们的2C值与倍性结果,进而可以计算得到1C值与1Cx值。从被子植物C值数据库中查得紫玉兰的C值为4.95 pg,据此可计算得出5种木兰科植物的C值及倍性结果(表1)。5种植物的DNA-C值各不相同,最大的是广玉兰,最小的是杂交马褂木。根据植物C值大小的5个等级:很小(≤1.4 pg)、小(≤3.5 pg)、中等(>3.5,<14.0 pg)、大(≥14.0 pg)、很大(≥35.0 pg)[22],该5种木兰科植物C值大小属于小到中等水平。由全倍体基因组大小2C值除以倍性可以得到基础基因组大小1Cx值,其范围是1.97~2.72 pg,除了深山含笑的1Cx值大小与紫玉兰相同之外,其他种的1Cx值皆有差异,表明其基础基因组大小存在一定程度的变异。

图1 紫玉兰的流式直方图Fig.1 The FCM histogram of M.liliiflora
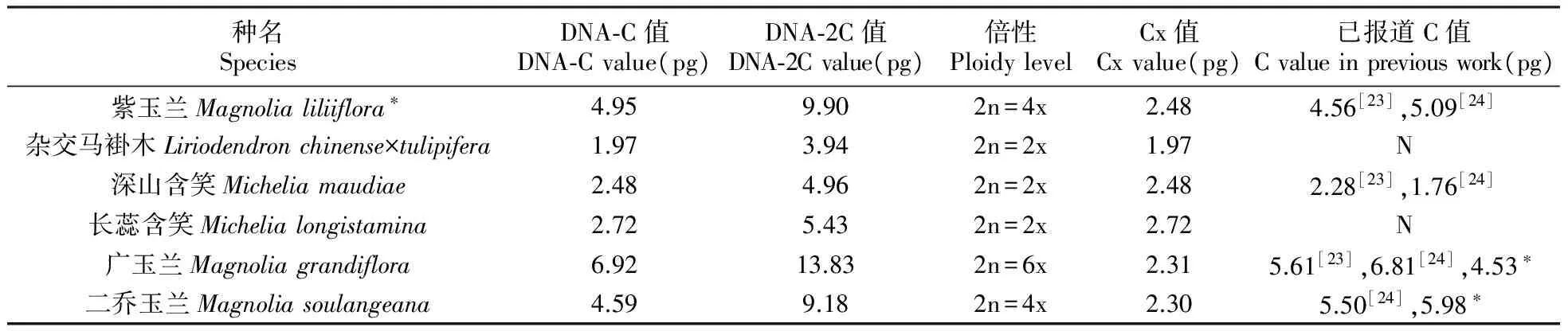
种名SpeciesDNA⁃C值DNA⁃Cvalue(pg)DNA⁃2C值DNA⁃2Cvalue(pg)倍性PloidylevelCx值Cxvalue(pg)已报道C值Cvalueinpreviouswork(pg)紫玉兰Magnolialiliiflora∗4.959.902n=4x2.484.56[23],5.09[24]杂交马褂木Liriodendronchinense×tulipifera1.973.942n=2x1.97N深山含笑Micheliamaudiae2.484.962n=2x2.482.28[23],1.76[24]长蕊含笑Michelialongistamina2.725.432n=2x2.72N广玉兰Magnoliagrandiflora6.9213.832n=6x2.315.61[23],6.81[24],4.53∗二乔玉兰Magnoliasoulangeana4.599.182n=4x2.305.50[24],5.98∗
注:*C值数据库(http://data.kew.org/cvalues);N.尚未报道
Note:*the database of C-value(http://data.kew.org/cvalues);N.Has not been reported

图2 以紫玉兰为对照5种木兰科植物的流式直方图Fig.2 Controlled by M.liliiflora,the FCM histogram of five species in Magnoliaceae
3 讨论
对于同一种植物而言,由于采用不同的标样、解离液、材料类型、染色方法、流式细胞仪和画图软件,C值测定值都会有所不同[25]。本研究采用的标样与待测样品同属一科,细胞核含量相近,满足内标法参照样本的选择条件[19]。以紫玉兰为内标,杂交马褂木与深山含笑的流式峰图如图1中A与B所示,目标样本峰同参照样本峰均不重叠,且CV值均小于6%,结果比较可靠。本研究也对长蕊含笑、广玉兰及二乔玉兰3种植物尝试过紫玉兰内标法,发现目标样本峰均与参照样本峰部分重叠,故改用外标法来测定其C值与倍性。外标法在进行常规的倍性分析与细胞核DNA含量测定时没有内标法精确,因此通过预实验提高外标法的实验精确度尤为重要。选择合适的解离液、材料类型、保存方法及材料用量等可以有效提高实验精确度。通过预实验得出:解离液采用LB01,实验材料选择未展开的芽内幼叶,采样后立即进行实验且材料用量0.05 g可以有效减少实验误差。为进一步提高实验精度,所有样本均采用相同染色液(PI),并加入RNA酶,以排除RNA的干扰。染色温度控制在4℃左右,从而增强荧光染料结合的稳定性,减少荧光损耗。此外,每个样品采集5 000~10 000个细胞,变异系数最大不能超过8%,尽量控制在5%左右,以保证实验结果的可靠性。国内外对木兰科植物的细胞学研究主要集中在核型分析上,其倍性水平大多已知,而关于DNA-C值的报道相对较少。木兰科核型研究表明[26],除木兰属有二倍体、三倍体、四倍体、五倍体和六倍体外,其他属都为二倍体。本研究所得两种含笑属植物以及杂交马褂木的流式结果均为二倍体,木兰属植物二乔玉兰和广玉兰分别为四倍体和六倍体,与报道相符。据文献报道,深山含笑的C值为2.28 pg[23]或1.76 pg[24],本研究测得的结果为2.48 pg;广玉兰C值测定结果为6.92 pg,文献报道其值为5.61 pg[23]或6.81 pg[24],均比被子植物C值数据库中收录的广玉兰C值4.53 pg大;数据库中收录的二乔玉兰C值为5.98 pg,另有文献报道其值为5.50 pg[24],而本研究测得的二乔玉兰C值偏小,为4.59 pg。究其原因,可能是由于不同的操作方法导致了测定结果的差异。除此之外,二乔玉兰为杂交种,在园林上栽培品种繁多,不同品种的C值可能存在一定的差异[27]。而且不同植物材料由于生境的不同C值也可能会发生变异,如Price等[28]测定了向日葵(Helianthusannuus)在不同光照条件下植株不同器官的核DNA-C值,发现在裸露的有直射光照的样地上,向日葵叶片DNA C-值为6.56±0.06 pg,半荫条件(从附近区域接收直射光和散射光)下向日葵叶片核DNA含量为6.21±0.07 pg。
Leitch等[29]由整个陆生植物基因组大小比较研究得出植物基因组大小进化趋势是朝着增大的方向进行。从木兰科内各属种的系统进化角度分析,是否也符合这种趋势呢?木莲属是木兰科最原始的类群,Parris等[23]测定的10种木莲属植物平均C值为2.44 pg;鹅掌楸属是木兰科最进化的类群,该属3个种的平均C值为1.80 pg。木兰属的界限历来是木兰科分类中争议的焦点,分子研究表明玉兰亚属与含笑属亲缘关系较其与木兰亚属更近[30]。木兰亚属(Subgen.Magnolia,)为较原始的类群,16种该亚属植物的平均C值为2.68 pg[23];而玉兰亚属(Subgen.Yulania)为较进化的类群,14种玉兰亚属植物的平均C值为4.07 pg[23]。含笑属为较进化类群,19种含笑属植物的C值平均数为2.31 pg[23]。2种拟单性木兰属植物的平均C值为6.02 pg[24],该属是木兰科中两性花向单性花过渡的中间类群[31]。根据叶江林等[24]的研究,古老种盖裂木(Talaumahodgsoni)的C值为2.95 pg,进化种合果木(Paramicheliabaillonii)与观光木(Tsoongiodendronodorum)的C值分别为2.67与2.09 pg。由此可见,在木兰科中,基因组大小的进化趋势总体上是从大到小,但这种趋势是否正确需要更多数据来进一步探索。
1.刘玉壶.木兰科植物及其珍稀濒危种类的迁地保护[J].热带亚热带植物学报,1997,5(2):1-12.
Liu Y H.Ex situ conservation of Magnoliaceae including its rare and endangered species[J].Journal of Tropical and Subtropical Botany,1997,5(2):1-12.
2.方炎明.植物学[M].北京:中国林业出版社,2005:284.
Fang Y M.Botany[M].Beijing:China forestry publishing house,2005:284.
3.王献溥,蒋高明.中国木兰科植物受威胁的状况及其保护措施[J].植物资源与环境学报,2001,10(4):43-47.
Wang X P,Jiang G M.The threatened status and protected measures of Magnoliaceae species in China[J].Journal of Plant Resources and Environment,2001,10(4):43-47.
4.Bai C K,Alverson W S,Follansbee A,et al.New reports of nuclear DNA content for 407 vascular plant taxa from the United States[J].Annals of Botany,2012,110(8):1623-1629.
5.Lysák M A,Doleželova M,Horry J P,et al.Flow cytometric analysis of muclear DNA content inMusa[J].Thero Appl Genet,1999,98:1344-1350.
6.Arumuganathan K,Earle E D.Nuclear DNA content of some important plant species[J].Plant Molecular Biology Reporter,1991,9(3):208-218.
7.Greilhuber J,Doležel J,Lysák M A,et al.The origin,evolution and proposed stabilization of the terms‘genome size’and ‘C-value’ to describe nuclear DNA contents[J].Annals of Botany,2005,95:255-260.
8.柳觐,孔广红,等.基于流式细胞术的澳洲坚果基因组C值测定[J].中国农学通报,2013,29(34):96-101.
Liu J,Kong G H,Ni S B,et al.Estimation of genomic C value ofMacadamiaintegrifoliaspp.by flow cytometry[J].Chinese Agricultural Science Bulletin,2013,29(34):96-101.
9.Chen G Q,Guo S L,Yin L P.Applying DNA C-values to evaluate invasiveness of angiosperms:validity and limitation[J].Biological Invasions,2010,12(5):1335-1348.
10.Hui H,Yan T,Zhang Q J,et al.Genome size variation among and withinCamelliaspecies by using flow cytometric analysis[J].PLoS ONE,2013,8(5):1-12.
11.施春晖,徐兰兰,王晓庆,等.流式细胞仪鉴定猕猴桃倍性技术研究[J].植物研究,2014,34(6):845-849.
Shi C H,Xu L L,Wang X Q,et al.Identification of kiwifruit ploidy using flow cytometry[J].Bulletin of Botanical Research,2014,34(6):845-849.
12.Bennett M D,Leitch I J.Nuclear DNA amounts in angiosperms:targets,trends and tomorrow[J].Annals of Botany,2011,107(3):467-590.
13.Doležel J,Greilhuber J,Suda J.Estimation of nuclear DNA content in plants using flow cytometry[J].Nature Protocols,2007,2(9):2233-2244.
14.Galbraith D.Simultaneous flow cytometric quantification of plant nuclear DNA contents over the full range of described angiosperm 2C values [J].Cytometry Part A,2009,75A:692-698.
15.王亚玲,张寿洲,李勇,等.木兰科13个分类群和12个杂交组合的染色体数目[J].植物分类学报,2005,43(6):545-551.
Wang Y L,Zhang S Z,Li Y,et al.Chromosome numbers of 13 taxa and 12 crossing combinations in Magnoliaceae[J].Acta Phytotaxonomica Sinica,2005,43(6):545-551.
16.龚洵,张国莉,潘跃芝.木兰科两个杂交组合的细胞学研究[J].园艺学报,2003,30(5):615-617.
Gong X,Zhang G L,Pan Y Z.A cytological study on two hybridized combinations of Magnoliaceae[J].Acta Horticulturae Sinica,2003,30(5):615-617.
17.孟爱平,王恒昌,李建强,等.中国木兰科11属40种植物的核形态研究[J].植物分类学报,2006,44(1):47-63.
Meng A P,Wang H C,Li J Q,et al.A karyomorphological study of 40 species in 11 genera of the Magnoliaceae from China[J].Acta Phytotaxonomica Sinica,2006,44(1):47-63.
18.方其,印丽萍,郭水良.应用流式细胞术测定植物DNA C-值的实验方法研究[J].植物检疫,2011,25(2):40-44.
Fang Q,Yin L P,Guo S.On method of application of flow cytometry to determine plant DNA C-value[J].Plant Quarantine,2011,25(2):40-44.
19.田新民,周香艳,弓娜.流式细胞术在植物学研究中的应用—检测植物核DNA含量和倍性水平[J].中国农学通报,2011,27(9):21-27.
Tian X M,Zhou X Y,Gong N.Applications of flow cytometry in plant research-analysis of nuclear DNA content and ploidy level in plant cells[J].Chinese Agricultural Science Bulletin,2011,27(9):21-27.
20.Yan J J,Zhang J B,Sun K Y,et al.Ploidy level and DNA content ofErianthusarundinaceusas determined by flow cytometry and the association with biological characteristics[J].PLoS ONE,2016,11(3):1-14.
21.李彩琴,王泽槐,徐咏珊,等.流式细胞术细胞核分离缓冲液的改良及大、小果型荔枝幼果和果皮细胞分裂活性比较[J].园艺学报,2011,38(9):1781-1790.
Li C Q,Wang Z H,Xu Y S,et al.Improvement of the cell nuclei suspensions for flow cytometry and comparison on the cell division activity of litchi fruitlet and pericarp which having different final fruit size[J].Acta Horticulturae Sinica,2011,38(9):1781-1790.
22.Ilia J,Mark W,Michael D.Phylogenetic analysis of DNA C-values provides evidence for a small ancestral genome size in flowering plants [J].Annals of Botany,1998,82(Supplement A):85-94.
23.Parris J K,Ranney T G,Knap H T,et al.Ploidy levels,relative genome sizes,and base pair composition inMagnolia[J].Journal of the American Society for Horticultural Science,2010,135(6):533-547.
24.叶林江,张志荣,孙志霞,等.木兰科主要属种核DNA含量(2C值)的检测[J].植物分类与资源学报,2015,37(5):605-610.
Ye J L,Zhang Z R,Sun Z X,et al.The determination of nuclear DNA content(2C-value) on some representative genus and species of Magnoliaceae[J].Plant Diversity and Resources,2015,37(5):605-610.
25.吴丽萍,唐岩,李颖岳,等.枣和酸枣基因组大小测定[J].北京林业大学学报,2013,35(3):77-83.
Wu L P,Tang Y,Li Y Y,et al.Estimation of genome size ofZiziphusjujubaandZ.acdiojujuba[J].Journal of Beijing Forestry University,2013,35(3):77-83.
26.张新华,夏念和.木兰科植物染色体数目报道[J].热带亚热带植物学报,2005,13(6):516-518.
Zhang X H,Xia N H.Chromosome numbers of five species and one hybrid in Magnoliaceae[J].Acta Phytotaxonomica Sinica,2005,13(6):516-518.
27.沈慧,黄建,佟岩,等.枣基因组大小研究[J].西北林学院学报,2016,31(3):138-142.
Shen H,Huang J,Tong Y,et al.Comparative analysis of genome sizes of Chinese jujube[J].Journal of Northwest Forestry University,2016,31(3):138-142.
28.Price H J,Morgan P W,Johnston J S.Environmentally correlated variation in 2C nuclear DNA C-content measurements inHelianthusannuusL.[J].Annals of Botany,1998,82(Supplement A):95-98.
29.Leitch I J,Soltis D E,Soltis P S,et al.Evolution of DNA amounts across land plants(Embryophyta)[J].Annals of Botany,2005,95(1):207-217.
30.Figar R B.Proleptic branch initiation inMicheliaandMagnoliasubgenusYulaniaprovides basis for combinations in subfamily Magnolioideae[A].//Liu Y H.Proceedings of the international symposium on the family Magnoliaceae[C].Beijing:Science Press,2000:14-25.
31.王亚玲,崔铁成,张寿洲.木兰科植物系统学研究进展[J].西北林学院学报,2003,18(2):22-28.
Wang Y L,Cui T C,Zhang S Z.The Studying Progress of Classification in Magnoliaceae[J].Journal of Northwest Forestry University,2003,18(2):22-28.
introduction:ZHAO Qing(1991—),female,graduate,major in plant physiology and biochemistry.
date:2016-09-06
AnalysisofDNAC-valueandPloidyofFiveSpeciesinMagnoliaceae
ZHAO Qing1ZHANG Qiang1ZHOU Peng2LIN Feng3FANG Yan-Ming1*
(1.College of Biology and the Environment,Nanjing Forestry University,Nanjing 210037;2.Jiangsu Academy of Forestry,Nanjing 211153;3.Advanced Analysis and Testing Center,Nanjing Forestry University,Nanjing 210037)
In this study, the C-value and ploidy of five species in Magnoliaceae was estimated by flow cytometry usingMagnolialiliifloraas the reference. The results showed that the two species ofMicheliaare diploid,Magnoliagrandiflorais hexaploid, andM.soulangeanais tetraploid. The C-Values of five species are different from each other. The C-value ofM.grandiflorais the largest among the five species investigated, while the C-value ofLiriodendronchinense×tulipiferais the smallest. The sizes of C-values of the five species are small to medium level.
flow cytometry;C-value;ploidy;Magnoliaceae
赵青(1991—),女,硕士研究生,主要从事植物生理生化方面的研究。
* 通信作者:E-mail:jwu4@njfu.edu.cn
2016-09-06
* Corresponding author:E-mail:jwu4@njfu.edu.cn
Q949.747.1
A
10.7525/j.issn.1673-5102.2016.06.008
