拟南芥同源四倍体减数分裂过程的分子细胞学分析
2016-11-10李云玲田保明崔明珠郝志达
李云玲 田保明 杨 妍 崔明珠 郝志达 位 芳
(郑州大学生命科学学院,郑州 450001)
拟南芥同源四倍体减数分裂过程的分子细胞学分析
李云玲 田保明 杨 妍 崔明珠 郝志达 位 芳*
(郑州大学生命科学学院,郑州 450001)
以拟南芥(Columbia生态型)二倍体(AA,2n=10)为材料,经0.2%秋水仙素处理和细胞学鉴定,成功获得拟南芥同源四倍体(AAAA,2n=20)。以二倍体为对照,通过对拟南芥同源四倍体减数分裂过程染色体行为的观察,以及减数分裂调控同源染色体联会与重组相关基因的定量PCR分析,研究结果表明,与二倍体相比,拟南芥同源四倍体叶片表皮细胞间气孔孔径显著增大,荚果变长,但气孔密度和结实率显著降低;在减数分裂过程中出现部分单价体和三价体,以及二价体和四价体等染色体配对构型;减数分裂期重组相关基因ZYP1表达水平降低,ASY1、DMC1、MRE11和SPO11-1表达水平均升高。因此,我们推断,伴随着多倍体化,与二倍体相比,多倍体植物减数分裂期染色体行为和相关基因表达都有一定改变,影响多倍体植物生殖发育以适应环境。
拟南芥;二倍体;同源四倍体;减数分裂;染色体
与二倍体相比,多倍体植物往往具有较强的生长势与适应性。在自然界,自发产生的多倍化现象包括同源多倍体(Autopolyploids)和异源多倍体(Allopolyploids)。所谓同源多倍体,是指增加的染色体组来自同一物种,一般由二倍体的染色体直接加倍产生。因此,与二倍体相比,通过0.2%秋水仙素处理加倍,所获得的多倍体植物除了叶片、花器官等表现巨大外[1],气孔保卫细胞的增大尤为明显[2],植株育性也有所改变[3]。同源多倍体减数分裂能否产生正常配子,是多倍体植物遗传多样性的物质基础,直接影响着植株育性与繁衍。目前,有关同源多倍体减数分裂染色体行为观察的报道较多。崔群香等[4]研究了白菜同源四倍体花粉母细胞减数分裂过程,发现终变期有少量三价体和单价体出现,虽然有染色体构型多样的现象,但减数分裂完成后生成的四分体结构正常;有关鸭茅不同倍性花粉母细胞减数分裂的研究发现四倍体材料中仅出现了少量的四价体,但两种倍性的鸭茅均能正常减数分裂,没有染色体滞后或者微核等异常现象[5]。然而,这些研究大部分只关注了多倍体植物减数分裂过程的基本事件,缺少系统的比较性研究,同时对多倍体植物减数分裂相关基因的研究报道较少。因此,本研究以模式植物拟南芥二倍体为研究材料,通过0.2%秋水仙素处理,经细胞学鉴定和形态观察,获得同源多倍体拟南芥,系统观察了拟南芥同源四倍体减数分裂染色体行为,并进一步利用实时定量PCR技术分析了一些代表性的减数分裂相关基因的表达模式变化,为多倍体植物遗传多样性提供必要的分子细胞学证据。
1 材料和方法
1.1 实验材料
野生型拟南芥为哥伦比亚生态型(Columbia-0),由郑州大学植物遗传育种实验室提供。培养条件:温度18~21℃; 相对湿度为60%~70%;16 h光照/8 h黑暗。
1.2 试验方法
1.2.1 同源四倍体拟南芥的获得
将拟南芥种子在低温(4℃)、黑暗条件下处理3~5 d,打破种子休眠。然后,用1%次氯酸钠溶液对种子进行表面消毒,无菌水冲洗2~3次。将种子点种于MS培养基上,培养2~3周用0.2%的秋水仙素黑暗处理茎尖生长点3~4 h,无菌水冲洗后转移至营养土中培养至成熟,分株收获种子,鉴定倍性。
1.2.2 拟南芥气孔观察和育性分析
取二倍体和同源四倍体拟南芥的成熟叶片,用镊子挑取叶片下表皮放在滴有一滴清水的载玻片上,将其展开并吸去多余的水,盖上盖玻片,显微镜观察,每个样品取5个视野观察统计,先在显微镜下数每一视野中气孔的数目,而后用物镜测微尺量得视野的直径,求视野的面积。由此计算单位面积内气孔的数量。同时,剪取成熟但尚未开裂的长荚果,放入脱色液(乙醇∶乙酸=3∶1)中,脱色4 h观察;取生长9周左右的拟南芥植株,不同倍性的材料均取5~10株,每株选10个荚果,用解剖针拨开种皮对种子进行统计分析。
1.2.3 拟南芥减数分裂的细胞学观察
选生长旺盛的拟南芥幼苗,摘下刚刚漏白的花序,放入卡诺固定液(乙醇∶冰乙酸=3∶1)中,固定3~4 h;柠檬酸缓冲液和无菌水分别清洗2~3次,37℃酶解(酶液成分,纤维素酶∶果胶酶=1∶1)5~6 h,将酶解后的花序转移至干净载玻片上,解剖显微镜下用解剖针解剖并释放花粉母细胞,烘干后经50 μg·mL-1的PI染色即可观察。
1.2.4 拟南芥减数分裂相关基因的定量分析
RNA提取采用CTAB法[6],反转录使用晶彩生物公司的反转录试剂盒,获得的cDNA作为荧光定量PCR的反应模板。RT-PCR检测所选用的内参基因β-actin及其它目的基因引物序列见表1。PCR反应程序为:94℃预变性2分钟;94℃ 20秒,55~60℃ 20秒,72℃ 20秒,40个循环;72℃延伸2分钟。

表1 引物序列
2 结果与分析
2.1 同源四倍体拟南芥的鉴定结果
拟南芥基因组相对较小,二倍体拟南芥有10条染色体(2n=2x=10)(图1:a);经秋水仙素处理后,所获得的同源四倍体拟南芥染色体为20条(2n=4x=20)(图1:b)。
2.2 拟南芥气孔观察和育性分析
研究结果表明,拟南芥二倍体叶片的气孔体积较小,单位面积内气孔数量较多(图2:a),单位面积内气孔数量约49.4个·mm-2;然而同源四倍体叶片气孔体积较大,单位面积内气孔数量较少(图2:b),约为20.8个·mm-2。因此,与二倍体相比,拟南芥同源四倍体的单位面积内气孔保卫细胞数量明显减少,二者差异较为显著。

图1 拟南芥倍性的细胞学鉴定 a.拟南芥二倍体有丝分裂间期(2n=10);b.拟南芥同源四倍体有丝分裂间期(2n=20)Fig.1 Mitotic interphase in diploid and autotetraploid Arabidopsis thaliana a.Diploid A.thaliana(2n=10); b.Autotetraploid A.thaliana(2n=20)

图2 拟南芥二倍体和四倍体气孔大小比较 a.二倍体叶片气孔,气孔体积较小且单位面积密度较高;b.同源四倍体叶片气孔,体积变大且密度变小Fig.2 Stoma cells in diploid and autotetraploid A.thaliana a.Diploid,stoma is smaller and in high density per unit area; b.Autotetraploid,stoma is larger with low density

图3 拟南芥二倍体和同源四倍体叶片气孔密度比较Fig.3 Stoma density in diploid and autotetraploid A.thaliana
此外,与拟南芥二倍体相比,同源四倍体拟南芥的果荚变长、较粗壮,但果夹内种子数量减少,出现了很多败育现象(图4)。统计结果表明,拟南芥同源四倍体的结实率约为49.79%,而二倍体拟南芥的结实率约为89.50%,二倍体结实率显著高于同源四倍体(图5)。

图4 拟南芥二倍体和同源四倍体果荚观察 a.荚果较大且败育的现象明显;b.荚果瘦小但结实率较高Fig.4 Fruits in diploid and autotetraploid A.thalianaa.Relatively longer pods with fewer aborted seeds; b.Relatively shorter pods with fully developed seeds
2.3拟南芥二倍体和同源四倍体的减数分裂过程分析
减数分裂前期Ⅰ的初期,染色体呈一个较大的染色质团(图6~7:a);偶线期时,同源染色体开始相互联系,五对染色体的着丝粒区域聚合到一起,形成一个染色较深的核心区域(图6~7:b);双线期时,在染色体铺展范围的非中心位置会有不联会区域的出现(图6~7:c )。至终变期,染色体浓缩,不同的交叉的二价体或多价体出现(图6~7:d )至第一次减数分裂后期,同源染色体分离(图6~7:e ),直至第二次减数分裂逐步完成,最终形成四体(图6~7:f)。通常情况下,减数分裂前期的各个时期的染色体都是以丝状染色质杂乱相互缠绕的状态存在的,因此不是太容易把他们区分开来,但是终变期以后染色体浓缩到极致呈短棒状才得以分辨它们的形态和数量。通过对染色体行为的观察,我们研究发现,拟南芥同源四倍体的减数分裂过程与二倍体基本一致,但减数分裂终变期至中期阶段,出现部分单价体和三价体,以及四价体和二价体,但至减数分裂后期,同源染色体能均匀分向两极且减数第二次分裂过程也未发现异常分裂。

图5 拟南芥二倍体和同源四倍体结实率比较Fig.5 Seed-set in diploid and autotetraploid A.thaliana

图6 拟南芥二倍体减数分裂过程Fig.6 Meiosis in diploid A.thaliana
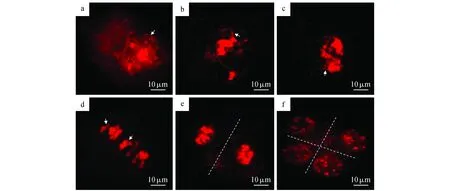
图7 拟南芥同源四倍体减数分裂过程Fig.7 Meiosis in autotetraploid A.thaliana
表2拟南芥二倍体和同源四倍体5个减数分裂相关基因表达分析
Table2Expressionoffivemeiosis-relatedgenesindiploidandautotetraploidA.thaliana
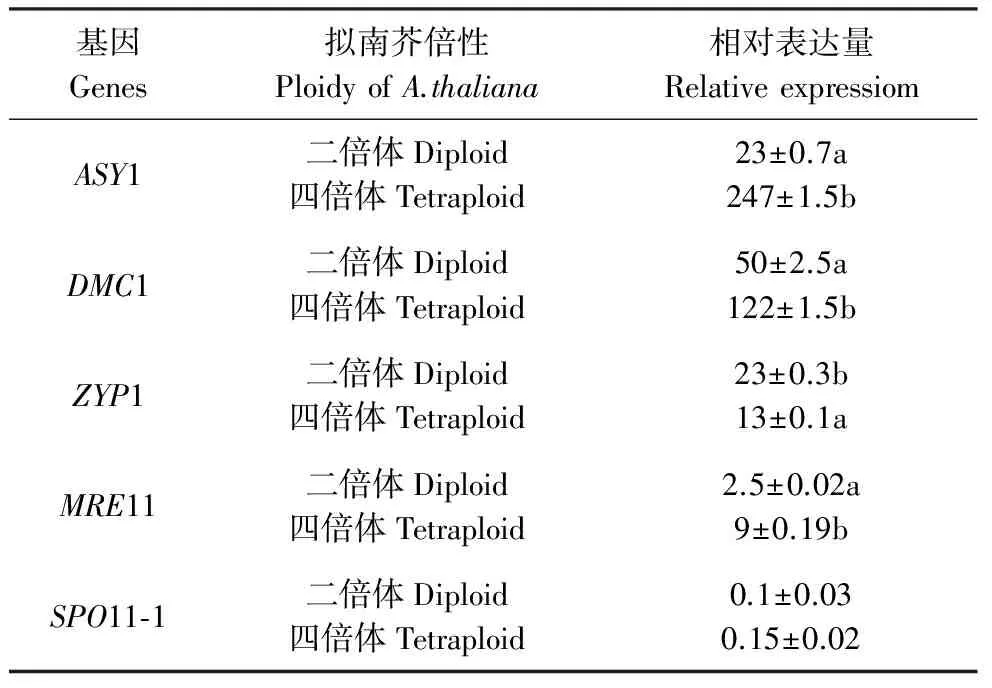
基因Genes拟南芥倍性PloidyofA.thaliana相对表达量RelativeexpressiomASY1二倍体Diploid四倍体Tetraploid23±0.7a247±1.5bDMC1二倍体Diploid四倍体Tetraploid50±2.5a122±1.5bZYP1二倍体Diploid四倍体Tetraploid23±0.3b13±0.1aMRE11二倍体Diploid四倍体Tetraploid2.5±0.02a9±0.19bSPO11⁃1二倍体Diploid四倍体Tetraploid0.1±0.030.15±0.02
注:a和b表示差异显著性,差异显著水平0.01。
Note:Letters (a and b) notify difference of significance, and significance level 0.01.
2.4拟南芥部分减数分裂相关基因的荧光定量分析
在减数分裂过程中,ASY1、ZYP1为联会复合体相关基因;SPO11-1和MRE11是重组过程中DNA双链断裂相关的基因;DMC1则与双链断裂的早期修复有关。荧光定量结果表明,,与二倍体相比,同源四倍体减数分裂过程中ASY1、DMC1表达水平明显升高,MRE11和SPO11-1水平有所提高,但不显著,ZYP1表达水平有所下将(图2)。依据各自功能的不同呈现不同的变化,主要功能性强且参与多项功能的上调明显,功能性相对单一的表现出略微上调。结合前人研究结果[7],我们推断,伴随着基因组倍性的改变,这些基因表达水平的变化很可能影响着同源多倍体重组频率的改变。
3 讨论
近年来,有关同源多倍体植物器官形态的报道较多。例如,与二倍体相比,多倍体植物分枝减少[8],茎杆长度和粗度增加,叶片面积增大[9],叶片气孔变大、密度减小,结实率降低等[10~12]。此外,由于基因组含量倍增,多倍体植物细胞核内容物增多、细胞核变大,细胞体积增大等[13]。减数分裂是否正常是影响结实率的一个重要因素。有关于辣椒枣和金银花的研究发现染色体的构型从终变期开始出现各种异常行为,从而导致染色体不均衡分离,最终影响育性[14~15]。在本研究中,与二倍体相比,同源四倍体拟南芥结实率也显著降低。本研究发现,同源四倍体拟南芥的减数分裂过程中出现部分多价体构型,但没有影响正常四分体的形成,所以推测,可能是正常配子后期发育或者是受精作用出现问题导致的有待进一步研究。
同时,本研究还深入分析了一些代表性的减数分裂相关基因。ASY1是联会复合体侧组分相关蛋白,是同源染色体联会和重组所必需的重要组分[16~17]。在染色体识别和联会交叉方面也发挥重要作用。同时有研究指出,ASY1介导拟南芥减数分裂中DMC1依赖型的同源重组过程[18],因此它与DMC1有相似的变化趋势。有关AtDMC1突变体的研究发现,AtDMC1更倾向于同源染色体之间的修复[19~20]。DMC1基因同时还参与DNA配对和交叉组装过程,并与DNA的代谢过程有关,因此加倍后它的变化较为显著;ZYP1是拟南芥中联会复合体的横向细丝蛋白,也是高等植物上所分离的第一个联会复合体蛋白。拟南芥中对ZYP1进行干扰发现ZYP1的缺失对重组的整体水平只有有限的影响[21~22],但是关于横向细丝蛋白在早期重组中发挥作用的报道普遍认为,横向细丝蛋白是重组相关蛋白程序性消耗必需的[23],当重组相关蛋白普遍提高消耗过多时它的含量就会下降,因此在不同的倍性中它的差异相对较小且本身表达量不高;拟南芥中,MRE11参与MRN复合物(植物的双链断裂修复蛋白,包括MRE11、RAD50和NBS1)的形成,是双链断裂推进所必需的,在双链断裂的修复过程中发挥直接作用,另外它还参与DNA检测、信号匹配、端粒保护和修复DNA双链断裂的过程[24~25],从它的这些功能推断他的表达量要高于功能单一的基因,比如SPO11-1。它在DNA检测、DSB修复以及信号匹配等方面的作用决定着加倍后它的相对表达量略微提高。变化趋势介于ASY1和SPO11-1之间。减数分裂的重组起始于双链断裂的形成,SPO11蛋白催化产生双链断裂,SPO11-2也发挥类似的功能,但是二者并不冗余,形成多聚异构体,共同催化DNA双链缺口(DSB) 形成。与二倍体相比,同源四倍体中SPO11表达水平有所提高,但并不显著,说明在诱导DNA双链断裂方面,不受基因组倍性影响。因此,综合这些基因的功能及其表达水平变化,我们可以初步推断,伴随着基因组倍性增加,减数分裂相关基因表达水平变化很可能是调控减数分裂期同源重组频率改变的重要原因。
1.张振超,张蜀宁,张伟,等.四倍体不结球白菜的诱导及染色体倍性鉴定[J].西北植物学报,2007,27(1):28-32.
2.何婷,刘成洪,杜志钊,等.气孔保卫细胞大小与油菜单倍体及二倍体倍性的相关性研究[J].上海农业学报,2012,28(4):42-45.
3.刘惠吉,张蜀宁,王华.青梗、优质、抗热同源四倍体白菜杂交新品种暑优1号选育[J].南京农业大学学报,2002,25(3):22-26.
4.崔群香,王倩,唐红艳,等.普通白菜同源四倍体花粉母细胞减数分裂及其雄配子体发育研究[J].扬州大学学报,2012,33(4):56-60.
5.张新全,杜逸,郑德成.鸭茅二倍体和四倍体PMC-减数分裂、花粉育性及结实性的研究[J].中国草地,1996,6:38-40.
6.刘洋,何心尧,马红波,等.用CTAB-PVP法提取棉花各组织总RNA的研究[J].中国农业大学学报,2006,11(1):53-56.
7.Pecinka A,Fang W,Rehmsmeier M,et al.Polyploidization increases meiotic recombination frequency inArabidopsis[J].BMC Biology,2012,9:24.
8.万正林,龙明华,邓俭英,等.黑皮冬瓜同源四倍体与起源二倍体农艺性状比较[J].南方农业学报,2014(9):1621-1625.
9.于文艳,刘世琦,梁庆玲,等.大蒜二倍体与四倍体生长和生理指标的比较研究[J].山东农业科学,2008(2):42-44.
10.李红,杨風,向增旭.甜叶菊同源四倍体离体诱导及鉴定[J].西北植物学报,2012,32(8):1692-1697.
11.刘静,赵庆芳,丁兰.兰州百合多倍体诱导及鉴定[J].北方园艺,2011(18):138-141.
12.Mohammadi P P,Moieni A,Ebrahimi A,et a1.Doubled haploid plants following colchicine treatment of microspore derived embryos of oilseed rape(BrassicanapusL.)[J].Plant Cell Tissue Organ Culture,2012,108:251-256.
13.Miller M,Zhang C,Chen Z J.Ploidy and hybridity effects on growth vigor and gene expression inArabidopsisthalianahybrids and their parents[J].G3:Genes Genomes Genet,2012,4(2):505-513.
14.吴改娥,刘平,刘孟军,等.二倍体和同源四倍体“辣椒枣”减数分裂的比较[J].园艺学报,2011,38(5):867-870.
15.王惠利,赵晓明.二倍体与四倍体金银花减数分裂观察[J].江苏农业科学,2014,42(9):211-214.
16.Caryl A P,Armstrong S J,Jones G H,et al.A homologue of the yeast HOP1 gene is inactivated in theArabidopsismeiotic mutantASY1[J].Chromosoma,2002,109(1-2):62-71.
17.Armstrong S J,Caryl A P,Jones G H,et al.ASY1,a protein required for meiotic chromosome synapsis,localizes to axis-associated chromatin inArabidopsisandBrassica[J].Journal of Cell Science,2002,115(18):3645-3655.
18.Eugenio S M,Santos J L,Gareth H,et al.ASY1 mediatesAtDMC1-dependent interhomolog recombination during meiosis inArabidopsis[J].Genes & Development,2007,21:2220-2233.
19.Li W X,Chen B C,Markmann M U,et al.TheArabidopsisAtRAD51gene is dispensable for vegetative development but required for meiosis[J].Proc Nat Acad Sci USA,2004,101(29):10596-10601.
20.Siaud N,Dray E,Gy I,et al.Brca2 is involved in meiosis inArabidopsisthalianaas suggested by its interaction withDMC1[J].EMBO Journal,2004,23(6):1392-1401.
21.Higgins J D,Sanchez M E,Armstrong S J,et al.TheArabidopsissynaptonemal complexproteinZYP1 is required for chromosome synapsis and normal fidelity of crossing over[J].Genes & Development,2005,19(20):2488-2500.
22.James D Higgins,Eugenio S M,et al.MRE11 deficiency inArabidopsisis associated with chromosomal instability in somatic cells andSPO11-dependent genome fragmentation during meiosis[J].Plant Cell,2004,16(8):1968-1978.
23.Wang M,Wang K J,Tang D,et al.The central element protein ZEP1 of the synaptonemal complex regulates the number of crossovers during meiosis in rice[J].Plant Cell,2010,22(2):417-430.
24.Bleuyard J Y,Gallego M E,White C I.Meiotic defects in theArabidopsisrad50 mutant point to conservation of the MRX complex function in early stages of meiotic recombination[J].Chromosoma,2004,113(4):197-203.
25.Franklin.TheArabidopsissynaptonemal complex proteinZYP1 is required for chromosome synapsis and normal fidelity of crossing over[J].Genes & Development,2005,19:2488-2500.
MolecularandCytologicalanalysisofMeiosisinAutotetraploidArabidopsisthaliana
LI Yun-Ling TIAN Bao-Ming YANG Yan CUI Ming-Zhu HAO Zhi-Da WEI Fang*
(School of Life Sciences,Zhengzhou University,Zhengzhou 450001)
The diploidArabidopsisthaliana(Columbia-0, 2n=10) was used to obtain autotetraploid plants(2n=20) after 0.2% colchicine treatment and cytological identification. Meiotic chromosome behaviors were comparatively observed in diploid and autotetraploidA.thaliana, and the meiosis-related genes were relatively quantified by Real-time PCR. The autotetraploidA.thalianaproduced relatively larger stoma and fruits, but the stomatal density and the seed-set were significantly reduced. Some chromosomal configurations were also observed during meiosis involving the trivalents, univalents, bivalents and quadrivalents in autotetraploid plants. The expression of several meiosis-related genes includingASY1,DMC1,MRE11 andSPO11-1 were up-regulated in autotetraploids. Therefore, as autopolyploidization proceeds, plants may adapt themselves into environment by accompanying with phenotype changes owing to the altered chromosomal behaviors and gene expressions.
Arabidopsisthaliana;diploid;autotetraploid;meiosis;chromosome
NSFC-河南人才培养联合基金(U1204308);河南省教育厅高等学校重点科研项目(13A180437)
李云玲(1989—),女,硕士研究生,主要从事植物分子细胞遗传学方面的研究。
* 通信作者:E-mail:fangwei@zzu.edu.cn
2015-10-23
Q943
A
10.7525/j.issn.1673-5102.2016.03.006
