基于壳聚糖/Ru(bpy)23+/SiO2纳米粒子电化学发光传感器用于尿酸的检测
2016-11-09樊雪梅王书民李哲建郑行望商洛学院化学工程与现代材料学院商洛76000陕西师范大学化学化工学院西安7006
樊雪梅 王书民 李哲建 郑行望(商洛学院化学工程与现代材料学院,商洛76000) (陕西师范大学化学化工学院,西安7006)
基于壳聚糖/Ru(bpy)23+/SiO2纳米粒子电化学发光传感器用于尿酸的检测
樊雪梅*1王书民1李哲建1郑行望21
1(商洛学院化学工程与现代材料学院,商洛726000)2(陕西师范大学化学化工学院,西安710062)
利用反相微乳液法制备了壳聚糖复合纳米粒子,采用Nafion/MCNT复合膜技术实现了对复合纳米粒子有效而稳定的固定,从而制备了电化学发光传感器,实现了对尿酸的检测。在0.1 mol/L PBS缓冲溶液(pH 7.4)中,当尿酸与修电极作用15 min时,电化学发光强度与尿酸浓度(1.0×10-10~1.0× 10-5mol/L)的负对数呈良好的线性关系,线性方程为IECL=-709.52-202.74lg C,相关系数R=0.9936,检出限为6.0×10-12mol/L。传感器表现出良好的重现性与稳定性,对1.0×10-8mol/L尿酸平行测定11次,发光强度的相对标准偏差为2.9%,测定尿酸实际样品的加标回收率在98.5%~103.5%之间。
电化学发光;壳聚糖纳米粒子;尿酸
1 引言
尿酸是核蛋白和核酸的代谢产物,人体内尿酸过量是许多疾病的征兆,如痛风、肾功能衰竭、心血管疾病等,故人体内尿酸的检测在临床诊断方面有着重要意义。目前,测定尿酸的方法主要有色谱法[1,2]、分光光度法[3,4]、荧光法[5,6]、化学发光法[7,8]、电化学法[9~11]等。
电化学发光因其设备简单、灵敏度高、适用范围广等特点而备受关注。但是目前利用电化学发光法测定尿酸的方法较少[12,13]。近年来,通过将发光试剂固定在电极表面制备得到固相电化学发光传感器,这样既节约了昂贵的发光试剂,又提高了灵敏度,拓宽了电化学发光法在分析化学中的应用。溶胶-凝胶膜法和Nafion/MCNT是目前应用最多的固定化技术,但是溶胶-凝胶法制备的电化学发光传感器稳定性较差[14]。利用二氧化硅微球包埋联吡啶钌,可以改善SiO2溶胶-凝胶法固定联吡啶钌传感器的稳定性[15,16]。壳聚糖分子中含有丰富的游离氨基和羟基,具有良好的吸附能力、导电能力和生物相容性,是电化学发光传感器中较优良的材料[17]。
2 实验部分
2.1仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈电子科技有限公司),Zennium电化学工作站(德国Zahner公司),UV-1600PC紫外-可见分光光度计(中国上海美谱达仪器有限公司),F-4600荧光分光光度计(日本日立公司),RT5 POWER电磁搅拌机(德国IKA公司),WF-300D超声波清洗机(宁波海曙五方超声设备有限公司),TDL-802B型离心机(上海安亭科学仪器厂),PT-RO 10L实验室超纯水设备(上海品拓环保工程设备有限公司)。三电极系统:工作电极为裸玻碳电极或修电极,Pt丝为对电极,Ag/AgCl (饱和KCl溶液)为参比电极。
多壁碳纳米管(MCNT,中国科学院成都有机化学有限公司,>7.5%,7~15 nm×0.5~10μm.);壳聚糖(MW=60000~120000 g/mol,乙酰化度≤40 mol%)、三联吡啶钌、Nafion 117、正硅酸乙酯、Triton×-100、正己醇、环己烷均购于Sigma公司;尿酸(天津市华东试剂厂);其余试剂均为分析纯。
2.2CRuS NPs的制备
分别取7.5 mL环己烷、1.8 mL TrionX-100和正己醇混合,加入300μL超纯水为分散相,搅拌0.5 h后,依次加入50μL 0.01 moL/L三联吡啶钌和150μL 0.5%壳聚糖溶液形成稳定的油包水结构,并加入适量NaOH溶液,将体系调为中性,然后持续搅拌1 h,依次加入90μL正硅酸乙酯、60μL氨水,再持续搅拌24 h,反应完全后,加入6 mL丙酮破乳,离心收集复合纳米粒子,然后分别以乙醇、超纯水超声离心,吸取上清液得复合纳米粒子,最终将其分散在NaAc-HAc缓冲溶液(pH 5.0)中,2℃保存。
2.3电化学发光传感器的制备
将玻碳电极(直径2 mm)在0.05μmAl2O3抛光粉上打磨光亮,分别在HNO3(1∶1,V/V),乙醇(1∶1,V/V),超纯水中超声3 min,干燥后。取10μL Nafion/MCNT混合液滴加于干净的玻碳电极表面,自然晾干。将修好的电极插入200μL均匀的CRuSNPs溶液中30 min,CRuSNPs复合纳米粒子通过静电吸附随时间逐渐自组装于Nafion/MCNT电极表面,随后用0.01 mol/L PBS(pH 7.4)冲洗电极,去除非特异性吸附的CRuSNPs纳米粒子,随后,用循环伏安技术将CRuSNPs/Nafion/MCNT电极在0.9~1.4 V的电位窗口下扫描至稳定,除去电极表面多余的,最终可制得电化学发光传感器。图1为电化学发光传感器的原理图。
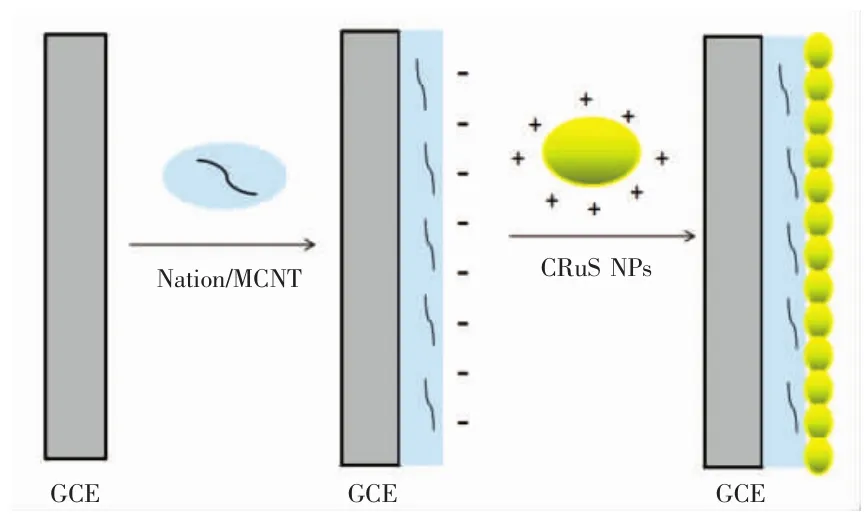
图1 电化学发光传感器的原理图Fig.1 Principle diagram ofelectrochemical luminescence sensor
2.4实验方法
以CRu NPs/Nafion/MCNT/GCE修电极为工作电极,当电解池中的尿酸与修电极作用15 min后,在-0.2~1.4 V范围内进行循环伏安扫描,扫描速率为100mV/s,介质为0.10mol/L PBS缓冲溶液(含50 mmol/L TPA,pH 7.4),光电倍增管负高压为800 V,记录电化学发光信号,通过电化学发光强度值对尿酸进行定量分析,所有实验均在室温下进行,所有电位值均相对于Ag/AgCl参比电极。
3 结果与讨论
3.1CRuSNPs的表征
对合成的CRuSNPs进行了TEM表征(图2),由图2可知,所制备的纳米颗粒的平均直径为50 nm且分散效果较好。CRuSNPs的紫外和荧光光谱图见图3。由图3A可知,合成的CRuSNPs复合纳米粒子与游离态的紫外吸收光谱形状相同,可知CRuSNPs在水溶液中具有很好的分散性。由图3B可知,在458 nm激发波长下,游离态的最大发射波长为596 nm,而CRuSNPs的最大发射波长较蓝移了17 nm,这可能是因为CRuSNPs溶液中的SiO-基团与之间的静电吸附使得被束缚在SiO2纳米粒子内部,致使CRuSNPs在溶液中时,很少与周围的水分子相互作用,显示出荧光发射波长相对较短[18]。
3.2传感器的电化学及电化学发光行为
实验对不同电极表面进行了电化学及电化学发光行为进行研究。由不同电极在0.1 mol/L PBS (pH 7.4)中循环伏安图(图4A)可见,Nafion/MCNT修电极(曲线 b)的电流强于裸玻碳电极(曲线a),这是因为MCNT具有较强的导电性,说明Nafion/MCNT已修于玻碳电极上,而CRuSNPs/ Nafion/MCNT修电极(曲线c)的电流强于Nafion/MCNT修电极(曲线b),这是因为CRuSNPs纳米粒子具有较大的比表面积,电子传导能力增强,且由曲线c还可看出,在+1.1 V处出现可逆的氧化还原峰,这正是的特征峰,说明CRuS NPs已成功修于Nafion/MCNT上。
由不同电极在50 mmol/L TPA(0.1 mol/L PBS,pH 7.4)中的电化学发光图(图4B)可知,裸电极(曲线a)和Nafion/MCNT修电极(曲线b)几乎不发光,但将CRuSNPs纳米粒子固定在Nafion/MCNT修电极上时,出现明显的发光现象(曲线c),这表明CRuSNPs已很好地固定在Nafion/MCNT电极表面,从而显示出良好的电化学发光行为。
稳定性和重现性对于构建可重复使用的修电极至关重要。由CRuS NPs/Nafion/MCNT修电极连续扫描电化学发光图(图4C)可见,Nafion/MCNT与CRuSNPs混合膜修电极在连续扫描10圈的过程中,电化学发光信号非常稳定。

图2 CRuSNPs的TEM图Fig.2 TEM image of chitosan-Rucomposite nanoparticles(CRuSNPs)
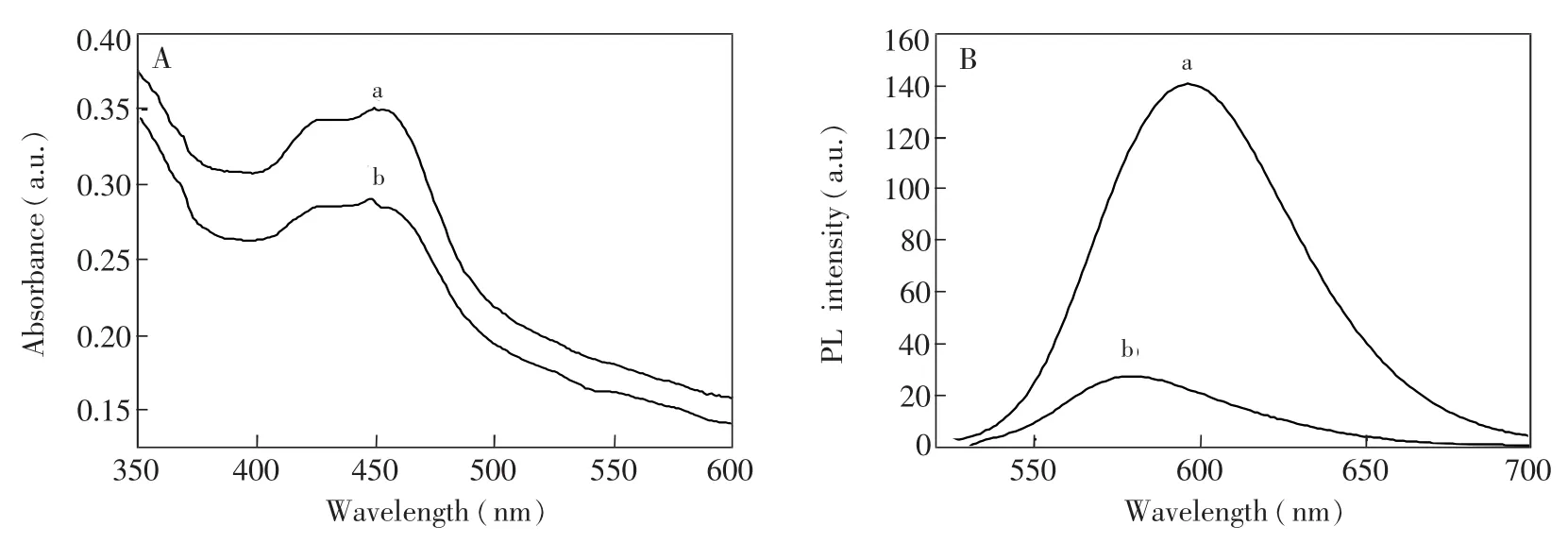
图3 Ru(bpy)和CRuSNPs(b)的紫外光谱图(A)和荧光光谱图(B)Fig.3 UV-vis spectra(A)and fluorescence spectraand CRuS NPs(b)
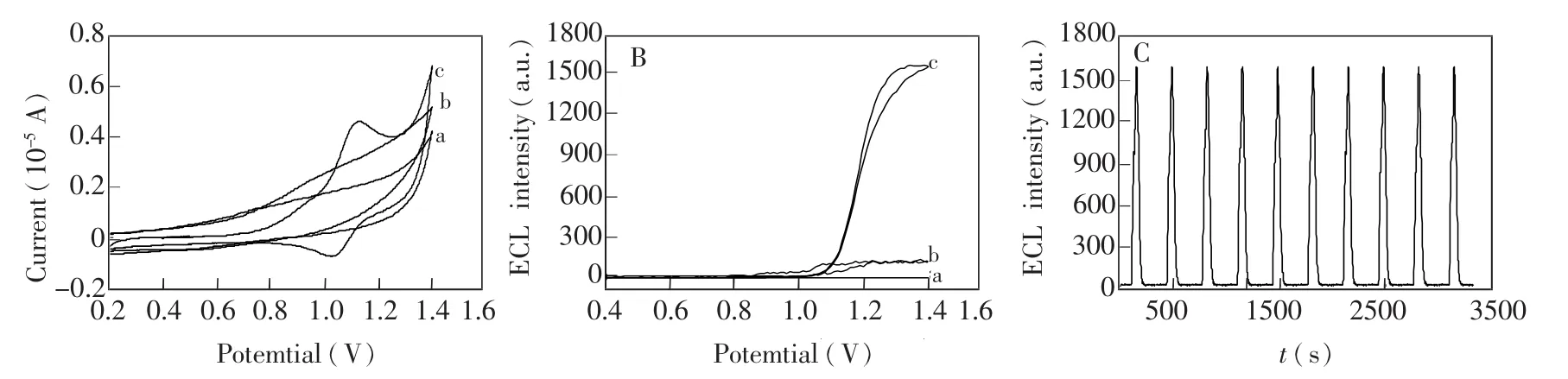
图4 不同电极在0.1 mol/L PBS(pH 7.4)中的循环伏安曲线(A),不同电极在0.1 mol/L PBS(含50 mmol/L TPA,pH 7.4)中的电化学发光曲线(B),CRu NPs-Nafion/MCNT修电极循环电位扫描10圈的电化学发光-时间曲线(C),其中GCE(a),Nafion/MCNT/GCE(b),CRu NPs-Nafion/MCNT/GCE(c)Fig.4 Cyclic voltammograms obtained at different electrodes in 0.1 mol/L PBS(pH=7.4)(A),ECL intensitypotential profiles obtained at different electrodes in 0.1mol/L PBS(pH 7.4)containing 50mmol/L tri-n-propylamine(TPA)(B),ECL intensity-time curves of CRu NPs-Nafion/MCNT/GCE obtained in 0.1 mol/L PBS (pH 7.4)containing 50 mmol/L TPA from continuous potential scanning over ten cycles(C).GCE(a),Nafion/MCNT/GCE(b),CRu NPs-Nafion/MCNT/GCE(c)
3.3尿酸在CRuSNPs/Nafion/MCNT修电极上的电化学发光行为
考察了尿酸在CRuS NPs/Nafion/MCNT修电极上的电化学发光行为。如图5所示,当在0.10 mol/L PBS(含50 mmol/L TPA,pH 7.4)中加入1.0×1007mol/L尿酸时,电化学发光强度降低,证明尿酸对 CRuS NPs/Nafion/MCNT修电极上的电化学发光有抑制作用。众所周知,对于电化学发光体系被电氧化为而TPA被电氧化为TprA0+,从而形成TprA0自由基和TprA0+反应得到从激发态返回至基态便产生电化学发光。尿酸对该电化学发光体系的猝灭原因可能是由于尿酸的加入,消耗了部分所致[13]。
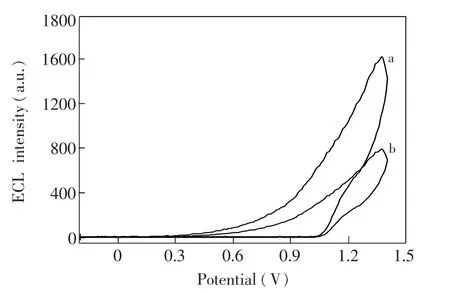
图5 CRuS NPs/Nafion/MCNT/GCE在含50 mmol/L TPA的0.10 mol/L pH 7.4 PBS(a)和含50 mmol/L TPA和0.10μmol/L尿酸的0.10 mol/L pH 7.4 PBS (b)中的电化学发光响应图。Fig.5 ECL intensity-potential profiles obtained at CRuS NPs/Nafion/MCNT/GCE in(a) 0.1 mol/L PBS (pH 7.4) containing 50 mmol/L TPA and (b) 0.1 mol/L PBS (pH 7.4) containing containing 50 mmol/L TPA and 1.0×1007μmol/L uric acid.
3.4实验条件的选择
CRu NPs中的羟基能与尿酸中的胺基形成氢键,故CRu NPs/Nafion/MCNT/GCE修电极与尿酸的作用时间及体系的pH值均对电化学发光强度有一定的影响。由图6可知,随着反应时间延长,电化学发光信号逐渐降低,到15 min时发光强度趋于平稳,再继续延长结合时间,响应信号几乎不变。这表明15 min时即可达到猝灭最大程度,因此选择15 min作为反应时间。实验考察了1.0×1007mol/L尿酸在pH 5.8~8.0范围内的电化学发光现象。结果表明,随着pH值增大,抑制效果先增大后减小,当pH=7.4时,抑制效果最大。因此选择pH 7.4的缓冲溶液进行后续实验。
3.5干扰实验
在最佳实验条件下,当尿酸浓度为1.0×1007mol/L,相对误差不超过±5%时,1000倍的K+,Na+,Fe2+,Zn2+,Ca2+,Mg2+,Cl0;500倍的葡萄糖、尿素、蔗糖;100倍的L-谷氨酸、L-赖氨酸、羟脯氨酸、抗坏血酸不干扰测定;50倍的草酸干扰测定,实验采取加入Ca2+消除干扰。
3.6传感器对尿酸的电化学发光响应
在优化实验条件下,按实验方法测定不同浓度尿酸电化学发光强度并绘制工作曲线(图7)。电化学发光强度和尿酸浓度(1.0×10010~1.0×1005mol/L)的负对数呈良好的线性关系,线性方程为: IECL=0709.52-202.74lg C,相关系数R=0.9936,检出限(S/N=3)为6.0×10012mol/L。
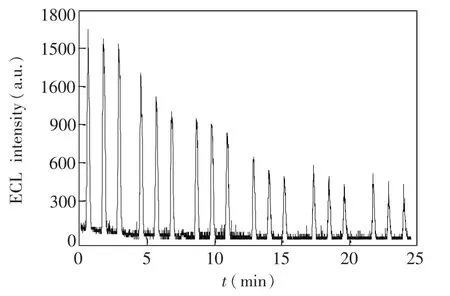
图6 1.0×1007mol/L尿酸电化学发光强度与反应时间的响应曲线Fig.6 ECL intensity-time curves of 0.1 mol/L PBS(pH 7.4)containing 1.0×1007mol/L uric acid

图7 不同浓度尿酸电化学发光响应曲线Fig.7 ECL intensity-potential curves with different concentrations of uric acid.(a)blank,(b)1.0×10010mol/L,(c) 1.0 × 1009mol/L,(d) 1.0 × 1008mol/L,(e)1.0×1007mol/L,(f)1.0×1006mol/L,(g)1.0× 1005mol/L.Inset:calibration curve for uric acid
3.7传感器的重现性和稳定性分析
用同一支传感器对1.0×10-8mol/L尿酸连续测定11次,电化学发光强度相对偏差为2.9%,用同一批次的5支传感器对1.0×10-8mol/L尿酸进行测定,电化学发光强度相对偏差为3.1%,说明此传感器有较好的重现性。为考察传感器的稳定性,使传感器吸附1.0×10-8mol/L尿酸溶液后,置于4℃下保存,定期测定电化学发光信号值。14天内,电化学发光强度几乎不变,说明传感器的稳定性较好。
3.8样品测定
取3份新鲜尿液0.5mL于50mL容量瓶中,加入1.00mL 0.01mol/LCaCl2以除去用高纯水定容,再将该溶液稀释1000倍,以此为分析样品,按照实验方法进行测定,同时,进行加标回收实验,测定结果见表1。加标回收率为98.5%~103.5%,RSD为2.3%~3.1%,表明本方法可用于实际样品的测定。
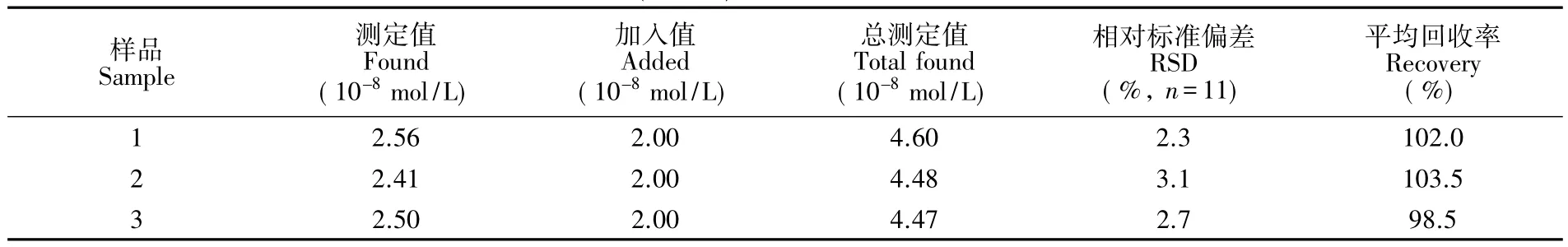
表1 尿液样品分析及回收率实验Table 1 Determination result of uric acid in urine(n=11)
4 结论
References
1Zuo R T,Zhou S,Zuo Y G,Deng YW.Food Chem.,2015,182(1):242-245
2Remane D,Grunwald S,Hoeke H,Mueller A,Roeder S,Bergenb M,Wissenbach D K.J.Chromatogr.B,2015,998-999:40-44
3Kumar V,Misr N,Paul J,Dhanawade B R,Varshney L.Polymer,2014,55(11):2652-2660
4Wua D,Lua H F,Xie H,Wu J,Wang CM,Zhang Q L.Sens.Actuators,B,2015,221(31):1433-1440
5Azmi N E,Ram li N I,Abdullah J,Hamid M A A,Sidek H,Rahman SA,Ariffin N,Yusof N A.Biosens.Bioelectron.,2015,67(15):129-133
6Bialokoz M M,Borowski P.J.Lumin.,2015,160:110-118
7Amjadi M,Manzoori J,Hallaj T.J.Lumin.,2014,153:73-78
8Yu JH,Wang SM,Ge L,Ge SG.Biosens.Bioelectron.,2011,26(7):3284-3289
9Yue H Y,Zhang H,Chang J,Gao X,Huang S,Yao L H,Lin X Y,Guo E J.Anal.Biochem.,2015,488(1):22-27
10FU Hai-Ying,WANG Jian-Xiu,DENG Liu.Chinese J.Anal.Chem.,2014,42(3):441-445付海莹,王建秀,邓留.分析化学,2014,42(3):441-445
11Chen D X,Wang Q,Jin J,Wu P,Wang H,Yu SQ,Zhang H,Cai C X.Anal.Chem.,2010,82(6):2448-2455
12Chu H H,Wei X H,Wu M S,Yan G L,Tu Y F.Sens.Actuators,B,2012,163(1):247-252
13Tao YW,Zhang X J,Wang JW,Wang XX,Yang N J.J.Electroanal.Chem.,2012,674(1):65-70
14Chu L,Zou G Z,Zhang X L.Mater.Sci.Eng.,C,2012,32(8):2169-2174
15Jia T T,Cai ZM,Chen X M,Lin Z J,Huang X L,Chen X,Chen G N.Biosens.Bioelectron.,2009,25(1):263-267
16Zhou LM,Huang JS,Yang L,Li L B,You T Y.Anal.Chim.Acta,2014,8 24(8):57-63
17Dai H,Chi Y,Wu X,Wang Y,WeiM,Chen G.Biosens.Bioelectron.,2010,25(6):1414-1419
18Dang J,Guo ZH,Zheng XW.Anal.Chem.,2014,86(18):8943-8950
Thiswork was supported by the National Natural Science Foundation of China(No.30970696).
2015年度《分析化学》最佳审稿专家
本刊2015年度收到论文千余篇,在广大分析化学专家的热情支持下,顺利完成全年的编辑出版工作,并荣获““中国百种杰出学术期刊(2014年度)”称号和“中国知网”评选的“2015中国最具国际影响力学术期刊”称号。衷心感谢广大分析化学工作者对本刊的支持与厚爱。为表彰在提高《分析化学》期刊学术质量工作中做出了突出贡献的审稿专家,编辑部举办了首届"最佳审稿专家"评选活动。此次评选主要依据审稿专家的审稿质量、审稿数量、审稿周期等评价指标,经综合评议,评选出了12名最佳审稿专家。名单公布如下:
Determination of Uric Acid Based on Chitosan/Ru(bpy)/SilicaNanoparticles Electrochem ilum inescence Sensor
FAN Xue-Mei1,WANG Shu-Min1,LIZhe-Jian1,ZHENG Xing-Wang2
1(College of Chemical Engineering and Modern Materials,Shangluo University,Shangluo 726000,China)2(School of Chemistry and Chemical Engineering,Shaanxi Normal University,Xi'an 710062,China)
Chitosan-Rucomposite nanoparticles(CRuS NPs)were prepared by reverse microemulsion method,and based on the Nafion/MCNT composite membrane technology,CRuS NPs were effectively andsteadilyimmobilizeonthesurfaceof aglassycarbonelectrodetopreparethe electrochemiluminescence sensor for uric acid determination.In 0.1 mol/L PBS(pH 7.4)buffer solution,whentheactuationdurationbetweenuricacidandthemodifiedelectrodewas15min,the electrochemiluminescence showed a good linear relationship to the negative logarithm of uric acid concentration in the range of 1.0×10-10-1.0×10-5mol/L,the linear equation was IECL=-709.52-202.74lg C and the correlation coefficient was 0.9936 with a detection limit of 6.0×10-12mol/L.The ECL sensor exhibited excellent repeatability and stability,and the RSD for 11 times determination of1.0×10-8mol/L uric acid was 2.9%.The recovery was 98.5%-103.5%in the determination of real Uric acid sample.
Electrogenerated chemiluminescence;Chitosan-Ru(bpy)nanoparticles;Uric acid
6 September 2015;accepted 29 December 2015)
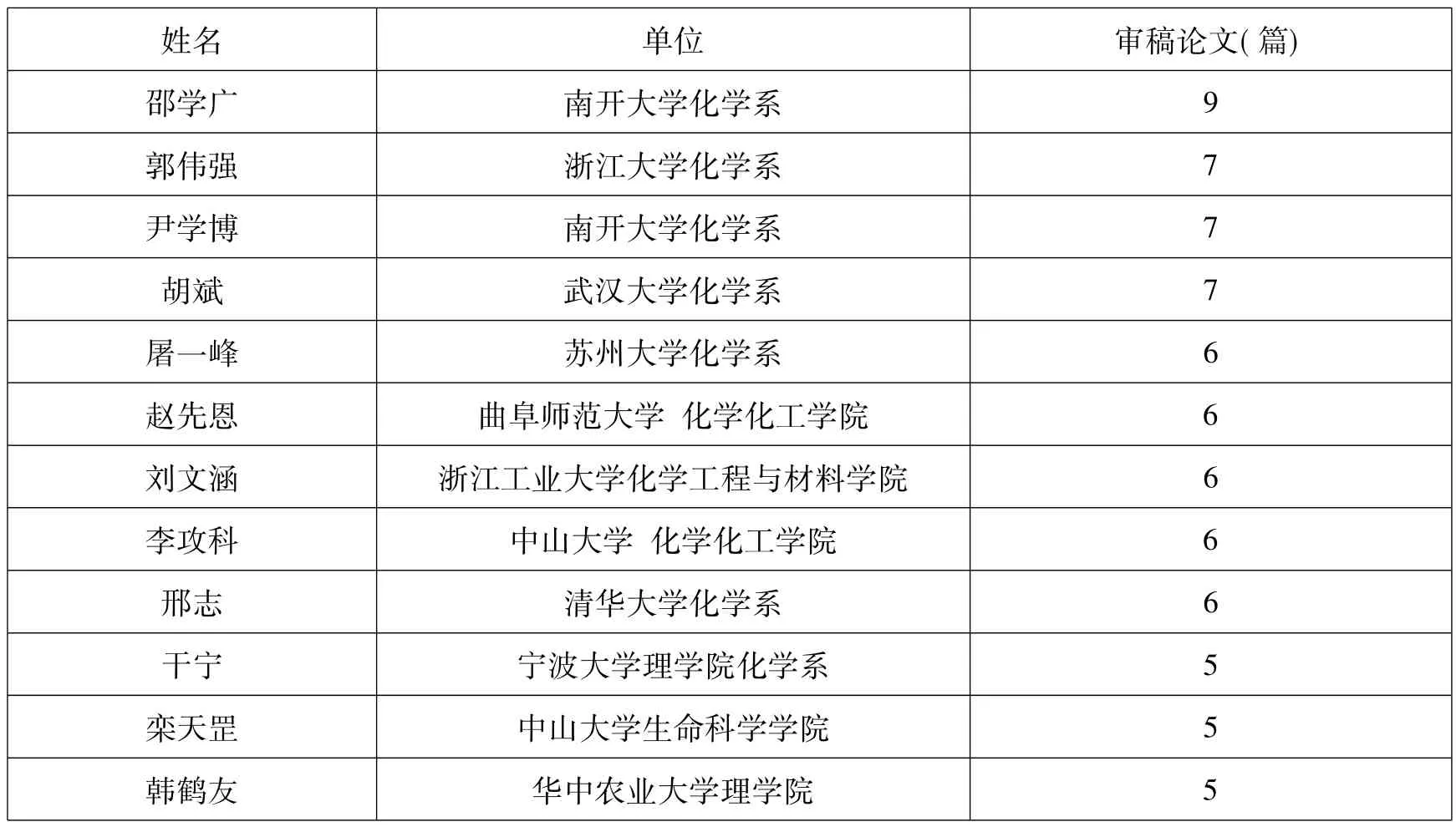
姓名 单位 审稿论文(篇)邵学广 南开大学化学系 9郭伟强 浙江大学化学系 7尹学博 南开大学化学系 7胡斌 武汉大学化学系 7屠一峰 苏州大学化学系 6赵先恩 曲阜师范大学化学化工学院 6刘文涵 浙江工业大学化学工程与材料学院 6李攻科 中山大学化学化工学院 6邢志 清华大学化学系 6干宁 宁波大学理学院化学系 5栾天罡 中山大学生命科学学院 5韩鹤友 华中农业大学理学院 5
10.11895/j.issn.0253-3820.150705
2015-09-06收稿;2015-12-29接受
本文系国家自然科学基金(No.30970696);陕西省科技统筹创新工程计划项目(2012KTDZ02-02);商洛市科技局计划项目(SK-2014-4)及陕西省尾矿资源综合利用重点实验室项目(14SKY-FWK06)资助。
*E-mail:fanxuemei527@163.com
