杂优-2平菇漆酶的分离纯化及酶学性质
2016-11-09廖海君李蕊伽白亚娟唐云明
廖海君,李蕊伽,陶 敏,白亚娟,唐 菁,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
杂优-2平菇漆酶的分离纯化及酶学性质
廖海君,李蕊伽,陶敏,白亚娟,唐菁,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
将杂优-2平菇菌丝进行液体培养,发酵液经硫酸铵分级沉淀、DEAE(diethylaminoethyl)-Sepharose fast flow层析和Superdex-200 prep grade层析等方法纯化,获得了电泳纯的杂优-2平菇漆酶,并对纯化的漆酶进行了部分酶学性质研究。结果显示,杂优-2平菇漆酶比活力为115 U/mg,分子质量约为244.0 kD,亚基分子质量约为85.6 kD。最适反应pH值和最适反应温度分别为5.0和55 ℃,在pH 6.0~8.0及40~55 ℃范围内稳定性较好;最适条件下,以2,2’-联氮-二(3-乙基苯并噻唑-6-磺酸)为底物的Km值为2.1 mmol/L,最大反应速率(vmax)为0.117 μmol/(min·L)。Fe2+、抗坏血酸对该酶活性具有完全抑制作用,乙二胺四乙酸、Ag+、Mg2+、Li+对该酶活性影响较小;草酸、甲醇、正丁醇、K+、Ca2+、Ba2+、Zn2+、Cd2+、Pb2+、Mn2+、Co2+对该酶活性有不同程度的抑制作用;Cu2+激活作用不明显;尿素、乙醇、异丙醇对该酶活性具有激活作用。
杂优-2平菇;漆酶;分离纯化;酶学性质
漆酶(laccase,EC 1.10.3.2)是一类含铜的多酚氧化酶,分布广泛,存在于真菌分泌物、高等植物、少量的细菌和昆虫组织中,是由日本学者吉田(Yoshi)于1883年首次从日本紫胶漆树漆液中发现的能催化漆固化过程的一种蛋白质;1894年,Bertrand将该蛋白质命名为漆酶(laccase)[1]。自漆酶被发现以来,该酶便成为生物学、环境科学和化学等交叉学科的研究对象。近年来,随着对漆酶性质的研究,该酶在食品工业、造纸工业、废水处理、环境污染物质脱毒及降解、染料脱色等领域显现出较大的应用潜力和研究价值[2-5],成为环境保护用酶的研究热点。由于不同来源的漆酶具有不同的底物专一性和不同的性质[6],目前有多种来源的漆酶的酶学性质和应用研究的相关报道[7-13],但鲜见杂优-2平菇(Pleurotus ostreatus heterosis-2)漆酶分离纯化及酶学性质研究的报道。杂优-2平菇作为人工种植品种之一,其生长能源主要来自于基质中大分子物质的分解,而漆酶作为一种胞外含铜多酚氧化酶,起着分解基质中木质素的作用。为充分了解杂优-2平菇漆酶的酶学性质,为其人工栽培提供理论支持,本实验对杂优-2平菇发酵液中的漆酶进行分离纯化并对其部分酶学性质进行研究,旨在为对漆酶进一步研究、食用菌生产和工业应用等方面提供参考。
1 材料与方法
1.1菌种、培养基与试剂
菌种为杂优-2平菇,购买于重庆伯民食用菌专业合作社。
改良PDA培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂18 g/L、蛋白胨5 g/L、头孢曲松钠125 μg/L、蒸馏水 1 000 mL、pH值自然。
液体培养基:马铃薯200 g/L、葡萄糖20 g/L、蛋白胨5 g/L、头孢曲松钠125 μg/L、蒸馏水1 000 mL、pH值自然。
2,2’-联氮-二(3-乙基苯并噻唑-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate),ABTS)(分析纯)、牛血清白蛋白 美国Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)标准品、DEAE(diethylaminoethyl)-Sepharose fast flow、Superdex-200 prep grade和凝胶层析分子质量标准品 美国GE Healthcare公司;考马斯亮蓝R-250 美国Bio-Rad公司;其余试剂均为国产分析纯。
1.2仪器与设备
精密电子天平 瑞士Mettler-Toledo公司;高速冷冻离心机 德国Thermo Fisher Scientific LED股份有限公司;Mill-Q plus 超纯水仪 美国Millipore公司;UV-2550型分光光度计、蛋白核酸定量仪 日本岛津公司;AKTA prime plus 蛋白纯化系统 美国GE公司;MC4L冷冻干燥机 德国Uni Equip公司;垂直板电泳槽和电泳仪 美国Bio-Rad 公司。
1.3方法
1.3.1漆酶的酶活力测定
使用ABTS法[14-17]:反应总体系为3 mL,包括0.2 mL 0.5 mmol/L的ABTS,2.7 mL 0.1 mol/L pH 4.8的乙酸-乙酸钠缓冲液和0.1 mL酶液。30 ℃条件下,测定反应3 min内420 nm波长处的光密度值(OD420nm),以煮沸3 min后的灭活酶液为空白对照。酶活力单位定义为每分钟转化1 μmol的底物所需酶量为一个酶活力单位(U)。漆酶活力按式(1)计算。

式中:V总、V酶分别代表反应体系的总体积和反应体系中酶液的体积/mL;∆OD420nm代表光密度变化值;ε为吸光系数,其值为36 000 L/(mol·cm);∆t为反应时间/min。
1.3.2杂优-2平菇漆酶在液体培养基中活力的变化规律
将杂优-2平菇菌丝块接种于300 mL液体培养基中,3个重复,28 ℃、175 r/min条件下振荡培养,在超净工作台中,每天从每个重复中取3 mL液体培养基,测定其漆酶活力的变化值。
1.3.3蛋白质含量的测定
[18],用牛血清白蛋白做标准曲线,采用考马斯亮蓝染料法(Bradford法)和紫外分光光度法计算蛋白质含量。
1.3.4漆酶比活力计算
分离纯化的每一步操作后所收集得到的总酶活力与总蛋白的比值即为所求漆酶比活力/(U/mg pro)。
1.3.5杂优-2平菇漆酶粗酶液的制备
杂优-2平菇菌种菌丝经活化后,接种于PDA固体培养基中,用封口膜将平板密封后放于28 ℃培养6 d,用直径为10 mm的无菌打孔器在长满菌丝的PDA培养基表面截取菌丝块,用无菌接种针将菌丝块接种于装有300 mL液体培养基的500 mL三角锥形瓶中,每瓶接种量为20块,在28 ℃、175 r/min条件下振荡培养6 d,将发酵液用8 层纱布过滤,滤液即为漆酶粗酶液。
1.3.6杂优-2平菇漆酶初酶液的制备
向粗酶液中加入硫酸铵至30%的饱和度,4 ℃静置2 h,在4 000 r/min条件下离心40 min,收集上清液;再向上清液中加入硫酸铵至80%的饱和度,在4 ℃静置2 h后,4 000 r/min离心50 min,去上清液收集沉淀。将沉淀溶解于20 mL 0.1 mol/L pH 6.0的磷酸盐缓冲液中,于4 ℃条件下透析24 h后,2 000 r/min 离心10 min,收集上清液,即为杂优-2平菇漆酶的初酶液。
1.3.7DEAE-Sepharose fast fl ow层析
用0.05 mol/L pH 6.0的磷酸盐缓冲液平衡DEAESepharose fast flow层析柱(26 mm×15 cm)12 h,取10 mL初酶液上样,用0~0.5 mol/L NaCl(用0.05 mol/L pH 6.0的磷酸缓冲液配制)溶液进行线性洗脱。以0.5 mL/min的流速洗脱,每管收集体积为5 mL,分别测定各收集管漆酶的酶活力和蛋白含量。收集酶活力较高管中的酶液,透析浓缩后进行凝胶层析。
1.3.8Superdex-200 prep grade层析
用0.05 mol/L pH 6.0的磷酸盐缓冲液平衡Superdex-200 prep grade层析柱(16 mm×60 cm)10 h后,取1.3.7节所得酶液5 mL上样,用0.05 mol/L pH 6.0的磷酸盐缓冲液进行洗脱,流速为0.3 mL/min,每管收集3 mL。测定各管收集液中漆酶的酶活力和蛋白含量,收集酶活力较高的酶液。在4 ℃条件下用去离子水透析12 h,冷冻干燥后于-20 ℃贮存备用。
1.3.9杂优-2平菇漆酶纯度的鉴定及分子质量的测定
将1.3.8节所得的漆酶,通过SDS-PAGE进行纯度鉴定,SDS-PAGE浓缩胶和分离胶的质量分数分别为5%、12%,上样量为10 μL。经凝胶过滤层析和SDS-PAGE电泳分别测定漆酶的全分子质量和亚基的分子质量[18]。
1.3.10漆酶酶学性质的测定
1.3.10.1 漆酶最适反应温度与热稳定性的测定
在不同温度梯度(20~85 ℃,温度梯度为5 ℃)、pH 4.8条件下测定漆酶活力,以酶活力最高值为100%,计算各温度下的相对酶活力,确定其最适反应温度。将酶液置于不同温度(30~65 ℃,温度梯度为5 ℃),每隔20 min测定其酶活力,以不保温的酶液酶活力为100%,计算各温度下不同时间段的相对酶活力,研究该漆酶的热稳定性。
1.3.10.2 漆酶最适反应pH值与酸碱稳定性的测定
在pH 3.0~8.0范围内测定漆酶活力,以酶活力最高值为100%,计算不同pH值条件下的相对酶活力,确定其最适反应pH值。将200 μL酶液分别与等体积不同pH 值(3~9)缓冲液混合均匀,4 ℃条件下静置3 h后,分别测定酶活力,以200 μL酶液与等体积蒸馏水混匀的同等条件下所测漆酶活力值为100%,计算不同pH值下的相对酶活力,以研究该漆酶的酸碱稳定性。
1.3.10.3 不同金属离子对漆酶活性的影响
将不同浓度(10~50 mmol/L)的K+、Ca2+、Ba2+、Zn2+、Cd2+、Pb2+、Mn2+、Co2+、Fe2+、Ag+、Mg2+、Li+、Cu2+离子与200 μL酶液等体积混匀,4 ℃条件下静置30 min,测定其酶活力。以200 μL酶液与等体积蒸馏水混匀后在同等条件下所测酶活力值为100%,计算不同金属离子在不同浓度下的漆酶相对酶活力。
1.3.10.4 不同化合物对漆酶活性的影响
将不同浓度(5~25 mmol/L)的抗坏血酸、草酸、尿素、EDTA与200 μL酶液等体积混匀后,4 ℃条件下静置30 min,测定不同化合物不同浓度下的漆酶活力。以与200 μL酶液等体积混匀的蒸馏水在相同条件下的酶活力为100%,计算不同化合物在不同浓度时的漆酶相对酶活力。
1.3.10.5 不同醇类有机溶剂对漆酶活性的影响
将不同体积分数(10%~50%)的甲醇、乙醇、异丙醇、正丁醇分别与200 μL漆酶酶液等体积混合后,4 ℃条件下静置30 min,测定不同有机醇类物质在不同含量下的漆酶酶活力。以与200 μL酶液等体积混匀的蒸馏水在相同条件下测的酶活力为100%,计算不同有机溶剂在不同浓度时的漆酶相对酶活力。
1.3.10.6 漆酶米氏常数(Km)和最大反应速率(vmax)的测定
配制不同浓度(0.1~1 mmol/L)的ABTS,在55 ℃、pH 5.0条件下测定漆酶的酶活力,采用双倒数作图法(Lineweaver-Burk)[19],求出漆酶的Km和vmax值。
2 结果与分析
2.1杂优-2平菇漆酶在液体培养基中的活性变化规律

图1 杂优-2平菇漆酶酶活力变化Fig.1 Change in laccase activity from Pleurotus ostreatus heterosis-2 during culture
杂优-2平菇发酵液中漆酶活力的测定结果如图1所示。杂优-2平菇在生长前期产酶量较低,因此漆酶活力较低。在第6 天酶活力达到峰值,随着培养时间的延长,酶活力逐渐降低。有研究表明漆酶与菌体的呼吸作用有关,为菌体生长提供更多可利用的能量,从而加快菇类的生长发育[20]。在本实验中,第6天后漆酶活力开始下降,可能是因液体培养基中菌丝体数量增多而氧的含量减少,导致漆酶菌丝呼吸作用减慢,产漆酶量减少,而消耗漆酶量大于生产量。
2.2杂优-2平菇漆酶的分离纯化
经DEAE-Sepharose fast flow层析后的杂优-2平菇漆酶结果如图2所示,酶活力峰主要集中在42~51 管,其中第47管的酶活力值最高。离子交换层析所得酶液,经Superdex-200 prep grade层析(图3),结果表明杂优-2平菇漆酶酶活力峰主要集中在27~39 管,第30管时酶活力峰最高,次峰为第36管。该结果说明经离子交换层析所得的酶液有2 个活性峰。弃次峰酶液,收集第30管(主峰)附近各管的酶液,进行SDS-PAGE分析,结果显示单一条带(图4),表明杂优-2平菇漆酶分离纯化已达电泳纯。后续研究均以该酶液为材料进行。杂优-2平菇漆酶纯化结果如表1所示:最终得到杂优-2平菇漆酶回收率为6.96%,纯化倍数为111.65 倍,比活力达到115 U/mg pro。

图2 杂优-2平菇漆酶酶液DEAE-Sepharose fast flow层析结果Fig.2 DEAE-Sepharose fast flow chromatography of laccase from Pleurotus ostreatus heterosis-2

图3 杂优-2平菇漆酶酶液Superdex-200 prep grade 层析结果Fig.3 Superdex-200 prep grade chromatography of laccase from Pleurotus ostreatus heterosis-2

表1 杂优-2平菇漆酶酶液分离纯化结果Table1 Summary of purification of laccase from Pleurotus ostreatus heterossiiss-2
2.3杂优-2平菇漆酶的分子质量
由图4可知,经SDS-PAGE测得杂优-2平菇漆酶的亚基分子质量约为85.6 kD,经过Superdex-200 prep grade层析测得全酶分子质量为244.0 kD(图5),由此可推测杂优-2平菇漆酶由3个亚基组成。

图4 杂优-2平菇漆酶的SDS-PAGE图谱Fig.4 SDS-PAGE of the laccase
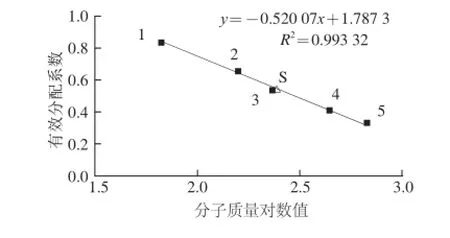
图5 Superdex-200 prep grade层析测得杂优-2平菇漆酶的分子质量Fig.5 Molecular weight estimation of the laccase by Superdex-200 prep grade chromatography
2.4杂优-2平菇漆酶的部分酶学性质
2.4.1漆酶最适反应温度与热稳定性

图6 反应温度对杂优-2平菇漆酶活力的影响Fig.6 Effect of temperature on the activity of the laccase
由图6可知,杂优-2平菇漆酶的最适反应温度为55 ℃,在一定温度范围内,随着温度升高,漆酶活力呈先增大后减小的趋势,在25~35 ℃之间,酶活力变化不大,40~65 ℃范围内,相对酶活力保持在90%以上,70 ℃后酶活力开始逐渐降低。由图7可见,在40~45 ℃范围内保温3 h后,相对酶活力均保持在较高水平(75%左右),50~55 ℃范围内保温2 h后,相对酶活力均维持在50%左右,60~65 ℃范围保温1 h后,几乎无酶活力。

图7 杂优-2平菇漆酶的热稳定性Fig.7 Thermal stability of the laccase
2.4.2漆酶最适反应pH值与酸碱稳定性

图8 pH值对杂优-2平菇漆酶活力的影响Fig.8 Effect of pH on the activity of the laccase
由图8可知,杂优-2平菇漆酶在pH 5.0时有最大酶活力,因此该酶的最适反应pH值为5.0。在pH 3.0~5.0范围内,酶活力较高,当pH值大于8.0时,该漆酶活力几乎完全丧失。酸碱稳定性结果如图9所示,在pH 6.0~7.0范围内孵育3 h后,漆酶相对酶活力为98%左右,pH 8.0时相对酶活力最大,而当pH>9.0时,相对酶活力开始有下降趋势。

图9 杂优-2平菇漆酶的酸碱稳定性Fig.9 pH stability of the laccase
2.4.3不同金属离子对漆酶活性的影响
在不同浓度条件下,不同金属离子及同一种金属离子均表现出对该漆酶的不同作用效果(图10),Ag+、Mg2+、Li+对漆酶活性影响不大;K+、Ca2+、Ba2+、Zn2+、Cd2+、Pb2+、Mn2+、Co2+均对该酶有不同程度的抑制作用,其中Fe2+具有强烈抑制作用;Cu2+促进作用不明显(表现为轻微抑制作用或无太大影响)。

图10 不同金属离子对杂优-2平菇漆酶活力的影响Fig.10 Effects of various mental ions on the activity of the laccase
2.4.4不同化合物对漆酶活力的影响

图11 不同化合物对杂优-2平菇漆酶活力的影响Fig.11 Effects of various compounds on the activity of the laccase
由图11可知,尿素对该酶有促进作用,在浓度为10 mmol/L时促进作用较明显;草酸和抗坏血酸对该酶有抑制作用,其中抗坏血酸抑制作用较强烈,浓度为5 mmol/L时完全抑制;EDTA对该酶作用不明显。
2.4.5不同醇类有机溶剂对漆酶活性的影响
由图12可知,乙醇、异丙醇在体积分数为20%和30%时,对漆酶具有促进作用,甲醇和正丁醇对漆酶具有抑制作用,其中正丁醇抑制作用强于甲醇。

图12 不同醇类有机溶剂对杂优-2平菇漆酶活力的影响Fig.12 Effects of alcohols on the activity of the laccase
2.4.6漆酶米氏常数(Km)和最大反应速率(vmax)的变化
在55 ℃、pH 5.0条件下,以不同浓度的ABTS为漆酶反应底物,测定漆酶反应速率(v)。采用Lineweaver-Burk法得到1/[S]与1/v的关系曲线(图13),计算得到杂优-2平菇漆酶对ABTS的Km值为2.1 mmol/L,vmax为0.117 μmol/(min·L)。

图13 双倒数法测定杂优-2平菇漆酶的米氏常数Fig.13 Kmdetermination of the laccase by Lineweaver-Burk plot
3 讨论与结论
漆酶是一类含铜氧化酶,其来源广泛,在环境保护、饮料加工、污染物降解等方面具有广泛应用价值。漆酶存在于食用菌菌体中,菌体在生长过程中,其营养物质木质素,需要在菌体分泌的以胞外漆酶为主体的氧化酶及其他酶(如过氧化物酶、酪氨酸酶等)的共同作用下,才能将木质素分解成能为可直接吸收利用的小分子物质。而且该胞外酶在分解木质素的同时,产生有毒的醌类或酚类物质,能够抑制杂菌生长,从而防止杂菌污染[21]。其次,漆酶与菌体呼吸作用有关,有利于维持呼吸过程中电子传递的正常运行,为菌体生长提供更多可利用的能量。
目前,已有多种真菌漆酶被分离纯化,其理化性质也被广泛研究。尽管最适反应温度、pH值等在相似范围内,但由于漆酶的来源不同,其酶学性质呈现差异性。综合已有食用菌漆酶数据,漆酶最适反应温度范围为25~80 ℃。黎莉等[22]对金针菇漆酶性质的研究结果表明,其最适反应温度为40 ℃,最适反应pH值为 2.0~4.5;李学梅等[23]对平菇漆酶性质研究结果为其最适反应温度60 ℃,最适反应pH 3.0;刘新颖等[24]对双鲍菇漆酶性质研究发现其最适反应温度为25 ℃,最适反应pH 5.0;陈琼华等[25]对韦伯灵芝漆酶性质研究发现其最适反应温度为50~60 ℃,最适反应pH 4.6。本实验结果表明,以杂优-2平菇为实验材料分离纯化的漆酶,其最适反应温度为55 ℃,高于白灵侧耳漆酶(50 ℃)[26],低于紫杉木齿菌漆酶(60 ℃)[15],该酶在该温度条件下热稳定性较好,保温2 h后,剩余相对酶活力为50%左右;该酶最适反应pH 5.0,与双鲍菇漆酶和木腐真菌漆酶[24,27]最适反应pH值相同,高于灵芝漆酶最适反应pH 3.0、糙皮侧耳菌漆酶pH 4.0,彩绒革盖菌pH 4.6[28-29]。在pH 3~8、4 ℃条件下静置3 h,其稳定性随pH值的增大而增大,与平菇漆酶酸碱稳定性相同。表明该酶在酸性和中性环境中有更强的适应性。
金属离子Fe2+对该漆酶活性有强烈抑制作用,其可能原因是Fe2+通过催化氧化还原产物ABTS+·的还原作用,使其恢复到底物起始状态来延缓酶催化氧化反应的进程[30]。K+、Ca2+、Ba2+、Zn2+、Cd2+、Pb2+、Mn2+、Co2+对该酶具有抑制作用,且随金属离子浓度的增大,抑制作用越强;Cu2+对该酶在浓度为0.2 mmol/L具有促进作用,高于或低于该浓度均表现抑制作用,而大多数研究表明Cu2+能明显促进漆酶活性,少数对漆酶活性无影响或有抑制作用;也有研究表明,高浓度金属离子对白腐菌的生长会产生一定毒害作用,这也许可以解释高浓度下杂优-2平菇漆酶活力降低的原因[15]。然而,低浓度条件下,金属离子对漆酶活性影响不大或降低,因此仍需进一步研究。Ag+、Mg2+、Li2+对该漆酶活性影响不大。在所研究的金属离子中,没有能使杂优-2平菇漆酶活性明显增强的金属离子。抑制剂EDTA在浓度为25 mmol/L、4℃条件下,孵育30 min,其剩余相对酶活力仍有89%,表明EDTA对该酶活性影响不大,该结果与抑制剂EDTA对紫杉木齿菌漆酶活性影响结果相同[15]。
杂优-2平菇漆酶亚基分子质量约为85.6 kD,全分子质量为244.0 kD,通常漆酶分子质量在40~80 kD之间,与毛木耳LacA(110 kD)[31],白灵侧耳pnLac(65 kD)[26],紫杉木齿菌漆酶(55.5 kD)[15],韦伯灵芝漆酶(40 kD)[25],灵芝漆酶同工酶(65~68 kD)[32]有很大差异且高于常见漆酶分子质量,表明不同来源漆酶分子质量间存在较大差异。该酶对底物ABTS的Km值为2.1 mmol/L,vmax为0.117 μmol/(min·L),其Km值均高于紫杉木齿菌漆酶(5.18×10-2mmol/L)、韦伯灵芝漆酶(1.38×10-2mmol/L)、白灵侧耳pnLac(0.117 mmol/L)和灵芝漆酶同工酶(3.7×10-3mmol/L)[15,25-26,32],表明该酶与底物的亲和力较差。
本实验以杂优-2平菇为实验材料分离纯化漆酶,其操作流程简单,在40~55 ℃条件下的热稳定性较好。自然界中,漆酶产量低,因此对漆酶及其酶学性质的研究,不仅对改造漆酶分子结构、高效表达及基因克隆有重要意义,而且对食用菌菌种改良和栽培有实践意义。对杂优-2平菇漆酶的酶学性质进行研究,可对其在生产、工业等方面的应用提供参考。
参考文献:
[1] 王锋, 刘英, 汪印, 等. 漆酶及其应用[J]. 生物加工过程, 2012, 10(4): 70-76. DOI:10.3969/j.issn.1672-3678.2012.04.015.
[2] 杜东霞. 漆酶的特性及其在工业中的应用[J]. 安徽农业科学, 2011,39(4): 1904-1907. DOI:10.13989/j.cnki.0517-6611.2011.04.045.
[3] BHATTACHARYA S S, KARMAKAR S, BANERJEE R. Optimization of laccase mediated biodegradation of 2,4-dichlorophenol using genetic algorithm[J]. Water Research, 2009, 43(14): 3503-3510. DOI:10.1016/j.watres.2009.05.012.
[4] 慎镛健, 张蓓蓓, 徐昌, 等. 漆酶的研究及进展[J]. 黑龙江环境通报,2015(2): 59-62.
[5] KUNAMNENI A, PLOU F J, BALLESTEROS A, et al. Laccases and their applications: a patent review[J]. Recent Patents on Biotechnology,2008, 2(1):10-24. DOI:10.2174/187220808783330965.
[6] RODRIGUEZ C S, TOCA H J L. Industrial and biotechnological applications of laccases: a review[J]. Biotechnology Advances, 2006,24(5): 500-513. DOI:10.1016/j.biotechadv.2006.04.003.
[7] 杨娟, 邹亚杰, 张瑞颖, 等. 白灵侧耳漆酶分离纯化及其酶学性质研究[J]. 菌物学报, 2015, 34(3): 456-464. DOI:10.13346/ j.mycosystema.140057.
[8] SAHAY R, YADAV R S S, YADAV K D S. Purification and characterization of laccase secreted by L. lividus[J]. Applied Biochemistry & Biotechnology, 2009, 157(2): 311-320. DOI:10.1007/ s12010-008-8265-5.
[9] 司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. DOI:10.13560/j.cnki.biotech. bull.1985.2011.02.018.
[10] OTHMAN A M, ELSHAFEI A M, HASSAN M M, et al. Purifi cation,biochemical characterization and applications of Pleurotus ostreatus ARC 280 laccase[J]. British Microbiology Research Journal, 2014,4(12): 1418-1439. DOI:10.9734/BMRJ/2014/11218.
[11] HALABURGI V M, SHARMA S, SINHA M, et al. Purification and characterization of a thermostable laccase from the ascomycetes Cladosporium cladosporioides and its applications[J]. Process Biochemistry, 2011, 46(5):1146-1152. DOI:10.1016/ j.procbio.2011.02.002.
[12] HAIBO Z, YING L, FENG H, et al. Purifi cation and characterization of a thermostable laccase with unique oxidative characteristics from Trametes hirsuta[J]. Biotechnology Letters, 2009, 31(6): 837-843. DOI:10.1007/s10529-009-9945-0.
[13] RODRIGUEZ C S, TOCA H J L. Industrial and biotechnological applications of laccases: a review[J]. Biotechnology Advances, 2006,24(5): 500-513. DOI:10.1016/j.biotechadv.2006.04.003.
[14] JING S, FENG P, CUI B. Purifi cation, biochemical characterization and dye decolorization capacity of an alkali-resistant and metaltolerant laccase from Trametes pubescens[J]. Bioresource Technology,2013, 128(1): 49-57. DOI:10.1016/j.biortech.2012.10.085.
[15] 董天保. 紫杉木齿菌漆酶的分离纯化及其对木质素的降解研究[D].武汉: 华中科技大学, 2013: 41-44.
[16] 张鹏. 以ABTS为底物测定漆酶活力的方法[J]. 印染助剂, 2007,24(1): 43-45. DOI:10.3969/j.issn.1004-0439.2007.01.014.
[17] 林俊芳, 刘志明, 陈晓阳, 等. 真菌漆酶的酶活测定方法评价[J]. 生物加工过程, 2009, 7(4): 1-8. DOI:10.3969/ j.issn.1762-3678.2009.04.001.
[18] 陈雅蕙. 生物化学实验原理和方法[M]. 北京: 北京大学出版社,2005: 69-71.
[19] 陈钧辉, 陶力, 朱婉华, 等. 生物化学实验[M]. 北京: 科学出版社,2004: 92-93.
[20] TURNER E M, WRIGHT M, WARD T, et al. Production of ethylene and other volatiles and changes in cellulase and laccase activities during the life cycle of the cultivated mushroom, Agaricus bisporus[J]. Journal of General Microbiology, 1975, 91(1): 167-176. DOI:10.1099/00221287-91-1-167.
[21] 吴坤, 闵航, 朱显峰, 等. 杂色云芝漆酶的分离、纯化和酶学特性研究[J]. 高校化学工程学报, 2003, 17(2): 173-179.
[22] 黎莉, 于德涵, 胡盼. 金针菇杂交菌株漆酶酶学性质的研究[J]. 农学学报, 2013, 3(6): 68-71. DOI:10.3969/j.issn.1007-7774.2013.06.017.
[23] 李学梅, 王涛, 王栋, 等. 平菇漆酶的性质和应用研究[J]. 环境科学与技术, 2008, 31(8): 39-41.
[24] 刘新颖, 朱启忠, 赵春媛, 等. 双孢菇漆酶酶学性质及染料脱色初探[J].北方园艺, 2010(14): 182-183.
[25] 陈琼华, 周玉萍, 陈晓, 等. 韦伯灵芝漆酶的分离纯化及其性质[J].食品科学, 2010, 31(5): 201-205.
[26] 杨娟. 白灵侧耳漆酶活性、纯化及其性质研究[D]. 北京: 中国农业科学院, 2014: 34-37.
[27] 傅恺, 付时雨, 张丽, 等. 亚热带木腐真菌产漆酶及其酶学性质[J]. 华南理工大学学报(自然科学版), 2011, 39(9): 152-157. DOI:10.3969/j.issn.1000- 565X. 2011. 09.026.
[28] 席丹, 陶用珍. 糙皮侧耳菌漆酶的分离纯化及部分性质研究[J].纤维素科学与技术, 2003, 11(4): 22-30. DOI:10.16561/j.cnki. xws.2003.04.004.
[29] 王宜磊, 刘兴坦. 彩绒革盖菌漆酶及多酚氧化酶活性研究[J].生物技术, 2004, 10(6): 15-18. DOI:10.16519/j.cnki.1004-311x.2000.06.007.
[30] 陈维新. 过渡金属离子对漆酶催化活性的影响[J]. 分析测试学报,2004, 23(4): 78-80.
[31] 杨建明, 张小敏, 邢增涛, 等. 毛木耳漆酶纯化及其部分漆酶特性的研究[J]. 菌物学报, 2005, 24(1): 61-70. DOI:10.13346/ j.mycosystema.2005.01.012.
[32] KO E M, LEEM Y E, CHOI H. Purification and characterization of laccase isozymes from the white-rot basidiomycete Ganoderma lucidum[J]. Applied Microbiology & Biotechnology, 2001, 57(1/2):98-102. DOI:10.1007/s002530100727.
Isolation, Purification and Characterization of Laccase from Pleurotus ostreatus Heterosis-2
LIAO Haijun, LI Ruijia, TAO Min, BAI Yajuan, TANG Jing, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweetpotato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
An electrophoretically pure laccase from the fermentation broth of Pleurotus ostreatus heterosis-2 was obtained through ammonium sulfate fractionation, DEAE-Sepharose fast flow chromatography and Superdex-200 prep grade chromatography. The results indicated that the specific activity of the purified enzyme reached 115 U/mg. The relative molecular weight of the laccase was approximately 244.0 kD, with a subunit molecular mass of roughly 85.6 kD. The enzymatic properties showed that the optimum pH and temperature for the laccase were 5.0 and 55 ℃, respectively. The enzyme was stabled at pH 6.0-8.0 and 40-55 ℃, and its apparent Kmand vmaxwere 2.1 mmol/L and 0.117 μmol/(min·L),respectively. Fe2+and ascorbic acid could completely inactivate the laccase, whereas the enzyme activity was slightly affected by EDTA, Ag+, Mg2+and Li+. Cu2+had little activating effect on laccase activity. The enzyme activity of laccase could be activated by urea, ethanol, and isopropanol, and inhibited by oxalic acid, methanol, n-butanol, K+, Ca2+, Ba2+,Zn2+, Cd2+, Pb2+, Mn2+, and Co2+.
Pleurotus ostreatus heterosis-2; laccase; isolation and purifi cation; enzymatic properties
10.7506/spkx1002-6630-201619025
Q946.5
A
1002-6630(2016)19-0147-07
廖海君, 李蕊伽, 陶敏, 等. 杂优-2平菇漆酶的分离纯化及酶学性质[J]. 食品科学, 2016, 37(19): 147-153. DOI:10.7506/ spkx1002-6630-201619025. http://www.spkx.net.cn
LIAO Haijun, LI Ruijia, TAO Min, et al. Isolation, purification and characterization of laccase from Pleurotus ostreatus heterosis-2[J]. Food Science, 2016, 37(19): 147-153. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619025. http://www.spkx.net.cn
2015-10-30
中央高校基本科研业务费专项资金项目(XDJK2016C110)
廖海君(1989—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:heking_liao@yahoo.com
唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
