真菌Simplicilliumlanosoniveum胞外多糖合成条件的优化及其动力学分析
2016-11-08邢向英陈敬宇董庆霖管瑞静闫双印
邢向英,陈敬宇,董庆霖,管瑞静,闫双印
(河北工业大学化工学院,天津 300130)
真菌Simplicilliumlanosoniveum胞外多糖合成条件的优化及其动力学分析
邢向英,陈敬宇,董庆霖*,管瑞静,闫双印
(河北工业大学化工学院,天津 300130)
Simplicilliumlanosoniveum(DT06)是一种能够合成特殊胞外多糖的半知菌类真菌。本文以真菌DT06为研究材料,采用BBD设计原则的响应面法优化其胞外多糖的合成工艺条件,并对其发酵动力学参数进行分析。在单因素实验的基础上,以胞外多糖得率为响应值,确定多糖合成的最优条件:初始pH4.87,葡萄糖40.65 g/L,蛋白胨10.38 g/L,温度30 ℃,转速140 r/min。优化后真菌DT06胞外多糖得率可达0.139 g/g,比优化前提高了32%。在此优化条件下,对DT06的发酵过程进行动力学分析,结果表明:DT06最大比生长速率μmax=0.156 h-1,其多糖合成与菌体生长部分偶联。与其它产多糖的真菌相比,DT06合成多糖的最大比合成速率较高达到0.066 h-1,但总的多糖得率却较低。碳平衡计算发现DT06还产生一种未知的中性含碳产物,其碳得率为0.129 g/g。上述实验为DT06多糖发酵过程的调控及其胞内代谢网络的优化提供了依据。
胞外多糖,真菌,响应面法,发酵动力学,碳平衡
真菌胞外多糖是由一种或多种单糖连接而成的直链或支链型高分子聚合物。其多糖具有特殊的性能,如乳化性,絮凝性[1],抗氧化性和抗热/机械稳定性等,因而在食品添加剂——增稠剂、抗氧化剂、药物载体,石油助剂方面得到广泛的应用。

1 材料与方法
1.1材料与仪器
菌种共生真菌DT06,中国科学院微生物研究所菌物标本馆保藏,保藏编号为:HMAS 242045;实验所用试剂均为分析纯;沙氏培养基葡萄糖40 g、蛋白胨10 g、蒸馏水1000 mL;查氏培养基葡萄糖40 g、硝酸钠1.5 g、磷酸氢二钾1.0 g、氯化钾0.5 g、硫酸镁0.5 g、硫酸亚铁0.01 g、蒸馏水1000 mL;PDA培养基土豆200 g、葡萄糖20 g、蒸馏水1000 mL。
HZQ-QG卧式空气恒温振荡器北京东联哈尔仪器制造有限公司;LG16-B高速冷冻离心机北京雷勃尔离心机有限公司;Model 868 pH计上海Thermo;722N可见分光光度计上海菁华科技仪器有限公司;FD-1冷冻干燥机北京博医康技术有限公司。
1.2实验方法
1.2.1培养方法从斜面上刮取孢子,转入20 mL无菌水中,振荡分散孢子,接种0.1%的孢子悬液于装有50 mL沙氏培养基的250 mL摇瓶中,在25 ℃,120 r/min的摇床中培养36 h 得到种子液。接种0.5%的种子液到100 mL发酵培养基摇瓶(250 mL)中,于25 ℃,120 r/min的摇床中培养。
1.2.2测定方法
1.2.2.1生物量的测定将发酵液于7000 r/min,离心10 min,得到沉淀的细胞,后用无菌水洗涤两次,置于电热恒温鼓风干燥箱中105 ℃烘干12 h称重。
1.2.2.2多糖和残糖测定多糖按文献[11]方法测定,还原糖用DNS法测定[12]。
1.2.3培养基筛选方法分别研究DT06在3种培养基,沙氏培养基、查氏培养基、土豆培养基中的产糖情况,综合分析确定出最适产糖基本培养基。
1.2.4单因素实验设计在最佳产糖培养基的条件上,分别改变碳氮浓度、pH、温度和转速,来研究其对多糖得率的影响。
1.2.4.1不同转速对多糖得率的影响转速分别为:80、100、120、140、160 r/min。其它条件为:温度25 ℃,pH6.0,最佳培养基碳氮源浓度。
1.2.4.2不同初始pH对多糖得率的影响初始pH分别为:4.0、5.0、6.0、7.0、8.0。其它条件为:温度25 ℃,转速120 r/min,最佳培养基碳氮源浓度。
1.2.4.3不同发酵温度对多糖得率的影响发酵温度分别为:20、25、30、35、40 ℃。其它条件为:pH6.0、转速120 r/min,最佳培养基碳氮源浓度。
1.2.4.4不同碳氮源浓度对多糖得率的影响将筛选的最佳产糖培养基碳氮源以其原始浓度为基点,分别设置5个等梯度浓度。其它条件为:温度25 ℃,pH6.0,转速120 r/min。
1.2.5BBD实验设计以产糖量最高的培养基为基础培养基进行单因素实验,初步确定主要因素对多糖得率的影响值范围,在单因素的实验结果基础上,根据BBD设计方法来设计表面响应方案,通过响应面分析得到多糖合成条件的最佳组合。每个因素分别以-1,0,1代表三水平进行编码,因数水平见表1。该模型通过最小二乘法拟合二次多项式方程表达为:
式中,Yeps/s代表响应结果多糖得率,A0率为常数项,Ai为线性系数,Aii为二次线性系数,Aij为交互项系数,Xi、Xj为各自变量编码值。
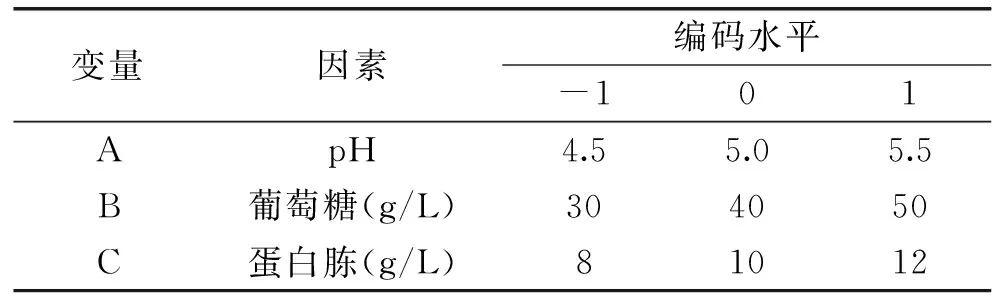
表1 实验因子及编码水平
1.2.6动力学模型建立以非结构模型中的Monod方程式(1)为基础方程建立生长动力学模型,产物合成类型主要分为三种,需先通过数据分析来确定产物的合成类型,而后建立合成动力学模型。
式(1)
其中,μmax为最大比生长速率,Cs为细胞浓度,Ks为底物饱和常数。
1.2.7动力学数据采集与处理分别采集不同时间点的菌体量、多糖量、残液体积、残糖浓度及pH。后根据公式(2~4)计算得到μ、qp、qs。每个点三组重复。所有数据均采用最小二乘法(Origin 8.0软件)进行处理。
式(2)
式(3)
式(4)
其中,μ、qp、qs分别为比生长、产物比合成、底物比消耗速率(h-1),rx、rp、rs分别为细胞生长、产物合成速率(g/L·h)、产物消耗。
2 结果与讨论
2.1培养基的筛选
实验数据表明(图1)DT06在沙氏培养基上多糖的浓度随着时间的变化迅速上升,发酵结束(148h)时,多糖得率为0.106g/g,而相同条件下DT06在查氏培养、土豆培养基上的得率较低,分别为0.022、0.047g/g。因此,沙氏培养基为DT06合成胞外多糖的最佳培养基。
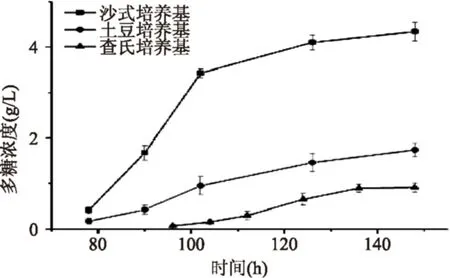
图1 多糖在不同培养基中的浓度曲线Fig.1 EPS synthesis curve in different medium
2.2单因素实验
2.2.1不同转速对多糖得率的影响由图2可以看出:随着转速的增加多糖得率呈平缓的上升后下降的趋势,当140 r/min时,多糖得率最大为0.116 g/g。出现该趋势的原因可能是:a.适当的增加转速刺激了细胞分泌多糖,当转速过大,导致细胞形态受损,多糖得率降低。b.该多糖合成为耗氧活动,适当的增加转速提高了溶氧量,多糖得率提高。因此选多糖合成的最佳培养转速为140 r/min。

图2 转速对多糖得率的影响Fig.2 Effect of roational speed on EPS yield
2.2.2不同初始pH对多糖得率的影响由图3可知,pH从4.0~5.0多糖得率呈急剧上升趋势,5.0到8.0急剧下降。真菌DT06合成多糖的适宜pH偏弱酸性,在4.5~5.5之间且pH为5.0时多糖得率最大为0.124 g/g。而已报道的真菌合成多糖的适宜pH多数在2.5~4.5之间[13-14],因此,真菌DT06的最适产糖pH比大部分真菌高。因此,选多糖合成的最佳pH是5.0。

图3 pH对多糖得率的影响Fig.3 Effect of inital pH on EPS yield
2.2.3不同发酵温度对多糖得率的影响由图4可知,发酵多糖得率随着温度呈现先增加后降低的趋势,但总体变化趋势不明显。该多糖的最佳合成温度并非菌体最适生长温度25 ℃,而是30 ℃,说明参与合成多糖的各种酶的最适温度较菌体生长温度要高。而当外界温度超过30 ℃,该类酶的活性降低,从而导致代谢受阻,多糖得率降低。因此,选多糖合成的最佳温度为30 ℃。
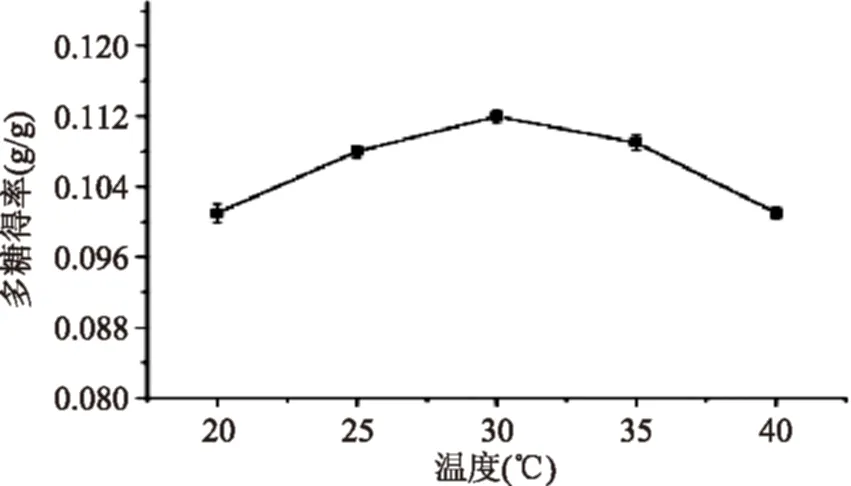
图4 温度对多糖得率的影响Fig.4 Effect of temperature on EPS yield
2.2.4不同葡萄糖浓度对多糖得率的影响由图5可知,葡萄糖在低浓度范围内时对多糖得率影响很大,多糖得率呈直线上升趋势,在40 g/L时达到最大0.104 g/g。因此,选多糖合成的最佳葡萄糖浓度为40 g/L。

图5 葡萄糖浓度对多糖得率的影响Fig.5 Effect of glucose concentration on EPS yield
2.2.5不同蛋白胨浓度对多糖得率的影响由图6可知,多糖得率随着蛋白胨浓度的增加呈现明显的变化趋势,10 g/L时多糖得率达到最大0.105 g/g。而当氮源浓度超过10 g/L时,多糖得率呈缓慢降低的趋势。因此该多糖合成的最佳蛋白胨浓度为10 g/L。
图6 蛋白胨浓度对多糖得率的影响 Fig.6 Effect of peptone concentration on EPS yield
综合可知:由图2~图6可以看出:不同发酵温度和转速对多糖得率影响不明显,而初始pH和碳源、氮源浓度对多糖得率较为显著。因此,对初始pH和碳源、氮源浓度进行响应面优化实验。
2.3响应面法优化分析
在单因素实验的基础上,以pH、葡萄糖、蛋白胨为优化三因素(A,B,C),-1、0、1为三水平,多糖得率(Yeps/s)为响应值设置实验,每组3个重复。根据BBD设计原则设计响应实验方案,实验因子编码及水平见表1。表2为不同实验条件下的真菌DT06多糖得率,通过对表2实验结果进行响应面分析,得到多糖得率的二次回归模型为:
Y=-6.0404+1.8114A+0.0237B+0.2476C-0.00895AC-0.0001BC-0.1763A2-0.0003B2-0.0096C2
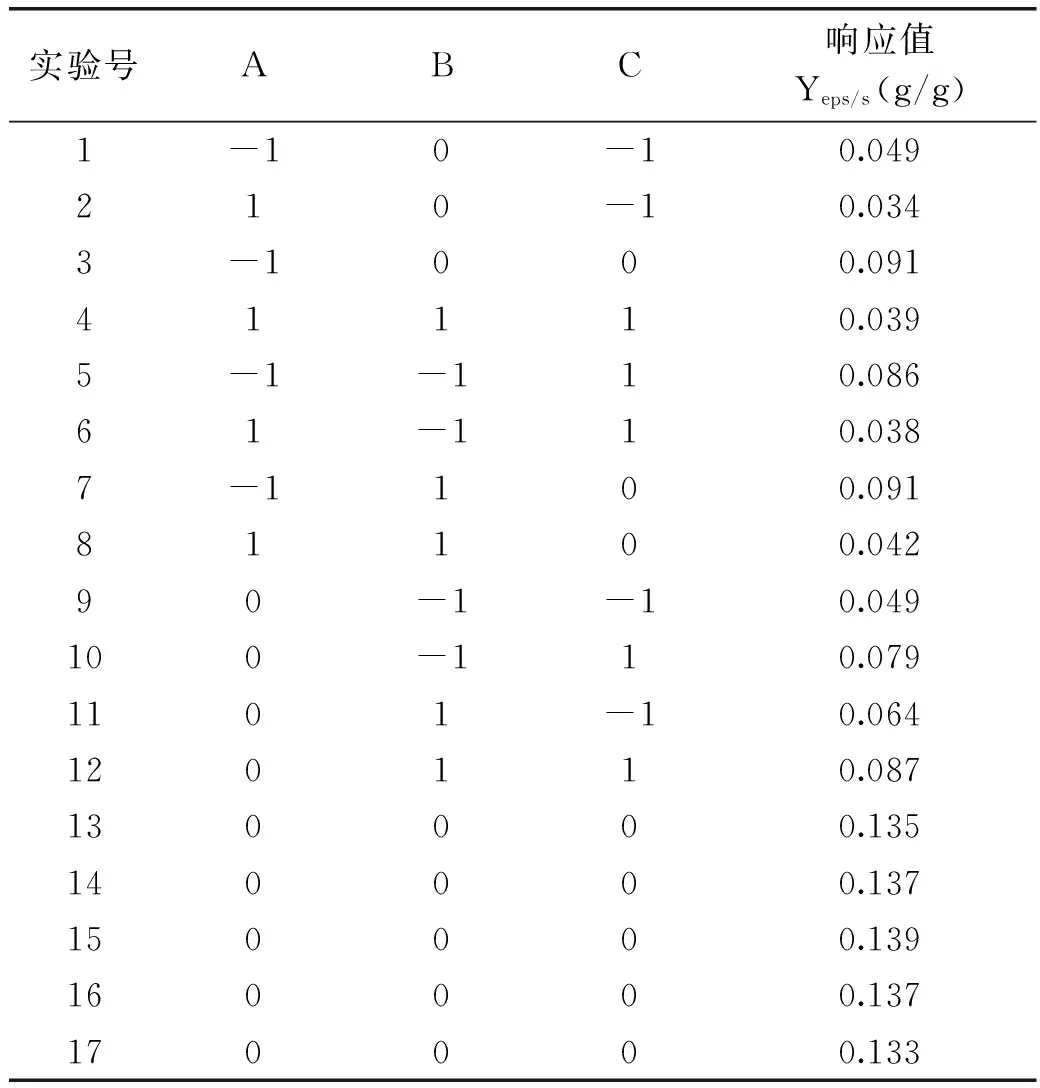
表2 BBD实验设计的单因素实验结果
回归方程的方差分析结果见表3。方差分析表明:模型p值<0.01,表现为显著,且失拟项p不显著,说明模型有效。其中A、B、C、AC、A2、B2、C2均为显著影响因素,AB、BC交互作用不显著,AC交互显著。结果显示各自变量的最优组合是:初始pH4.87,葡萄糖40.65 g/L,蛋白胨10.38 g/L,预测得率为0.141 g/g。图7为交互因素的响应曲面图。经优化验证,实测平均得率为0.139 g/g,平均相对误差为1.4%在允许误差范围内,表明该模型模拟程度较好,实验方案合理。总体比较,优化后比优化前多糖得率提高了32%。
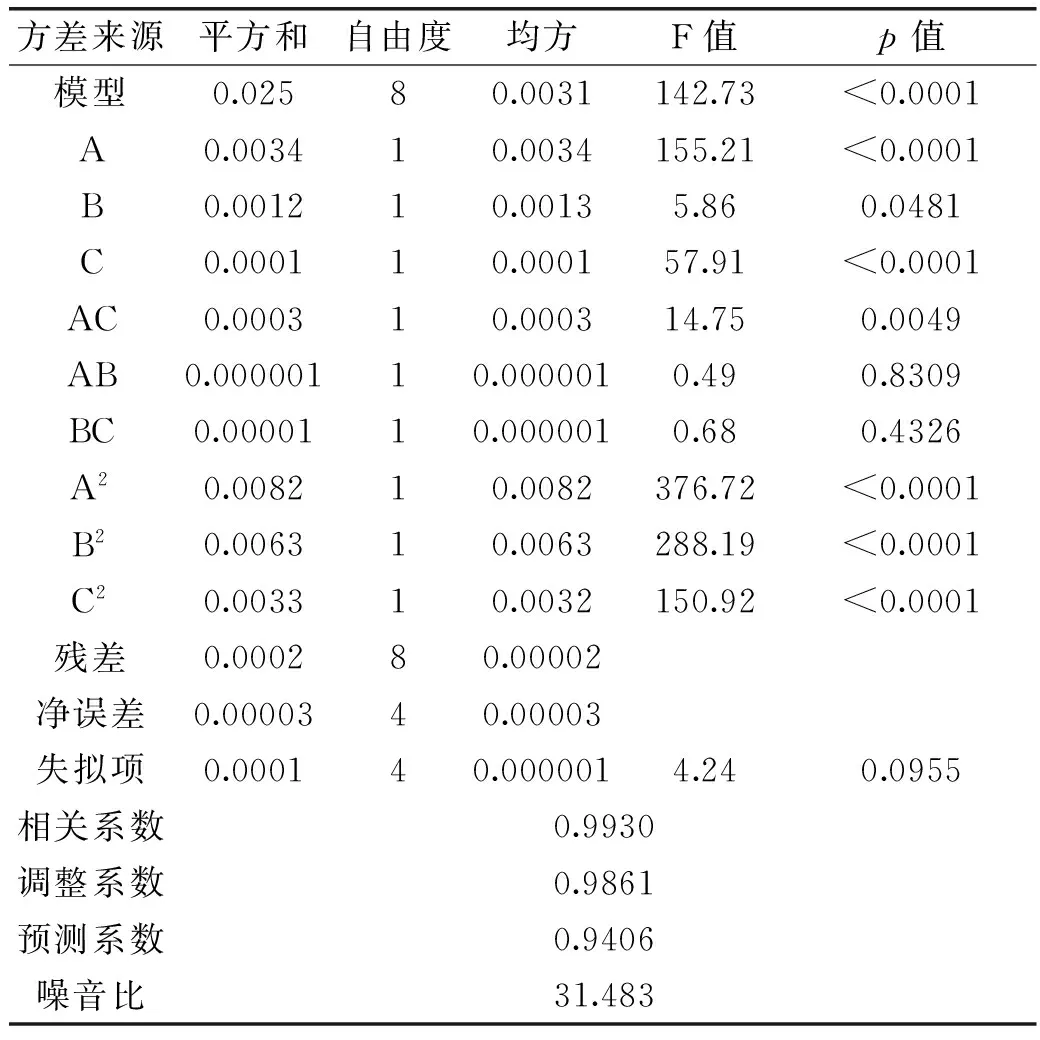
表3 BBD实验方差分析
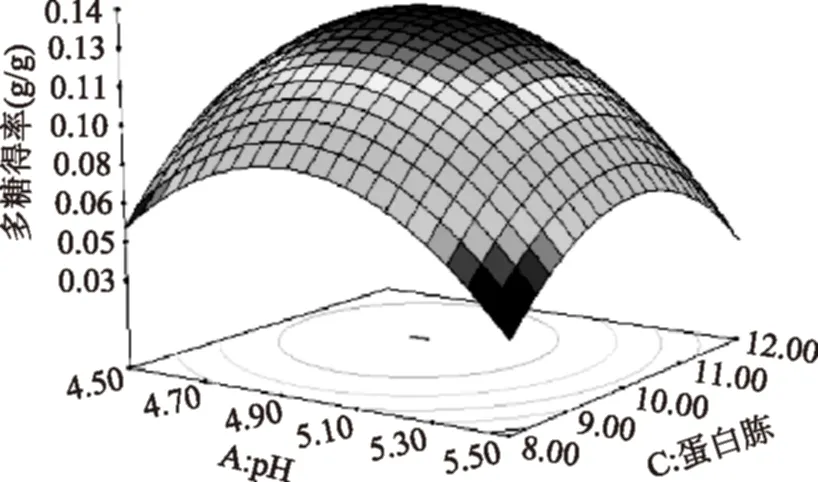
图7 蛋白胨浓度和pH对多糖得率影响的响应面图Fig.7 Response surface of peptone concentration and pH on EPS yield
2.4动力学分析
在最优发酵条件下(初始pH4.87,葡萄糖40.65 g/L,蛋白胨10.38 g/L,转速140 r/min,30 ℃)对DT06的发酵过程进行动力学分析。在146 h发酵结束时,发酵液pH呈现逐渐上升的趋势,最后稳定在6.1左右。生物量浓度、底物浓度见表4。
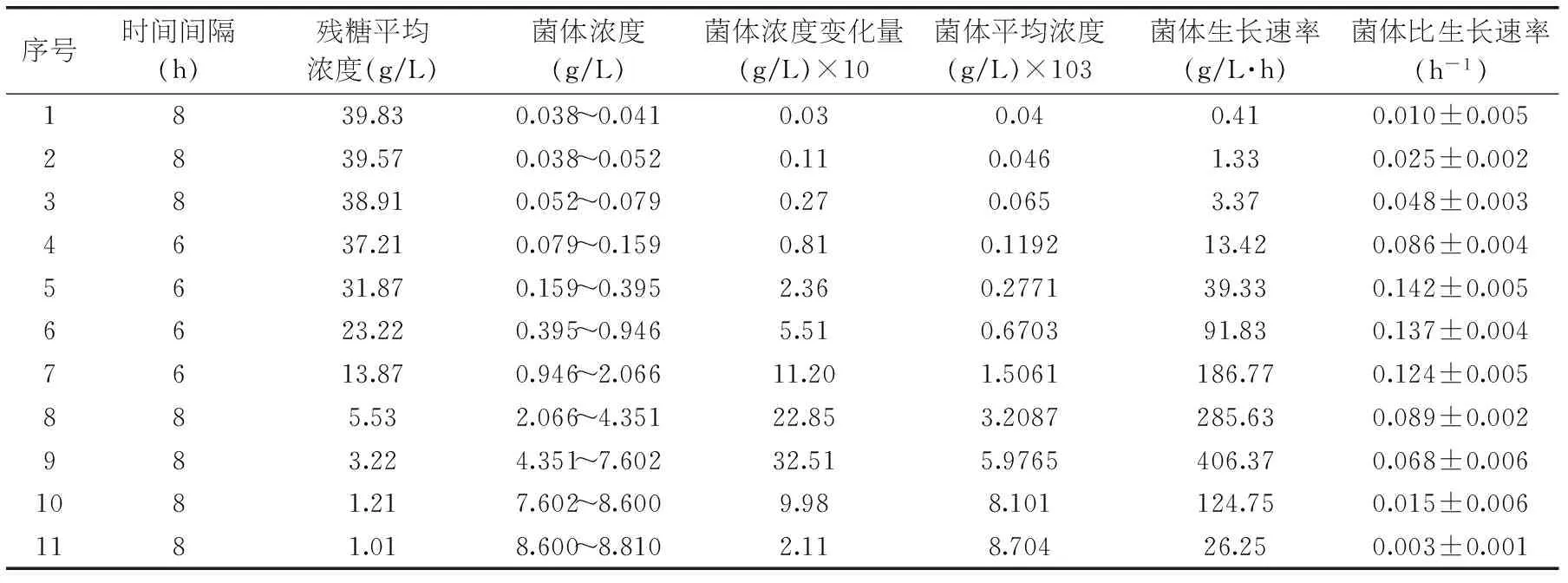
表4 底物、生物量浓度及比速率随时间变化的数据表
2.4.1细胞生长动力学据表4数据,对式(1)进行非线性模拟,得到μmax=0.156 h-1,Ks=5.18 g/L,拟合度R2为0.914。
式(5)
如图8所示,实验验证值与模拟值平均相对误差为8.98%,趋势吻合较好,式(2)可以用来模拟求解真菌DT06的动力学参数。真菌DT06的最大比生长速率较已报道(表5)的偏高,其主要原因可能是:第一,DT06本身代谢的特殊性;第二,发酵条件的不同。

图8 实验验证数据与方程模拟值Fig.8 Experimental value of specific growthrate versus substrate and model fit
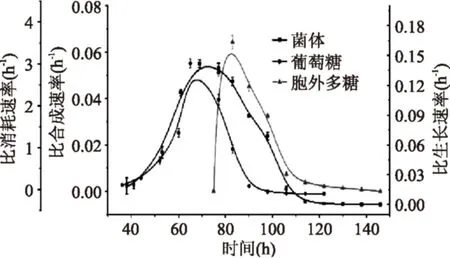
图9 发酵过程中比速率的时间变化曲线Fig.9 The course of specific rates in the batch fermentation
2.4.2多糖合成动力学发酵过程的比速率变化曲线(图9)表明:细胞生长的比速率(图10)与多糖合成的比速率(葡萄糖)的变化不同步。当比生长速率上升并达到0.142 h-1时,多糖比合成速率为0,而当比生长速率下降至0.12 h-1左右时,多糖合成才开始,并在83 h达到最大值0.066 h-1。因此DT06的多糖合成与细胞生长为半偶联(部分偶联),可采用Luedeking-piret方程(6)来模拟多糖合成与细胞生长的关系:
rp=αγx+βcx
式(6)
其中,α和β分别表示多糖合成与细胞生长偶联的产物系数,和与细胞浓度相关的产物生成系数。
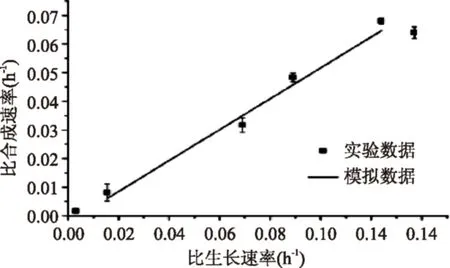
图10 实验值与方程模拟值Fig.10 Experimental value of specific growth rateversus specific production rate and model fit
由(1)式与(6)式结合,得到一定范围内,比合成速率与底物浓度的关系方程(7)如下:
式(7)
据此对多糖合成速率与菌体生长速率程进行拟合,得到α=0.539,β=0.002,R2=0.990(图10),且实验验证值与模拟值(图11)平均相对误差为6.57%。则式(7)变为:
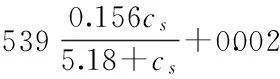
式(8)
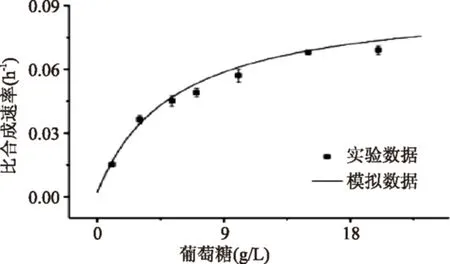
图11 实验值与方程模拟值Fig.11 Experimental value of specific productionrate versus substrate and model fit
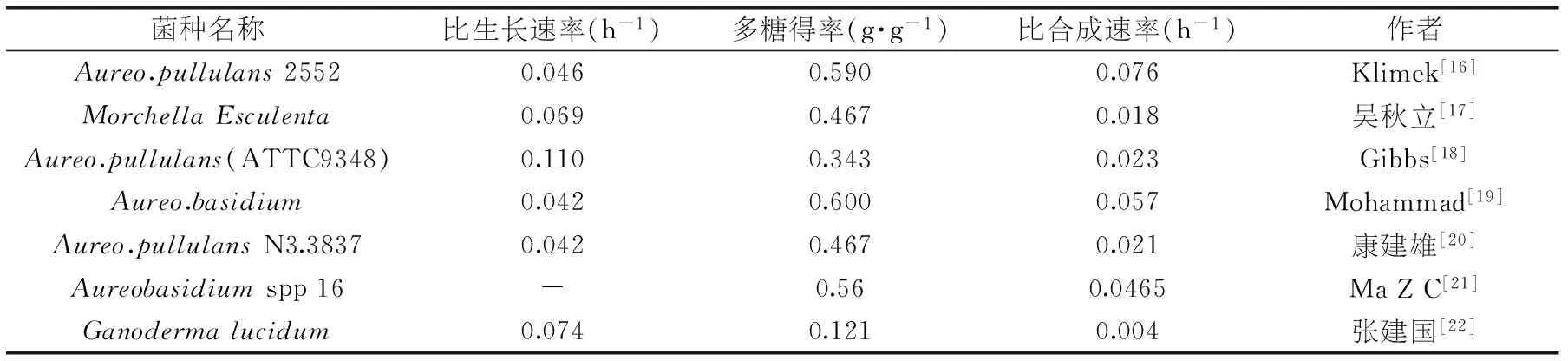
表5 部分产糖真菌动力学参数
注:部分数据经文献原始数据推算得到。
DT06合成胞外多糖的途径目前尚不清楚,但其动力学特性与合成途径较为复杂的柠檬酸、赖氨酸[15]相似。这可能由于与一般的葡聚糖如普兰多糖不同,DT06合成的胞外多糖为杂多糖主要由半乳糖和葡萄糖连接而成[10-11],因此,合成途径相对复杂。
2.4.3反应计量学平衡计算由于真菌DT06的最大比生长速率(0.156 h-1)和最大比合成速率(0.066 h-1)都高于其它产多糖真菌(表5),但其多糖得率(0.14 g/g)却明显低于其他真菌。推测其原因可能是 DT06发酵过程中还产生了其它的胞外产物。为此又进行了碳平衡验证,其次级产物微量可忽略,CO2的得率参考酵母[23]的最大值0.409 C-mole/C-mole,维持消耗me与比消耗速率qs参考Van Aalst-van Leeuwen报道的数据[24]。
CH2O+aO2+bNH3-cCH2O-dCH1.8O0.5N0.2-eCO2-fH2O-gCHxOyNz=0
底物葡萄糖P简式CH2O;细胞X组成式CH1.8O0.5N0.2;产物多糖P分子简式CH2O;未知含碳产物y分子简式CHxOyNz。
整个反应过程中的碳衡算方程如下:
msc-mpc-mxc-yco2/s·msc-myc=0
式(9)

式(10)

式(11)
其中,mxc表示物质x中含碳总量。由上式(9)、(10)计算得出未知含碳产物碳得率Yyc/sc为0.174 g/g,该值要比胞外多糖碳得率0.14 g/g稍高。若考虑DT06的维持消耗,扣除最大维持消耗碳分率Ye/s0.045 g/g,知产物的碳得率仍可达0.129 g/g。因此,可推断虽胞外多糖最大比合成速率较高,但由于其他含碳产物的分流,流向胞外多糖的碳流量下降,最终导致了胞外多糖得率较低。这分析结果为代谢网络的优化研究提供了的依据。
3 结论
3.1SimplicilliumlanosoniveumDT06最佳发酵条件为:发酵液初始pH4.87,葡萄糖40.65 g/L,蛋白胨10.38 g/L。模型预测值为0.141 g/g经实验验证,最大平均得率为0.139 g/g,比优化前胞外多糖提高了32%,该模型能够准确模拟多糖的合成量。
3.2DT06的多糖合成与细胞生长部分偶联,最大比生长速率和最大产物比合成速率分别为0.156,0.066 h-1及Ks=5.18 g/L。
3.3在发酵过程中产生一种未知的含碳产物,碳得率为0.129 g/g,因而导致碳代谢通量的分流和多糖得率的下降。
[1]何建玲,杨双双,黄金田,等. 响应面分析优化假单胞菌产絮凝剂的培养条件[J]. 食品工业科技,2015,36(16):183-192.
[2]Farina J I,Vinarta S C,Cattaneo M,et al. Structural stability of Sclerotium rolfsii ATCC 201126 beta-glucan with fermentation time:a chemical,infrared spectroscopic and enzymatic approach[J]. Journal of Applied Microbiology,2009,106(1):221-232.
[3]Bulmer M A,Catley B J,Kelly P J. The effect of ammonium ions and pH on the elaboration of the fungal extracellular polysaccharide,pullulan,byAureobasidiumpullulans[J]. Applied Microbiology and Biotechnology,1987,25(4):362-365.
[4]Wang C Y,Mao W J,Chen Z Q,et al. Purification,structural characterization and antioxidant property of an extracellular polysaccharide fromAspergillusterreus[J]. Process Biochemistry,2013,48(9):1395-1401.
[5]Chen Y,Mao W J,Tao H W,et al. Structural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungusAspergillussp Y16[J]. Bioresource Technology,2011,102(17):8179-8184.
[6]Stasinopoulos S J,Seviour R J. Exopolysaccharide production by Acremonium persicinum in stirred-tank and air-lift fermentors[J]. Applied Microbiology and Biotechnology,1992,36(4):465-468.
[7]Ward N A,Robertaon C L,Chanda A K. Effects ofSimplicilliumlanosoniveumon Phakopsora pachyrhizi,the Soybean Rust Pathogen,and Its Use as a Biological Control Agent[J]. Phytopathology,2012,120(8):749-760.
[8]余永涛,何生虎,赵清梅. 宁夏苦豆子中产苦参碱内生真菌的分离与鉴定[J]. 中国农业科学,2013,46(13):2643-2654.
[9]Zhou H B,Bi P Y,Wu X G. Improved Polysaccharide Production in Submerged Culture of Ganoderma lucidum by the Addition of Coixenolide[J]. Applied Biochemical and Biotechnology,2014,172:1497-1505.
[10]董庆霖,陈博,邢向英,等. 一株蓝藻内生真菌的鉴定及其产物抑菌活性[J]. 化工学报,2011,62(6):1655-1661.
[11]Dong Q L,Lin T Y,Xing X Y. Identification of a symbiotic fungus from blue-green alga and its extracellular polysaccharide[J]. Letters in Applied Microbiology,2014,58(4):303-310.
[12]Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical and Bioanalytical Chemistry,1959,31(3):426-428.
[13]Desmond P F A,Robert J S. Influence of varying nitrogen sources on polysaccharide production byAureobasidiumpullulansin batch culture[J]. Applied Microbiology and Biotechnology,1990,32(6):637-644.
[14]Dziasmis S,Dana H,Jaromir K,et al. Cryptococcus laurentii Extracellular Biopolymer Production for Application in Wound Management[J]. Applied Biochemistry and Biotechnology,2014,174(4):1344-1353.
[15]Lee H W,Pan J G,Lebeault J M. Characterisation of kinetic parameters and metabolic transition of Corynebacterium glutamicum on l-lysine production in continuous culture[J]. Applied Microbiology and Biotechnology,1995,43(6):1019-1027.
[16]Klimek J,Ollis D F. Extracellular microbial polysaccharides:Kinetics ofPseudomonassp.,Azotobacter vinelandii,andAureobasidiumpullulansbatch fermentations[J]. Biotechnology and Bioengineering,1980,22(11):2321-2342.
[17]武秋立,安家彦. 羊肚菌胞外多糖发酵动力学模型[J]. 南开大学学报,2005,38(1):43-48.
[18]Gibbs P A,Seviour R J. Does the agitation rate and/or oxygen saturation influence exopolysaccharide production byAureobasidiumpullulansin batch culture?[J]. Applied Microbiology and Biotechnology,1996,46:503-510.
[19]Mohammad F H A,Badr E M,Tayeb M E. Polysaccharide production byAureobasidiumPullulansIII. The influence of intial sucrose concentration on batch kinetics[J]. Biomass and Bioenergy,1995,8(2):121-129.
[20]康建雄,孟少魁,吴磊. 生物絮凝剂普鲁兰的发酵动力学模型研究[J]. 哈尔滨工业大学学报,2005,37(10):1370-1372.
[21]Ma Z C,Fu W J,Liu G L,et al. High-level pullulan production by Aureobasidium pullulans var. melanogenium P16 isolated from mangrove system[J]. Applied Microbiology and Biotechnolog,2014,98:4865-4873.
[22]张建国,陈晓明,贺新生. 灵芝胞外多糖分批发酵动力学模型[J]. 生物工程学报,2007,23(6):1065-1070.
[23]Nielsen J,Villadsen J,Liden G. Bioreaction Engineering Principles,second edition[M]. Beijing:Chemical Industry Press,2004.
[24]Van Aalstt-Van Leeuwen M A,Pot M A,Van Loosdrecht M,et al. Kinetic Modeling of Poly(b-hydroxybutyrate)Production and Consumption by Paracoccus pantotrophus under Dynamic Substrate Supply[J]. Biotechnology and Bioengineering,1997.(5):773-782.
Optimization and kinetics analyses of exopolysaccharide production bySimplicilliumlanosoniveum
XING Xiang-ying,CHEN Jing-yu,DONG Qing-lin*,GUAN Rui-jing,YAN Shuang-yin
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,China)
The optimum synthesis conditions and fermentation kinetic parameters ofSimplicilliumlanosoniveumDT06 which was a Deuteromycetes fungus being capable of producing unique exopolysaccharide(EPS)was researched. Based on single factor experiment,the optimum culture conditions for EPS yield coefficient were determined applying Box-Behnken design(BBD). Under the optimized conditions(40.65 g/L glucose,10.38 g/L peptone,pH4.87,temperature 30 ℃ and rotation speed 140 r/min),the highest EPS yield coefficient 0.139 g/g was obtained,which increased 32% compared with that before optimization. Kinetics analyses indicate that the maximum specific growth rate(μmax)of DT06 was 0.156 h-1,while its EPS synthesis was semi-growth-associated with a maximum specific production rate 0.066 h-1,which was relative higher than those of other EPS-producing Fungi. Nevertheless its average EPS yield coefficient was relative low. Carbon-balance analysis revealed that apart from EPS DT06 also produced a unknown products with a carbon yield coefficient of 0.129 g/g. These results provided essential parameters for controlling DT06’s fermentation process and improving its metabolic network.
exopolysaccharide;fungus;RSM;fermentation Kinetic;carbon-balance
2016-03-04
邢向英(1965-),女,硕士,副教授,研究方向:天然产物与合成,E-mail:xyxing@hebut.edu.cn。
董庆霖(1964-),男,教授,研究方向:天然代谢产物与代谢工程,E-mail:qldong@hebut.edu.cn。
TS201.2
A
1002-0306(2016)18-0185-07
10.13386/j.issn1002-0306.2016.18.027
