单增李斯特菌便捷检测试纸的制备及检测效果
2016-11-07郑晓风刘英玉张军涛张晓红
郑晓风,韩 勇,刘英玉,张军涛,张 琦,张晓红,姚 刚,
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.新疆乌鲁木齐市畜牧草原工作站,新疆 乌鲁木齐 830000)
单增李斯特菌便捷检测试纸的制备及检测效果
郑晓风1,韩勇2,刘英玉1,张军涛1,张琦1,张晓红1,姚刚1,*
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.新疆乌鲁木齐市畜牧草原工作站,新疆 乌鲁木齐 830000)
目的:研究一种快速、便捷检测食品中单增李斯特菌的方法,拟对本实验室制备的单增李斯特菌快速检测试纸(Listeria monocytogenes-fast test paper,LM-FTP)(专利受理号:201510274726.9)进行检测效果评价。方法:采集肉样、乳样、水样和蔬菜,用LM-FTP进行检测,并与市售单增李斯特菌检测试纸片(3M PetrifilmTM)进行比对实验。结果:LM-FTP的检测特异性为100%,检测限为2.1×104CFU/mL。增菌培养到报告结果只需5.5 h。LM-FTP和3M PetrifilmTM检测都可对样品完成检测,对农贸市场畜产品及蔬菜检测,二者符合率为75%,对超市同类食品检测,二者符合率为62.5%;对超市熟食检测时,二者符合率为93.75%。结论:与市售3M Petrifi lmTM检测方法相比,LM-FTP检测试纸制备简单,操作便捷,较3M PetrifilmTM的24 h报告结果更节省时间,但在检测灵敏度方面有一定差距,尚需进一步研究改进。
单增李斯特菌;酶底物法;快速检测试纸
单增李斯特菌(Listeria monocytogenes)是常见的食源性致病菌,它已于2002年被世界卫生组织列为第四大重要的食源性致病菌[1]。单增李斯特菌广泛存在于自然界中,主要是通过污染乳制品、畜禽产品、生熟肉、蔬菜引起发病[2-4]。人和动物误食后可引起胃肠炎、败血症等,对免疫力低下者如肿瘤、艾滋病的更容易引起感染[5-10]。据美国疾病预防与控制中心报道,全美国每年有2 000多例严重的病症是由单增李斯特菌引起的[11],国内目前还没有相关报道[12],但是张淑红等对河北省2005—2013年食品中检出了单增李斯特菌[13]。李斯特菌病的死亡率可达20%~70%[14-16]。
纵观各国单增李斯特菌检测技术,主要包括传统的生化培养技术、免疫学检测技术、液相色谱技术以及分子生物学技术等。传统的生化培养技术主要包括:增菌、分离和鉴定3 个环节,因此耗时、耗力,常需要6~7 d出结果[17]。免疫学检测技术以抗原抗体免疫为基础,制备特异性克隆抗体检测细菌,具有高特异、快速的特点得到青睐,但抗体种类繁多,对专业技术人员和仪器设备依赖程度高。分子生物学检测技术研究热点是有碱基配对原理的核酸探针杂交技术、快速扩增目的基因为检测原理的聚合酶链式反应技术等[18],具有灵敏度高、特异性好等优点,但所需仪器昂贵,对实验室条件要求高,难以满足畜产品生产一线对食源致病微生物的源头检测需求,特别是我国欠发达地区的现场检测需求问题更加凸显。由于我国鲜少有与本研究原理相关的检测技术,因此,拟采用美国3M公司生产的3M PetrifilmTM和本室制备的LM-FTP检测试纸进行检测效果比对实验,以期研发出具有自主知识产权的单增李斯特菌便捷检测技术。
1 材料与方法
1.1材料与菌株
牛肉、鸡肉、羊肉、散称鲜牛乳、青菜等 市购;国产品牌纯牛奶、牛肉、培根肉、三文鱼、火腿、鸡腿肉、精腿肉、蛋黄、矿泉水、纯净水等来自超市的熟食和瓶装水。
标准单增李斯特菌CICC21633菌株、沙门氏菌菌株、大肠杆菌菌株 中国工业微生物菌种保藏管理中心;金黄色葡萄球菌 新疆农业大学微生物实验室分离鉴定并保存。
1.2试剂与仪器
脑心浸液培养基(CM917)、脑心浸液琼脂(CM918) 北京陆桥技术有限责任公司;营养肉汤、营养琼脂 北京奥博星生物技术有限责任公司;氯化钠天津市盛奥化学试剂有限公司;单增李斯特菌检测试纸本实验室自制;Whatman滤纸 英格兰梅德斯国际滤纸有限公司;环境单增李斯特菌检测试纸片 美国3M公司。
电热恒温培养箱 长沙市西区起重电器厂;SJ-CJ-2F型双人双面净化工作台 苏州净化设备有限公司;DHG-9140A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;PHS-3C数字式pH计 上海精贤光电科技有限公司;紫外-可见光分光光度计 德国Eppendorf公司;PL203电子天平 梅勒特-托利多仪器(上海)有限公司;优普系列超纯水机 成都超纯科技有限公司。
1.3方法
1.3.1单增李斯特菌检测试纸制备
根据单增李斯特菌产生的酶遇其底物显色的原理,采用单因素试验[19]对最佳底物浓度、pH值、反应时间、反应温度等进行筛选,将筛选出的最佳条件再采用正交试验设计[20]进行单增李斯特菌检测最佳显色反应条件的优化筛选。将Whatman滤纸裁剪成长×宽为4 cm×1 cm的试纸条,高压灭菌,无菌操作包被底物,制备成单增李斯特菌检测试纸(LM-FTP)(已经申请专利,专利受理号:201510274726.9),见图1,4 ℃密封保存。
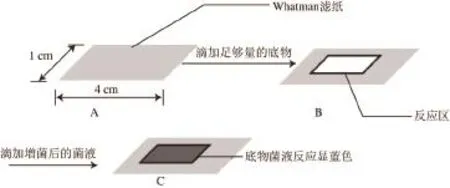
图1 1LMLM-FTP制备示意图Fig.1 Scheme of LM-FTP preparation
1.3.2样品前处理
将待检水样、肉样、乳样等按GB 4789.30—2010《食品微生物学检验:单核细胞增生李斯特氏菌检验》[21]进行样品的前处理。实验前将高压过的剪刀、平皿、镊子等试验器材放入无菌操作台内进行紫外照射。然后用灭菌后的剪刀在操作台内取肉样25 g进行剪碎,将剪碎好的样品转入盛有225 mL生理盐水的锥形瓶内进行1∶10混匀并用无菌封口膜进行封口,为了充分混匀肉样和生理盐水还需要手动混匀并且标记。乳样和水样是用1 mL的移液枪吸取25 mL与生理盐水进行1∶10混匀最后再将锥形瓶放置37 ℃电热恒温培养箱内培养24 h。
1.3.3样品增菌
24 h后取出锥形瓶,在无菌操作台内,用枪吸取1 mL样品处理液加入9 mL脑心浸液培养基内并轻轻混匀,在37 ℃恒温摇床上,以180~190 r/min的转速,振荡培养5 h。
1.3.4单增李斯特菌检测试纸特异性检测
将鉴定完全的沙门氏菌、大肠杆菌及金黄色葡萄球菌进行增菌后,滴加在LM-FTP检测试纸上,同时用单增李斯特菌显色结果做对比,从而确定LM-FTP的特异性。
1.3.5单增李斯特菌检测试纸灵敏度检测
按照2、4、10、100 倍的比例将增菌培养后的单增李斯特菌进行倍比稀释,取稀释好的菌液滴加到LM-FTP上,并对其灵敏度与3M Petrifi lmTM灵敏度对比研究。
1.3.6单增李斯特菌检测试纸的检测
37 ℃恒温摇床振荡培养5 h后移出离心管,进行检测。每平皿内放3 片LM-FTP检测试纸,滴加富集5 h后的菌液。结果判定:观察显色反应,若显蓝色,判定为单增李斯特菌阳性结果,不显蓝色则判定为阴性。
1.3.7环境单增李斯特菌检测试纸片的检测
按照3M PetrifilmTM的说明书进行操作,用1 mL的移液器吸取3 mL富集5 h后的菌液,垂直均匀的滴加在测试片中央,静置10 min,以使胶体凝固。每个样品增菌液滴加2 片测试片,以做重复。同时做1 片阴性对照测试片。置于37 ℃恒温培养箱培养24 h。结果判定:观察紫红色菌落的存在与否,若测试片上出现紫红色菌落,则表示检出单增李斯特菌;若测试片上未出现紫红色菌落,则表示未检出单增李斯特菌。
1.3.8符合率计算

2 结果与分析
2.1单增李斯特菌检测试纸特异性检测结果由表1和图2判定结果:只有单增李斯特菌显蓝色,

表1 1LM-FTP特异性检测结果Table1 Specificity of LM-FTP


图2 2LM-FTP特异性检测结果Fig.2 Specificity of LM-FTP
其他的3 株菌不显色,特异性100%。
2.2单增李斯特菌检测试纸灵敏度检测结果
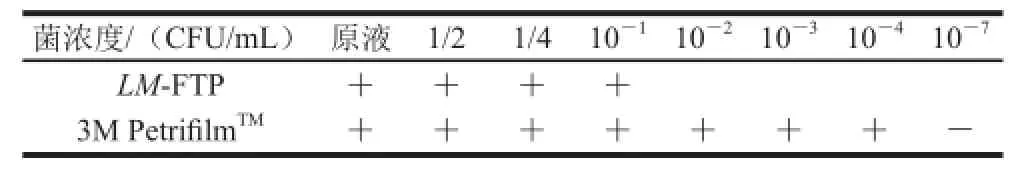
表2 LM-FTP灵敏度检测结果Table2 Sensitivity of LM-FTP

图3 3LMLM-FTP灵敏性检测结果Fig.3 Sensitivity of LM-FTP

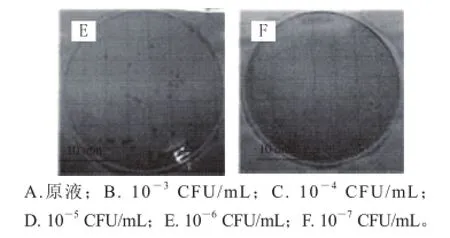
图4 3MPetrifilmTM灵敏性检测结果Fig.4 Sensitivity of 3M PetrifilmTM
由表2和图3、4结果得知,LM-FTP的检测最低限为2.1×104CFU/mL,3M Petrifi lmTM检测最低限为1 CFU/mL。
2.3农贸市场和超市畜产品结果
本实验室自制LM-FTP与3M Petrifi lmTM的检测符合率比较表明,农贸市场畜产品及蔬菜检测符合率为75%,而超市同类食品检测符合率为62.5%。

表3 农贸市场与超市畜产品样品检测结果比较Table3 Comparison of results obtained using LM-FTP and 3M PetrifilmTM for the detection of samples collected from farmer s market and supermarket
如图5~7所示,LM-FTP检测到单增李斯特菌,则试纸片显蓝色(图中均未显示颜色,下同);反之,试纸片不显色。3M PetrifilmTM检测片检测到单增李斯特菌则会出现紫红色菌落;反之,则未出现紫红色菌落。
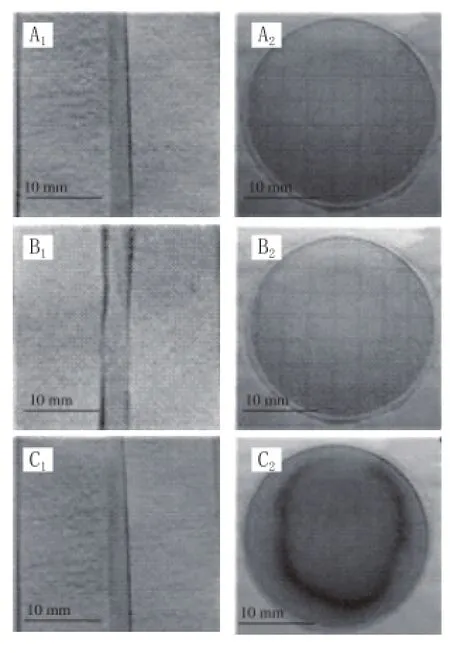
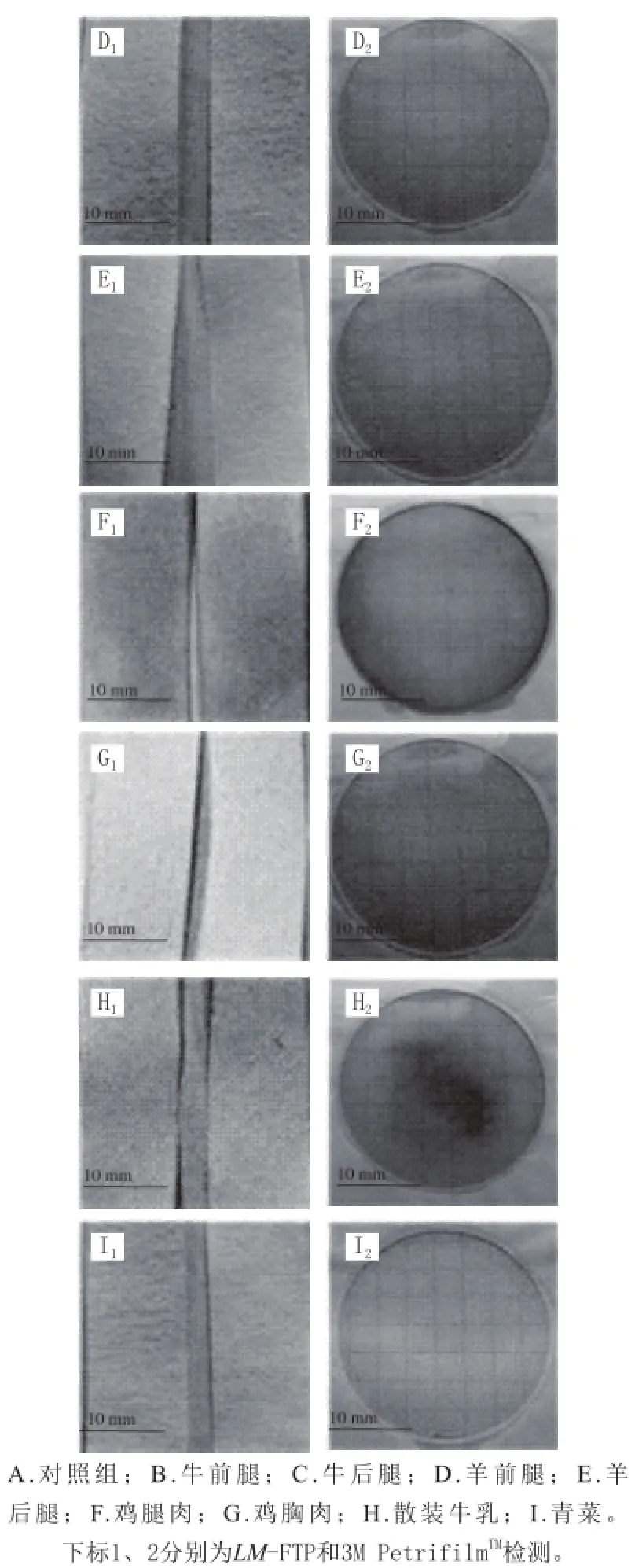
图 5 农贸市场LM-FTP和3M PetriffiilmTM检测结果Fig. 5 Results of LM-FTP and 33MM PetrifilmTMfor samples collected from farmer’s market

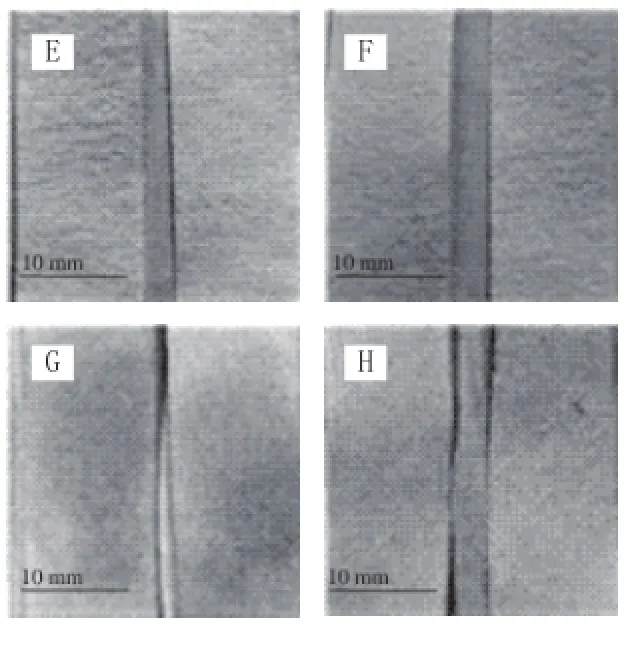
图6 超市畜产品LM-FTP检出结果Fig.6 Results of LM-FTP detection for livestock samples collected from supermarket

图7 超市畜产品3M PetrifilmTM检出结果Fig.7 Results of 3M PetrifilmTMdetection for livestock samples collected from supermarket
2.4超市熟食检测结果
LM-FTP与3M PetrifilmTM在对超市熟食检测检测结果对比结果发现,二者的符合率为93.75%(表4)。LMFTP与3M Petrifi lmTM具体检测结果如图8、9所示。

表4 超市熟食检测结果对比Table4 Comparison of results obtained using LM-FTP and 3M PetrifilmTMfor the detection of supermarket delis

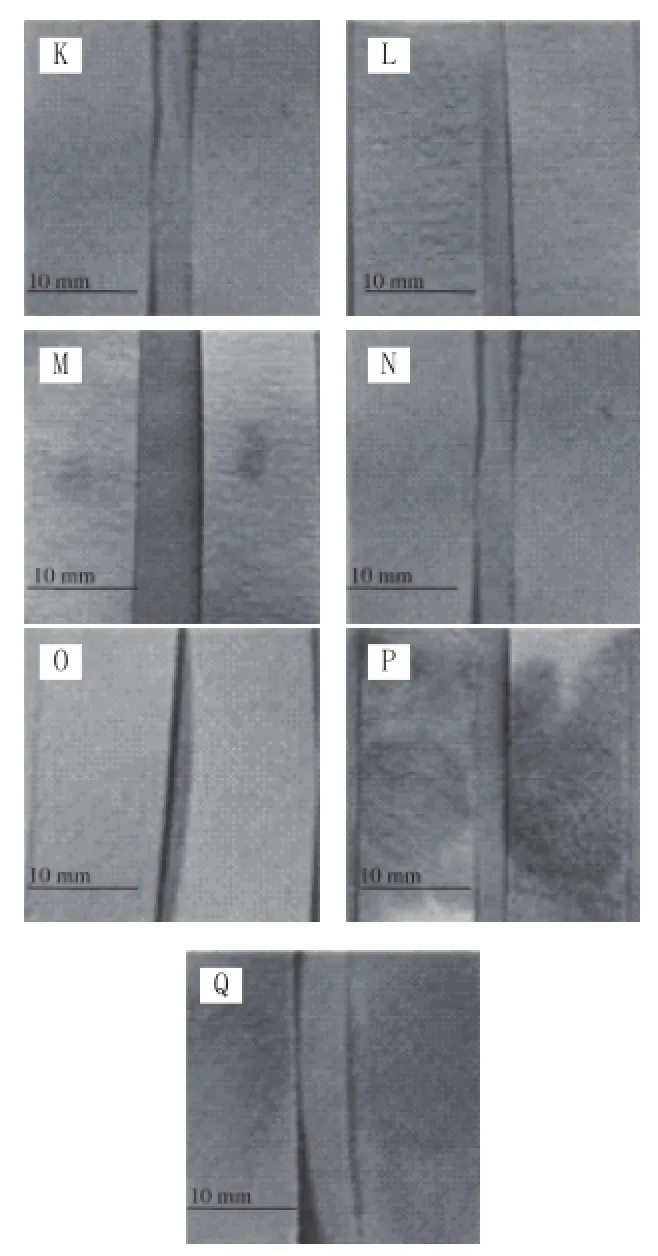
图8 超市熟食LM-FTP检测结果Fig.8 Results of LM-FTP detection for supermarket delis

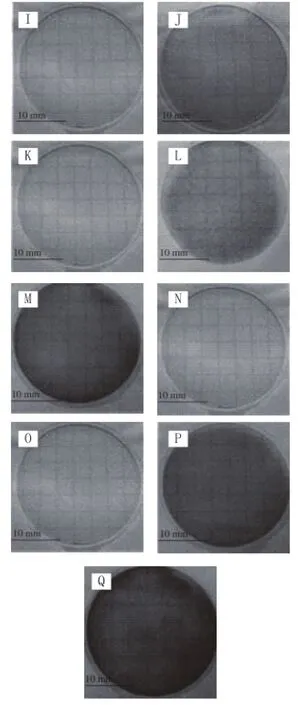
图9 超市熟食3M PetrifilmTM检测结果Fig.9 Results of 3M PetrifilmTMdetection for supermarket delis
3 讨 论
目前,单增李斯特菌是李斯特属中唯一引起人和动物患病的一种食源性致病菌[22],因此能够实现对该菌的快速检测技术我国食品安全控制的首要任务之一。崔焕忠等[23]研究的胶体金检测试纸检测食品中单增李斯特菌而制备的特异性抗体,具有快速、特异性强等特点,但是单抗制备昂贵,所以进行食品样品检测费用较高,同时该技术对食品中单增李斯特菌检测最低限为3.9×105CFU/mL,而LM-FTP的检测限为2.1×104CFU/mL,相比较而言,LM-FTP灵敏度较高,能够满足食品中单增李斯特氏菌检测的需要。分子生物学检测中李敏等[24]用免疫磁珠分离PCR方法对食品中单增李斯特菌快速检测,具有极好的特异性、灵敏性,但存在所需仪器设备昂贵且对操作技术要求高等缺陷,在食品样品中无法实现大批量的检测。毛燕等[25]将免疫磁珠技术与显色培养基相结合检测牛乳中的单增李斯特菌的实验结果准确、直观,但是需要4~7 d报告结果,不利于快速检测。
美国、欧盟等发达国家对单增李斯特菌快速检测方法已经相对成熟,已开发出各种快检系统和自动化仪器,流式细胞技术只需要1 min即可完成定量分析,但仪器投入昂贵,提高了检测成本[14]。目前市场上较实用的3M PetrifilmTM试纸片,需要依赖国外进口,且价格平均45~50 元。而我国对单增李斯特菌研究的经验和方法起步相对较晚[26],从而表明我国自主研发快速检测技术的必要性。
本实验室研制的试纸是利用单增李斯特菌合成酶遇特异的底物产生肉眼可见的显色反应,完成对该菌的快速检测,无需任何仪器即可判定结果,简化了操作步骤,也减少了专业技术人员的指导。LM-FTP前期制备的理念来自微流控芯片技术,它是以纸张作为材料,具有质量轻、易储藏、便于销毁、价格低廉等优点。LM-FTP只需要滴加液体40 μL,并且显色结果可以长期保存。LM-FTP的研制有利于食品生产一线,特别是偏远地区检测技术薄弱地方进行食源性致病微生物的初步普查与检测,为食品中单增李斯特菌污染控制提供便捷技术支撑。然而,由于LM-FTP与3M Petrifi lmTM检测试纸比较而言,在熟食品检测中符合率较高,达到93.75%,但在农贸市场畜产品及蔬菜检测符合率为75%,而超市同类食品检测符合率为62.5%,尚存在较大差距,其主要原因可能在于熟食是经过高温灭菌环节,而单增李斯特菌是不耐37 ℃高温的,证明熟食中含菌量低,LM-FTP和3M PetrifilmTM都不能检测出,仍需要对LM-FTP的灵敏度进一步研究改进。
4 结 论
与市售3M PetrifilmTM检测方法相比,本实验室自制的LM-FTP制备简单,操作便捷,从增菌培养到报告结果时间短,只需要5.5 h,即可呈现肉眼可见的显色反应,较3M PetrifilmTM24 h报告结果更节省时间。但与市售3M PetrifilmTM相比,在检测灵敏度方面尚需进一步研究改进提高。
[1] 石磊, 王文燕, 闫鹤. 猪肉中单核细胞增生李斯特菌的分离与耐药性研究[J]. 现代食品科技, 2013, 29(12): 2826-2829.
[2] 龚云伟, 郭宏. 食品中单增李氏菌污染的调查[J]. 现代预防医学, 2007, 34(10): 1902-1903. DOI:10.3969/j.issn.1003-8507.2007.10.039.
[3] KRAMARENKO T, ROASTO M, MEREMAE K, et al. Listeria monocytogenes prevalence and serotype diversity in various foods[J]. Food Control, 2013, 30(1): 24-29. DOI:10.1016/ j.foodcont.2012.06.047.
[4] BOUAYAD L. HAMDI T M. Prevalence of Listeria spp. in ready to eat foods (RTE) from Algiers (Algeria)[J]. Food Control, 2012, 23(2):397-399. DOI:10.1016/j.foodcont.2011.08.006.
[5] 贾艳艳, 何雷, 郁川, 等. 洛阳地区鸡肉中单增李斯特菌毒力基因的分布研究[J]. 河南农业科学, 2015, 44(1): 135-138.
[6] HAMON M, BIERNE H, COSSART P. Listeria monocytogenes: a multifaceted model[J]. Nature Reviews Microbiology, 2006, 4(6): 423-434. DOI:10.1038/nrmicro1413.
[7] RUCKERL I, MUHTEREM-UYAR M, MURI-KLINGER S, et al. Listeria monocytogenes in a cheese processing facility: learning from contamination scenarios over three years of sampling[J]. International Journal of Food Microbiology, 2014, 189(1): 98-105.
[8] ALTHAUS D, LEHNER A, BRISSE S, et al. Characterization of Listeria monocytogenes strains isolated during 2011-2013 from human infections in Switzerland[J]. Foodborne Pathogens and Disease, 2014, 11(10): 753-758.
[9] 丁建英, 韩剑众. 食品中单增李斯特菌的存在现状及检测方法研究进展[J]. 食品研究与开发, 2008, 29(12): 171-174. DOI:10.3969/ j.issn.1005-6521.2008.12.050.
[10] MONTERO D, VIDAL R, VIDAL M, et al. Molecular epidemiology and genetic diversity of Listeria monocytogenes isolates from a wide variety of ready-to-eat foods and their relationship to clinical strains from listeriosis outbreaks in Chile[J]. Frontiers in Microbiology, 2015, 6(1): 384.
[11] DALTON C B, AUSTIN C C, SOBEL J, et al. An outbreak of gastroenteritis and fever due to Listeria monocytogenes in milk[J]. New England Journal of Medicine, 1997, 336(2): 100-105. DOI:10.1056/NEJM199701093360204.
[12] 马弋, 邵翠翠, 杨乐天, 等. 单增李斯特氏菌核酸层析检测试剂盒在食品检测中的应用[J]. 公共卫生与预防医学, 2015, 26(1): 109-110.
[13] 张淑红, 侯凤伶, 关文英, 等. 2005-2013年河北省即食食品中单增李斯特菌污染及耐药特征研究[J]. 中国食品卫生杂志, 2014, 26(6):596-599.
[14] 华晓芳, 黄雪松. 食品中单增李斯特菌的检测新技术[J]. 食品科技, 2007, 32(6): 230-232. DOI:10.3969/j.issn.1005-9989.2007.06.069.
[15] 陶文靖. 李斯特菌检验及快检技术[J]. 质量与认证, 2015, 6(1): 66-67.
[16] 何景, 程楠, 许文涛. 食品微生物新型快速筛查技术研究进展[J].食品科学, 2015, 36(13): 288-293. DOI:10.7506/spkx1002-6630-201513053.
[17] 郭桂萍, 葛红梅, 王匀, 等. 单增李斯特菌检测技术研究进展[J]. 中国食物与营养, 2011, 17(3): 12-15. DOI:10.3969/ j.issn.1006-9577.2011.03.003.
[18] 付瑞燕, 周阳, 祝长青. 食品中单增李斯特菌检测技术研究进展[J].安徽农业大学学报, 2012, 39(6): 940-943.
[19] 刘园园. 沙门氏菌、金黄色葡萄球菌及单增李斯特菌的同步快速检测方法的研究[D]. 广州: 华南理工大学, 2010.
[20] 徐金亭. 免疫磁珠的制备及其富集、分离单增李斯特菌的研究[D].深圳: 暨南大学, 2011.
[21] 卫生部. GB 4789.30—2010 食品微生物学检验: 单核细胞增生李斯特氏菌检验[S]. 北京: 中国标准出版社, 2010.
[22] 李敏, 孟瑾, 郑小平, 等. IMS-PCR对食品中单增李斯特菌快速检测[J]. 乳业科学与技术, 2010(3): 131-134. DOI:10.3969/ j.issn.1671-5187.2010.03.009.
[23] 崔焕忠, 张辉, 王兴龙. 胶体金试纸快速检测食品中单增李斯特菌[J].食品科学, 2010, 31(4): 239-242.
[24] 曹玮, 王宁, 王晓英, 等. 单增李斯特菌PCR-ELISA快速检测技术研究[J]. 卫生研究, 2009, 38(6): 662-666.
[25] 毛燕, 黄小林, 许恒毅, 等. 免疫磁分离技术在食源性单增李斯特菌检测中应用的研究进展[J]. 食品工业科技, 2015, 36(8): 351-355.
[26] 黄敏欣, 钱敏, 赵文红, 等. 肉及肉制品中单增李斯特菌的研究进展[J]. 肉类工业, 2015(3): 45-49. DOI:10.3969/ j.issn.1008-5467.2015.03.014.
Preparation and Applicability of a Simple and Fast Test Strip to Detect Listeria monocytogenes
ZHENG Xiaofeng1, HAN Yong2, LIU Yingyu1, ZHANG Juntao1, ZHANG Qi1, ZHANG Xiaohong1, YAO Gang1,*
(1. College of Veterinary Medicine, Xinjiang Agricultural University, Ürümqi 830052, China;2. Ürümqi Station of Animal Husbandry and Pasture of Xinjiang Province, Ürümqi 830000, China)
Purpose: In the present study, a paper-based test strip for the fast and simple detection of foodborne L. monocytogenes (LM) was prepared and named as LM-FTP (Patent Acceptance Number: 201510274726.9), and its performance was evaluated. Methods: The performance evaluation was carried out in comparison with 3M Petrifi lmTMby using them to detect samples of meat, milk, drinking water and vegetable collected from farmer's market and supermarket. Results: The specifi city of LM-FTP was 100% with a limit of detection of 2.1 × 104CFU/mL, and the detection process from bacterial enrichment to obtainment of analytical results took about 5.5 hours. Both LM-FTP and 3M Petrifi lmTMcould enable the detection of the samples we tested. The coincidence rate between the results obtained using LM-FTP and 3M Petrifi lmTMfor the detection of livestock products and vegetables from farmer's market was about 75%, whereas that for those from supermarket was about 62.5%. In addition, the coincidence rate between the results of both methods for supermarket delis was about 93.75%. Conclusions: LM-FTP is simpler to prepare, easier to use, and time saving compared with 3M Petrifi lmTM, but it was inferior to 3M Petrifi lmTMin terms of sensitivity. Therefore, LM-FTP remains to be further improved.
Listeria monocytogenes; enzyme substrate method; rapid test strip
10.7506/spkx1002-6630-201620033
S852.612
A
1002-6630(2016)20-0191-07
郑晓风, 韩勇, 刘英玉, 等. 单增李斯特菌便捷检测试纸的制备及检测效果[J]. 食品科学, 2016, 37(20): 191-197.
DOI:10.7506/spkx1002-6630-201620033. http://www.spkx.net.cn
ZHENG Xiaofeng, HAN Yong, LIU Yingyu, et al. Preparation and applicability of a simple and fast test strip to detect Listeria monocytogenes[J]. Food Science, 2016, 37(20): 191-197. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620033. http://www.spkx.net.cn
2016-02-01
新疆维吾尔自治区高技术发展计划项目(201411105);新疆维吾尔自治区研究生教育创新计划-新疆研究生科研创新项目(XJGRI2015093)
郑晓风(1991—),女,硕士研究生,研究方向为畜产品质量安全。E-mail:1439831292@qq.com
姚刚(1959—),男,教授,博士,研究方向为动物生长发育调控及畜产品质量安全。E-mail:yaogang516@163.com
