大籽蒿精油化学成分及其抗菌抗氧化活性
2016-11-07李海亮陈海魁徐福利王渭玲李继霖
李海亮,陈海魁,徐福利,3,,王渭玲,李继霖
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.北方民族大学生物科学与工程学院,宁夏 银川 750021;3.中国科学院水利部水土保持研究所,陕西 杨凌 712100;4.西北农林科技大学生命科学学院,陕西 杨凌 712100)
大籽蒿精油化学成分及其抗菌抗氧化活性
李海亮1,陈海魁2,*,徐福利1,3,*,王渭玲4,李继霖4
(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.北方民族大学生物科学与工程学院,宁夏 银川 750021;3.中国科学院水利部水土保持研究所,陕西 杨凌 712100;4.西北农林科技大学生命科学学院,陕西 杨凌 712100)
采用水蒸气蒸馏法提取采自西藏地区藏药大籽蒿的精油,通过气相色谱-质谱联用技术分析鉴定其化学成分,采用峰面积归一化法确定各成分的相对含量;并对大籽蒿精油体外抑菌能力和抗氧化能力进行测定。大籽蒿精油中共鉴定48 种化合物,占精油总量的95.36%,主要成分为红没药醇、兰香油奥、α-水芹烯、棕榈酸和薰衣草醇等;体外抑菌结果表明,大籽蒿精油对枯草芽孢杆菌、粪肠球菌、金黄色葡萄球菌和新型隐球菌具有较强的抑菌效果,而对大肠杆菌具有较弱抑菌效果;体外抗氧化活性结果表明大籽蒿精油对1,1-二苯基-2-三硝基苯肼自由基、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基和羟自由基具有一定的的清除能力,且清除效果强于VC。关键词:大籽蒿;精油;抗氧化活性;抑菌活性
蒿属(Artemisia L.)为菊科一、二年生或多年生草本植物,全球约有500余种,我国有180余种[1-2],各省均有分布;西藏分布有57 种,6变种,其中15 种为西藏特有种。蒿属在我国为一种“药食两用”的民族传统中药材,具有清热解毒、抗菌消炎、祛风除湿、通经活络、活血、止血、抗艾滋病等功效[3-7]。
精油也称挥发油,不同植物的精油具有不同的功效,如:薰衣草精油可用于治疗感冒、鼻窦炎和鼻喉黏膜炎;蒿属植物和茶树精油具有较强的抑菌和驱虫作用;柴胡精油所制备的注射液具有退热作用;丁香精油有局部麻醉止痛作用;薄荷精油可用于治疗应激性肠综合征、非溃疡性消化不良和神经性头痛[8-9]。蒿属植物富含挥发油,其中含有萜烯类、酯类、醇类等化学物质,具有较强的生物活性。研究表明蒿属植物精油对金黄色葡萄球、表皮葡萄球菌、大肠杆菌、新型链球菌等具有较强的抑菌作用,且具有很强的体外抗氧化作用[10-12]。而植物精油独特的作用使它走进人们的日常生活,人们利用薰灯或薰炉将精油挥发出来,达到净化空气的目的,且要比使用市售香水更利于健康;而作为一天然香料原料,茴香油、肉桂皮油和白兰油等70多种植物精油广泛用于日化工业。
大籽蒿(Artemisia sieversiana)藏语称“坎巴”,全株或地上部分供药用、食用。研究表明大籽蒿具有抗缺氧、抗癌的作用;在高原地区大籽蒿可用于治疗紫外线辐射所引起的灼伤[13]。刘群等[14]研究表明,采自于长春地区的大籽蒿地上部分精油中主要化学成分为1,8-桉叶油素、丁香烯、丁香烯和樟脑;但樟脑对人体肝、肾、神经系统均具有较强的毒性。Vasylievna等[15]研究发现分布于俄罗斯布里亚特地区的大籽蒿地上部分精油中主要成分为兰香油奥,大根香叶烯D、红没药醇、neryl-3-methylbutanoate和neryl-2-methylbutanoate等。可见植物精油化学成分因环境的不同其中化学成分差异极大。
西藏因其高海拔、低氧的特殊环境使得植物的化学成分产生多样化,而目前笔者鲜见到国内外关于西藏高原生境中大籽蒿精油化学成分分析和精油生物活性的相关研究。本实验采用水蒸气蒸馏法提取采自西藏地区的大籽蒿全株精油,采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术分析鉴定大籽蒿精油化学成分,并对其体外抑菌活性、抗氧化活性进行测定,以期为合理开发、利用大籽蒿这一民族传统中药资源提科学依据。
1 材料与方法
1.1材料、试剂、菌种与仪器
大籽蒿于盛花期(2014年9月末至10月初)采自于西藏拉萨地区,经甘肃省张掖市河西学院高海宁副教授鉴定为大籽蒿(Artemisia sieversiana)干燥全株。
C8~C24正构烷烃标准品、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)diammonium salt,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;VC(分析纯) 上海阿拉丁试剂公司;氨苄青霉素(ampicillin,AMP)、吐温-280、胰蛋白胨、酵母提取物、氢氧化钠、氯化钠、无水乙醇、无水硫酸钠、水杨酸、硫酸亚铁、磷酸二氢钾、磷酸氢二钠、氯化钾等均为国产分析纯。
枯草芽孢杆菌(B. s u b t i l i s)、大肠杆菌(E. coli)、粪肠球菌(E. faccalis)、金黄色葡萄球菌(S. aureus)、新型隐球菌(C. neoformans) 北京北纳创联生物技术公司。
KDM调温电热套 山东邺城华鲁电热仪器有限公司;Voyager型GC/MS联用仪 美国Finnigan公司;Clevenger type蒸馏装置 实验室组装;722S分光光度计、FA2104N电子天平 上海精密科学仪器有限公司。
1.2方法
1.2.1大籽蒿精油的提取
将采集的新鲜植物材料去杂后阴干;称量取适量植物材料用Clevenger type蒸馏装置(含直型冷凝管、油水分离器等)蒸馏3~4 h时,至精油馏出量不再增加;收集油水分离器中上层的油层,得到具有特殊香气的大籽蒿精油,用无水硫酸钠干燥后于-20 ℃密封保存。
1.2.2GC-MS分析条件
G C条件:A g i l e n t H P-5石英毛细管柱(30 m×0.25 mm,0.25 μm);载气:高纯氦气;载气压力:0.25 MPa;分流进样,分流比:10∶1;流速:1.0 mL/min;进样量:1 μL;进样口温度:250 ℃;起始温度60 ℃,保留2 min,以10 ℃/min升温至250 ℃维持10 min至分析完成。
MS条件:离子源:电子电离源;离子温度:200 ℃;电子能量:07 eV;灯丝电流:80 μA;扫描范围:41~450 u;扫描间歇:0.5 s。
1.2.3体外抑菌检测
菌悬液的制备[16]:菌株经活化后接种于液体Luriabertani(LB)培养液中,37 ℃,200 r/min振荡培养隔夜(12 h)后接种于新LB培养液中,37 ℃、150 r/min培养至OD600nm值为0.3;按1∶50的比例,用液体LB培养基稀释为浓度约为107CFU/mL的菌悬液。
大籽蒿精油抑菌剂的制备[17]:植物精油以LB培养液(含0.5%吐温280)为溶剂,按8∶92(V/V)配成大籽蒿精油溶液;最高质量浓度视大籽蒿精油溶解度进行调整(精油须完全溶解,精油实际最高实验质量浓度为20 μg/mL)。
最低抑菌浓度(minimum inhibitory concentration,MIC)的测定[18]:利用微量稀释法测定植物精油MIC,略作改动。每孔加入100 μL的液体培养基,再加入100 μL相应的精油抑菌剂,最后加入100 μL菌悬液(每孔菌量为106CFU/mL)。37 ℃培养24 h,观测细菌的生长情况,以无菌落生长的最低浓度为MIC,以LB培养液作空白对照、AMP(最高质量浓度250 μg/mL)作阳性对照、菌液作阴性对照。每个菌种设3 个重复,MIC取平均值。
1.2.4抗氧化活性测定
1.2.4.1DPPH自由基清除能力测定
参考王茜等[19]方法,略作改动。用无水乙醇配制质量浓度分别为20、50、100、150、200 μg/mL的大籽蒿精油溶液,配制同样质量浓度的VC溶液作为对照样品溶液。取1 mL样品溶液和1 mL浓度为2×10-4mol/L的DPPH溶液,混匀后室温暗反应30 min,以无水乙醇作参比,测定517 nm波长处的吸光度A,同样测定1 mL样品溶液与1 mL无水乙醇混合后517 nm波长处的吸光度A0,再测定1.0 mL DPPH溶液与10 mL无水乙醇混合液在517 nm波长处的吸光度A1(重复3 次),按式(1)计算清除率:
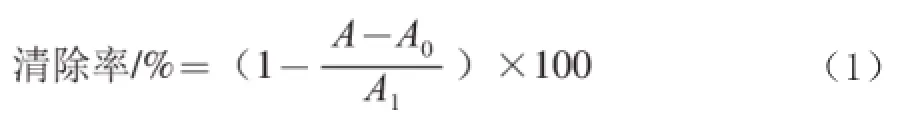
1.2.4.2ABTS+·清除能力测定
参照Cristina等[20]方法配制2 mmol/L ABTS溶液,吸取50 mL ABTS溶液与200 mL 70 mmol/L K2S2O8溶液混合,室温避光放置12~16 h后得ABTS+·溶液。用磷酸缓冲液(phosphate buffered saline,PBS,pH 7.0~7.2)将A B T S+·溶液稀释至在7 3 4 n m波长处吸光度为0.70±0.02。用无水乙醇配制质量浓度分别为20、50、100、150、200 μg/mL的大籽蒿精油溶液,配制同样质量浓度的VC溶液作为对照样品溶液。取0.1 mL样品溶液,加入1.9 mL ABTS+·溶液,在734 nm测其吸光度(重复3 次),按式(2)计算清除率:

式中:A0为ABTS+·溶液的吸光度;A为加大籽蒿精油溶液后的吸光度。
1.2.4.3羟自由基清除能力的测定[21-22]
用无水乙醇配制质量浓度分别为20、50、100、150、200 μg/mL的大籽蒿精油溶液,配制同样质量浓度的VC溶液作为对照样品溶液。取样品溶液2 mL,依次加入1.0 mL 0.01 mol/L FeSO4、1.5 mL 10% H2O2溶液,混匀静置10 min,再加入2 mL 0.01 mol/L水杨酸溶液,混匀后37℃的恒温水浴锅中反应30 min,510 nm波长处测其吸光度。分别以1.5 mL蒸馏水代替双氧水、2 mL无水乙醇代替样品同法测得的吸光度(重复3 次),按式(3)计算清除率:

式中:A0为空白对照液中的吸光度;A1为样品溶液的吸光度;A2为未加过氧化氢溶液样品的吸光度。
大籽蒿精油对DPPH自由基、ABTS+·和羟自由基的半抑制浓度(half maximal inhibitory concentration,IC50)采用SPSS 19.0进行计算。
2 结果与分析
2.1大籽蒿精油化学成分分析
利用GC-MS联用仪计算机NIST-MS谱库自动检索各组分的质谱数据,并对结果参考有关标准图谱和化合物保留指数进行核对和补充检索,经峰面积归一化法计算,得出各组分的相对含量[23]。化合物保留指数(retention index,RI)按式(4)计算:
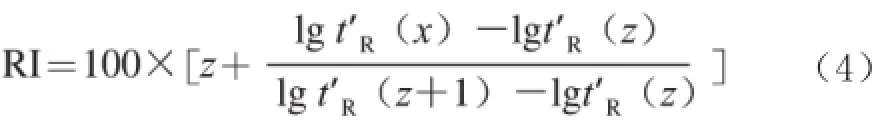
式中:t'R为校正保留时间;z和z+1分别为目标化合物(x)流出前后的正构烷烃所含碳原子的数目。
于上述实验条件下对大籽蒿精油成分用GC-MS法进行分析,得总离子流图,见图1;大籽蒿精油化学成分及其相对含量见表1。由表1可见,大籽蒿精油中共鉴定49 种化合物,占精油总量的95.36%。其中主要化学成分为红没药醇(34.47%)、兰香油奥(23%)、α-水芹烯(5.22%)、棕榈酸(3.85%)、薰衣草醇(3.45%)等。
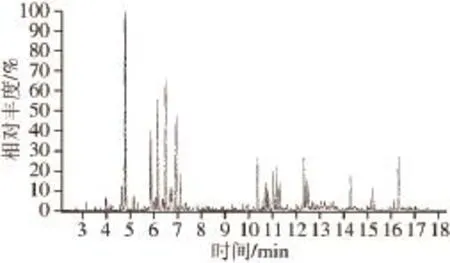
图1 大籽蒿精油成分总离子流图Fig.1 GC-MS total ion current chromatogram of essential oil from A. sieversiana

表1 大籽蒿精油化学成分及含量Table1 Chemical composition of essential oil from A. sieversiana

续表1
2.2大籽蒿精油的抑菌作用
抑菌实验结果的见图2,结果统计见表2,大籽蒿精油因乳化稀释处理后颜色较浅,故大籽蒿精油处理和AMP处理彼此互为背景,抑菌质量浓度梯度抑菌现象以肉眼观察为准。从表2可以看出:供试大籽蒿精油对除E.coli外的其他4 种菌(B. subtilis、E. faccalis、S. aureus、C. neoformans)均有不同程度的抑制作用;供试大籽蒿精油在实验质量浓度内对E.coli抑制作用不明显,而对C. neoformans的抑制作用最明显,MIC为5.5 μg/mL;C. neoformans因属AMP不敏感型,在实验质量浓度内未能起到抑制作用。

图2 大籽蒿精油抑菌效果Fig.2 Antimicrobial effect of the essential oil on different bacteria

表2 大籽蒿精油的MMIICCTable2 MIC values of the essential oil
2.3大籽蒿精油抗氧化活性
2.3.1大籽蒿精油对DPPH自由基的清除作用

图3 大籽蒿精油对DPPH自由基的清除能力Fig.3 DPPH scavenging effect of the essential oil
DPPH是一种人工合成的有机自由基,常用来评估抗氧化物的供氢能力,在有机溶剂中非常稳定[24]。如图3所示,大籽蒿精油对DPPH自由基具有一定的清除能力,VC和大籽蒿精油清除DPPH自由基的IC50分别为56、43 μg/mL,可见样品大籽蒿精油对DPPH自由基清除能力总体强于VC;当大籽蒿精油质量浓度为200 μg/mL时对DPPH自由基清除率达到86.7%。
2.3.2大籽蒿精油对ABTS+·的清除作用
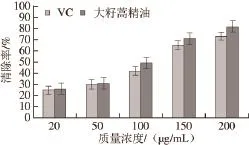
图4 大籽蒿精油对ABBTTSS+·的清除能力Fig.4 ABTS+· scavenging effect of the essential oil
ABTS+·是一种呈蓝绿色相对稳定的水溶性自由基,抗氧化物与ABTS+·反应后使溶液褪色,特征吸光度降低。在该反应体系中溶液褪色越明显则表明所检测物质的总抗氧化能力越强[25]。如图4所示,大籽蒿精油对ABTS+·的清除作用与其质量浓度呈正相关,当大籽蒿精油质量浓度为200 μg/mL时清除率达到82%,高于同质量浓度的VC(73%);大籽蒿精油和VC清除ABTS+·的IC50分别为64、43 μg/mL,可见大籽蒿精油对ABTS+·的清除作用要强于VC。
2.3.3大籽蒿精油对羟自由基的清除作用

图5 大籽蒿精油对羟自由基的清除能力Fig.5 Hydroxyl free radical scavenging effect of the essential oil
从图5可知,在实验质量浓度范围内,大籽蒿精油和VC对羟自由基的清除能力均呈现明显的量效关系,随着质量浓度的增加清除羟自由基的清除能力增大;VC和大籽蒿精油清除羟自由基的IC50分别为89、51 μg/mL,可见大籽蒿精油对羟自由基的清除效果要明显强于VC。当大籽蒿精油质量浓度为200 μg/mL时对羟自由基的清除率达到了78%,要强于同质量浓度的VC。
3 结 论
本实验通过GC-MS技术对西藏地区所产大籽蒿的精油化学成分进行鉴定分析,大籽蒿精油中主要化学成分为红没药醇、兰香油奥、薰衣草醇和α-水芹烯等,其中红没药醇、兰香油奥两种组分总含量占精油总量的一半以上,而在本实验大籽蒿精油中未检测到侧柏酮、樟脑等有毒成分[14-15,26],可见环境因素对大籽蒿精油中化学成分影响很大。现代药理实验表明红没药醇具有抗炎、灭菌、愈合溃疡、溶解胆石等作用,在医药行业中具有广泛的的用途[27];兰香油奥则具有明显的体内抗炎能力[28]。
大籽蒿精油体外抑菌实验表明:大籽蒿精油对枯草芽孢杆菌、粪肠球菌、金黄色葡萄球菌和新型隐球菌均具有较强的抗菌能力,且抑菌效果强于AMP;而供试大籽蒿精油对大肠杆菌的抑菌能力较其他菌较弱。大籽蒿精油体外抗氧化活性实验表明大籽蒿精油对DPPH自由基、ABTS+·和羟自由基的IC50均低于VC,说明大籽蒿精油具有较强的体外抗氧化能力,且抗氧化作用要强于VC。
综上所述可见西藏地区所产大籽蒿及其精油可以作为一种较为安全的抑菌药材和天然抗氧化物来源,在食品、饲料、医疗中具有广泛的开发潜力。
[1] PELLICER J, GAMATJE T, MOLERO J, et al. Origin and evolution of the south American endemic Artemisia species (Asteraceae):evidence from molecular phylogeny, ribosomal DNA and genome size data[J]. Australian Journal of Botany, 2010, 58(7): 605-616. DOI:10.1071/BT10047.
[2] LIN Y R, HUMPHRIES C J, GILBERT M G, et al. Artemisia[M]// Flora of China. Beijing: Science Press & Missouri Botanical Garden Press, 2011: 6-748.
[3] ZHANG W J, YANG K, YOU C X, et al. Bioactivity of essential oil from Artemisia stolonifera (Maxim.) Komar. and its main compounds against two stored-product insects[J]. Journal of Oleo Science, 2015, 64(3): 299-307. DOI:10.5650/jos.ess14187.
[4] CHOI B R, KUMAR S K, ZHAO C, et al. Additive effects of Artemisia capillaris extract and scopoletin on the relaxation of penile corpus cavernosum smooth muscle[J]. International Journal of Impotence Research, 2015, 27(6): 225-232. DOI:10.1038/ijir.2016.1.
[5] KIM W S, CHOI W J, LEE S, et al. Anti-inflammatory, antioxidant and antimicrobial effects of artemisinin extracts from Artemisia annua L.[J]. Korean Journal of Physiology and Pharmacology Official Journal of the Korean Physiological Society and the Korean Society of Pharmacology, 2015, 19(1): 21-27. DOI:10.4196/kjpp.2015.19.1.21.
[6] MA C M, NAKANURA N, HATTORI M. Inhibitory effects on HIV-1 protease of tri-p-coumaroylspermidine from Artemisia caruifolia and related amides[J]. Chemical and Pharmaceutical Bulletin, 2001, 49(7):915-917. DOI:10.1248/cpb.49.915.
[7] 陈世林, 林余霖. 中草药大典[M]. 北京: 军事医学科学出版社, 2006.
[8] 张应烙, 尹彩萍, 赖伟明, 等. 井冈山47 种植物提取物对几种病原菌的生物活性[J]. 江苏农业科学, 2005(4): 51-53. DOI:10.3969/ j.issn.1002-1302.2005.04.017.
[9] 派翠西亚·戴维斯. 芳香宝典: 芳香疗法二[M]. 北京: 东方出版社, 2004.
[10] MARINAS I C, OPREA E, CHIFIRIUC M C, et al. Chemical composition and antipathogenic activity of Artemisia annua essential oil from Romania[J]. Chemistry and Biodiversity, 2015, 12(10):1554-1564. DOI:10.1002/cbdv.201400340.
[11] ANAYA-EUGENIO G D, RIVERO-CRUZ I, BYE R, et al. Antinociceptive activity of the essential oil from Artemisia ludoviciana[J]. Journal of Ethnopharmacology, 2016, 81(11): 403-411. DOI:10.1016/ j.jep.2016.01.008.
[12] ABU-DARWISH M S, CABRAL C, GONCALVES M J, et al. Artemisia herba-alba essential oil from Buseirah (South Jordan):chemical characterization and assessment of safe antifungal and antiinflammatory doses[J]. Journal of Ethnopharmacology, 2015, 174:153-160. DOI:10.1016/j.jep.2015.08.005.
[13] 桑吉, 土旦卓玛, 徐福春. 藏药大籽蒿化学成分的研究现状[J]. 西藏科技, 2012(12): 77-78. DOI:10.3969/j.issn.1004-3403.2012.12.033.
[14] 刘群, 邓治邦. 大籽蒿挥发油化学成分的研究[J]. 东北师大学报(自然科学版), 1991(2): 63-66.
[15] VASYLIEVNA Z S, ERDEMOVNA R T, DORZHIEVNA R L, et al. Comparative studies on composition of essential oil in three wormwoods (Artemisia L.) from Buryatia and Mongolia[J]. Journal of Essential Oil-Bearing Plants, 2015, 18(3): 637-641. DOI:10.1080/0972 060X.2014.958547.
[16] MARTINS A P, SALFUEIRO L R, GONCALVES M J, et al. Essential oil composition and antimicrobial activity of Santiria trimera bark[J]. Planta Medica, 2003, 69(1): 77-79. DOI:10.1055/s-2003-37025.
[17] 康文艺, 杨小生. 中型滇丁香抑菌及抗耐药菌株作用的研究[J]. 天然产物研究与开发, 2002(5): 40-42. DOI:10.3969/ j.issn.1001-6880.2002.05.012.
[18] 钱利生. 医学微生物学[M]. 上海: 上海医科大学出版社, 2000.
[19] 王茜, 苟学梅, 高刚, 等. 蓬莪术干叶和鲜叶精油化学成分分析与抗氧化、抑菌活性研究[J]. 食品工业科技, 2015, 36(8): 97-102. DOI:10.13386/j.issn1002-0306.2015.08.011.
[20] CRISTINA D A, RUFIAN-HENARES J A, MORALES F J. Assessing the antioxidant activity of melanoidins from coffee brews by different antioxidant methods[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 7832-7836. DOI:10.1021/jf0512353.
[21] 权美平, 田呈瑞. 茜草精油抗氧化及DNA损伤保护效果[J]. 食品与生物技术学报, 2015(11): 1225-1231.
[22] 莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学, 2006, 27(9): 110-115. DOI:10.3321/j.issn:1002-6630.2006.09.022.
[23] 施钧慧, 汪聪慧. 香料质谱图集[M]. 北京: 中国质谱学会, 1992: 18-221.
[24] 张逸波, 郑文杰, 黄峙, 等. 硒杂环化合物SPO清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(7): 1866-1871. DOI:10.3964/j.issn.1000-0593(2010)07-1866-06.
[25] 郑善元, 陈填烽, 郑文杰, 等. 单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(9): 2417-2423. DOI:10.3964/j.issn.1000-0593(2010)09-2417-07.
[26] 周金沙, 朱良, 李乐, 等. 褐苞蒿挥发油成分及其抗菌活性研究[J].食品与机械, 2014(2): 152-155.
[27] 黄瑞, 张建水, 刘烽, 等. 红没药醇和异红没药醇的合成进展[J]. 上海应用技术学院学报(自然科学版), 2012(2): 141-146. DOI:10.3969/ j.issn.1671-7333.2012.02.014.
[28] SAFAYHI H, SABIERAJ J, SAILER E R, et al. Chamazulene: an antioxidant-type inhibitor of leukotriene B4formation[J]. Planta Medica, 1994, 60(5): 410-413. DOI:10.1055/s-2006-959520.
Chemical Composition, Antimicrobial and Antioxidant Activities of the Essential Oil of Artemisia sieversiana
LI Hailiang1, CHEN Haikui2,*, XU Fuli1,3,*, WANG Weiling4, LI Jilin4
(1. College of Natural Resources and Environment, Northwest A&F University, Yangling 712100, China;2. College of Biological Science and Engineering, Beifang University of Nationalities, Yinchuan 750021, China;3. Institute of Soil and Water Conservation, Ministry of Water Resources, Chinese Academy of Sciences, Yangling 712100, China;4. College of Life Sciences, Northwest A&F University, Yangling 712100, China)
The chemical composition, antimicrobial and antioxidant activities of the essential oil of Artemisia sieversiana, a traditional medicinal herb in Tibet, China, were investigated. A total of 48 components, representing 95.36% of the total oil, were identified by gas chromatography-mass spectrometry (GC-MS), with the main constituents being α-bisabolol, chamazulene, α-phellandrene, palmitic acid and lavandulol. The antimicrobial activities of the oil were evaluated against five microorganisms, Bacillus subtilis, Escherichia coli, Enterococcus faecalis, Staphylococcus aureus and Crytococcus neofonman, respectively. The results showed that the oil possessed inhibitory activity against B. subtilis, E. faccalis, S. aureus and C. neoformans, amon+g which the best inhibition was observed against C. neoforman with a minimum inhibitory concentration (MIC) of 5.5 μg/mL. The oil revealed a relatively stronger scavenging effect on 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS+·) and hydroxyl free radicals in a concentration-dependent way.
Artemisia sieversiana; essential oil; antioxidant activity; antimicrobial activity
10.7506/spkx1002-6630-201620011
R962
A
1002-6630(2016)20-0063-06
李海亮, 陈海魁, 徐福利, 等. 大籽蒿精油化学成分及其抗菌抗氧化活性[J]. 食品科学, 2016, 37(20): 63-68.
DOI:10.7506/spkx1002-6630-201620011. http://www.spkx.net.cn
LI Hailiang, CHEN Haikui, XU Fuli, et al. Chemical composition, antimicrobial and antioxidant activities of the essential oil of Artemisia sieversiana[J]. Food Science, 2016, 37(20): 63-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620011. http://www.spkx.net.cn
2016-01-25
国家民委科研项目(14BFZ005);陕西省科技计划项目(S2014SF4025);河西学院青年教师基金项目(QN2014-20)
李海亮(1982—),男,博士研究生,研究方向为植物营养学和天然产物化学。E-mail:slalihailiang@163.com
陈海魁(1980—),男,讲师,博士,研究方向为植物学。E-mail:haikui2000@hotmail.com
徐福利(1958—),男,研究员,博士,研究方向为植物营养学和生态学。E-mail:xfl@nwsuaf.edu.cn
