ChiTaSBSS1200血液核酸检测系统的分析性能验证
2016-11-06聂湘辉刘丽华胡莅鸿
聂湘辉 刘丽华 胡莅鸿
ChiTaSBSS1200血液核酸检测系统的分析性能验证
聂湘辉 刘丽华 胡莅鸿
广东省河源市中心血站(河源513000)
目的 对ChiTaSBSS1200血液核酸检测系统(简称“ChiTaS”)主要分析性能进行验证,确定该系统是否稳定、准确、可靠。方法 参照美国临床实验室标准化协会(CLSI)相关文件要求,对在ChiTaS上开展的HBV-DNA、HCV-RNA、HIV-RNA项目进行检出限、精密度、准确度及抗干扰等方面验证。结果 ChiTaS分析系统HBV-DNA、HCV-RNA、HIV-RNA最低检出限分别为3.63(3.16~6.26)IU/mL、12.71(10.37~21.63)U/mL、25.49(21.43~37.48)IU/mL;HBV-DNA、HCV-RNA、HIV-RNA阳性样本总变异系数分别为2.56%、1.03%、3.36%;22个阴性样本和10个阳性样本进行8混样模式检测结果为反应性,拆分检测结果:阳性样本符合率100%、阴性样本符合率100%;溶血血浆(血红蛋白含量为5 g/L)、脂肪血浆(甘油三酯大于6.3 mmol/L)对低浓度HBV(6.3 IU/mL)、HCV(23.3 IU/mL)、HIV(47.6 IU/mL)样本检出无显著影响。结论 ChiTaS检出限、精密度、准确度等均达到生产商的检测性能的要求,实验室该系统的检测能力可以满足本血站对无偿献血者样本的常规核酸检测要求。
核酸检测 性能验证
检测系统的分析性能评价是临床检验质量管理的重要内容之一。《血站技术操作规程(2015版)》要求所有血液在进行血清学检测的基础上,必须进行核酸检测。随着血液核酸检测全覆盖工作的推进,如何对血液核酸检测的新设备进行性能验证、有效进行过程监控是很多血站检验科面临的难题。目前核酸检测系统的操作性能和分析性能信息大部分由生产厂家提供,这些参数源自厂家在最佳条件下完成,因此实验室应对各自实验室检测系统重新评价或建立性能参数,才能保证检测结果符合临床应用需求[1]。CAP认可和ISO15189要求对于定量检测性能验证均有详细说明,对于免疫学定性检测性能验证指标尚无明确的行业标准。国内专家认为在定性检测中最重要的性能验证应包括检测的精密度、准确性及最低检出限[2]。本研究参照美国临床实验室标准化协会(CLSI)相关文件要求,从检出限、精密度、准确度率等方面对ChiTaS检测系统进行性能验证:
1 材料与方法
1.1 材料
1.1.1 样本来源 选择本血站2015年1月1日—2016年1月1日采集的无偿献血者血浆。收集的所有样本均严格按照本科室现行SOP要求检测[3]。①阴性样本:实验室检测HBVsAg、HBVsAb、HBVeAg、HBVeAb、HBVcAb、抗-HCV、抗-TP、抗-HIV、HBV-DNA、HCV-RNA、HIV-RNA检测结果均为阴性;②HBV阳性样本:HBVsAg、HBVeAg/ HBVeAb、HBVcAb、HBV-DNA结果均为阳性;③HCV阳性样本:稀释后的HCV阳性质控品;④HIV阳性样本:抗-HCV双试剂阳性且确认试验结果阳性;⑤溶血血浆(血红蛋白含量为5 g/L)及脂肪血浆(甘油三酯大于6.3 mmol/L)由本实验室制备,HBV-DNA、HCV-RNA、HIVRNA检测结果均为阴性。
1.1.2 主要仪器 ChiTaS BSS1200自动核酸纯化仪;ABI 7500核酸扩增仪;HR40-IIA2生物安全柜;DL-5M低速冷冻离心机。
1.1.3 主要试剂 HBV-DNA、HCV-RNA、HIV-RNA核酸检测试剂盒(PCR-荧光法)由上海浩源生物科技有限公司提供,批号为MF20160102。质控品由北京康彻思坦生物技术有限公司提供,HBV-DNA、HCV-RNA、HIV-RNA浓度分别为500 IU/mL、2000 IU/mL、2000 IU/mL,批号为201601001。
1.2 方法
1.2.1 检出限验证 将HBV-DNA、HCV-RNA、HIV-RNA定值质控品用阴性血浆进行梯度稀释,HBV-DNA、HCVRNA、HIV-RNA系列浓度为:①12.6 IU/mL、46.6 IU/ mL、95.2 IU/mL;②6.3 IU/mL、23.3 IU/mL、47.6 IU/ mL;③3.2 IU/mL、11.7 IU/mL、23.8 IU/mL;④1.5 IU/ mL、5.8 IU/mL、11.9 IU/mL。采用单人份检测模式(简称“单检”),每个浓度重复10次,统计分析其95%检出限及置信区间。
1.2.2 准确度验证 22例阴性样本与HBV(6例)、HCV(2例)、HIV(2例)阳性样本交替间隔排列。先采用混合样本检测模式(简称“混检”),呈反应性结果再进行单检拆分。
1.2.3 精密度验证 分别将HBV-DNA、HCV-RNA、HIVRNA质控品稀释至100%检出限(由厂家提供),即稀释后HBV-DNA、HCV-RNA、HIV-RNA质控品终浓度分别为18.9 IU/mL、69.9 IU/mL、142.8 IU/mL。对该样采用单检模式检测,连续检测5天,每日重复检测4次,阳性结果以Ct值表示,参照文献[4]计算Ct值的标准差和变异系数(CV值),同厂家提供的允许CV值比较。
1.2.4 抗干扰确认 将HBV、HCV、HIV质控品按一定比例分别加入到溶血血浆、重度脂肪血浆(乳糜状)及阴性血浆中,使HBV、HCV、HIV质控品在血浆中终浓度分别为:6.3 IU/mL、23.3 IU/mL、47.6 IU/mL。与阴性样本混检模式检测20次。
1.2.5 质控检测 每次实验过程中同时检测试剂盒配套的阴性、阳性对照以及外部购买的阳性质控(浓度为厂家提供的100%检出限)。当每次质控结果在控且符合实验室SOP要求时,实验数据为有效,否则要求重新检测。
1.2.6 统计方法 应用SPSS 13.0统计软件PROBIT统计分析系统的95%检出限及其相关置信区间。准确性和精密度分别用阴性、阳性检出率、Ct值的标准差及变异系数进行验证。
2 结 果
2.1 检出限验证结果 HBV-DNA、HCV-RNA、HIVRNA95%检出限分别为3.63 IU/mL、12.71 U/mL、25.49 IU/mL,均低于厂家提供的检出限。见表1。
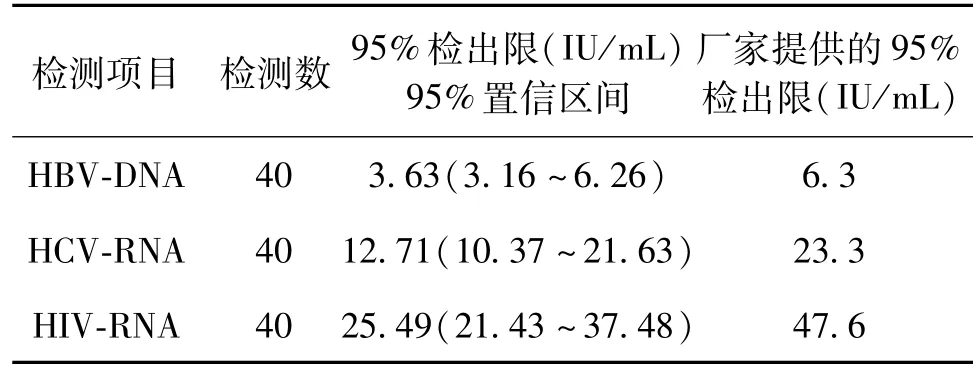
表1 ChiTaS系统检测HBV-DNA、HCV-RNA、HIV-RNA检出限验证结果
2.2 准确度验证结果 22个阴性样本和10个阳性样本进行8混样模式检测结果为反应性,拆分单检结果中22个阴性,阴性符合率100%;10个阳性样本结果分别为HBVDNA 6例、HCV-RNA 2例、HIV-RNA 2例,阳性符合率为100%。
2.3 精密度验证结果 HBV-DNA、HCV-RNA、HIV-RNA结果均为阳性,Ct值的均数分别为37.93、33.63、40.60,总变异系数分别为2.56%、1.03%、3.36%。均低于厂家要求允许的CV值(10%)。
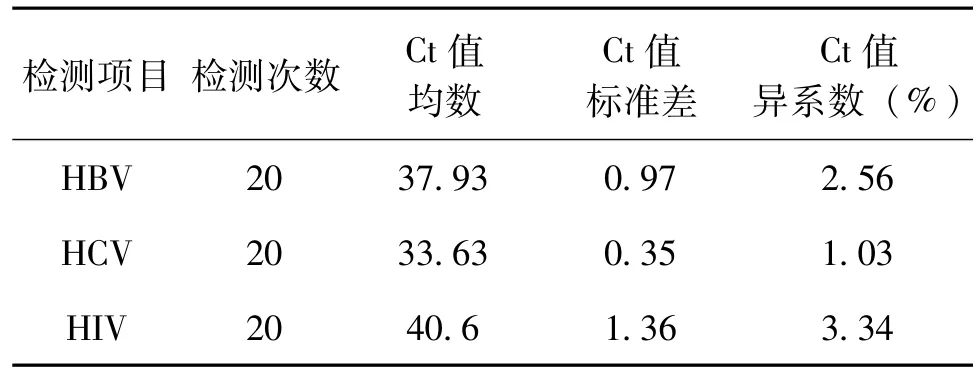
表2 ChiTaS系统检测HBV-DNA、HCV-RNA、HIV-RNA精密度验证结果
2.4 抗干扰能力验证 含有低浓度HBV-DNA、HCVRNA、HIV-RNA质控品的溶血血浆(血红蛋白含量为5 g/ L)、重度脂肪血浆(甘油三酯大于6.3 mmol/L)及正常阴性血浆检测结果见表3:在溶血血浆及重度脂肪血浆中HIV-RNA的检出率较低,分别为90%(18/20)和95%(19/20),与正常阴性血浆检出率(95%)比较,差异无统计学意义,P=0.147;=1.026,P=0.311);在溶血血浆、重度脂肪血浆及正常阴性血浆中HBV-DNA、HCV-RNA检出率均为100%(20/20)。溶血血浆及重度脂肪血浆对低浓度的HBV-DNA、HCV-RNA、HIV-RNA检出均无影响。
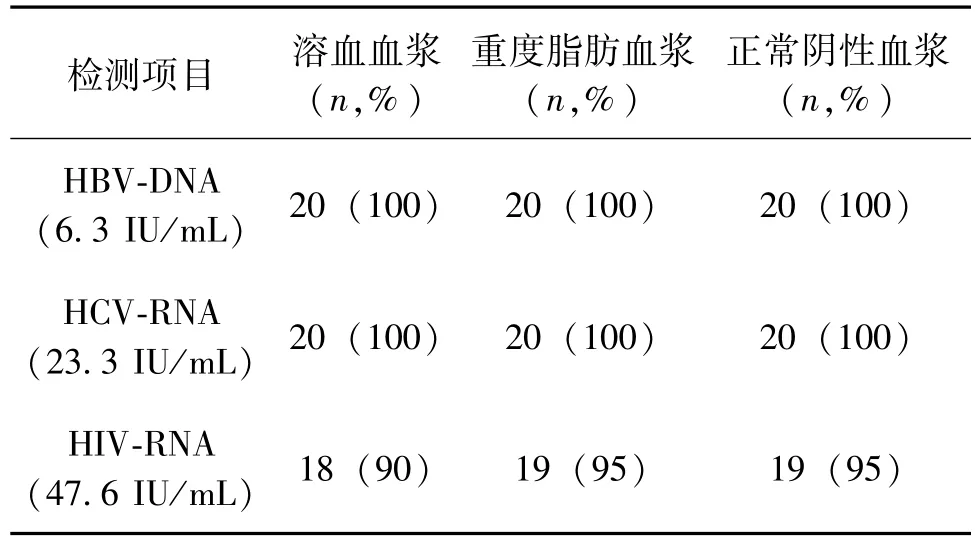
表3 ChiTaS系统对溶血血浆和重度脂肪血浆干扰能力验证结果
3 讨 论
血站实验室实行有效的质量控制,对于相关输血传染病检出、保障输血安全至关重要[5]。实验室应尽量选择特异性、灵敏性高及稳定性好的检测系统。目前国内血站实验室检测均采用国家法规规定的血液检测方法,基本上实现自动化检测设备和商品化试剂盒。葛红卫[6]等提出为获得准确、稳定检测结果,实验室除在血液检测方法使用之前对检测系统进行确认外,还应在使用一定时间周期内,对已经过确认的检测方法的进行性能验证,识别使用过程中产生的偏差,并及时加以纠正。ChiTas可以采取混检或单检模式HBV-DNA/HCV-RNA/HIV-RNA单管同时检测,直接报告反应性病原体种类,不需要再进行鉴别检验。本研究采用购买的定值血浆质控品,每个项目均收集40例检测结果做检出限验证分析,结果显示该系统HBV-DNA、HCV-RNA、HIV-RNA检出限分别为3.63(3.16~6.26)IU/mL、12.71(10.37~21.63)U/mL、25.49(21.43~37.48),符合FDA对NAT血液筛查HBV(100 IU/mL)、HCV(100 copies/mL)、HIV(100 copies/mL)分析灵敏度要求[7],均低于厂家提供的检出限,符合实验室核酸检测要求。曹谊[8]等认为研究结果与厂家参数比较不完全一致,其原因可能是由于厂家进行性能验证时使用的是国际标准品和大样本检测。
对于定性试验,准确度通常采用阴性、阳性符合率来验证[9]。本研究采用混检、单检模式确认阴性、阳性符合率,结果显示:混检阳性符合率、单检拆分阳性率符合率为100%。在拆分单检时,相间排列在阳性样本间22个阴性样本结果均为阴性,阴性符合率100%,未出现假阳性。由于本实验室实行剔除酶免结果阳性样本再进行核酸检测策略,样本阳性率低,且在整个性能验证过程中未出现样本间交叉污染现象,故本研究未对该仪器抗交叉污染性能进行验证。
精密度作为性能验证的重要指标之一,定量检测通常以变异系数或标准差表示。定性检测的精密度验证可以根据检测样本的S/C0值,按照定量检测方式进行CV值的分析。本研究中,由于ABI7500核酸扩增仪结果无法导出S/ C0值,则采用Ct值计算CV值。结果显示:HBV-DNA、HCV-RNA、HIV-RNA总变异系数分别为2.56%、1.03%、
3.36 %,均低于厂家低于测定的CV值(10%),说明Chi-TaS系统在本实验室具有良好的精密度,符合实验要求。同时,ChiTaS系统抗干扰能力强,低浓度阳性样本不受样本中脂肪血浆(甘油三酯)、溶血血浆(血红蛋白)的影响。
综上所述:ChiTaS检出限、精密度、准确度等参数符合要求,实验室该系统的检测能力可以满足本血站对样本的常规核酸检测要求。
[1]赵芹,辛青松,李峥嵘,等.ABIViiA 7 Taqman HBVDNA检测系统性能验证[J].国际检验医学杂志,2015(5):669-670.
[2]李金明.定性测定的性能验证[C]//中华医学会第九次全国检验医学学术会议暨中国医院协会临床检验管理专业委员会第六届全国临床检验实验室管理学术会议论文汇编.2011.
[3]黄璐,聂湘辉,刘丽华.河源市无偿献血者人群结构特征与血液检测结果分析[J].广州医药,2015,46(6):77-80.
[4]王薇,王治国,李少男.临床实验室对厂家声明的精密度和真实度的性能验证要求[J].检验医学,2010,25(12):1001-1005.
[5]滕青,汪传喜,戎霞,等.全血和机采血小板献血不良反应的调查分析[J].广州医药,2011,42(3):65-66.
[6]葛红卫,王鸿捷.血站实验室血液检测方法确认的技术实践[J].中国输血杂志,2014,27(4):345-348.
[7]姚凤兰,汪德海,查祎,等.Procleix TIGRIS核酸分析系统分析性能及操作性能确认研究[J].中国输血杂志,2014,27(4).361-367.
[8]曹谊,王凯,王玲玲,等.HBV/HCV/HIV血液核酸筛查试剂的性能验证研究[J].检验医学与临床,2015(12):90-92.
[9]张保平,董莉,冯新平,等.乙肝病毒表面抗原方法学性能验证的评价和分析[J].职业与健康,2010,26(7):106-106.
10.3969/j.issn.1000-8535.2016.04.022
2016-03-25)
