2型糖尿病肾病患者肾组织中STOML2的表达及作用
2016-11-06陈浩雄傅君舟刘日光
陈浩雄 傅君舟 何 凤 刘日光
2型糖尿病肾病患者肾组织中STOML2的表达及作用
陈浩雄 傅君舟 何 凤 刘日光
广州市第一人民医院肾内科(广州510180)
目的 探讨2型糖尿病肾病(DN)患者肾组织中STOML2的表达及作用。方法 免疫组化检测临床2型糖尿病肾病患者肾组织STOML2的表达及定位,采用慢病毒转染方法建立稳定过表达STOML2的HK-2细胞系,并应用Western blot检测肾小管上皮细胞钙粘蛋白(E-cadherin)、Fibronectin和STOML2的表达。结果 STOML2在DN患者肾组织的肾小管上皮细胞胞浆中表达明显升高。在高糖刺激HK-2细胞建立的EMT模型中,STOML2呈时间依赖表达上调。STOML2稳定高表达时,E-cadherin表达下调,而Fibronectin明显上调,即能促进肾小管上皮细胞发生EMT。结论 STOML2可能通过促进肾小管上皮细胞向间充质细胞分化,进而参与糖尿病肾病肾脏纤维化的发生发展。
糖尿病肾病 上皮细胞-间质转化 纤维化 STOML2
糖尿病(diabetic mellitus,DM)患者中,若血糖控制欠佳若干年可发展为糖尿病肾病(diabetic nephropathy,DN)。DN是DM最常见也是最严重的并发症之一,是导致终末期肾衰竭(End Stage Renal Disease,ESRD)的常见病因,这严重影响了DM患者的生存和预后,目前研究显示,糖尿病肾病的发生率随着DM患者年龄的增长和病程延长而不断增高[1]。国内资料显示,DN已成为我国ESRD的第二位病因[2]。迄今为止,糖尿病肾病的发病机制尚未完全阐明。现有研究表明,肾小管间质纤维化是DN进展为ESRD的主要病理基础,上皮细胞-间质转化(Epithelialmesenchymal transition,EMT)被认为是肾间质纤维化发生发展的核心环节之一[3]。Stomatin样蛋白2(stomatin like protein 2,STOML2)是近期新发现的基因,该基因在恶性肿瘤中的表达上调明显,可促进肿瘤的转移[4]。在本项研究中,我们检测临床糖尿病肾病患者肾组织中STOML2的表达及定位,并探讨其在肾小管上皮细胞向间质细胞转化过程中的作用。
1 材料与方法
1.1 材料
1.1.1 试剂 DMEM/F12培养基、胎牛血清(美国Gibco Invitrogen),小鼠抗STOML2单抗(美国Abcam),小鼠抗E-cadherin单抗和小鼠抗Fibronectin单抗(美国B&D),兔抗a-tubulin多抗(美国Santa Cruz)。质粒pSin-EF2-vector和pSin-EF2-STOML2由中山大学李隽教授惠赠。免疫组织化学试剂盒购自北京中杉金桥生物技术公司。其余化学试剂为国产分析纯化。
1.1.2 仪器设备 凝胶成像、图像分析系统(美国Bio-Rad),Western印迹仪(美国R&D),紫外分光光度计(英国Jenway),3K18低温离心机(美国Sigma),Zeiss Axio Imager A1正立荧光显微镜(德国ZEISS)。
1.2 方法
1.2.1 收集广州市第一人民医院肾内科经病理确诊为2型糖尿病肾病且病理分期为III期的肾组织20例,并选取临床肾癌患者正常肾组织(距肿瘤10 cm)10例作为对照。每例标本部分组织经4%多聚甲醛固定后行石蜡包埋、切片。病理切片特殊染色(HE染色、Masson染色)由广州市第一人民医院病理科完成。
1.2.2 HKC细胞培养:人肾小管上皮细胞株(HK-2)由北京协和医科大学郑法雷教授惠赠。细胞用含10%FCS的DMEM/F12培养基培养,每2~3天传代一次。将细胞消化吹打混匀,接种于6孔板中,待细胞生长至70%融合时,按实验设计加入高糖(含50mmol/L葡萄糖)分别培养HK-2细胞24 h、48 h、72 h,收集细胞样品,采用Western blot分析。
1.2.3 Western印迹 在各时间点收集细胞,加SDS细胞裂解液提取细胞总蛋白,Bradford法测定蛋白浓度。10% SDS-PAGE电泳分离,电转至硝酸纤维素膜,5%BSA封闭,STOML2(1∶1000)、E-cadherin(1∶2500)、fibronectin(1∶5000)一抗4℃孵育过夜,抗兔a-tubulin(1∶1000)一抗室温孵育1 h,相应的二抗IgG(1∶1000)室温孵育1 h后,显影成像。以a-tubulin为内参,应用图像分析软件扫描特异性条带。
1.2.4 免疫组织化学分析 采用免疫组化SP法检测STOML2蛋白表达:取5μm厚的10%甲醛固定的石蜡切片,二甲苯脱蜡水化。3%过氧化氢(H2O2)5 min灭活内源性酶,PBS冲洗3次,热修复抗原,室温血清封闭10 min后分别滴加稀释的一抗小鼠抗STOML2单克隆体(1:200),4℃孵育过夜,PBS洗涤3次,滴加鼠二抗IgG,室温孵育1 h,PBS洗涤3次,DAB显色。苏木素轻度复染核,自来水冲洗返蓝,脱水、透明、封片,镜检。每次染色均同时以PBS缓冲液替代一抗作为阴性对照。每张切片400倍下随机选取20个不重叠视野,拍片。
1.2.5 构建STOML2稳定过表达的HK-2细胞系 首先,采用磷酸钙转染制备慢病毒。将HEK293细胞均匀接种于10 cm皿中(培养皿预先以0.1%明胶铺底),待细胞密度达到70%~80%时进行转染。采用磷酸钙法转染,分别将目标质粒Psin-EF2-STOML2/Psin-EF2-vector 2μg及其包装质粒psPAX2质粒2μg和pMD2.G质粒2μg,分别震荡混匀加入67μl磷酸钙转染试剂,混匀室温静置20分钟将转染体系加入培养皿中,轻晃混匀,放入培养箱中培养。6 h候后换液成完全培养基15mL,培养48 h。收集培养基,2000 rpm离心,收集上清。超滤柱过滤,4℃,6000 g离心30 min,使体积缩小至1 mL。病毒浓缩液分装后于-80℃冰箱存放,备用。其次,将慢病毒液感染靶细胞。将靶细胞HK-2细胞接种于6孔板,培养至60%左右密度,用生理盐水洗一遍后加入2 mL完全培养基,再加入500μl病毒浓缩液,并加入polybrance试剂(促进病毒颗粒的融合感染)至终浓度为8μg/mL,培养箱培养6 h。补加2 mL完全培养基,继续感染24 h。24 h后更换新鲜的完全培养基,培养12 h。并利用1μg/mL嘌呤霉素筛选已转染成功的阳性克隆细胞,扩增后冻存备用。
2 结 果
2.1 STOML2在DN肾组织中表达明显上调 正常对照组的HE染色显示肾组织结构清晰,肾小球大小正常,肾间质无增宽;Masson染色显示肾小球及肾间质无明显胶原沉积;免疫组化显示,近曲小管和远曲小管的肾小管上皮细胞胞核中几乎无STOML2表达。而DN肾组织HE染色显示肾小球出现肥大或硬化,肾间质增宽;Masson染色显示肾小球及肾间质有明显胶原沉积,表明存在肾脏纤维化;免疫组化显示,STOML2在肾小管上皮细胞浆高表达,明显较对照组升高,见图1。
2.2 STOML2在高糖诱导的肾小管上皮细胞EMT模型中表达上调 高糖(High glucose,HG)(50 mmol/L)刺激HK-2细胞建立高糖诱导的EMT模型过程中,上皮细胞的Marker分子E-cadherin表达随HG刺激时间的延长而降低,而间充质细胞的Marker分子Fibronectin随HG刺激时间的延长而增加,此时STOML2表达逐渐上调,在HG刺激72h时表达最高,见图2,提示STOML2可能参与调控高糖诱导的肾小管上皮细胞EMT过程。
2.3 稳定过表达STOML2可诱导HK-2细胞发生EMT 我们采用慢病毒的方法将质粒Psin-EF2-STOML2/Psin-EF2-vector分别转染至HK-2细胞,采用嘌呤霉素筛选阳性克隆细胞,建立稳定的细胞系(HK-2-Control,HK-2-STOML2),收集细胞样品,采用Western blot检测发现在STOML2稳定高表达时,E-cadherin表达下调,而Fibronectin明显上调,见图3,表明STOML2可以诱导HK-2细胞发生EMT。
3 讨 论
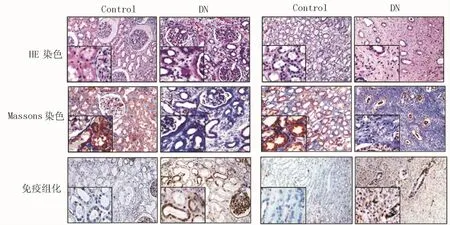
图1 STOML2在DN肾组织中表达明显上调(×200)
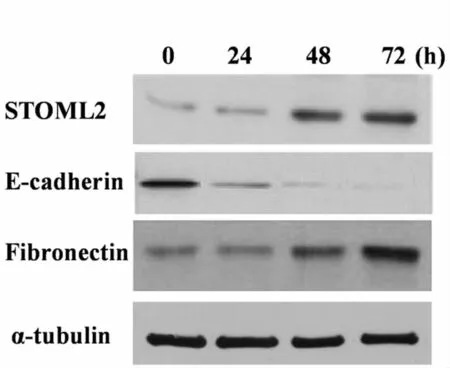
图2 STOML2在高糖诱导的肾小管上皮细胞EMT模型中表达上调

图3 稳定过表达STOML2可诱导HK-2细胞发生EMT
以往研究认为肾小球病变在糖尿病肾病的发病中起重要作用,然而近年来研究者发现肾小管间质病变在糖尿病肾脏病发病早期也至关重要,并且肾小管间质病变的严重程度与蛋白尿排泄量和肾功能进行性下降密切相关,对糖尿病肾病患者的生存和预后有严重影响[5]。糖尿病肾病患者的临床病理变化为:早期出现肾小管肥大,空泡变性,肾小管管腔扩张,刷状缘面积减少DN,肾小管基底膜增厚;晚期表现为肾小管萎缩及间质纤维化,间质纤维化的部位多伴有肾小球硬化。Gnudi等研究发现,糖尿病微量蛋白尿患者仅29%出现典型的肾小球硬化和小动脉透明变,然而有42%患者出现肾间质病变,表现为肾小管肥大和间质扩张[6]。糖尿病早期肾脏小管间质病理改变是启动和促进肾小管间质纤维化进程的关键因素且不完全依赖于肾小球病变,是导致DN的独立因素之一[7],所以对DN肾小管间质病变的研究也非常重要。本研究发现STOML2在临床DN患者肾组织及高糖诱导的肾小管上皮细胞中均高表达,体外高表达STOML2能明显促进肾小管上皮细胞向间充质细胞转化,提示STOML2可能促进DN的纤维化发生发展。
DN进展为终末期肾病的主要病理基础是肾小管间质纤维化,细胞外基质(extracellular matrix,ECM)在肾脏局部进行性积聚是DN的主要病理表现,而承担ECM合成的主要是肌成纤维细胞[8]。目前研究表明在肾间质纤维化的发展过程中,约30%~50%的新增成纤维细胞来源于肾小管上皮细胞的EMT过程[9]。在糖尿病中引发EMT的原因主要为高血糖、血管紧张素Ⅱ(AT-Ⅱ)、晚期糖基化终末产物(advanced glycation end products,AGEs)和氧化应激等这些因素均可促进TGF-β1的表达,并通过TGF-β通路的活化促进DN的发生发展[6,10]。EMT是具有极性的上皮细胞转化成具有活动能力、能够在细胞基质间自由移动的间质细胞的过程,其特征为上皮细胞表型丧失及间质特性的获得。EMT主要表现为上皮细胞标志蛋白上皮钙粘蛋白(E-cadherin)、ZO-1、β-连环蛋白(β-catenin)等的表达降低;间质细胞标志蛋白纤维连结素(Fibronectin)、玻形蛋白(vimentin)、神经钙粘蛋白(N-catenin)等表达增加,导致细胞形态和结构改变[11]。Zhang等[12]的研究发现STOML2能降低食管鳞状上皮细胞的粘附,下调E-cadherin表达。本研究显示稳定过表达STOML2的肾小管上皮细胞,上皮细胞标志蛋白E-cadherin表达明显下调,而间充质细胞标志蛋白Fibronectin明显上调,表明STOML2能有效促进肾小管上皮细胞向间充质细胞转化,进而促进细胞外基质的生成。
由于肾纤维化早期阶段的EMT是可逆的,所以及早干预有可能诱导已发生EMT的肾小管上皮细胞恢复正常,维持肾脏正常的组织结构和功能。通过本项研究,明确了高糖能上调STOML2的表达,且高表达STOML2能有效促进肾小管上皮细胞发生EMT,这不仅加深了对EMT及DN肾间质纤维化的认识,还提示减低STOML2的表达和功能可作为一个新的DN治疗靶点。
[1]KANWAR YS,SUN L,XIE P,et al.A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J].Annu Rev Pathol,2011,6:395-423.
[2]SATIRAPOJB.Review on pathophysiology and treatment of diabetic kidney disease[J].J Med Assoc Thai,2010,93 Suppl6:S228-241.
[3]MATHIESON PW.The podocyte as a target for therapies——new and old[J].Nat Rev Nephrol,2011,8(1):52-56.
[4]LAPATSINA L,BRAND J,POOLE K,et al.Stomatindomain proteins[J].Eur JCell Biol,2012,91(4):240-245.
[5]AGGARWAL PK,VERON D,THOMAS DB,et al. Semaphorin3a promotes advanced diabetic nephropathy[J].Diabetes,2015,64(5):1743-1759.
[6]GNUDI L,THOMAS SM,VIBERTI G.Mechanical forces in diabetic kidney disease:a trigger for impaired glucose metabolism[J].J Am Soc Nephrol,2007,(8):2226-2232.
[7]NAKAGAWA T,TANABE K,CROKER BP,et al.Endothelial dysfunction as a potential contributor in diabetic nephropathy[J].Nat Rev Nephrol,2011,7(1):36-44.
[8]LIU Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,(2):212-222.
[9]ZEISBERG EM,POTENTA SE,SUGIMOTO H,et al. Fibroblasts in kidney fibrosis emerge via endothelial-tomesenchymal transition[J].JAm Soc Nephrol,2008,19(12):2282-2287.
[10]WEIJ,SHIY,HOU Y,et al.Knockdown of thioredoxin-interacting protein ameliorates high glucose-induced epithelial tomesenchymal transition in renal tubular epithelial cells[J].Cell Signal,2013,25(12):2788-2796.
[11]ZEISBERGM,NEILSON EG.Biomarkers for epithelialmesenchymal transitions[J].JClin Invest,2009,119(6):1429-1437.
[12]ZHANG L,DING F,CAOW,et al.Stomatin-like protein 2 is overexpressed in cancer and involved in regulating cell growth and cell adhesion in human esophageal squamous cell carcinoma[J].Clin Cancer Res,2006,12(5):1639-1646.
The role of STOML2 in renal tissue of patients w ith type 2 diabetic nephropathy
Chen Haoxiong,Fu Junzhou,He Feng,et al.Department of Nephrology,Guangzhou First People'sHospital,Guangzhou 510180,China
Objective To investigate the expression and role of STOML2 in renal tissue of patientswith type 2 diabetic nephropathy. M ethods To detecthe expression and localization of STOML2 in clinical renal tissue in patientswith type 2 diabetic nephropathy by immunohistochemistry,and use lentiviral transfectionmethod to establish a stable cell line of over-expressing STOML2,lastly applywestern blot to detect the expression of E-cadherin,Fibronectin and STOML2 in renal tubular epithelial cells. Results STOML2 was significantly increased in renal tubular epithelial cytoplasm of patients with DN.In the EMT model of HK-2 cells stimulated by high glucose,STOML2 was increased in a time dependent.Overexpression of STOML2 led to E-cadherin down-regulated,while Fibronectin up-regulated,which promoted the occurrence of EMT in renal tubular epithelial cells. Conclusion STOML2 may be involved in the development and progression of renal fibrosis in diabetic nephropathy by mediating epithelial-mesenchymal transition of renal tubular epithelial cells.
Diabetic nephropathy;Epithelial-mesenchymal transition;Fibrosis;STOML2
10.3969/j.issn.1000-8535.2016.04.013
2016-04-08)
广州市医药卫生科技引导项目(20151A010019)
傅君舟,E-mail:fujzhou@163.com
