黄芩苷对哮喘大鼠p38 MAPK信号通路影响初探
2016-11-06张秋玲潘竞锵
韩 超 杨 柳 张秋玲 潘竞锵 徐 俊
黄芩苷对哮喘大鼠p38 MAPK信号通路影响初探
韩 超1杨 柳2张秋玲1潘竞锵1徐 俊2
1 广州市中医医院(广州510130)2 暨南大学药学院(广州510632)
目的 初步探讨黄芩苷防治支气管哮喘的作用机理。方法 用卵蛋白致敏大鼠制备支气管哮喘动物模型,经黄芩苷干预治疗,运用免疫组化法及Western Blot法检测各组大鼠肺组织匀浆中p38 MAPK磷酸化蛋白表达量。结果 两种检测方法均显示,p38 MAPK磷酸化蛋白水平在模型组中有明显的增加,地塞米松组、黄芩苷高剂量组和低剂量组的p38 MAPK磷酸化蛋白水平均低于模型组(P<0.05)。结论 黄芩苷能有效治疗哮喘的作用与抑制哮喘大鼠p38 MAPK信号通路的表达密切相关。
黄芩苷 哮喘 p38 MAPK信号通路
丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)信号转导途径是参与哮喘发病的一条重要的信号转导机制,p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38 MAPK)信号通路为MAPK家族的重要成员。参与了对多种炎症细胞因子和多种类型的细胞应激信号的传导,在哮喘的发生和发展过程中有着重要作用[1-2]。本课题组研究翘芩方治疗哮喘大鼠的实验结果表明,翘芩方能有效改善哮喘的发生发展[3-4]。此方中黄芩为主药,黄芩苷(Baicalin)为黄芩的主要有效成份之一。本实验我们通过建立卵蛋白(OVA)致敏的大鼠哮喘的动物模型,观察黄芩苷对哮喘大鼠模型p38 MAPK信号通路的影响。
1 材料与方法
1.1 动物 SD大鼠,SPF级,均购自广东省医学实验动物中心,体重150~180 g,鼠龄6~8周,雌性,许可证号:SCXK(粤)2012-0117。
1.2 药物与试剂 黄芩苷(由暨南大学药学院提供,含量95%);卵清白蛋白(OVA)(sigma,USA,批号:A5253);氢氧化铝干粉(广州化学试剂厂,批号:20191201-2);醋酸地塞米松(浙江仙琚制药股份有限公司生产,批号:140692);生理盐水(常州兰陵制药有限公司,批号:H52020069);4%多聚甲醛固定液(博士德生物,批号:AR1068);饱和苦味酸(武汉谷歌生物股份有限公司,批号:140527);磷酸化P38抗体(上海碧云天生物技术有限公司,批号:AM063-1);RIPA蛋白裂解液(武汉博士德生物技术有限公司,批号:10C09A05);RNAiso Plus(Takara-宝生物工程(大连)有限公司,批号:AA1607-1);BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,批号:P0012S)。
1.3 仪器 超声雾化器(鱼跃,型号:402AI)。脱水机(武汉俊杰电子有限公司,型号:JJ-12J)。包埋机(武汉俊杰电子有限公司,型号:JB-P5)。病理切片机(上海徕卡仪器有限公司,型号:RM2016)。涡旋混合器(天悦电子,型号:TYXH-II)。显微镜(OPTIKA,型号:M-114)。高速冷冻离心机(美国Thermo,型号:Sorvall ST16R)。恒温振荡器(美国Crystal Technology,型号:IS-RDD3)。凝胶电泳、电转仪(美国Bio-RAD,型号:10025025 REV A)电子分析天平(瑞士METTLER,型号:PB602-L)。磁力搅拌器(德国IKA,型号:Big Squid)。
1.4 方 法
1.4.1 哮喘模型的制备 大鼠于干燥、通风、安静的环境下适应性饲养一周后采用文献[5-6]方法并加以改进制备哮喘模型。本实验由广州市中医医院伦理委员会监督,符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定。
致敏阶段:模型组及给药组大鼠在实验开始时第1天、第8天ip给予10%卵清白蛋白(OVA)混悬液1 mL,空白对照组用生理盐水代替,共给予两次抗原致敏。
激发阶段:第15天开始,将各组大鼠分别置于密闭的有机玻璃容器内进行超声雾化以诱发哮喘,每次吸入1% OVA混悬液(空白对照组用生理盐水代替),流量0.5mL/ min,30min/次。哮喘激发每日1次,连续2周。以呼吸急促,咳嗽,严重者呈深、慢呼吸或呼吸节律不整,行动迟滞或俯伏不动等表现为激发成功。
1.4.2 分组及给药 SD大鼠,50只,150~180 g,雌性,于干燥、通风、安静的环境中适应性饲养一周后,随机分为5组,每组10只。从大鼠首次致敏次日开始,各组大鼠以对应药物灌胃,自第15天起,给药30 min后进行相应的激发,(其中地塞米松组从第15天开始,进行隔天给药);1次/天,共4周:①正常对照组:生理盐水5 mL/(kg· d);②模型组:生理盐水5 mL/(kg·d);③地塞米松组:0.27 mg/(kg·d);④黄芩苷高剂量组:0.32 g/(kg· d);⑤黄芩苷低剂量:0.08 g/(kg·d)。
1.4.3 标本采集及相关检测 各组大鼠均在末次激发后24小时内取材:用4%戊巴妥钠腹腔麻醉,1 mL/kg体重,完全昏迷后,取其仰卧固定于洁净的解剖台上,取左肺上、中、下叶肺组织分别置于10%福尔马林中固定24h,进行常规脱水,石蜡包埋,制成切片。同时取右肺于5 mL塑料离心管中,并于-80℃保存。
1.4.4 肺脏组织病理观察 取左上叶肺组织切片进行HE染色、Masson三色染色,显微镜下观察肺组织的炎症改变及气道壁胶原沉积情况。采用Image-Pro Plus图像分析软件测量支气管周围胶原染色面积(2μm/μm基底膜)。
1.4.5 免疫组织化学染色检测肺组织磷酸化的P38MAPK的蛋白表达 肺组织石蜡切片按常规进行脱蜡水化后,置于蒸馏水中浸泡,取出。置于盛满EDTA抗原修复缓冲液(Ph 9.0)的修复盒中于微波炉内进行抗原修复。自然冷却后将切片置于PBS(PH7.4)中洗涤后放入3%过氧化氢溶液中室温避光孵育,PBS洗涤,阻断内源性过氧化物酶。切片稍甩干后滴加3%BSA,室温封闭后,PBS洗涤,滴加相应的一抗于组织上孵育后,继而滴加相应的二抗,PBS洗涤,DAB显色,Harris苏木素复染细胞核,蒸馏水冲洗,脱水封片,显微镜镜检,图像采集分析。
1.4.6 Western blot法检测肺组织磷酸化的P38MAPK水平
总蛋白的提取:取实验各组大鼠右肺组织并在相同部位剪取大约30 mg肺部组织,用组织剪将所取肺组织剪碎,PBS洗涤,直到肺组织呈现乳白色。加500μl RIPA裂解液,在玻璃匀浆器中于冰面上充分研磨,取研磨后匀浆于1.5 mL EP管中放冰面静置30 min充分裂解后,于高速离心机12000 r/min离心15 min,取上清液400μl于新EP管中12000 rpm/min离心10min。反复操作至蛋白提取液中无任何杂质,取上清液,测定蛋白浓度。
蛋白浓度测定:用BCA法对蛋白浓度进行检测并计算上样量,同时对提取蛋白100℃、5 min热变性。冷却后-80℃留存备用。
Western blot分析:根据蛋白浓度调整上样体积确保每孔以30~50μg的相等的总蛋白量上样。采用电压200 V进行SDS-PAGE电泳进行分离,然后以350 mA、120 min的条件电转到用甲醇处理过的PVDF膜上;待转膜结束,用Western Blotting封闭液在摇床上室温封闭2 h;然后将pp38抗体用一抗稀释液按1∶1000比例稀释,GAPDH用一抗稀释液按1∶2000比例稀释,在4℃下用摇床将各个抗体与PVDF膜孵育过夜。第二天将PVDF膜用PBST在摇床上洗涤3次,每次10 min,再将PVDF膜与HRP标记的二抗(1∶3000)在室温下孵育2 h,用PBST洗涤3次,每次10 min。最后滴加适量ECL发光液,在暗室中用X胶片曝光、显影和S定影,对Western blot目的条带进行分析。
1.4.7 统计学方法 所有数据均以(¯x±s)表示,采用SPSS 13.0统计软件处理,各组组间差异比较采用单因素方差分析。显著性水平α=0.05。
2 结 果
2.1 肺组织病理学改变 肺组织石蜡HE染色,镜下观察显示对照组支气管壁结构完整光滑,细胞排列整齐,管腔内及管周未见明显的异常表现;模型组支气管变形,管径变窄,管壁结构变化,管腔内有大量的炎症渗出物,管周有大量炎性细胞的浸润及堆积;地塞米松组支气管结构完整,管壁细胞排列紊乱,管径正常,管周有少量炎症细胞浸润;黄芩苷低剂量组支气管稍微变形,管壁细胞排列紊乱,管径变窄,管腔内有少量炎症性渗出物,管周有较大量炎性细胞浸润;黄芩苷高剂量组支气管稍微变形,管壁细胞排列紊乱,管径正常,管腔内有少量炎症性渗出物,管周有少量炎性细胞浸润。见图1。
2.2 大鼠肺组织免疫组化染色结果 相对于空白对照组,模型组的p-p38含量增多(P<0.5);相对于模型组,地塞米松组和黄芩苷高剂量组的p-p38含量均降低(P<0.01),黄芩苷低剂量组的p-p38含量则未见有差异。见图2~3。
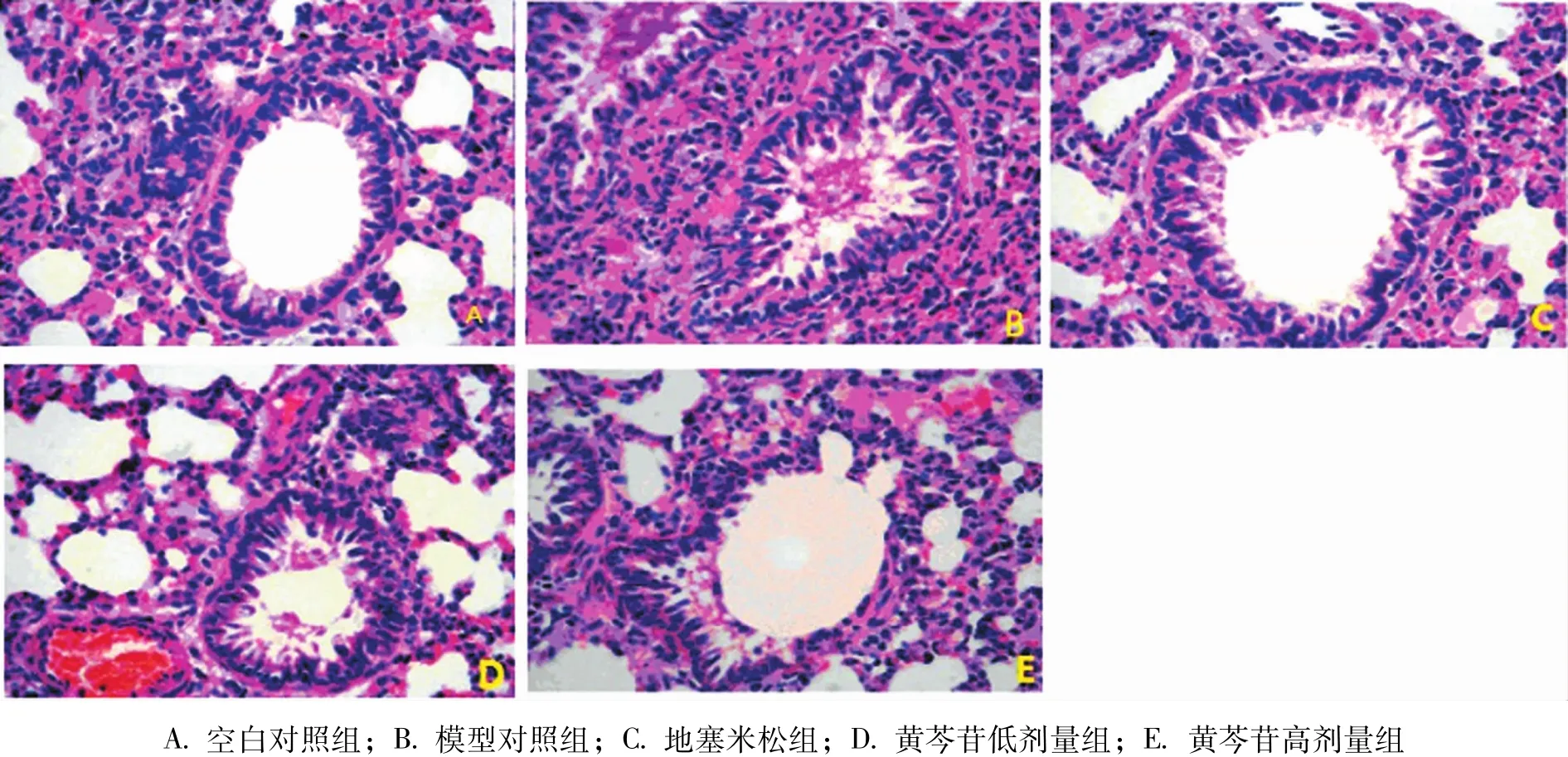
图1 肺组织HE染色(20×20)
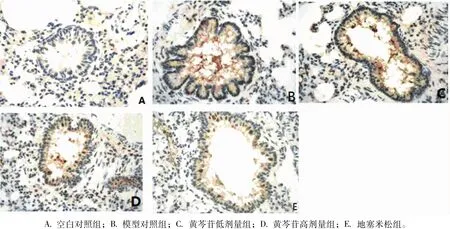
图2 哮喘模型大鼠支气管和肺组织p-p38MAPK在大鼠肺组织中的表达(20×20)
2.3 大鼠肺及气道组织磷酸化p38 MAPK表达的变化 相对于空白对照组,模型组的p-p38含量增多(P<0.05);相对于模型组,地塞米松组的p-p38含量降低(P<0.05);黄芩苷高、低剂量组的p-p38含量均有一定程度的降低(P<0.05)。见图4~6。
3 讨 论
支气管哮喘(简称哮喘)是一种严重危害人类健康的慢性呼吸道疾病,以慢性气道炎症、气道高反应性及气道重建为主要特征,其中炎症在哮喘病理生理过程中扮演关键角色[7],探讨哮喘的发病机制并制定有效的防治措施已成为全球热点。

图3 大鼠左肺中叶p-p38mark免疫组化,阳性表达IOD定量分析图

图4 各组大鼠肺和气道组织p-p38MAPK磷酸蛋白表达

图5 各组大鼠肺部组织p-p38MAPK蛋白表达水平比较
黄芩为传统中药,有着悠久的使用历史,黄芩苷是从黄芩根中提取分离出来的一种黄酮类化合物,为其主要有效提取成分之一,具有显著的生物活性。有着多种药理活性。近年来,国内外对黄芩苷进行了大量的研究均证实,黄芩苷在抗炎、清除氧自由基、减轻组织的缺血再灌注损伤、调节免疫、促进细胞凋亡以及抗肿瘤和HIV等多方面均有作用[8-9]。有文献报道黄芩苷可显著减少哮喘豚鼠血及肺泡灌洗液内嗜酸性粒细胞计数及肺细胞灌洗液细胞总数[10]。还有研究发现用黄芩苷干预哮喘大鼠模型,气道壁平滑肌层厚度较模型组明显变薄,胶原沉积明显减少,减缓和阻止气道壁结构的改变[11]。但至今鲜见有其对哮喘信号传导方面的相关研究报道。随着越来越多的黄芩苷药理活性被发现,提示着黄芩苷有着广泛的开发与应用前景。
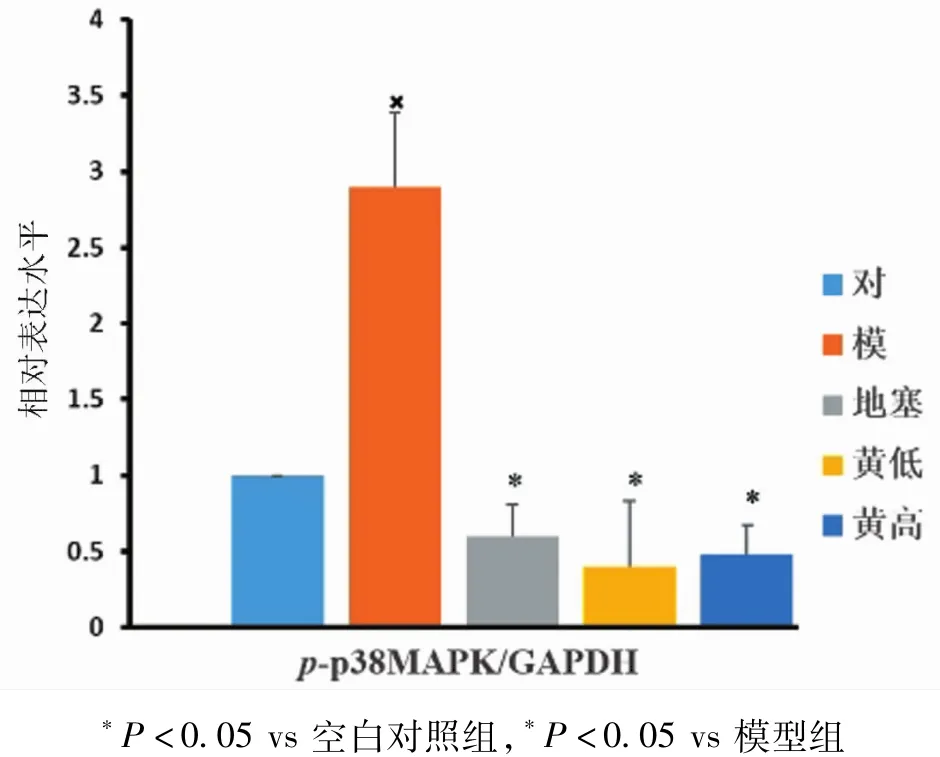
图6 各组大鼠气道组织p-p38MAPK蛋白表达水平比较
p38 MAPK可作用于多种炎性细胞和炎性介质而参与哮喘的病理生理过程,如参与了肥大细胞、嗜酸性粒细胞的定位迁移和淋巴细胞的发育、分化、成熟和活化的全过程,在哮喘的发生和发展过程中有着重要作用[12]。研究表明在气道炎性反应中,许多炎性介质的产生和作用都依赖于应激导致的p38 MAPK信号通路[2]。p38 MAPK与炎症、应激反应的调控密切相关。当细胞外信号作用于MAPK上游激酶,通过级联反应,催化苏氨酸和酪氨酸双位点特异性磷酸化,MAPK随之活化,进而可磷酸化下游激酶和细胞浆内或细胞核内转录因子,介导基因表达、炎性因子产生,在炎性细胞的增殖、分化、凋亡、宿主免疫防御等方面扮演关键性作用[13]。近年来,越来越多的研究资料表明,p38 MAPK可能在哮喘发病机制的多个环节发挥重要作用[14]。如研究证明,诸多与哮喘病理生理相关的重要炎性介质如TNF-α、IL-8、COX-2、内毒素等都是经p38 MAPK途径的活化而调节的。此外,有动物实验研究表明,p38 MAPK还参与IL-1β介导的大鼠气道平滑肌细胞增生、气道炎症、黏液高分泌、气道高反应性和气道重塑。这些体内/体外研究结果提示p38 MAPK可能是这一领域中治疗靶点。
笔者前期在对我院制剂翘芩清肺剂的研究中发现,翘芩清肺剂对OVA诱导的大鼠哮喘发作具有良好的防治作用[3-4]。而黄芩作为翘芩清肺剂的君药之一,具有清热燥湿,泻火解毒的作用,起着重要的药理作用。在此基础上,我们对黄芩苷防治哮喘的作用展开了进一步的研究。本实验结果显示,用黄芩苷进行干预性治疗,可有效改善OVA诱导哮喘大鼠的气道壁病理改变,下调哮喘大鼠肺、气道组织内的p38 MAPK磷酸化蛋白表达。这些结果提示,黄芩苷能有效抑制p38 MAPK蛋白磷酸化,进而影响其信号通路的表达,并可能通过级联反应减少了白三烯、前列腺素等一系列炎症介质的产生,从而对哮喘的发生发展起到防治作用。
另一方面,我们在研究中也发现,病鼠p38 MAPK免疫组化呈现的结果提示,黄芩苷对哮喘大鼠p38 MAPK信号通路的表达抑制作用有一定的剂量依赖性,但Western blotting的检测却并不能证实这一点。接下来,我们将继续探讨黄芩苷对p38 MAPK信号通路的调节是否存在剂量依赖关系,为进一步开发新型的防治哮喘的制剂提供更多的实验依据。
[1]李良昌,朴红梅,秦向征,等.羌活提取物对哮喘小鼠Thl/Th2细胞平衡的影响及其对p38信号通路的作用[J].解剖学报,2013,44(6):819-823.
[2]黄翠萍,张珍祥,徐永健.p38丝裂原活化蛋白激酶信号传递通路与支气管气道炎症[J].国外医学呼吸系统分册,2005,25(9):656-659.
[3]韩超,齐春丽,潘竞锵,等.翘芩清肺剂对哮喘大鼠平喘作用与变态及血管活性因子关系的研究[J].中国实验方剂学杂志,2012,18(4):176-179.
[4]韩超,齐春丽,潘竞锵,等.翘芩清肺剂对哮喘大鼠Th1/Th2细胞因子失衡的影响[J].中国现代应用药学杂志,2013,30(11):1178-1182.
[5]LEE M,KIM S,KWON OK,et al.Anti-inflammatory and anti-asthmatic effects of resveratrol,a polyphenolic stilbene,in a mouse model of allergic asthma[J].International Immunopharmacology,2009,9(4):418.
[6]SAKAGUCHIS.Regulatory T cells key controllers of immunologic selftolerance[J].Cell,2000,101:455.
[7]BATEMAN ED,HURD SS,BARNESPJ,et al.Global strategy for asthma management and prevention:GINA executive summary[J].Eur Respir J,2008,31(1):142-178.
[8]黄志军.黄芩苷药理作用研究进展[J].天津药学,2012,24(3):61-64.
[9]张喜平,田华,程琪辉.黄芩苷的药理作用研究现状[J].中国药理学通报,2003,19(11):1212-1215.
[10]倪健,董竞成.三种中药药效成分抗支气管哮喘变应性炎症的实验研究[J].中国实验方剂学杂志,2004,10(4):49-51.
[11]吴世满,武永杰,刘丽,等.黄芩苷和川芎嗪对哮喘大鼠气道壁重构的影响与机制探讨[J].华中科技大学学报(医学版),2009,38(4)491-494.
[12]柳振宇,延光海,金哲悟,等.朝药鹿茸提取物对哮喘小鼠p38 MAPK表达及IL-4等的影响[J].中华中医药杂志(原中国医药学报),2015,30(11):4154-4156.
[13]王亮,李亚妹,杨红申,等.多西环素对哮喘大鼠血清IgE、肺组织磷酸化p38及基质金属蛋白酶9的影响[J].临床荟萃,2015,30(5):556-561.
[14]李锋,周新.p38丝裂原活化蛋白激酶与慢性气道疾病[J].中华哮喘杂志,2010,4(4):291-294.
Influence of Baicalin on P38 MAPK signal pathways of rat asthmamodel
Han Chao,Zhang Qiuling,Pan Jingqiang.Guangzhou Hospital of Chinesemedicine,Guangzhou 510130,China
Yang Liu,Xu Jun.College of pharmacy,Jinan University,Guangzhou 510632,China
Objective To explore the mechanism of Baicalin in treatment of bronchia asthma. Methods Animal models of bronchia asthma weremade in rats sensitized with egg albumen.After the treatmentof Baicalin,immunohistochemistry and western-blotmethods were used to testexpression quantity of phosphorylated p38 protein of lung tissue in allgroups of guinea rats. Results Our data confirmed that the level of phosphorylated p38 protein increased significantly in model group,but it decreased in hexadecadrol group,high dose and low dose Baicalin group(P<0.05). Conclusion The effects of Baicalin in asthmamodelwere associated with inhibition of P38 MAPK signal pathways in a dose-dependentmanner.
Baicalin;Asthma;P38 MAPK signal pathways
10.3969/j.issn.1000-8535.2016.04.002
2016-04-06)
广东省中医药局基金项目(20141226);广州市中医药、中西医结合项目(20142A011001)
