梅毒螺旋体膜蛋白Tpp47通过RhoA/ROCK信号通路调控血管内皮细胞通透性
2016-11-06张瑞丽王千秋
张瑞丽 王千秋
214002无锡,南京医科大学附属无锡市第二人民医院皮肤科(张瑞丽);中国医学科学院 北京协和医学院 皮肤病研究所临床性病防治室(王千秋)
梅毒螺旋体膜蛋白Tpp47通过RhoA/ROCK信号通路调控血管内皮细胞通透性
张瑞丽 王千秋
214002无锡,南京医科大学附属无锡市第二人民医院皮肤科(张瑞丽);中国医学科学院 北京协和医学院 皮肤病研究所临床性病防治室(王千秋)
目的 探讨梅毒螺旋体膜重组蛋白Tpp47对血管内皮细胞通透性影响的调控机制。方法 用人脐静脉内皮细胞(HUVEC)构建细胞单层模型,重组蛋白Tpp47(rTpp47)直接与HUVEC单层模型混合培养,或RhoA/ROCK信号通路特异性抑制剂Y-27632预处理后再用rTpp47刺激HUVEC单层模型,以煮沸灭活的rTpp47处理HUVEC单层模型为阴性对照组,采用ELISA检测各组培养1、4 h时辣根过氧化物酶(HRP)流量,培养12 h用荧光染料罗丹明-鬼笔环肽染色细胞骨架系统,共聚焦显微镜下观察细胞骨架蛋白F肌动蛋白排列变化。用Western印迹检测rTpp47与煮沸灭活的rTpp47分别处理HUVEC单层模型后细胞RhoA的表达水平。结果 rTpp47刺激HUVEC单层模型1 h时HRP流量(0.81±0.10)高于阴性对照组(0.39±0.09),差异有统计学意义(P<0.05),而此时Y-27632预处理组HRP流量(0.51±0.10)与单用rTpp47刺激组及阴性对照组相比,差异无统计学意义(均P>0.05)。培养4 h时,单用rTpp47刺激组HRP流量显著增加(2.31±0.14),且高于Y-27632预处理组(1.21±0.12)及阴性对照组(0.73±0.12),差异有统计学意义(均P<0.05),而Y-27632预处理组与阴性对照组之间差异无统计学意义。rTpp47刺激HUVEC后,与煮沸灭活的rTpp47作用HUVEC相比,细胞中RhoA表达增加。同时,rTpp47刺激细胞中骨架蛋白F肌动蛋白重排,在胞质中形成应力纤维,抑制剂Y-27632可部分抑制F肌动蛋白重排。结论 梅毒螺旋体膜重组蛋白Tpp47可通过RhoA/ROCK信号转导通路调控血管内皮细胞通透性。
苍白密螺旋体;内皮,血管;通透性;脐静脉;肌动蛋白;Tpp47;RhoA/ROCK信号通路
血管炎症反应在梅毒发病机制中起重要作用,梅毒螺旋体膜蛋白诱导的炎症是导致血管炎症改变的主要因素[1]。梅毒螺旋体膜蛋白Tpp47是螺旋体的主要膜抗原之一,前期[2]研究中,我们发现,重组蛋白Tpp47(rTpp47)可上调血管内皮细胞粘附分子表达及促进单核细胞趋化因子分泌。研究发现,RhoA/ROCK信号转导通路在血管内皮细胞通透性的调节、炎症细胞的浸润等多个生物学过程中起到重要的作用[3-4]。该信号通路在血管内皮炎症反应中被活化,细胞间连接及细胞骨架系统改变部分依赖于RhoA信号传导[5]。本研究中,我们构建了人脐静脉内皮细胞(HUVEC)单层模型,通过观察rTpp47对血管内皮细胞通透性、RhoA蛋白表达及细胞骨架系统的影响,进一步探讨rTpp47在血管炎症反应中的作用。
资料和方法
一、主要试剂与仪器
辣根过氧化物酶(HRP)检测试剂盒、辣根酶标记山羊抗兔IgG、抗RhoA抗体(美国Cell Signaling公司),DMEM培养基、胎牛血清(美国Gibco公司),罗丹明-鬼笔环肽、Matrigel基质、多聚甲醛、RhoA/ROCK信号通路特异性抑制剂Y-27632(美国Sigma公司),Transwell小室(美国Coning公司),激光共聚焦专用培养皿(美国BD公司)。原代培养的HUVEC由第三军医大学全军胸外中心赠送,单核细胞株THP-1细胞本实验室保存,rTpp47由深圳市菲鹏生物股份有限公司赠送,已去除内毒素,纯度>90%。Eppendorf AG低速离心机、Eppendorf 5810R低温高速离心机(德国Eppendorf公司),Labconco超净工作台(美国Labconco公司),Thermo Scientific1500酶标仪(芬兰热电公司),荧光显微镜、EX70倒置显微镜及共聚焦激光扫描显微镜FV-1000(日本Olympus公司)。
二、方法
1.细胞培养及HUVEC单层模型构建:HUVEC培养于含10%胎牛血清的DMEM培养基(含0.05%青链霉素双抗),置于37℃、5%CO2孵箱中培养,选状态良好的细胞进行实验。取50 μl稀释的Matrigel基质铺于Transwell小室的上室,37℃放置2 h。洗涤Matrigel 2次,加入细胞悬液(4×104个细胞)100 μl,下室加入 DMEM 培养基 600 μl,37 ℃、5%CO2培养箱中孵育7~10 d,倒置显微镜下观察细胞已经融合,向Transwell小室及下室中各加培养基,使内外池液面差>0.5 cm,4 h后观察液面差。若液面差仍>0.5 cm,则为4 h渗漏实验阳性,选取4 h渗漏实验阳性的孔板用于后续实验。
2.ELISA法测定HUVEC单层通透性:向HUVEC单层模型的Transwell小室中加入rTpp47,使其终浓度为400 μg/L,以煮沸灭活的rTpp47为阴性对照组,每孔设3个复孔,37℃、5%CO2培养箱中培养 24 h。取 100 μg/L HRP 溶液 100 μl加入Transwell小室,下室中加入不含HRP的无酚红DMEM培养基600μl,分别于培养1、4h时取下室培养基50μl于96孔板中,加入四甲基联苯胺100μl/孔,酶标仪450 nm波长处测量样本HRP吸光度A值,HRP是测定血管内皮通透性的代表性大分子物质。另一组实验中,RhoA/ROCK信号通路特异性抑制剂Y-27632预处理HUVEC单层模型30 min后,再加入rTpp47刺激HUVEC单层模型,按上述步骤检测450 nm波长处样本HRP吸光度A值。
3.Western印迹检测RhoA表达:将HUVEC接种于细胞培养板,37℃、5%CO2培养箱培养24 h,换新鲜培养基(不含青链霉素双抗),加入rTpp47,使终浓度为400 μg/L,以煮沸灭活的rTpp47为阴性对照组,每孔设3个复孔,37℃、5%CO2培养箱培养24 h。收集细胞,加入细胞裂解液,超声裂解。裂解上清进行SDS-PAGE电泳。蛋白转移到硝酸纤维素膜上。5%脱脂奶粉室温封闭2 h,加入一抗(1∶1 000)兔抗鼠RhoA抗体,4℃缓慢振荡过夜。洗膜3次,加入辣根酶标记山羊抗兔IgG二抗(1∶8 000),37℃缓慢振荡1 h。ECL化学发光法试剂作用于硝酸纤维素膜5 min,曝光胶片。Quantity One软件分析记录每条蛋白电泳带的灰度值,GAPDH蛋白为内参照,比较条带灰度值进行定性分析。
4.细胞骨架蛋白F肌动蛋白表达:将HUVEC接种于激光共聚焦专用培养皿,37℃、5%CO2培养箱培养24h。加入rTpp47,使终浓度为400μg/L,以煮沸灭活的rTpp47为阴性对照组,每孔设3个复孔,37℃、5%CO2培养箱培养12 h。4%甲醛室温固定15 min,洗细胞3次,加入0.05%TritonX-100/PBS室温破膜1min,加入1%BSA100μl室温封闭细胞20~30min,加入10 μmol/L荧光染料罗丹明-鬼笔环肽工作液100μl,37℃培养2h,共聚焦显微镜下观察骨架蛋白F肌动蛋白排列变化。另1组实验中,RhoA/ROCK信号通路特异性抑制剂Y-27632预处理接种于激光共聚焦专用培养皿上的HUVEC 30 min后,再加入rTpp47刺激HUVEC,后续步骤同上,共聚焦显微镜下观察骨架蛋白F肌动蛋白排列变化。
三、统计学分析
结 果
一、rTpp47对血管内皮细胞通透性的影响
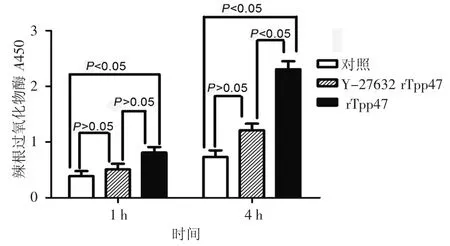
图1 rTpp47对HUVEC单层通透性的影响 a:P<0.05;b:P>0.05
rTpp47刺激HUVEC单层模型1 h时HRP流量为(0.81±0.10),通路抑制剂Y-27632预处理组HRP流量为(0.51±0.10),阴性对照组为(0.39±0.09),SNK-q统计分析显示rTpp47组HRP流量显著高于阴性对照组,差异有统计学意义(P<0.05)。通路抑制剂Y-27632预处理组与单用rTpp47组及阴性对照组比较,差异无统计学意义(均P>0.05)。rTpp47刺激HUVEC单层模型4 h时HRP流量(2.31±0.14)较同时期阴性对照组(0.73±0.12)差距明显加大,差异有统计学意义(P<0.05),Y-27632预处理组HRP流量(1.21±0.12)显著低于单用rTpp47组(2.31±0.14),差异有统计学意义(P<0.05),但与阴性对照组(0.73± 0.12)比较,差异无统计学意义(P>0.05)。rTpp47刺激HUVEC单层模型1 h时HRP流量为(0.81±0.10),显著高于阴性对照组(0.39±0.09,P<0.05),4 h时HRP流量(2.31±0.14)较同时期阴性对照组(0.73±0.12)差距明显加大,差异有统计学意义(P<0.05)。通路抑制剂Y-27632预处理组1 h时HRP流量(0.51±0.10)与单用rTpp47刺激组(0.81±0.10)及阴性对照组(0.39±0.09)相比,差异无统计学意义(均P>0.05);4 h时,Y-27632预处理组HRP流量(1.21±0.12)明显低于单用rTpp47刺激组(2.31±0.14),差异有统计学意义(P<0.05),但与阴性对照组(0.73±0.12)相比差异无统计学意义(P>0.05)。提示rTpp47可显著提高HUVEC对大分子物质的通透性,Y-27632可部分抑制rTpp47诱导的血管内皮细胞通透性。见图1。
二、rTpp47对细胞骨架系统重排的影响
激光共聚焦显微镜显示,阴性对照组HUVEC内的F肌动蛋白主要富集于细胞膜的周边,分布均匀(图2A),rTpp47刺激后,细胞周边的F肌动蛋白明显减少,胞质中出现密集的应力纤维(图2B)。Y-27632预处理组HUVEC中应力纤维少于单用rTpp47刺激组,但稍多于阴性对照组(图2C)。提示rTpp47可刺激F肌动蛋白在胞质中表达,Y-27632可部分抑制rTpp47诱导的细胞骨架系统改变。
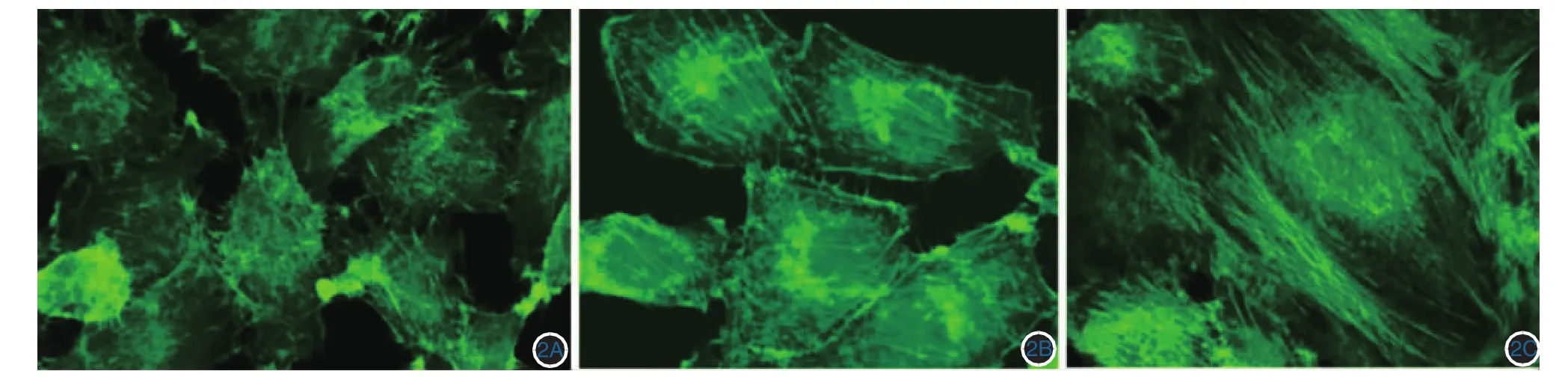
图2 rTpp47对细胞骨架蛋白F肌动蛋白重排的影响 2A:阴性对照组,F肌动蛋白主要富集于细胞膜周边,胞质中应力纤维较少;2B:Y-27632预处理组,胞质中见少量应力纤维;2C:rTpp47刺激组,胞质中见大量应力纤维
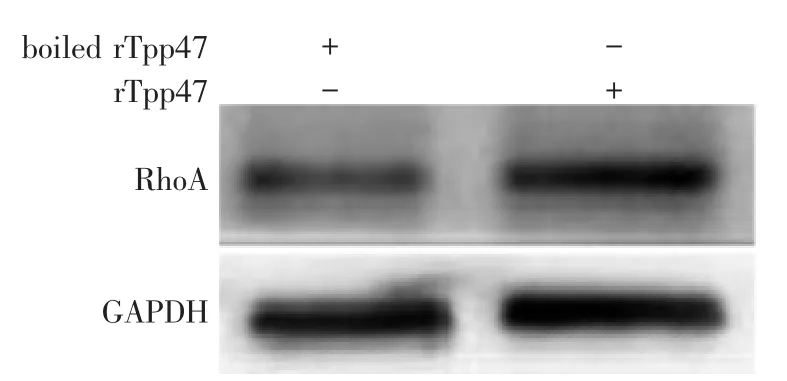
图3 Western印迹检测rTpp47对RhoA蛋白表达的影响
三、rTpp47对RhoA蛋白表达的影响
Western印迹检测rTpp47刺激后HUVEC中RhoA蛋白的表达,结果显示,rTpp47刺激组HUVEC中的RhoA蛋白表达水平显著高于于阴性对照组,提示rTpp47可促进RhoA蛋白表达。见图3。
讨 论
血管内皮屏障是由内皮细胞单层和基膜组成的一层半选择性通透屏障,它控制着血管内外物质交换。炎症介质、病原微生物及其代谢成分均可损伤内皮屏障功能,使其通透性增高,血浆蛋白渗出,引起组织、器官水肿和功能障碍,血管内皮细胞的炎症反应是血管内皮屏障功能障碍的基础[6-7]。梅毒螺旋体介导的炎症和免疫反应是梅毒发病的基础,主要由位于螺旋体外膜及细胞周质的膜蛋白发挥作用。对多种梅毒螺旋体膜蛋白的研究结果显示,膜蛋白可激活炎症细胞,释放炎症介质、细胞因子,造成组织损伤或诱导宿主细胞凋亡,为主要的炎症激动剂[8-9]。前期研究中,我们用rTpp47刺激HUVEC,结果显示rTpp47可促进内皮细胞的增殖、分泌黏附分子及促进内皮细胞与淋巴细胞之间的粘附,提示Tpp47在梅毒的血管内皮细胞炎症反应发生中可能起重要作用。我们利用HUVEC构建细胞单层模型,观察Tpp47对血管内皮通透的影响。我们选择HRP作为示踪剂,检测Tpp47对血管内皮细胞大分子物质通透性的影响,结果显示,rTpp47刺激HUVEC单层后,HRP流量显著增加,说明Tpp47可提高HUVEC单层通透性。
血管内皮通透性主要由内皮细胞间连接产生的黏附力与细胞肌动蛋白骨架所产生的张力共同维持[10-11]。生理状态下,血管内皮细胞内的两种肌动蛋白处于平衡状态,当受到外界信号刺激后,内皮细胞内游离的G肌动蛋白单体会结合形成聚合状态的F肌动蛋白,并且通过自身螺旋形成微丝,这一过程称为细胞骨架重排,F肌动蛋白重排可使内皮细胞收缩,细胞间裂隙产生,血管内皮通透性增加[12]。本研究中,我们发现rTpp47可诱导细胞骨架蛋白重组。肌动蛋白与细胞-细胞之间的紧密连接和粘附连接有密切联系,rTpp47诱导细胞骨架重组,细胞间连接松散,细胞间出现缝隙,血管内皮细胞通透性增高。
研究发现,RhoA/ROCK信号转导通路在炎症介质、细胞因子诱导的内皮细胞骨架重组中起重要作用[13-14]。本研究Western印迹实验结果显示,rTpp47可诱导血管内皮细胞中RhoA蛋白的表达,进而激活RhoA/ROCK信号转导通路。当Rho激酶被激活时,活化的Rho激酶一方面失活LIM激酶介导的cofilin(一种分割肌动蛋白的蛋白质)而调制肌动蛋白细胞骨架。另一方面通过磷酸化肌球蛋白磷酸酶靶亚单位抑制肌球蛋白磷酸酶活性,以及直接磷酸化肌球蛋白轻链(MLC)的调节轻链增加MLC磷酸化。Y-27632是RhoA下游效应器ROCK的特异抑制剂,可与ROCK催化位点结合而抑制激酶活性[15]。我们用Y-27632预处理HUVEC单层模型后发现,Y-27632可部分减轻rTpp47诱导的血管内皮细胞通透性增高及细胞骨架蛋白F肌动蛋白重排,提示RhoA/ROCK信号通路参与rTpp47诱导的血管内皮细胞通透性改变。
[1]Lee JH,Choi HJ,Jung J,et al.Receptors forTreponema pallidumattachment to the surface and matrix proteins of cultured human dermal microvascular endothelial cells[J].Yonsei Med J,2003,44(3):371-378.DOI:10.3349/ymj.2003.44.3.371.
[2]张瑞丽,王千秋.梅毒螺旋体膜蛋白Tpp47对血管内皮细胞黏附功能影响的实验研究[J].中华皮肤科杂志,2014,47(5):328-332.DOI:10.3760/cma.j.issn.0412-4030.2014.05.007.
Zhang RL,Wang QQ.Treponema pallidummembrane protein Tpp47 promotes the adhesion ability of vascular endothelial cellsin vitro:an experimental study [J].Chin J Dermatol,2014,47(5):328-332.DOI:10.3760/cma.j.issn.0412-4030.2014.05.007.
[3]Vandenbroucke E,Mehta D,Minshall R,et al.Regulation of endothelial junctional permeability[J].Ann N Y Acad Sci,2008,1123:134-145.DOI:10.1196/annals.1420.016.
[4]Spindler V,Schlegel N,Waschke J.Role of GTPases in control of microvascular permeability[J].Cardiovasc Res,2010,87(2):243-253.DOI:10.1093/cvr/cvq086.
[5]McKenzie JA,Ridley AJ.Roles of Rho/ROCK and MLCK in TNF-alpha-induced changes in endothelial morphology and permeability[J].J Cell Physiol,2007,213(1):221-228.
[6]Spiropoulou CF,Srikiatkhachorn A.The role of endothelial activation in dengue hemorrhagic fever and hantavirus pulmonary syndrome[J].Virulence,2013,4(6):525-536.DOI:10.4161/viru.25569.
[7]Wei Z,Yang J,Xia YF,et al.Cardamonin protects septic mice from acute lung injury by preventing endothelial barrier dysfunction[J].J Biochem Mol Toxicol,2012,26(7):282-290.DOI:10.1002/jbt.21420.
[8]Giacani L,Molini B,Godornes C,et al.Quantitative analysis of tpr gene expression inTreponema pallidumisolates:Differences among isolates and correlation with T-cell responsiveness in experimental syphilis[J].Infect Immun,2007,75(1):104-112.DOI:10.1128/IAI.01124-06.
[9]Sellati TJ,Waldrop SL,Salazar JC,et al.The cutaneous response in humans toTreponema pallidumlipoprotein analogues involves cellular elements of both innate and adaptive immunity [J].J Immunol,2001,166 (6):4131-4140.DOI:10.4049/jimmunol.166.6.4131.
[10]Wiggins-Dohlvik K,Merriman M1,Shaji CA,et al.Tumor necrosis factor-α disruption of brain endothelial cell barrier is mediated through matrix metalloproteinase-9[J].Am J Surg,2014,208(6):954-960.DOI:10.1016/j.amjsurg.2014.08.014.
[11]Kawai Y,Kaidoh M,Yokoyama Y,et al.Pivotal roles of lymphatic endothelial cell layers in the permeability to hydrophilic substances through collecting lymph vessel walls:effects of inflammatory cytokines[J].Lymphat Res Biol,2014,12 (3):124-135.DOI:10.1089/lrb.2014.0002.
[12]Wang J,Sun L,Si YF,et al.Overexpression of actin-depolymerizing factor blocks oxidized low-density lipoprotein-induced mouse brain microvascular endothelial cell barrier dysfunction[J].Mol Cell Biochem,2012,371 (1-2):1-8.DOI:10.1007/s11010-012-1415-7.
[13]Liu X,Yan F,Yao H,et al.Involvement of RhoA/ROCK in insulin secretion of pancreatic β-cells in 3D culture [J].Cell Tissue Res,2014,358(2):359-369.DOI:10.1007/s00441-014-1961-2.
[14]Xie X,Chen C,Huang K,et al.RhoA/rho kinase signaling reduces connexin43 expression in high glucose-treated glomerular mesangial cells with zonula occludens-1 involvement[J].Exp Cell Res,2014,327(2):276-286.DOI:10.1016/j.yexcr.2014.07.019.
[15]Wei B,Shang YX,Li M,et al.Cytoskeleton changes of airway smooth muscle cells in juvenile rats with airway remodeling in asthma and the RhoA/ROCK signaling pathway mechanism[J].Genet Mol Res,2014,13 (1):559-569.DOI:10.4238/2014.January.22.2.
Treponema pallidummembrane protein Tpp47 regulates the permeability of vascular endothelial cells via the RhoA/ROCK signal pathway:an experimental study
Zhang Ruili,Wang Qianqiu
Department of Dermatology,Wuxi No.2 People′s Hospital,Wuxi 214002,Jiangsu,China (Zhang R);Department of Sexually Transmitted Disease Clinical Management,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Wang QQ)
ObjectiveTo investigate mechanisms underlying the regulation of the permeability of vascular endothelial cells by theTreponema pallidummembrane protein Tpp47.MethodsHuman umbilical vascular endothelial cell(HUVEC)monolayers were established as a model,and were directly cultured with the presence of recombinant Tpp47 protein (rTpp47-treated group),or boiled and inactivated rTpp47 (negative control group).Some HUVEC monolayers,which were pretreated with the RhoA/ROCK signal pathway inhibitor Y-27632 for 30 minutes and then cultured with the presence of rTpp47,served as the pretreatment group.After 1-and 4-hour additional culture,enzymelinked immunosorbent assay(ELISA)was performed to estimate the permeability of these cell monolayers to horseradish peroxidase (HRP).After 12 hours of culture,rhodamine-phalloidin was used to stain cytoskeletal proteins,and confocal laser scanning microscopy was performed to observe the arrangement of the cytoskeletal protein F-actin.Western-blot analysis was conducted to measure the expressions of RhoA in HUVECs treated with rTpp47 or inactivated rTpp47.ResultsThe supernatant level of HRP(expressed as the absorbance value at 450 nm)was significantly higher in the rTpp47-treated group than in the negative control group(0.81±0.10 vs.0.39±0.09,P<0.05),but no significant difference was observed between the pretreatment group (0.51±0.10)and rTpp47-treated group or negative control group(bothP>0.05)after 1-hour culture.Similarly,the rTpp47-treated group showed significantly increased levels of HRP compared with the pretreatment group and negative control group(2.31±0.14 vs.1.21±0.12 and 0.73±0.12,bothP< 0.05),while there was no significant difference between the pretreatment group and negative control group after 4-hour culture.The expression of RhoA in HUVECs treated with rTpp47 was significantly higher than that in those treated with inactivated rTpp47.Confocal laser scanning microscopy showed that rTpp47 treatment led to the rearrangement of F-actin in HUVECs followed by the formation of stress fibers in cytoplasm,while Y-27632 could partly inhibit the rearrangement of F-actin.ConclusionThe recombinantTreponema pallidummembrane protein Tpp47 can regulate the permeability of vascular endothelial cells through the RhoA/ROCK signal pathway.
Treponema pallidum;Endothelium,vascular;Permeability;Umbilical veins;Actins;Tpp47;RhoA/ROCK signaling pathway
Wang Qianqiu,Email:doctorwqq@163.com
2015-04-24)
(本文编辑:吴晓初)
王千秋,Email:doctorwqq@163.com
10.3760/cma.j.issn.0412-4030.2016.01.005
江苏省自然科学基金(BK2010136),江苏省临床医学科技专项(BL2012003)
Fund programs:Natural Science Foundation of Jiangsu Province of China(BK2010136);Jiangsu Provincial Special Program of Medical Science(BL2012003)
