MiR-146a在长波紫外线诱导人皮肤成纤维细胞光老化中作用机制的研究
2016-11-06李晓李巍杨清华李之珩古桂雄
李晓 李巍 杨清华 李之珩 古桂雄
215003苏州大学附属儿童医院儿童保健科(李晓、古桂雄),皮肤科(李巍),普通外科(杨清华),实验室(李之珩)
·论著·
MiR-146a在长波紫外线诱导人皮肤成纤维细胞光老化中作用机制的研究
李晓 李巍 杨清华 李之珩 古桂雄
215003苏州大学附属儿童医院儿童保健科(李晓、古桂雄),皮肤科(李巍),普通外科(杨清华),实验室(李之珩)
目的 探讨长波紫外线(UVA)诱导人皮肤成纤维细胞(HSF)光老化中miR-146a的表达情况,以及上调miR-146a表达对其靶基因Smad4及细胞光老化的影响。方法 以10 J/cm2UVA照射HSF(UVA照射组),分别在0、3、7、14 d提取RNA,实时定量PCR检测miR-146a的表达量。通过慢病毒转染上调miR-146a的表达(miR-146a过表达组),在7 d、14 d后用荧光显微镜观察转染效率,并通过实时定量PCR验证细胞内miR-146a表达量。空白对照组为正常培养的HSF(不做任何处理),miR-146a过表达组为慢病毒转染HSF后,再用UVA照射。MTT法检测空白对照组、UVA照射组、miR-146a过表达组、miR-146a过表达组细胞增殖吸光度(A值),实时定量PCR检测各组细胞内老化相关基因p53、p16和p21 mRNA的表达,Western印迹法检测各组细胞内Smad4蛋白表达。采用重复测量的方差分析、析因设计的方差分析进行统计学分析。结果 重复测量的方差分析显示,随培养时间的延长,UVA照射组和空白对照组miR-146a的表达量均逐渐下降(F=213.840,P<0.01);UVA照射组表达量低于空白对照组(F=52.55,P<0.01),且照射时间越长,下调越明显。慢病毒转染HSF后,细胞内均有较高的荧光表达,miR-146a过表达组在第7天(10.31±0.17)与第14天时(9.65±0.19)的miR-146a表达量差异无统计学意义(P>0.05),但较空白对照组(分别为8.33±0.13和7.86±0.11)显著增高,组间差异有统计学意义(F=42.49,P<0.01)。析因设计的方差分析显示,UVA照射对细胞增殖活性有抑制作用(P<0.01),UVA照射组、UVA+miR-146a组细胞增殖均分别低于空白对照组、miR-146a过表达组(P<0.01);慢病毒转染上调miR-146a的表达对细胞增殖活性也有影响(P<0.01),但miR-146a过表达组与空白对照组差异无统计学意义(P>0.05),UVA+miR-146a组显著高于UVA照射组(P<0.01)。实时定量PCR和Western印迹法结果显示,UVA照射可上调p21、p53、p16 mRNA的表达(均P<0.01),同时对细胞内Smad4蛋白表达有促进作用(P<0.01);UVA照射组、UVA+miR-146a组p21、p53、p16 mRNA和Smad4蛋白表达均分别高于空白对照组、miR-146a过表达组(均P<0.01),而miR-146a过表达组与空白对照组相比差异均无统计学意义(均P>0.05),UVA+miR-146a组均显著低于UVA照射组(均P<0.01)。结论 在UVA诱导光老化的HSF中,miR-146a的表达受到抑制,上调其表达能够抑制Smad4的表达,促进光老化细胞增殖,起到抗细胞光老化的作用。
成纤维细胞;紫外线;皮肤衰老;微RNAs;Smad4蛋白质;miR-146a
微RNAs(miRNAs)在人类基因中仅占1%~5%,却能调控至少30%人类蛋白编码基因和大约60%mRNA。我们前期对长波紫外线(UVA)诱导成纤维细胞光老化中差异表达的miRNA进行了基因芯片筛选,发现 miR-146a的表达出现下调[1]。MiR-146a 是miRNAs家族成员之一,参与细胞增生、免疫、炎症等多种生物学过程[2]。Targetscan软件分析显示,作为miR-146a的靶点基因,Smad4是信号转导蛋白Smads的功能活动中心,编码的信号转导蛋白在组织的发育、再生及修复中起重要作用[3]。本研究中,我们建立了UVA照射诱导的原代人皮肤成纤维细胞(HSF)的光老化模型[1],检测HSF中miR-146a和Smad4的表达,并用慢病毒转染上调miR-146a的表达,观察其对细胞增殖和光老化的影响,探讨其内在的分子机制。
资料与方法
一、标本来源
本研究方案经苏州大学附属儿童医院伦理委员会审核批准,按“知情同意,自愿参加”的原则,在本院泌尿外科中收集3~12岁健康儿童包皮环切术后皮肤标本,家属签署知情同意书。
二、主要试剂与仪器
DMEM培养基、胎牛血清、胰蛋白酶(美国Gibco公司);UVA辐射仪(SH4 A型,上海希格玛高技术有限公司,波长320~400 nm,辐射强度25 mW/cm2)、噻唑兰(MTT)、分散酶、胶原酶、β 肌动蛋白、Smad4鼠单克隆抗体(美国Sigma公司);Trizol(美国Invitrogen公司);增强化学发光试剂(ECL)(美国Bethyl公司);山羊抗小鼠IgG抗体(上海碧云天生物技术有限公司);miR-146a慢病毒载体、慢病毒转染试剂盒(上海吉凯基因化学技术有限公司);兔抗人Smad4多克隆抗体、实时定量PCR试剂盒、SYBR荧光染料试剂(日本TaKaRa公司);ABI7300实时定量PCR仪(美国应用生物系统公司)。
三、细胞培养
包皮块用含双抗的PBS漂洗3次,清除皮下脂肪和血管,剪成3 mm×1 mm的皮条,37℃下用分散酶消化3~4 h,分离表皮与真皮。将真皮剪成碎沫状,在胶原酶作用下37℃消化2~4 h。用200目筛网过滤,离心后将细胞重悬于含10%胎牛血清和1%青霉素+链霉素的DMEM培养基中,37℃5%CO2培养箱中培养。将处于亚融合状态对数生长期细胞以0.02%EDTA和0.25%胰酶消化传代,10代以内的细胞用于后续实验。
四、实验分组与处理
将培养的HSF分为4组:①空白对照组:不做任何处理;②UVA照射组:照射UVA,分别于照射第 0、3、7、14天提取 UVA照射组和空白对照组HSF的总RNA,实时定量PCR检测miR-146a的表达量;③miR-146a过表达组:慢病毒转染HSF,并于转染后第7、14天用荧光显微镜观察转染效率,并通过实时定量PCR验证细胞内miR-146a表达量;④UVA+miR-146a组:慢病毒转染HSF后,用UVA照射,照射方法同UVA照射组。
UVA照射步骤:吸去细胞培养液,PBS冲洗2次,再加入少量PBS覆盖底面,培养皿于冰水中照光。以宽谱UVA照射,照射剂量为10 J/cm2,连续照射14 d[1]。照射后弃去 PBS,重新加入培养基。
慢病毒转染HSF:miR-146a慢病毒表达载体的构建和鉴定由南京吉凯生物技术有限公司设计完成,并按照慢病毒转染手册转染HSF。
五、RT-PCR 检测 p53、p21、p16 mRNA 及 miR-146a的表达
采用Trizol试剂盒提取各组总RNA。按反转录试剂盒说明书配制反应体系,总体积20 μl,37℃反转录15min,85℃5s使反转录酶失活,即获得cDNA,置-20℃冰箱中保存。用染料法(SYBR GreenⅠ)进行相对定量分析。PCR反应体系共20 μl,包括SYBR 10 μl,ROX Reference Dye(× 50)0.4 μl,双蒸水6 μl,上游和下游引物各 0.8 μl,cDNA 2 μl。各引物序列见表1,引物由南京迪瑞生物技术有限公司合成。两步法实时定量PCR:95℃5 s;95℃5 s,60℃30 s,40个循环。每循环1次就收集1个荧光强度数据,建立实时扩增曲线,其产物荧光强度与其表达量,即模板中目的基因的丰度呈正相关。以β肌动蛋白作为内参照,用2-ΔΔCt法计算目的基因的相对表达值。每个样品设3个复孔,结果取平均值。
六、MTT法检测细胞增殖活性
各组成纤维细胞经常规传代培养至对数生长期,倒掉旧培养液,加入0.25%胰酶消化,待细胞变圆成单个,加入完全培养液轻轻吹打,使其成单细胞悬液。收集细胞至离心管中,280×g离心5 min。弃去上清液,沉淀加入培养基悬浮混匀,调整细胞密度为5×104/ml~10×104/ml。96孔板中每孔加入细胞悬液100 μl,使每孔细胞数为 5× 103~ 10 × 103。混匀后置37℃、5%CO2培养箱培养24 h,每组设5个复孔。取出96孔板,吸去上清液,更换新的培养基,每孔加 5 g/L MTT 溶液 20 μl,37 ℃、5%CO2培养箱培养 4 h,倾去上清液,每孔加入 DMSO 150 μl,在水平摇床上充分振荡10 min,酶标仪490 nm下测定各孔A值,A值越高说明细胞增殖活性越强。

表1 PCR引物序列
七、Western印迹法检测Smad4蛋白的表达量
根据实验设计的分组,即空白对照组、UVA照射组、miR-146a过表达组、UVA照射+miR-146a过表达组,以10 J/cm2UVA照射成纤维细胞连续14 d建立光老化模型,培养以后收集细胞,用预冷PBS洗涤3次,将细胞重悬于裂解液中,冰浴30 min,使细胞充分裂解。然后4℃8 000×g离心5 min,收集上清液进行蛋白质定量。各组取等量蛋白质,经10%SDS-PAGE分离后,半干转膜至PVDF膜上,封闭后与一抗结合,4℃摇床过夜;TBST洗涤后与二抗结合反应,同上洗涤,用ECL发光显色,以β肌动蛋白作为对照。
八、统计学分析
结 果
一、UVA照射HSF对miR-146a表达的影响
照射前,UVA照射组HSF miR-146a表达量与空白对照组差异无统计学意义;UVA照射第3、7、14天,UVA照射组miR-146a表达量持续下调,且低于同时间空白对照组(均P<0.05)。见图1。重复测量的方差分析显示,随着培养时间的延长,miR-146a表达量逐渐下降(F=213.840,P<0.01);UVA 照射组miR-146a表达量较对照组出现下调(F=52.55,P<0.01),且照射时间越长,下调越明显;培养时间与分组之间存在交互作用,即两组miR-146a表达量随时间的变化趋势不同(F=21.241,P<0.01)。
二、慢病毒介导miR-146a的过表达及实时定量PCR验证
慢病毒载体转染HSF后,第7天和14天时细胞内均有较强的荧光表达(图2)。实时定量PCR结果显示,miR-146a过表达组在第7天(10.31±0.17)与第14天时(9.65±0.19)的miR-146a表达量差异无统计学意义(F=1.989,P>0.05),但较空白对照组(分别为8.33±0.13和7.86±0.11)显著增高,组间差异有统计学意义(F=42.49,P<0.01),且时间与分组无交互作用(F=0.054,P>0.05)。
三、上调miR-146a表达对细胞增殖的影响
MTT结果显示,空白对照组、UVA照射组、miR-146a过表达组、UVA+miR-146a组细胞增殖(A值)分别为 0.8072± 0.0505、0.2518± 0.0595、0.7957±0.0805和0.5959±0.0281。析因设计的方差分析显示,UVA照射对细胞增殖活性有抑制作用(F=128.033,P<0.01);慢病毒转染上调miR-146a的表达对细胞增殖活性也有影响(F=24.838,P<0.01),UVA照射和慢病毒转染上调miR-146a的表达有交互作用(F=28.392,P<0.01)。UVA照射的单独效应分析显示:UVA照射组、UVA+miR-146a组细胞增殖均分别低于空白对照组、miR-146a过表达组(P<0.01);慢病毒转染上调miR-146a表达的单独效应分析显示:miR-146a过表达组细胞增殖A值与空白对照组相比差异无统计学意义(P>0.05),UVA+miR-146a组细胞增殖A值显著高于UVA照射组(P<0.01)。
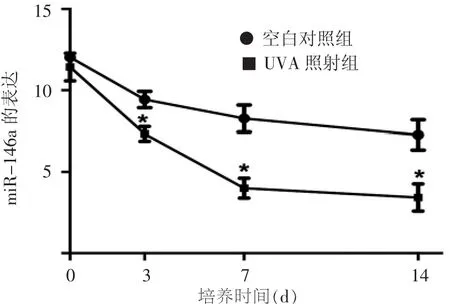
图1 UVA照射人皮肤成纤维细胞对miR-146a表达的影响
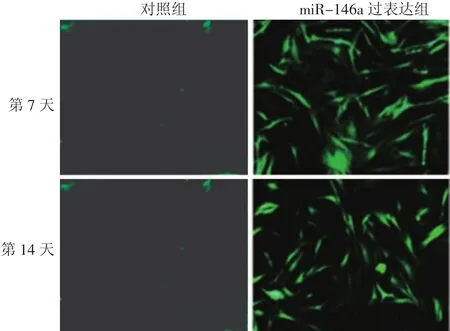
图2 miR-146a慢病毒转染成纤维细胞后第7、14天荧光表达情况(×100) 转后第7、14天时细胞内均有较强的荧光表达,表明miR-146a慢病毒转染成功
四、上调miR-146a表达对老化相关基因的影响
析因设计的方差分析显示,UVA照射可上调细胞老化相关基因p21、p53、p16 mRNA的表达(F=444.909、275.110、127.228,均 P<0.01),慢病毒转染miR-146a后,则可下调各基因mRNA的表达(F=41.141、28.178、25.932,P<0.01),UVA 照射与慢病毒转染上调miR-146a的表达有交互作用(F=41.785、43.101、29.413,均 P<0.01)。各单独效应分析显示:UVA 照射组、UVA+miR-146a组 p21、p53、p16 mRNA的表达均分别高于空白对照组、miR-146a过表达组(均P<0.01);而miR-146a过表达组p21、p53、p16 mRNA的表达与空白对照组相比差异均无统计学意义(均 P>0.05),UVA+miR-146a组 p21、p53、p16 mRNA的表达均显著低于UVA照射组(均P<0.01)。见图 3。
五、miR-146a作用于靶基因Smad4的效应
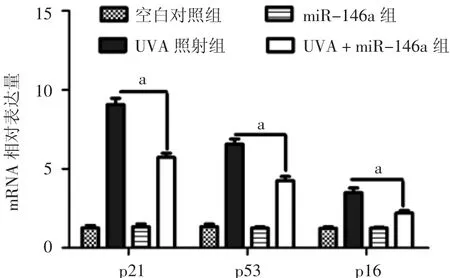
图3 UVA照射14 d后各组成纤维细胞老化相关基因p21、p53、p16 mRNA表达 a:与UVA照射组相比,miR-146a慢病毒转染成纤维细胞并UVA照射后,各老化相关蛋白表达显著降低(P<0.01)
Western印迹结果显示,空白对照组、UVA照射组、miR-146a过表达组、UVA+miR-146a组Smad4的表达量分别为 0.24±0.055、1.74±0.238、0.22±0.26和0.88±0.207。见图4。析因设计的方差分析显示,UVA照射对细胞内Smad4蛋白表达有促进作用(F=133.981,P<0.01);慢病毒转染对 Smad4表达也有影响(F=22.139,P<0.01),UVA照射和慢病毒转染上调miR-146a表达有交互作用(F=20.076,P<0.01)。各单独效应分析显示,UVA照射组、UVA+miR-146a组细胞内Smad4蛋白表达量均分别高于空白对照组、miR-146a过表达组(P<0.01);而miR-146a过表达组细胞内Smad4蛋白表达量与空白对照组相比差异无统计学意义(P>0.05),UVA+miR-146a组细胞内Smad4蛋白表达量显著低于UVA照射组(P<0.01)。
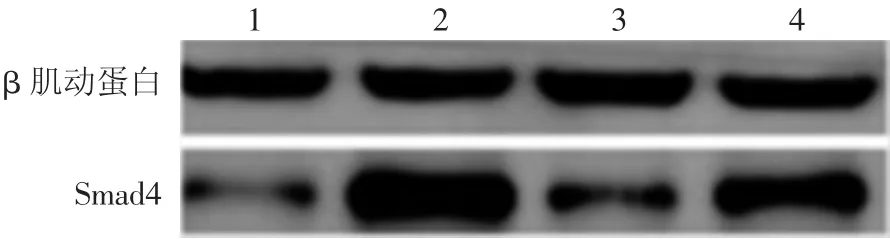
图4 Western印迹法检测UVA照射14 d后各组人皮肤成纤维细胞Smad4蛋白表达 1:空白对照组;2:UVA照射组;3:miR-146a过表达组;4:UVA+miR-146a组
讨 论
光老化是一个复杂的过程,由多种基因和生长因子调控。UVA照射在光老化的发病机制中发挥重要作用,且长期UVA照射可诱发皮肤癌[4]。MiRNAs通过作用于特定的靶基因发挥作用,在转录后水平调节基因的表达[5],并已被用于疾病的诊断、治疗和预后[6]。
本课题组前期研究发现,miR-146a在细胞光老化中出现下调[1]。MiR-146是miRNAs家族中的一员,包括两个进化保守的miRNA基因:miR-146a和miR-146b。两者的成熟序列仅在3′端存在两个碱基的差异,功能大致相同。MiR-146是第1个被发现在免疫系统中具有调节作用的miRNA,表达于T细胞、B细胞、单核细胞及巨噬细胞等[7]。新近研究发现,miR-146a作用于Numb的mRNA可以增加小鼠黑素瘤细胞的增殖能力,而Numb是Notch信号的抑制因子[8]。
本研究结果显示,UVA可以诱导HSF中miR-146a的下调,提示其在光老化的发生发展过程中可能发挥重要的作用。用慢病毒转染成纤维细胞,上调miR-146a的表达,经过UVA照射诱导细胞光老化后,发现miR-146a表达的上调能促进光老化细胞的增殖活性,并能抑制老化相关基因p53、p16和p21 mRNA的表达。推测miR-146a具有抗光老化作用。
本课题组前期通过生物信息学方法预测miR-146a可能作用的靶基因[1],并通过Western印迹法进行验证,结果显示,无UVA照射时,miR-146a对Smad4表达无作用;有UVA照射时,miR-146a对Smad4具有一定调控作用,能够抑制Smad4的表达。导致这种现象的可能原因是无UVA照射时,Smad4的表达处于基础水平,而miR-146a在应急条件下才发挥作用。Smad4是信号转导蛋白Smads的功能活动中心,编码的信号转导蛋白主要参与转化生长因子β(TGF-β)超家族信号在细胞内的转导。TGF-β是一种多功能多肽,在组织的发育、再生及修复中起重要作用。TGF-β还是一种具有多功能活性的细胞因子,可以调节细胞增殖、分化和凋亡,对多种细胞因子有重要影响[9-10]。研究表明,miR-146a可通过作用于Smad4影响TGF-β通路,从而调节细胞的增殖和分化[11]。另有研究表明,Smad4可以抑制肿瘤细胞的增殖,如胰腺癌[3]、胃癌[12]等。
综上所述,本研究证实,miR-146a在UVA诱导的光老化细胞中出现显著的表达下调,上调其表达则能降低老化相关蛋白的表达,增加光老化细胞的增殖能力,从而可以抗光老化。而miR-146a的调控作用极有可能是通过作用于靶基因Smad4来实现的。由此推断,miR-146a在光老化的发生和发展中具有调控靶基因的作用,这可能为将来治疗光老化提供药物靶点。
[1]Li W,Zhou BR,Hua LJ,et al.Differential miRNA profile on photoaged primary human fibroblasts irradiated with ultraviolet A[J].Tumour Biol,2013,34(6):3491-3500.DOI:10.1007/s13277-013-0927-4.
[2]Chan EK,Ceribelli A,Satoh M.MicroRNA-146a in autoimmunity and innate immune responses[J].Ann Rheum Dis,2013,72 Suppl 2:ii90-95.DOI:10.1136/annrheumdis-2012-202203.
[3]Singh P,Wig JD,Srinivasan R.The Smad family and its role in pancreatic cancer[J].Indian J Cancer,2011,48 (3):351-360.DOI:10.4103/0019-509X.84939.
[4]Gasparro FP.Sunscreens,skin photobiology,and skin cancer:the need for UVA protection and evaluation of efficacy [J].Environ Health Perspect,2000,108 Suppl 1:71-78.DOI:10.1289/ehp.00108s171.
[5]Iorio MV,Croce CM.MicroRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBO Mol Med,2012,4 (3):143-159.DOI:10.1002/emmm.201100209.
[6]Filipowicz W,Bhattacharyya SN,Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight?[J].Nat Rev Genet,2008,9 (2):102-114.DOI:10.1038/nrg2290.
[7]Williams AE,Perry MM,Moschos SA,et al.Role of miRNA-146a in the regulation of the innate immune response and cancer[J].Biochem Soc Trans,2008,36(Pt 6):1211-1215.DOI:10.1042/BST0361211.
[8]Forloni M,Dogra SK,Dong Y,et al.miR-146a promotes the initiation and progression of melanoma by activating Notch signaling[J].Elife,2014,3:e01460.DOI:10.7554/eLife.01460.
[9]Kane NM,Jones M,Brosens JJ,et al.TGFβ1 attenuates expression of prolactin and IGFBP-1 in decidualized endometrial stromal cells by bothSMAD-dependent and SMAD-independent pathways[J].PLoSOne,2010,5(9):e12970.DOI:10.1371/journal.pone.0012970.
[10]Xiao B,Zhu ED,Li N,et al.Increased miR-146a in gastric cancer directly targets SMAD4 and is involved in modulating cellproliferation and apoptosis[J].Oncol Rep,2012,27(2):559-566.DOI:10.3892/or.2011.1514.
[11]Liu Z,Lu CL,Cui LP,et al.MicroRNA-146a modulates TGF-β1-induced phenotypic differentiation in human dermal fibroblasts bytargeting SMAD4[J].Arch Dermatol Res,2012,304(3):195-202.DOI:10.1007/s00403-011-1178-0.
[12]Chen F,Zhuang M,Peng J,et al.Baicalein inhibits migration and invasion of gastric cancer cells through suppression of the TGF-βsignaling pathway[J].Mol Med Rep,2014,10(4):1999-2003.DOI:10.3892/mmr.2014.2452.
Role of miR-146a in ultraviolet A-induced photoaging of human skin fibroblasts and its mechanism
Li Xiao,Li Wei,Yang Qinghua,Li Zhiheng,Gu Guixiong
Department of Child Health Care,Children′s Hospital of Soochow University,Suzhou 215003,China (Li X,Gu GX);Department of Dermatology,Children′s Hospital of Soochow University,Suzhou 215003,China (Li W);Department of General Surgery,Children′s Hospital of Soochow University,Suzhou 215003,China(Yang QH);Laboratory of Children′s Hospital of Soochow University,Suzhou 215003,China(Li ZH)
Objective ToinvestigatemiR-146a-Smad4expressionduringultravioletA(UVA)-inducedphotoaging of human skin fibroblasts (HSFs),and to evaluate effects of up-regulation of miR-146a expression on its target gene Smad4 and cell photoaging.Methods HSFs were isolated from the prepuce,and subjected to primary culture and maintained up to 10thpassage.Then,the HSFs were classified into 4 groups:blank control group receiving no treatment,UVA group irradiated with 10 J/cm2UVA,miR-146a group transfected with a lentiviral vector expressing miR-146a,UVA+miR-146a group transfected with the lentiviral vector expressing miR-146a followed by UVA radiation.Real time PCR was performed to measure miR-146a expression in HSFs in the UVA group on day 0,3,7 and 14 after UVA radiation.Fluorescence microscopy was carried out to estimate transfection efficiency on day 7 and 14 in the miR-146a group after transfection,and real time PCR was performed to quantify miR-146a expression in these cells.Methyl thiazolyl tetrazolium(MTT)assay was conducted to evaluate proliferative activity of HSFs,real time PCR to quantify mRNA expressions of photoaging-related genes p53,p21 and p16,and Western blot analysis to measure Smad4 protein expression in these cells.Statistical analysis was carried out by using repeated-measures analysis of variance and factorial design analysis of variance.Results Repeated-measures analysis of variance showed that the expression of miR-146a decreased over time in both the UVA group and blank control group(F=213.840,P < 0.01),and significantly lower in the UVA group than in the blank control group (F=52.55,P<0.01),with the difference between the two groups increasing over time.After transfection with the lentiviral vector expressing miR-146a-Smad4,HSFs showed a strong fluorescence intensity of miR-146a.The expression level of miR-146a was significantly higher in the miR-146a group than in the blank control group on day 7 and 14 after transfection(10.31±0.17 vs.8.33±0.13 on day 7,9.65±0.19 vs.7.86±0.11 on day 14,F=42.49,P<0.01),but insignificantly different between day 7 and 14 in the miR-146a group (P>0.05).Factorial design analysis of variance showed that UVA radiation had an inhibitory effect on the proliferative activity of HSFs(P<0.01),whichwassignificantlylowerinthe UVAgroup than in the blank controlgroup(P <0.01),and lower in the UVA+miR-146a group than in the miR-146a group (P<0.01).The lentivirus-mediated up-regulation of miR-146a expression also affected cellular proliferative activity (P<0.01),which was significantly higher in the UVA+miR-146a group than in the UVA group(P < 0.01),but insignificantly different between the miR-146a group and blank control group(P > 0.05).Real time PCR and Western blot analysis both revealed that UVA radiation could increase the expressions of p53,p21 and p16 mRNAs as well as Smad4 protein(allP < 0.01).Concretely speaking,the expressions of p53,p21,p16 mRNAs and Smad4 proteinwereallsignificantlyhigherintheUVAgroupthanintheblankcontrolgroup (allP<0.01),andhigherintheUVA+miR-146a group than in the miR-146a group (allP<0.01),but significantly lower in the UVA+miR-146a group than in the UVA group(allP<0.01),and insignificantly different between the blank control group and miR-146a group(allP>0.05).Conclusion The expression of miR-146a is inhibited in UVA-induced photoaged HSFs,and its up-regulation may counteract cell photoaging by suppressing Smad4 expression in,and promoting proliferation of,photoaged HSFs.
Fibroblasts;Ultraviolet rays;Skin aging;MicroRNAs;Smad4 protein;miR-146a
s:Li Wei,Email:carfield1981@126.com;Gu Guixiong,Email:szggx000@163.com
李巍,Email:carfield1981@126.com;古桂雄,Email:szggx000@163.com
10.3760/cma.j.issn.0412-4030.2016.03.011
国家自然科学基金(81301380);江苏省自然科学基金(BK2012168)
Fund programs:National Natural Science Foundation of China(81301380);Natural Science Foundation of Jiangsu Province of China(BK2012168)
2015-05-18)
(本文编辑:周良佳 颜艳)
