动物扰动对湿地植物根区有机碳和氮形态的影响
2016-11-04王琪飞顾佳茹徐德福李映雪
王琪飞,顾佳茹,徐德福,李 鑫,李映雪,张 玉
(大气环境与装备技术协同创新中心/ 江苏省大气环境监测与污染控制高技术研究重点实验室,江苏 南京 210044)
动物扰动对湿地植物根区有机碳和氮形态的影响
王琪飞,顾佳茹,徐德福①,李 鑫,李映雪,张 玉
(大气环境与装备技术协同创新中心/ 江苏省大气环境监测与污染控制高技术研究重点实验室,江苏 南京 210044)
构建复合垂直流人工湿地,分别向复合垂直流人工湿地的下行池和上行池中加入蚯蚓和泥鳅,研究泥鳅和蚯蚓对人工湿地中植物根区基质有机碳和氮形态及含量的影响。结果表明,加入泥鳅后人工湿地植物根区基质的总有机碳(TOC)、易氧化有机碳(EOOC)、微生物量有机碳(MBC)、可溶性有机碳(DOC)和硝态氮平均含量分别增加16.7%、10.8%、19.1%、33.8%和68.4%,但铵态氮平均含量减少14%。加入蚯蚓后TOC、EOOC、MBC、DOC和硝态氮的含量分别增加74.6%、39.7%、40.4%、45.1%和91.8%;铵态氮平均含量下降42.8%。人工湿地中加入蚯蚓后有机碳、硝态氮和铵态氮含量的变化率比单独加入泥鳅高。相关分析表明,TOC、EOOC、MBC含量分别与硝态氮含量呈极显著正相关(P<0.01),加入动物提高了人工湿地植物根区有机碳含量,并促进人工湿地的硝化过程,增加硝态氮含量。
人工湿地;动物扰动;有机碳组分;硝态氮;铵态氮
湿地作为地球重要的碳汇,在陆地碳循环和全球气候变化中起到了重要作用。湿地碳循环不仅在全球碳循环中具有极其重要的地位,而且对全球的气候变化表现出较高的敏感性[1],湿地土壤有机质是湿地植物的最主要营养源,其含量直接影响着湿地生态系统的生产能力[2]。氮元素作为湿地中重要的营养元素之一,与土壤有机质的循环及迁移密切相关[3],碳、氮循环作为生态系统重要的功能过程之一,对人工湿地的运行起着重要作用。
蚯蚓(Eiseniafetida)在生态系统中扮演着消费者、分解者和调节者等多重作用,能够增加系统的稳定性。蚯蚓影响土壤中的碳循环。MARASHI等[4]研究表明,北美地区中Allolobophoracaliginosa和Octolasioncyaneum这2种蚯蚓每年能消化浅层土壤(15 cm)中10%的有机质。VAN RHEE[5]报道蚯蚓活动能提高牧草、小麦和三叶草的生物量,接种蚯蚓(A.caliginosa)处理组干物质量比无蚯蚓对照组分别提高3.5、1.6和7倍。SHUSTER等[6]通过连续3 a(每年春季和秋季)向土壤中加入蚯蚓,结果发现增加anecic类蚯蚓显著增加了土壤中0~10和10~20 cm平均有机碳含量。于建光等[7]指出接种蚯蚓和施用秸秆条件下能显著增加土壤碳的库存量。可见,蚯蚓对土壤有机碳有重要影响。湿地中有机碳含量受湿地类型和植物类型的影响。张文菊等[8]研究了洞庭湖湿地土壤有机碳垂直分布特征,得出洞庭湖3类湿地间有机碳的分布与组成存在一定差异。钟春棋等[9]对闽江口鳝鱼滩原生芦苇沼泽湿地进行研究,发现芦苇沼泽地的易氧化碳稳定性高,芦苇沼泽湿地受到人类活动影响后,轻组物质含量和有机碳含量均有不同程度的减少。目前,有关湿地土壤碳和氮的研究多集中于不同水分条件、植被类型、围垦年限和利用方式等环境因素[10]。有关动物扰动对于人工湿地有机碳及氮形态的影响则鲜见报道。该研究通过向人工湿地中加入蚯蚓和泥鳅(Misgurnusanguillicaudatus),研究动物对人工湿地碳氮含量及形态的影响,以期为动物扰动对人工湿地中碳、氮迁移转化的影响提供理论基础。
1 材料与方法
1.1 人工湿地系统
人工湿地系统位于南京信息工程大学生态园,采用由高低2个池子组合而成的复合垂直流人工湿地(图1)。高池为长60 cm、宽60 cm、高90 cm的进水池,称为下行池;低池为长60 cm、宽60 cm、高90 cm的出水池,称为上行池;上行池和下行池底部使用2个直径为5 cm的聚氯乙烯管相连接,在出水池外侧自上而下安装4个排水阀。用纱网分别将下行池和上行池分隔成3个区域,且分别在下行池和上行池区域1种植8株茭白,区域2种植6株美人蕉,区域3种植9株水菖蒲。实验用水为模拟的生活污水,采用硫酸铵、磷酸二氢钾、蛋白胨和葡萄糖配制而成,CODCr、ρ(氨氮)、ρ(TN)和ρ(TP)分别为191.8~249.9、10.9~17.4、13.9~27.5和1.7~3.8 mg·L-1。

图1 人工湿地示意
分别模拟4种复合垂直流人工湿地系统:(1)由基质〔V(细沙)∶V(水稻秸秆)=97∶3〕和植物构成(人工湿地Ⅰ)(CK);(2)基质〔V(细沙)∶V(水稻秸秆)=97∶3〕和植物组成,于上行池池中加入10条泥鳅(人工湿地Ⅱ);(3)基质〔V(细沙)∶V(水稻秸秆)=97∶3〕和植物组成,于上行池中加入10条泥鳅,下行池中加入1.5 kg蚯蚓(人工湿地Ⅲ);(4)基质〔V(细沙+青沙)∶V(水稻秸秆)=97∶3〕和植物组成,在上行池中加入10条泥鳅,下行池中加入1.5 kg蚯蚓(人工湿地Ⅳ)。
1.2 样品采集和分析
实验于2014年3月建设并运行,2014年12月中旬,分别取不同人工湿地不同植物种植区基质。取样前,将人工湿地中的水排干,一段时间后用小铲挖出整株植物,轻轻抖动植物根系,从根系上掉落下的基质为根区基质,剔除基质中的植物残体和其他杂物,并将基质样品分成2部分,一部分用于测定不同形态的有机碳含量;另一部分用于测定铵态氮和硝态氮含量。有机碳分别测定总有机碳(TOC)、易氧化有机碳(EOOC)、微生物量有机碳(MBC)和可溶性有机碳(DOC),其测定方法分别为:TOC含量采用重铬酸钾容量法-外加热法[11]107-109,EOOC含量采用高锰酸钾氧化法[12],DOC含量采用水浸提-有机碳分析仪[13],MBC含量采用氯仿熏蒸-K2SO4浸提法[11]231-232。铵态氮含量采用2 mol·L-1的KCl浸提,靛酚蓝比色法测定[11]159-160;硝态氮含量采用2 mol·L-1的KCL浸取,紫外分光光度法测定[14]。
1.3 数据分析
不同形态有机碳与铵态氮、硝态氮之间的相关性采用SPSS 19.0软件分析。
2 结果与分析
2.1 基质TOC含量
在加入蚯蚓初期有少量蚯蚓死亡,7月人工湿地Ⅲ和Ⅳ蚯蚓密度分别为2 300和2 500条·m-2;实验过程中除人工湿地Ⅱ有2条泥鳅死亡外,其他均正常生长。如图2所示,人工湿地Ⅱ上行池中TOC平均含量较人工湿地Ⅰ增加16.7%,说明泥鳅的扰动有利于提高人工湿地TOC含量。人工湿地Ⅲ下行池中TOC平均含量较人工湿地Ⅱ高74.6%。人工湿地Ⅳ上行池和下行池TOC平均含量较人工湿地Ⅲ分别增加48.2%和35.7%。
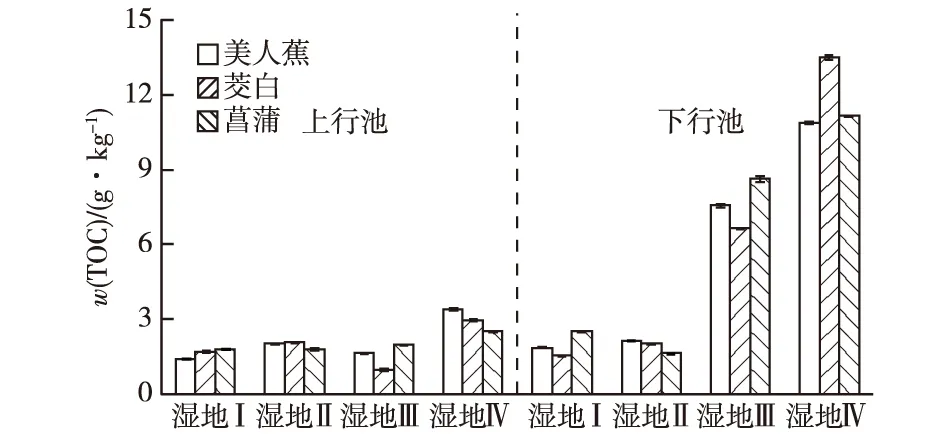
处理
2.2 基质EOOC含量
EOOC可用于指示土壤有机碳在短期内的变化特征[15],是反映土壤有机碳有效性和土壤质量的重要指标,EOOC占TOC的比例越大,表明土壤有机碳越高,稳定性越低[16]。人工湿地基质EOOC含量如图3所示,下行池EOOC含量总体高于上行池。人工湿地Ⅱ上行池中EOOC平均含量较人工湿地Ⅰ高10.8%,说明加入泥鳅可提高EOOC含量。人工湿地Ⅲ下行池中EOOC平均含量较湿地Ⅱ高39.7%。另外,湿地Ⅳ上行池和下行池中EOOC平均含量分别比人工湿地Ⅲ高27.2%和41.8%。
2.3 基质MBC含量
土壤微生物活性可以用来反映土壤污染程度,MBC是评价土壤的重要指标之一[17]。MBC是土壤有机碳中最活跃的部分,影响MBC的因素有温度、水分和植被类型等[18]。从图4可知,不同人工湿地MBC含量差异显著,最低为38.13 mg·kg-1,最高达174.87 mg·kg-1。人工湿地Ⅱ上行池中MBC平均含量较人工湿地Ⅰ高19.1%,说明泥鳅扰动也能提高人工湿地MBC含量。人工湿地Ⅲ下行池中MBC平均含量较人工湿地Ⅱ高40.4%,表明加入蚯蚓和泥鳅的复合影响大于泥鳅的单独影响。人工湿地Ⅳ上行池与下行池中MBC平均含量较人工湿地Ⅲ分别增加41.2%和30.1%。

处理

处理
2.4 基质DOC含量
由图5可以看出,人工湿地Ⅱ上行池中DOC平均含量较人工湿地Ⅰ高33.8%。人工湿地Ⅲ下行池中DOC平均含量比人工湿地Ⅱ高45.1%,可见加入蚯蚓同样可以增加人工湿地DOC含量,并且对DOC含量的影响较单独加入泥鳅更显著。湿地Ⅳ上行池中DOC平均含量较湿地Ⅲ高46.4%,湿地Ⅳ下行池中较湿地Ⅲ低22.3%。DOC主要来源于近期的植物枯枝落叶和土壤有机质中的腐殖质,不稳定,易淋失,并且易受季节变化影响[19]。因此,人工湿地Ⅳ下行池中DOC平均含量低于人工湿地Ⅲ,上行池中则高于人工湿地Ⅲ,这可能与复合垂直流人工湿地Ⅳ中更多的DOC从下行池流入上行池有关。有研究表明,有10%~40%的可溶性有机物能够被微生物直接吸收利用[20],因此,DOC含量的增加可能与加入动物后微生物数量增加有关。
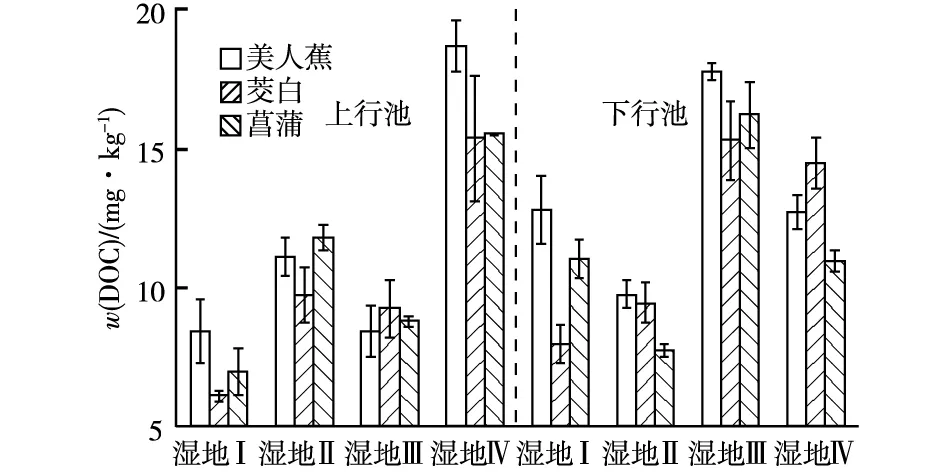
处理
2.5 基质硝态氮含量
从图6可以看出,人工湿地基质硝态氮含量范围在0.001~0.291 g·kg-1之间,硝态氮含量低的原因可能有2个方面:一是采用的基质为砂,对硝态氮的吸附能力弱;二是实验用水氨氮含量高,硝态氮含量低。人工湿地Ⅱ上行池硝态氮平均含量比人工湿地Ⅰ高68.4%,加入泥鳅显著增加了人工湿地硝态氮含量。人工湿地Ⅲ下行池硝态氮平均含量较人工湿地Ⅱ高91.8%,蚯蚓和泥鳅的共同扰动对硝态氮含量的影响较泥鳅单独扰动更大。人工湿地Ⅳ上行池和下行池中硝态氮平均含量比人工湿地Ⅲ分别增加33.2%和59.2%。
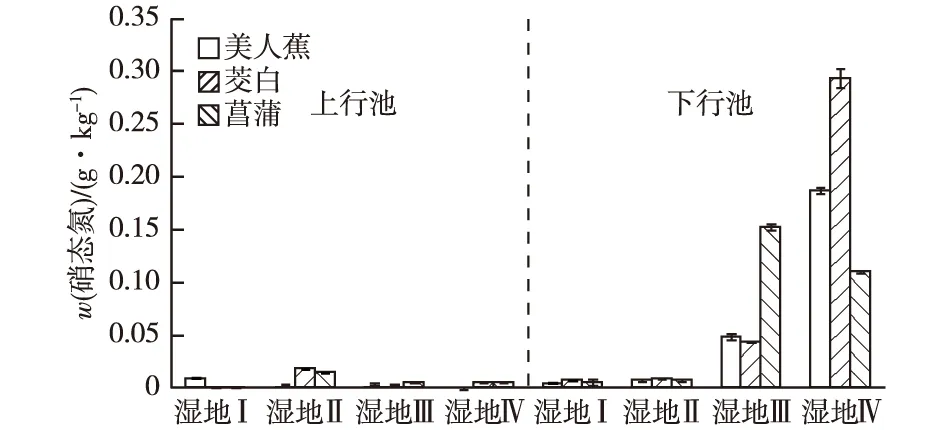
处理
2.6 基质铵态氮含量
从图7可知,人工湿地基质ρ(铵态氮)为1.143~11.534 mg·kg-1,人工湿地Ⅱ上行池铵态氮平均含量较人工湿地I减少14%,人工湿地Ⅲ下行池较人工湿地Ⅱ减少42.8%。同样地,人工湿地Ⅳ上行池和下行池铵态氮平均含量比人工湿地Ⅲ分别减少37%和43.6%。贺慧等[21]认为蚯蚓活动形成的洞穴为硝化细菌提供生长发育的空间,能提高土壤的硝化速率。王霞等[22]报道蚯蚓处理后的土壤硝态氮和矿质总氮明显增加。因此,动物扰动使基质铵态氮含量下降,其原因可能与动物扰动促进硝化而使铵态氮转化为硝态氮有关。

处理
2.7 基质氮含量与各有机碳组分的关系
基质中不同形态有机碳含量与硝态氮的相关分析如图8所示。基质TOC、MBC、EOOC与硝态氮之间均呈极显著正相关(P<0.01)。该结果与张景等[23]研究结果相似,即森林土壤中有机碳含量与硝态氮含量呈显著正相关。氮的转化包括有机氮矿化、形成铵态氮、铵态氮通过硝化作用形成硝态氮以及硝态氮可进一步通过反硝化作用形成氮气等。硝态氮与有机碳含量呈正相关,可能与有机碳为硝化细菌提供碳源、有利于硝化细菌的生长、促进硝化过程有关。蚯蚓能提高人工湿地的硝化潜力[24],因此,加入动物后,基质硝态氮含量增加可能与动物促进硝化反应、增加硝态氮含量有关。
3 结论
复合垂直流人工湿地加入泥鳅和蚯蚓后均能增加上行流和下行流人工湿地中有机碳和硝态氮含量,降低铵态氮含量,且蚯蚓和泥鳅的复合扰动对有机碳、硝态氮和铵态氮含量的影响均高于单独泥鳅。加入泥鳅和蚯蚓后,基质中硝态氮含量与TOC、EOOC、MBC含量呈极显著正相关,这表明动物扰动增加了人工湿地有机碳含量,促进了硝化过程,导致湿地中硝态氮含量增加。
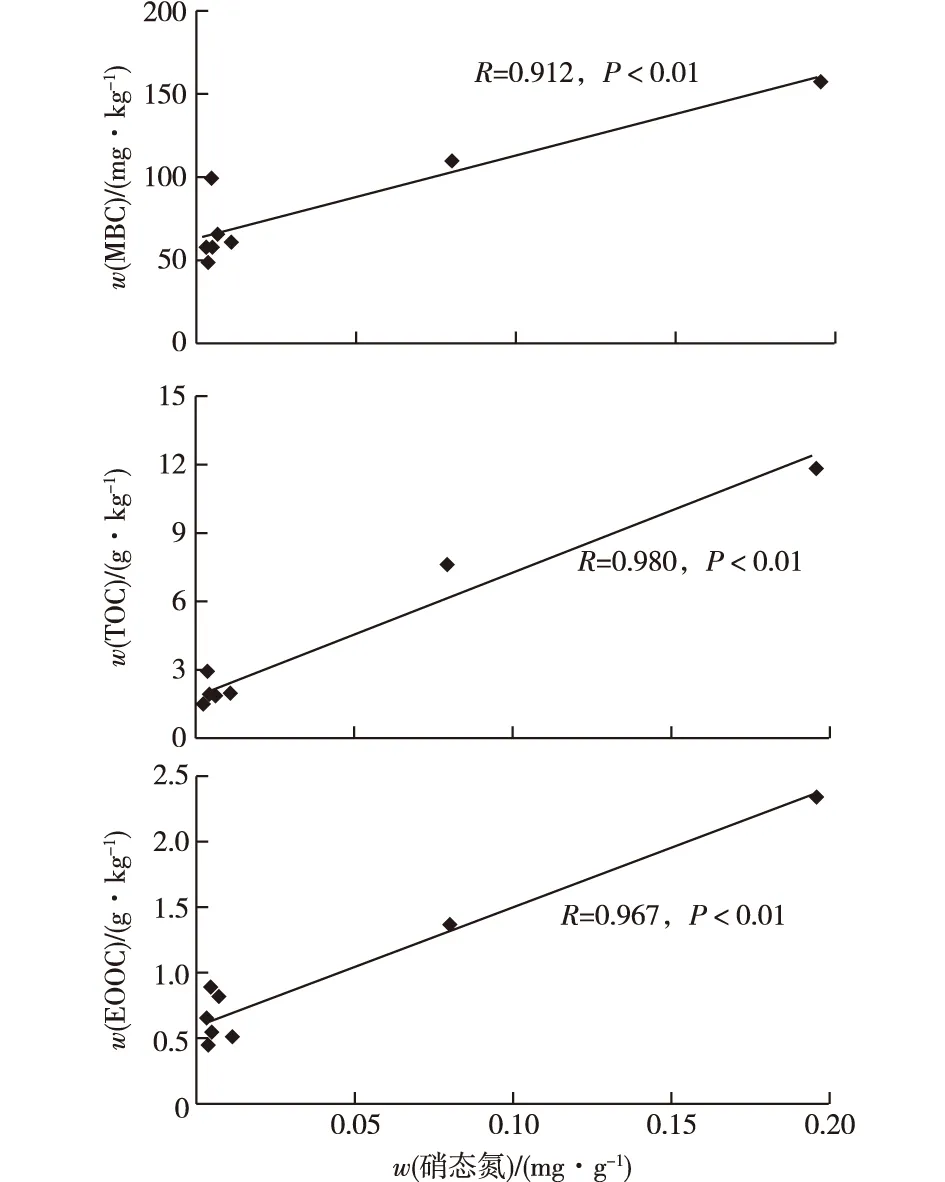
图8 硝态氮与各有机碳组分的相关性
[1] 孙广友.中国湿地科学的进展与展望[J].地球科学进展,2000,15(6):666-672.
[2] XIAO H L.Climate Change in Relationship to Soil Organic Matter[J].Soil Environment,1999,8(4):304-304.
[3] 刘方,王世杰,刘秀明,等.喀斯特石漠化区不同优势树种根际土壤有机碳及氮磷的变化[J].中国岩溶,2011,30(1):59-65.
[4] MARASHI A R A,SCULLION J.Earthworm Casts Form Stable Aggregates in Physically Degraded Soils[J].Biology and Fertility of Soils,2003,37(6):375-380.
[5] VAN RHEE J A.Earthworm Activity and Plant Growth in Artificial Cultures[J].Plant and Soil,1965,22(1):45-48.
[6] SHUSTER W D,SUBLER S,MCCOY E L.Deep-Burrowing Earthworm Additions Changed the Distribution of Soil Organic Carbon in a Chisel-Tilled Soil[J].Soil Biology & Biochemistry,2001,33(7):983-996.
[7] 于建光,胡锋,李辉信,等.接种蚯蚓对土壤团聚体分布、稳定性及有机碳赋存的影响[J].水土保持学报,2010,24(3):175-180.
[8] 张文菊,彭佩钦,童成立,等.洞庭湖湿地有机碳垂直分布与组成特征[J].环境科学,2005,26(3):56-60.
[9] 钟春棋,曾从盛,仝川.不同土地利用方式对闽江口湿地土壤活性有机碳的影响[J].亚热带资源与环境学报,2010,5(4):65-70.
[10]盛宣才,邵学新,吴明,等.水位对杭州湾芦苇湿地土壤有机碳、氮、磷含量的影响[J].生态与农村环境学报,2015,31(5):718-723.
[11]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[12]BLAIR G J,LEFROY R D B,LISLE L.Soil Carbon Fractions Based on Their Degree of Oxidation,and the Development of a Carbon Management Index,For Agricultural Systems[J].Australia Journal of Agricultural Research,1995,46(7):1459-1466.
[13]张文敏,吴敏,王蒙,等.杭州湾湿地不同植被类型下土壤有机碳及其组分分布特征[J].土壤学报,2014,51(6):1351-1360
[14]宋歌,孙波,教剑英.测定土壤硝态氮的紫外分光光度法与其他方法的比较[J].土壤学报,2007,44(2):288-293.
[15]张仕吉,项文化.土地利用方式对土壤活性有机碳影响的研究进展[J].中南林业科技大学学报,2012,32(5):134-143.
[16]朱志建,姜培坤,徐秋芳.不同森林植被下土壤微生物量碳和易氧化态碳的比较[J].林业科学研究,2006,19(4):523-526.
[17]薛菁芳,高艳梅,汪景宽.长期施肥与地膜覆盖对土壤微生物量碳氮的影响[J].中国土壤与肥料,2007(3):55-58.
[18]KALBITZ K.Controls on the Dynamics of Dissolved Organic Matter in Soils:A Review[J].Soil Science,2000,165(4):277-304.
[19]HAYNES R J.Labile Organic Matter As an Indicator of Organic Matter Quality in Arable and Pastoral Soils in New Zealand[J].Soil Biology & Biochemistry,2000,32(2):211-219.
[20]MARTENS R.Current Methods for Measuring Microbial Biomass C in Soil:Potentials and Limitations[J].Biology & Fertility of Soils,1995,19(2/3):87-99.
[21]贺慧,郑华斌,刘建霞,等.蚯蚓对土壤碳氮循环的影响及其作用机理研究进展[J].中国农学通报,2014,30(33):120-126.
[22]王霞,李辉信,朱玲,等.蚯蚓活动对土壤氮素矿化的影响[J].土壤学报,2008,45(4):641-648.
[23]张景,蒋新革,何介南,等.森林土壤有机碳含量与不同形态氮含量的相关性[J].中南林业科技大学学报,2013,33(7):114-118.
[24]XU De-fu,LI Ying-xue,HOWARD A,etal.Effect of EarthwormEiseniafetidaand Wetland Plants on Nitrification and Denitrification Potentials in Vertical Flow Constructed Wetland[J].Chemosphere,2013,92:20-206.
(责任编辑: 陈 昕)
Effect of Animal Disturbance on Organic Carbon and Form of Nitrogen in Wetland Plant Root Zone.
WANG Qi-fei, GU Jia-ru, XU De-fu, LI Xin, LI Ying-xue, ZHANG Yu
(Collaborative Innovation Center of Atmospheric Environment and Equipment Technology/ Jiangsu Key Laboratory of Atmospheric Environment Monitoring and Pollution Control, Nanjing 210044, China)
A complex vertical-flow wetland consisting of an upstream flow cell and a downstream flow cell was constructed in an experiment for exploration of effects of addition of earthworms and loaches into the two cells on organic carbon and nitrogen in form and content in the plant root zone of the constructed wetland. Results show that the addition of loaches increased the average content of total organic carbon (TOC), easily oxidized organic carbon (EOOC), microbial biomass carbon (MBC), dissolved organic carbon (DOC) and nitrate nitrogen by 16.7%, 10.8%, 19.1%, 33.8% and 68.4% , respectively, and decreased the average content of ammonia nitrogen by 14%, while the addition of earthworms increased the content of TOC, EOOC, MBC, DOC and nitrate nitrogen by 74.6%, 39.7%, 40.4%, 45.1% and 91.8%, respectively, and decreased the content of ammonia nitrogen by 42.8%. Obviously the effects of the addition of earthworms were higher than those of loaches on organic matter, nitrate nitrogen and ammonia nitrogen. Correlation analysis shows that the content of TOC, EOOC and MBC was significantly related to the content of nitrate nitrogen (P<0.01). All the findings indicate that introduction of animals into wetlands increases organic carbon content in the plant root zone of the constructed wetland, and stimulates nitrification process in the wetland, thus increased the content of nitrate nitrogen in the soil.
constructed wetland;animal disturbance;organic carbon fractions;nitrate nitrogen;ammonia nitrogen
2015-10-08
江苏省自然科学基金(BK20141477);江苏省大学生实践创新项目(201610300037);国家自然科学基金(40901257);江苏高校“青蓝工程”(20161507);教育部留学回国人员科研启动基金(20145048)
X52
A
1673-4831(2016)05-0813-05
10.11934/j.issn.1673-4831.2016.05.019
王琪飞(1991—),男,江苏扬中人,硕士生,主要研究方向为污染水体生态修复。E-mail: 403446121@qq.com
① 通信作者E-mail: defuxu1@163.com
