腈菌唑在豇豆及露地土壤中的沉积及消解特性
2016-11-04刘雅楠李文卓曹梦超王蒙岑朱国念
刘雅楠,李文卓,魏 鹏,曹梦超,赵 颖,王蒙岑,朱国念
(浙江大学农药与环境毒理研究所,浙江 杭州 310058)
腈菌唑在豇豆及露地土壤中的沉积及消解特性
刘雅楠,李文卓,魏 鹏,曹梦超,赵 颖,王蒙岑①,朱国念
(浙江大学农药与环境毒理研究所,浙江 杭州 310058)
利用QuEChERS与气相色谱-串联质谱法(GC-MS/MS)建立了腈菌唑在豇豆(Vignaunguiculata)及土壤中的残留分析方法;并结合田间试验,研究了腈菌唑在豇豆和露地土壤中的初始沉积及消解特性。结果表明,在0.001~2 mg·kg-1浓度范围内,腈菌唑的仪器响应值与其浓度呈良好的线性关系,其最小检出量为8.0×10-12g。豇豆和土壤样品经乙腈提取后采用弗罗里硅土小柱净化,GC-MS/MS测定;当豇豆和土壤空白样品基质中腈菌唑添加量为0.05~2 mg·kg-1时,平均回收率为86.6%~105.4%,相对标准偏差为3.0%~7.0%。方法的准确度、精密度和灵敏度可满足豇豆及土壤中腈菌唑的残留检测要求。田间试验结果发现,腈菌唑在豇豆中的残留初始沉积量差异不显著,在土壤中的残留初始沉积量稍有差异,在豇豆和土壤中的消解半衰期分别为3.1~4.3和10.5~12.1 d,豇豆的生长稀释和降雨是导致其在不同地区消解速率存在差异的主要因素。
腈菌唑;豇豆;土壤;残留;初始沉积;消解动态
腈菌唑(myclobutanil),化学名称为2-(4-氯苯基)-2-(1H,1,2,4-三唑-1-甲基)己腈,是由美国罗门哈斯公司开发的一种高效、低毒、杀菌谱广的三唑类杀菌剂[1],作用方式为抑制病原菌麦角甾醇的生物合成[1-2],对子囊菌、担子菌等引起的白粉病、锈病、黑星病、灰斑病、褐斑病具有较好的防治效果[3]。腈菌唑化学结构式见图1。
腈菌唑近年来被广泛用于豇豆(Vignaunguiculata)等作物[4-6],但其所引起的生态风险仍不明确。目前,关于腈菌唑在不同作物中的残留分析方法有一定报道。如崔淑华等[1]用乙腈作为提取溶剂,采用气相色谱-串联质谱(GS-MS/MS)测定大蒜中的腈菌唑残留;楼正云等[7]采用乙腈提取、气相色谱-电子捕获检测器(GC-ECD)检测黄瓜和土壤中的腈菌唑残留;施翠娥等[8]采用二氯甲烷萃取,中性氧化铝柱净化,GC-ECD测定梨中的腈菌唑残留;韩丙军等[9]采用气相色谱-氮磷检测器(GC-NPD)测定香蕉中的腈菌唑残留;沈伟健等[10]采用固相萃取净化、GC-MS/MS测定了腈菌唑等12种三唑类杀菌剂在大豆和玉米中的残留;WANG等[11]采用弗罗里硅土小柱净化、GC-ECD测定烟草和土壤中的腈菌唑残留;LIU等[12]采用Sep-Pak固相提取柱净化、气相色谱-离子阱质谱(GC-ITMS)测定小麦和土壤中的腈菌唑残留。但对腈菌唑在豇豆作物上的残留消解特性及生态风险尚鲜见报道。
图1 腈菌唑的化学结构式
笔者利用QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)萃取豇豆和土壤样品,用弗罗里硅土小柱净化,GS-MS/MS分析,建立豇豆及其土壤中腈菌唑残留快速、灵敏、准确的分析方法,并选择南方豇豆主产地——浙江、福建开展田间试验,阐明腈菌唑在豇豆生态系统中的残留沉积和消解特性,为评估使用腈菌唑的农产品质量安全与生态风险提供基础数据。
1 材料与方法
1.1 供试材料
腈菌唑标准品(w=98.3%)购于国家标准物质中心,供试药剂为w=40%的可湿性粉剂(美国陶氏益农公司)。
田间试验地为浙江省诸暨市江藻镇和福建省厦门市灌口镇豇豆露地大田。浙江省诸暨市地处浙中内陆,属亚热带季风气候区,四季分明,光照充足,雨水丰沛,年温差大于同纬度邻县,为典型的丘陵山地气候。年平均气温为16.3 ℃,年降水量为1 373 mm,年均降水日为158.3 d,相对湿度82%,年均日照时数为1 887.6 h,年日照百分率为45%。试验地土壤类型以丘陵山地红壤为主,pH值为6.5,有机质含量w约为1.5%。豇豆品种为芝豇。
福建省厦门市属亚热带海洋性气候区,温和多雨,夏无酷暑,冬无严寒,全年平均气温为21 ℃,年平均降水量约为1 100 mm。年平均气温为 20.6 ℃,年降水量为1 315 mm,3—9月为春夏多雨湿润季节,相对湿度为78%,年均日照时数为1 953 h。试验点土壤类型为砂质红壤,pH值为6.0,有机质含量w约为2.1%。豇豆品种为矮豇豆。
1.2 仪器设备与试剂
Agilent Technologies 7 000C GC Triple Quad(美国Agilent Technologies公司);色谱柱HP-5MS(30 m×0.25 mm×0.25 μm,美国Agilent Technologies公司);Bond Elut-Fl (弗罗里硅土)小柱(200 mg,3 mL)(Agilent Technologies);N-EVAP 11氮吹仪(苏州尔立公司);250 mL离心瓶、250 mL锥形瓶、具塞量筒、三角漏斗、容量瓶、刻度试管、电子天平等实验室常用仪器设备。载气为氦气(φ=99.999%),碰撞气为氮气(φ=99.999%);重蒸水;乙腈、氯化钠、硫酸镁、乙酸乙酯等均为分析纯。
1.3 田间试验
为探明腈菌唑在豇豆上的残留沉积及消解特性,参照NY/T 788—2004《农药残留试验准则》[13]和《农药登记残留田间试验标准操作规程》[14]的要求设计试验小区。每个小区面积30 m2,小区间设保护行,各重复3次。于豇豆结荚初期施药,制剂用量为450 g·hm-2,施药后分别于0(2 h)、1、3、5、7、10、14、21、28 d采样。浙江点施药时间为2014年8月21日,福建点施药时间为2014年8月4日。
豇豆样本的采集:在小区内随机选择10个点,采集豇豆架上、中、下不同部位无病害豇豆荚1 kg,将豇豆荚剪成小段,捣碎混匀,四分法取250 g装入样本容器中,贴好标签,于-20 ℃冰柜中保存。
土壤样本的采集:随机取点10个,用取土器采集0~10 cm的土壤1~2 kg,除去土壤中的碎石、杂草和植物根茎等杂物,混匀后采用四分法留样250 g,装入样本容器中,贴好标签,于-20 ℃冰柜中保存。
另设空白对照,施用与药液同等体积的清水。
1.4 分析方法
1.4.1 QuEChERS萃取
称取豇豆(土壤)样品20 g于250 mL离心瓶中,加入20 mL去离子水,静置15 min,再加入50 mL乙腈,匀浆2 min(土壤为振荡30 min),过滤至具塞量筒,加6 g氯化钠和8 g硫酸镁振摇2 min,静置2 h,吸取上清液5 mL,用旋转蒸发仪减压浓缩近干,氮气吹干后,用乙酸乙酯定容至2 mL,待净化。
1.4.2 弗罗里硅土小柱净化
采用5 mLV(乙酸乙酯)∶V(正己烷)=1∶9的混合液预淋洗弗罗里硅土小柱,弃去;将1.4.1节所述的样品待净化液上柱,并用2 mLV(乙酸乙酯)∶V(正己烷)=1∶1的混合液淋洗3次,收集全部淋出液于10 mL试管中。氮气吹干后,用2 mL乙酸乙酯定容,过0.22 μm孔径有机膜,待测。
1.4.3 GC-MS/MS分析
进样口温度:260 ℃;柱温:初始温度80 ℃,保持1 min,以30 ℃·min-1升温至200 ℃,保持1 min,以15 ℃·min-1升温至260 ℃,保持6 min;进样量:1 μL,不分流进样,载气为氦气,流速2.25 mL·min-1;离子源温度230 ℃,MSD传输线温度250 ℃;猝灭气体为氦气,流速1.5 mL·min-1,碰撞气为氮气,流速1.0 mL·min-1。选取质荷比为152m/Z的产物离子为定量离子,质荷比为152和125m/Z的产物离子为定性离子对,如表1所示。此条件下,腈菌唑的保留时间为9.510 min。
表1 质谱多重反应监测参数
Table 1 MRM parameters used in study

保留时间/min前级离子质荷比(m/Z)产物离子质荷比(m/Z)驻留时间/ms碰撞能量/eV9.51017915210059.51017912510010
1.5 标准曲线的绘制
将1 g·L-1腈菌唑标准溶液分别稀释配制为0.1、1.0、5.0、10.0、20.0 mg·L-1系列标准溶液,再分别用豇豆和土壤空白样品提取液稀释。具体稀释步骤为:取上述标准工作液1 mL于10 mL容量瓶中,分别用豇豆和土壤空白样品提取液定容,即得到质量浓度分别为0.01、0.1、0.5、1.0和2.0 mg·L-1的标准工作溶液,在上述GC-MS/MS条件下进行测定,采用外标法定量,以进样浓度为x轴、响应值为y轴,得到腈菌唑的标准工作曲线。
2 结果与分析
2.1 工作曲线与最小检出量
在优化后的分析条件下,腈菌唑的保留时间为9.510 min,在0.01~2.0 mg·L-1范围内腈菌唑的仪器响应值(y)与浓度(x)呈良好的线性关系,其中以豇豆提取液作为基质溶液时,标准工作曲线的线性方程为y=23 084x+391.9,R2=0.999 6;以土壤提取液作为基质溶液时,标准工作曲线的线性方程为y=23 966x-54.87,R2=0.998 7。利用10倍信噪比计算得出仪器的最小检出量为8.0×10-12g。
2.2 方法的准确度与精密度
分别取豇豆和土壤的空白样品,添加5.0、50.0、200.0 mg·kg-1腈菌唑标准溶液进行回收率实验,每个浓度处理重复5次。腈菌唑前级离子和产物离子质谱图见图2。腈菌唑在豇豆和土壤中的添加回收率见表2。结果显示,豇豆样品中添加量为0.05~2.0 mg·kg-1时,腈菌唑回收率为86.6%~97.2%,相对标准偏差为3.0%~7.0%;土壤样品基质中添加量为0.05~2.0 mg·kg-1时,腈菌唑回收率为104.5%~105.2%,相对标准偏差为3.1%~5.5%。说明该方法的准确度和精密度均较好,符合农药残留检测要求。

图2 腈菌唑前级离子和产物离子质谱图
表2 腈菌唑在豇豆和土壤中的添加回收率及相对标准偏差
Table 2 Recovery rate and relative standard deviation of myclobutanil in cowpea and soil relative to concentration of the substance

样品添加水平/(mg·kg-1)平均回收率/%相对标准偏差/%豇豆0.0597.27.00.592.83.22.086.63.0土壤0.05104.55.50.5105.43.12.0105.23.4
2.3 残留初始沉积和消解动态
施药后0 d(2 h)采样分析发现腈菌唑在两地豇豆中的残留初始沉积量无明显差异,土壤中的残留初始沉积量稍有差异。回归分析结果表明,腈菌唑在豇豆生态系统中的消解动态符合一级动力学方程(图3~4),消解动力学参数见表3。腈菌唑在浙江和福建2地豇豆和土壤中的消解半衰期分别为3.1~4.3 和10.5~12.1 d。

图3 腈菌唑在豇豆中的消解动态

图4 腈菌唑在土壤中的消解动态
3 讨论
腈菌唑在不同植物样品基质中的净化方法已有一定报道,如韩丙军等[9]在提取香蕉中的腈菌唑时用乙腈提取、溶剂置换法净化,谭龙波[15]和陈丽萍等[16]采用氧化铝小柱净化辣椒和毛豆样品。张志恒等[17]则发现在分析草莓样品时未采取净化手段也不会对目标物的分析造成干扰。笔者在研究中发现豇豆样品的基质干扰相对较大,采用已有报道的净化手段效果并不理想。因此,笔者探讨了弗罗里硅土小柱、十八烷基固相萃取柱(Cleaner C18-SPE,Agela Technologies)、N-丙基乙二胺(PSA,Agela Technologies)对豇豆样品的净化效果。结果表明,C18-SPE小柱对腈菌唑的吸附能力较强,利用较强的洗脱液将腈菌唑洗脱的同时也洗脱了大量杂质;PSA虽然有较好的去除色素干扰的效果,但由于其对腈菌唑具有一定的吸附性,造成其添加回收率较低;而在采用弗罗里硅土小柱净化时,不仅净化效果好,添加回收率也较高,故采用弗罗里硅土小柱净化样品。
表3 腈菌唑在豇豆和土壤中的消解动力学方程
Table 3 Degradation dynamic equations of myclobutanil in cowpea and soil
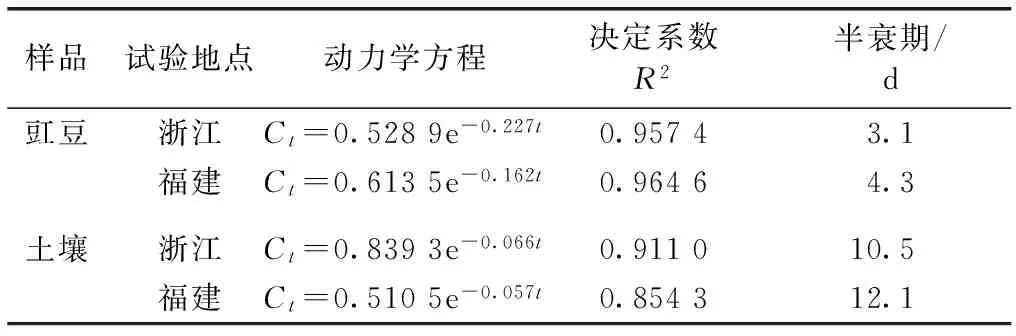
样品试验地点动力学方程决定系数R2半衰期/d豇豆浙江Ct=0.5289e-0.227t0.95743.1福建Ct=0.6135e-0.162t0.96464.3土壤浙江Ct=0.8393e-0.066t0.911010.5福建Ct=0.5105e-0.057t0.854312.1
Ct为农药残留量,mg·kg-1;t为消解时间,d。
腈菌唑在两地豇豆中的初始沉积量差异不明显,而在两地土壤中的沉积量具有一定差异,原因在于药剂未直接施用于土壤表面,而两地豇豆植株的叶面积指数存在一定差异,导致腈菌唑在土壤中初始沉积量的不同。此外,腈菌唑在豇豆中的消解半衰期明显短于其在土壤中的消解半衰期。这可能是由于在露地条件下,降雨会将一部分沉积于豇豆表面的腈菌唑残留冲刷至土壤;其次,光照和叶面微生物群落等非生物和生物因素的共同作用也加速了其在豇豆上的残留降解;另外,腈菌唑具有内吸性,药液被植物吸收后传导至豇豆植株其他部位,豇豆的生长稀释作用对豇豆中腈菌唑残留的消解也会起到促进作用。而沉积于土壤中的腈菌唑残留不仅受土壤中微生物降解,还会受淋溶和吸附作用等影响[18],但豇豆土壤细菌群落的多样性(16S-rRNA gene指纹图谱比对,未发表数据)低于豇豆植株表面及内生细菌的多样性,且土壤中光解作用明显较弱,这可能是导致土壤中腈菌唑残留期相对较长的原因。
楼正云等[7]研究发现腈菌唑在黄瓜及其土壤中的半衰期分别为2.5~2.7和14.1~14.3 d;杨淑娟等[19]研究发现腈菌唑在菜用大豆和豌豆中的半衰期为3.2~3.6 d。笔者发现,腈菌唑在豇豆和土壤中的消解半衰期分别为3.1~4.3 和10.5~12.1 d,与之前报道的其他蔬菜作物对比,半衰期的差异并不显著,说明其在不同作物上消解速率差异不显著,总体消解较快。
进一步对比浙江诸暨和福建厦门2个试验点的结果,可以发现腈菌唑在浙江诸暨点的消解半衰期较福建厦门点短。浙江点试验周期为2014年8月21日—2014年9月18日,福建点试验周期为2014年8月4日—2014年9月1日,查询试验期间两地天气数据(http:∥lishi.tianqi.com/),发现浙江消解试验中降雨时间为23 d,福建消解试验中降雨时间为10 d,据此推测,浙江点腈菌唑消解速率应明显快于福建点,但同时福建地区日照时间较长,加速了腈菌唑的光解速率,因此浙江点消解半衰期略短于福建点。
4 结论
采用优化的QuEChERS萃取、弗罗里硅土小柱净化、GS-MS/MS检测,建立了一套腈菌唑在豇豆样品和土壤样品中的残留分析方法。该方法回收率高,重现性好,对检测其他豆类蔬菜中的腈菌唑残留具有参考价值。研究发现,不同田间环境引起腈菌唑消解速率差异的主要因素为生长稀释作用和降雨、光照等环境因子。此外,田间试验表明腈菌唑在豇豆和土壤中消解较快,半衰期分别为3.1~4.3 和10.5~12.1 d,该结果为进一步评估腈菌唑使用的农产品安全与生态风险提供了重要的理论依据。
[1] 崔淑华,王开运,杨娟,等.腈菌唑在大葱中的残留分析与消解动态[J].农药,2011,50(4):283-285,288.
[2] 徐能华.蔬菜水果中腈菌唑农药残留气相色谱(ECD)检测法[J].农药,2008,47(5):359-360.
[3] 王思威,孙海滨,曾繁娟,等.腈菌唑在荔枝及土壤中的残留动态研究[J].农学学报,2011,1(4):28-31.
[4] 王佩芝.豇豆类型及研究概况[J].世界农业,1986(4):40-43.
[5] 王志波,康文斌.25%腈菌唑乳油在豇豆白粉病防治上的应用[J].现代农业科技,2007(14):70,73.
[6] GREGORY M K,DE GERRIT B,QUIMETTE D,etal.Systemic Properties of Myclobutanil in Soybean Plants,Attecting Control of Asin Soybean Rust (Phakopsorapachyrhizi)[J].Pest Management Science,2008,64(12):1285-1293.
[7] 楼正云,汤富彬,罗逢健,等.腈菌唑在黄瓜和土壤中的残留动态[J].农药,2008,47(3):205-207.
[8] 施翠娥,陈枫,王军.12.5%腈菌唑乳油在梨和土壤中的残留分析方法及残留动态研究[J].安徽农业科学,2008,36(16):6850-6852.
[9] 韩丙军,杨建斌,彭黎旭,等.腈菌唑在香蕉上的降解残留研究[J].农业环境科学学报,2007,26(增刊1):197-200.
[10]沈伟健,桂茜雯,余可垚,等.气相色谱-负化学离子源质谱测定大豆和玉米中12种三唑类杀菌剂的残留量[J].色谱,2009,27(1):91-95.
[11]WANG Xiu-guo,LI Yi-qiang,XU Guang-jun,etal.Dissipation and Residues of Myclobutanil in Tobacco and Soil Under Field Conditions[J].Bullentin of Environmental Contamination and Toxicology,2012,88(5):759-763.
[12]LIU Xing-ang,DONG Feng-shou,WANG Xu,etal.The Dissipation Rates of Myclobutanil and Residues Analysis in Wheat and Soil Using Gas Chromatography-Ion Trap Mass Spectrometry[J].International Journal of Environmental Analytical Chemistry,2009,89(13):957-967.
[13]NY/T 788—2004,农药残留试验准则[S].
[14]农业部农药鉴定所.农药登记残留田间试验标准操作规程[R].北京:中国标准出版社,2007.
[15]谭龙波.腈菌唑在辣椒上的残留检测方法研究[J].安徽农业科学,2010,38(5):2213-2215.
[16]陈丽萍,林志平.毛豆中腈菌唑残留量的气相色谱法测定[J].亚热带植物科学,2006,35(3):48-50.
[17]张志恒,李红叶,吴珉,等.百菌清、腈菌唑和吡唑醚菌酯在草莓中的残留及其风险评估[J].农药学学报,2009,11(4):449-455.
[18]李晓亮,秦智伟,侯利园,等.土壤环境因素对残留农药降解的影响[J].东北农业大学学报,2009,40(4):132-135.
[19]杨淑娟,郭建辉,蔡恩兴,等.菜用大豆和豌豆中腈菌唑残留动态研究[J].安全与环境学报,2008,8(6):1-4.
(责任编辑: 许 素)
Deposition and Degradation of Myclobutanil in Cowpea and Open Field.
LIU Ya-nan, LI Wen-zhuo, WEI Peng, CAO Meng-chao, ZHAO Ying, WANG Meng-cen, ZHU Guo-nian
(Institute of Pesticide and Environmental Toxicology, Zhejiang University, Hangzhou 310058, China)
An analytical method using QuEChERS extraction and GC-MS/MS (gas chromatography coupled with tandem mass spectrometry)was established for analysis of myclobutanil residues in cowpea and soil of the field, and initial deposition and degradation dynamics of myclobutanil in cowpea and soil of the field was also investigated in a field experiment. Results show that response value of the instrument was in linear relationship with concentration of myclobutanil in the range of 0.001-2 mg·kg-1, and LOD of the instrument was 8×10-12g. Myclobutanilin cowpea and soil samples were extracted with acetonitrile, purified with SPE Bond Elut-Fl columns and determined with GC-MS/MS. When myclobutanil content in the cowpea and soil samples was in the range between 0.05-2 mg·kg-1, the mean recovery rate reached 86.6%-105.4% with relative standard deviation being 3.0%-7.0%, which means the method satisfies the requirements for detection of myclobutanil residue in cowpea and soil in accuracy, precision and sensitivity. The field experiment shows that the deposition of myclobutanil in cowpea in the initial phase was not significant and differed slightly from that in the soil. The half-life of the substance in cowpea and soil ranged of 3.1-4.3 and 10.5-12.1 d and the growth-dilution effect of cowpea and precipitation are two dominant factors leading to variation of degradation rate of the substance in different regions.
myclobutanil;cowpea;soil;residue;initial deposition;degradation dynamics
2015-11-13
农业部农药登记残留试验项目(2013F161);中央高校基本科研业务费专项(517302-172210151)
X592
A
1673-4831(2016)05-0832-05
10.11934/j.issn.1673-4831.2016.05.022
刘雅楠 (1990—),女,内蒙古呼和浩特人,硕士生,主要研究方向为农药残留与膳食风险评估。E-mail: liuyanan@zju.edu.cn
① 通信作者E-mail: wmctz@zju.edu.cn
