OCT对多发性硬化与视神经脊髓炎谱系疾病患者视功能损伤的评价
2016-11-04王梅子王淑然王丽娜瞿远珍
王梅子,王淑然,王丽娜,汤 洋,雷 鹍,方 民,杨 柳,瞿远珍
·临床论著·
OCT对多发性硬化与视神经脊髓炎谱系疾病患者视功能损伤的评价
王梅子,王淑然,王丽娜,汤洋,雷鹍,方民,杨柳,瞿远珍
•METHODS: Retrospective case control study. Two hundred three cases were collected from August 2014 to January 2016 in Beijing Tian Tan Hospital. They were divided into four groups, including the normal group (n=60), the RRMS group (n=60), the NMOSD anti-aquaporin-4 autoantibody seropositive(NMOSD-AQP4-Ab seropositive) group (n=48), and the NMOSD-AQP4-Abseronegative group (n=35). All people were detected for the average and four quadrants (superior, inferior, nasal, temporal) of pRNFL thickness and the average and two quadrants (superior, inferior) of GCC thickness with OCT. One way analysis of variance or nonparametric tests was used to compare the differences of pRNFL and GCC thickness between groups.
•RESULTS: Comparing with the normal group, the average and all quadrants of pRNFL and GCC thickness in the RRMS, the NMOSD-AQP4-Ab seropositive and the NMOSD-AQP4-Ab seronegative group were thinner (P<0.01). Among them, the pRNFL and GCC thickness in the NMOSD-AQP4-Ab seropositive group was the thinnest. Differences between groups in the pRNFL thickness: compared with the RRMS group, all quadrants of pRNFL and GCC thickness in the NMOSD-AQP4-Ab seropositive group were significantly thinner(P<0.01); compared with the NMOSD-AQP4-Ab seronegative group, the inferior, nasal and temporal pRNFL thickness in the NMOSD-AQP4-Ab seropositive group were significantly thinner(P<0.05), while the superior quadrant did not show significant differences(P>0.05); compared with the RRMS group, the superior pRNFL thickness in the NMOSD-AQP4-Ab seronegative group was significantly thinner(P<0.05), while the inferior, nasal and temporal quadrants did not show significant differences(P>0.05). Differences between groups in the GCC thickness: compared with both the RRMS and the NMOSD-AQP4-Ab seronegative group, all quadrants of GCC thickness in the NMOSD-AQP4-Ab seropositive group were significantly thinner(P<0.05); compared with the RRMS group, the superior GCC thickness in the NMOSD-AQP4-Ab seronegative group was significantly thinner(P<0.01), while the inferior quadrant did not show significant difference(P>0.05).
•CONCLUSION: The optic nerve and axon impairment in NMOSD-AQP4-Ab seropositive group was the most severe and the impairment in RRMS group was the least severe. The impairment in NMOSD-AQP4-Ab seronegative group was between the former two, and could be more similar to that of RMMS.
目的:利用光学相干断层扫描(OCT)检测复发缓解型多发性硬化(RRMS)与视神经脊髓炎谱系疾病(NMOSD)患者的视乳头周围视网膜神经纤维层(pRNFL)和黄斑区神经节细胞复合体(GCC)厚度,探讨疾病所致的视神经及轴突损伤情况。
方法:回顾性病例对照分析。收集2014-08/2016-01首都医科大学附属北京天坛医院收治的RRMS患者60例、NMOSD-AQP4抗体阳性患者48例、NMOSD-AQP4抗体阴性患者35例及正常对照健康人群60例,通过OCT检测pRNFL(包括平均和上方、下方、鼻侧、颞侧四个象限)和GCC(包括平均和上方、下方两个象限)的厚度,采用单因素方差分析或秩和检验进行比较分析。
结果:RRMS、NMOSD-AQP4抗体阳性及NMOSD-AQP4抗体阴性组pRNFL(平均和四个象限)及GCC厚度(平均和上方、下方)均较正常对照组减少,差异有统计学意义(P<0.01),其中NMOSD-AQP4抗体阳性组的pRNFL及GCC厚度最薄。组间pRNFL厚度比较:NMOSD-AQP4抗体阳性组与RRMS组相比,四个象限pRNFL厚度均明显变薄,差异有统计学意义(P<0.01);NMOSD-AQP4抗体阳性组与NMOSD-AQP4抗体阴性组相比,下方、鼻侧、颞侧象限pRNFL均更薄,差异有统计学意义(P<0.05),上方pRNFL厚度无统计学差异(P>0.05);NMOSD-AQP4抗体阴性组和RRMS组相比,上方pRNFL厚度更薄,差异有统计学意义(P<0.05),下方、鼻侧、颞侧象限pRNFL厚度上无统计学差异(P>0.05)。组间GCC厚度比较:NMOSD-AQP4抗体阳性组上方、下方象限GCC厚度比RRMS组和NMOSD-AQP4抗体阴性组变薄明显,差异有统计学意义(P<0.05),NMOSD-AQP4抗体阴性组和RRMS组相比,上方GCC厚度更薄,差异有统计学意义(P<0.01),下方GCC厚度无统计学差异(P>0.05)。
结论:NMOSD-AQP4抗体阳性患者的轴突损伤最明显,RRMS患者损伤最轻,而NMOSD-AQP4抗体阴性患者介于二者之间,且与RRMS更为相似。
多发性硬化;视神经脊髓炎谱系疾病;水通道蛋白4;光学相干断层成像;视网膜神经纤维层;视网膜神经节细胞复合体
引用:王梅子,王淑然,王丽娜,等.OCT对多发性硬化与视神经脊髓炎谱系疾病患者视功能损伤的评价.国际眼科杂志2016;16(7):1253-1257
0引言
多发性硬化(multiple sclerosis,MS)与视神经脊髓炎(neuromyelitis optiea,NMO)属于中枢神经系统炎性脱髓鞘疾病,二者均累及视神经和脊髓,引起神经元及轴突的脱髓鞘和退行性变,临床上常以单相、先后相继发生的双侧视神经炎或脊髓炎起病[1-2]。随着特异性结合水通道蛋白4(anti-aquaporin-4 autoantibody,AQP4)抗体的发现[3],Wingerchuk等[4]在2015年重新制定了NMO的诊断标准,即将NMO整合到视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD),再分为AQP4抗体阳性型和阴性型,二者临床表现、实验室指标明显不同。目前认为MS与NMOSD是两种不同的疾病[1-2],NMOSD-AQP4抗体阳性和阴性的患者在临床特点,流行病学方面也有不同,后者更类似于MS,预后相对良好[5],但临床上三者难以鉴别。近年来很多研究以光学相干断层扫描(optical coherence tomography,OCT)描述MS和NMOSD的视网膜神经纤维层(retinal nerve fiber layer,RNFL)及黄斑部神经节细胞复合体(ganglion cell complex,GCC)的不同损伤特点[6-8]。也有个别文献将NMOSD相关视神经炎按照AQP4抗体情况分组比较[5-6,9],得出了不同的结论。本研究首次对复发缓解型MS(relapsing-remitting multiple sclerosis,RRMS)、NMOSD-AQP4抗体阳性和阴性的视神经炎患者进行病例回顾对照分析,以期通过OCT检查探讨疾病的视神经及轴突损伤特点,为疾病鉴别及治疗提供依据。
1对象和方法
1.1对象回顾性收集2014-08/2016-01在首都医科大学附属北京天坛医院神经内科诊治的RRMS及NMOSD患者,记录其一般资料、视神经炎(optic neuromyelitis,ON)发作次数、视力、眼压、裂隙灯、眼底及OCT检查结果。本研究病患组包括RRMS组(n=60例)、NMOSD-AQP4抗体阳性组(n=48例)和NMOSD-AQP4抗体阴性组(n=35例)。RRMS患者采用2010年McDonald 修订的诊断标准[1]。NMOSD患者采用2014年或2015年Wingerchuk修订的NMOSD诊断标准[2,4],根据患者AQP4抗体情况分为NMOSD-AQP4抗体阳性组和NMOSD-AQP4抗体阴性组。所有患者年龄20~65(平均32.65±11.56)岁,均有视神经受累,双眼发病者随机纳入一只眼与单眼患病者共同分析,OCT检查在急性ON发作后6mo测量。排除标准:青光眼、糖尿病、视网膜病变及影响视神经的视路疾病,影响检查的严重屈光间质混浊,屈光度>-3.0DS。同期选取年龄相匹配的60例健康志愿者作为对照组,排除眼科及神经科疾病,矫正视力≥1.0,屈光度≤-3.0DS。获得所有参与者知情同意。
1.2方法
1.2.1AQP4抗体的检测本研究所有NMOSD患者的血清标本均由我院采集后送至北京协和医院临床神经免疫实验室采用细胞间接免疫荧光法检测[10]。所有患者签署知情同意书,标本检测2次,由两名专业人员分别进行检测及判读。
1.2.2 OCT检查应用OCT的GCC和视乳头神经纤维层 (optic nerve head,ONH)扫描模式。GCC扫描以黄斑中心凹为中心,扫描深度2mm,分辨率5μm,直径7mm。ONH扫描以视乳头为中心,扫描深度2.3mm,分辨率5μm,直径3.45mm。计算机图像分析系统自动进行GCC厚度及视乳头周围视网膜神经纤维层(peripapillary retinal nerve fiber layer,pRNFL)厚度的测量。主要分析指标为GCC平均厚度、上方GCC及下方GCC厚度;平均及上方、下方、鼻侧、颞侧四个象限的pRNFL厚度。
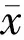
表1 病患组及正常对照组一般资料分析±s
注: ON: 视神经炎;多组间比较采用Kruskal-WallisH秩和检验,χ2、P:四组间比较; *: 病患组三组间比较;aP<0.05vsNMOSD-AQP4抗体阳性组;cP<0.05vsNMOSD-AQP4抗体阴性组;eP<0.05vsRRMS组;hP<0.01vs正常对照组。
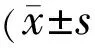
表2 病患组及正常对照组的pRNFL和GCC厚度分析,μm)
注:pRNFL:视乳头周围视网膜神经纤维层;GCC:神经节细胞复合体;四组间比较采用单因素方差分析;F、P:四组间比较;两两比较采用LSD-t检验:bP<0.01vsNMOSD-AQP4抗体阳性组;cP<0.05vsNMOSD-AQP4抗体阴性组;eP<0.05vsRRMS组;hP<0.01vs正常对照组。
统计学分析:采用SPSS 21.0统计软件进行分析。各项指标以均数±标准差表示,若满足参数检验的应用条件,多组间比较采用方差分析,两两比较采用LSD-t检验。若不满足参数检验的应用条件,多组间比较采用Kruskal-WallisH秩和检验,两两比较采用Nemenyi检验。以P<0.05为差异有统计学意义。
2结果
2.1一般资料由表1可见,病患组患者与正常对照组比较,各组的性别构成(P=0.007)、视力(P<0.01)之间的差异均有统计学意义,年龄差异无统计学意义(P>0.05)。病患组的病程、ON发作次数分析,各组之间差异无统计学意义(P>0.05)。采用Nemenyi检验对组间存在差异的性别和视力进行两两比较,NMOSD-AQP4抗体阳性组女性患者更多(男∶女=1∶8.6),较其他两组有统计学差异(P<0.05)。NMOSD-AQP4抗体阴性组女性患者(男∶女=1∶2.5)较RRMS组(男∶女=1∶1.5)多,但两组无统计学差异(P=0.294)。NMOSD-AQP4抗体阳性组和NMOSD-AQP4抗体阴性组之间视力无差异(P=0.688),均比RRMS组差,差异有统计学意义(P<0.05)。病患组各组视力均比正常对照组差,差异有统计学意义(P<0.01)。
2.2病患组及正常对照组的pRNFL和GCC厚度分析由表2可见,病患组平均和各个象限的pRNFL和GCC厚度均较正常对照组减少,四组间有统计学差异(P<0.01)。其中NMOSD组低于RRMS组,NMOSD-AQP4抗体阳性组的pRNFL及GCC厚度比RRMS组和NMOSD-AQP4抗体阴性组又明显变薄。
2.2.1 pRNFL厚度分析NMOSD-AQP4抗体阳性组患者与RRMS组相比,平均、上方、下方、鼻侧、颞侧象限pRNFL厚度均明显更薄,差异有统计学意义(P<0.01)。NMOSD-AQP4抗体阳性组患者与NMOSD-AQP4抗体阴性组相比,除了上方pRNFL厚度无统计学差异(P>0.05),平均(P<0.01)、下方(P<0.01)、鼻侧(P=0.039)、颞侧(P<0.01)象限pRNFL均更薄,差异有统计学意义(P<0.05)。NMOSD-AQP4抗体阴性组和RRMS组相比,平均、下方、鼻侧、颞侧象限pRNFL厚度上无统计学差异(P>0.05),而在上方pRNFL厚度更薄,差异有统计学意义(P<0.05)。
2.2.2 GCC厚度分析NMOSD-AQP4抗体阳性组患者与RRMS组相比,平均、上方、下方GCC厚度均明显更薄,差异有统计学意义(P<0.01)。NMOSD-AQP4抗体阳性组患者与NMOSD-AQP4抗体阴性组相比,平均(P<0.01)、上方(P=0.015)、下方(P<0.01)GCC厚度均更薄,差异有统计学意义(P<0.05)。NMOSD-AQP4抗体阴性组和RRMS组相比,平均、下方GCC厚度无统计学差异(P>0.05),仅上方GCC厚度更薄,差异有统计学意义(P<0.05)。
3讨论
ON是中青年常见的致盲性疾病,目前采取的病因分型中特发性脱髓鞘视神经炎最常见,包括MS相关ON(MS-ON),NMO相关ON(NMO-ON),其他中枢神经系统脱髓鞘性ON[11]。关于MS与NMO的异同一直备受关注[12-17],二者早期以视神经炎或脊髓病变起病时难以鉴别,且都引起视神经不可逆的损伤。近来发现AQP4抗体是针对NMOSD特异性较高(大于90%)的免疫标记物,63% NMOSD患者可以发现血清AQP4抗体阳性,而另外一部分患者血清AQP4抗体始终阴性,在MS患者中基本检测不到AQP4抗体[3]。部分文献报道NMOSD-AQP4抗体阳性患者比阴性患者视神经损伤重[5,9]。视网膜神经纤维缺乏髓鞘,不受脱髓鞘影响,RNFL和GCC的变化可以反映MS及NMOSD轴突缺失及神经节细胞凋亡的程度[18]。我们应用OCT检查RNFL和GCC,评价MS和NMOSD-AQP4抗体阳性或阴性患者轴突丢失和神经节细胞死亡的不同特点,以及视网膜损伤与视野损害的相关性,为鉴别MS及NMOSD提供信息,协助临床医生诊断并预测疾病进展。
与多数文献类似[5,14,17],本研究中NMOSD与MS均好发于中青年女性,为避免年龄因素对RNFL的影响,选择年龄相匹配的健康志愿者作为对照,各组之间无统计学差异。魏世辉等报道的中国人ON中AQP4抗体阳性组女性明显多于抗体阴性组,而NMOSD-AQP4抗体阳性与阴性患者之间性别无差异[5]。某些文献报道NMOSD与MS患者之间的性别无差异[7,14,17],但样本量较小。本研究发现NMOSD-AQP4抗体阳性组的女性明显比抗体阴性组、MS组多,后两组无统计学差异(男性∶女性,抗体阳性组1∶8.6,抗体阴性组1∶2.5,MS组1∶1.5)。这与Lamirel和Weinshenker的报道一致[9,19],NMOSD-AQP4阳性组女性更多(抗体阳性组1∶9.2,抗体阴性组1∶1.9,MS组1∶2)。性别比例的不同提示NMOSD-AQP4抗体阳性患者和NMOSD-AQP4抗体阴性、MS患者是不同的群体。本研究提示,NMOSD-AQP4抗体阳性组和阴性组视力无差异,均比RRMS组差。魏世辉与Lamirel也报道NMOSD-AQP4阳性组与阴性组在视力恢复上无差异[5,9]。而大多数报道[6-7,15]认为NMOSD患者视力比MS差,Costello等[20]认为RNFL损伤阈值约为75μm时才会出现视功能降低,RRMS患者视神经受累后pRNFL损伤较轻,还可能存在轴突的修复,视力预后较好。
本研究结果显示RRMS和NMOSD患者的平均pRNFL、平均GCC均较正常对照组明显减少,且NMOSD-AQP4抗体阳性组损伤最明显。Bennett等[8]总结与正常人相比,MS的平均pRNFL减少至74~95μm,NMO约55~83μm,黄斑区GCC也减少。视神经炎导致视神经轴突丢失和神经节细胞的死亡是引起RNFL及GCC减少的主要原因[8]。
本研究发现NMOSD-AQP4抗体阳性组患者与RRMS组相比,平均、上方、下方、鼻侧、颞侧象限pRNFL均明显变薄(P<0.01)。与多数报道一致,NMOSD患者的pRNFL损伤比MS患者更重,视功能预后更差[6,14-16]。Naismith等[14]发现pRNFL厚度在NMO-AQP4抗体阳性患者发生ON后较MS患者有显著变薄,估计每减少1μm诊断NMO的机会增加8%。MS主要是炎性脱髓鞘改变,且后期有胶质增生修复[17],轴突的退行性损伤较轻[7]。NMO主要的病理改变是灰质和白质的空洞坏死,与血管壁变薄后的缺血有一定关系[14],而AQP4抗体在无髓鞘视盘的高表达使抗体阳性NMO-ON的pRNFL损伤更重[12]。NMOSD-AQP4抗体阳性组患者与NMOSD-AQP4抗体阴性组相比,除了上方pRNFL厚度无统计学差异,平均、下方、鼻侧、颞侧象限pRNFL均更薄。与魏世辉等的报道类似,NMOSD-AQP4抗体阳性组的平均、下方、鼻侧pRNFL厚度比抗体阴性组薄[5]。文献证实AQP4抗体主要表达在血管周围星形胶质细胞的足突上,在视盘周围血管分布丰富的区域造成的神经损伤重,神经纤维丢失的也最明显[12,21],NMOSD-AQP4抗体阳性患者的RNFL损伤可能与AQP4表达量有关[16]。NMOSD-AQP4抗体阴性组患者和RRMS组相比,平均、下方、鼻侧、颞侧象限pRNFL厚度上无统计学差异(P>0.05),而在上方pRNFL厚度更薄,差异有统计学意义(P<0.05)。文献提示NMOSD-AQP4抗体阴性患者在临床特点,流行病学方面更类似于MS,pRNFL损伤也比NMOSD-AQP4抗体阳性患者轻[5]。关于NMOSD-AQP4抗体阴性患者和MS患者pRNFL的差异尚不明确,本研究提示二者仅在上方有差异,其余象限及平均pRNFL无差异。这可能与NMOSD更容易损伤上下方pRNFL,MS更容易损伤以小直径轴突为主的含有乳斑束神经纤维的颞侧pRNFL有关[8,14-15],但此结果受限于样本量及抗体检测的准确性,有待多中心研究证实。
多项研究表明,在MS-ON及NMO-ON患者中GCC厚度(包括黄斑区视网膜的神经纤维层、神经节细胞层和内从状层)明显下降,且比pRNFL厚度更能反应视神经和视功能损伤的程度[7,12,15,18]。本研究发现NMOSD-AQP4抗体阳性组患者分别与RRMS组、NMOSD-AQP4抗体阴性组相比,平均、上方、下方GCC厚度均更薄(P<0.01、<0.05)。NMOSD-AQP4抗体阴性组和RRMS组相比,平均、下方GCC厚度无统计学差异(P>0.05),仅上方GCC厚度更薄,差异有统计学意义(P<0.05)。Kyung等报道NMO-ON的黄斑区GCC厚度比MS-ON患者薄,在外环的上方最薄,提示GCC的损害在NMO和MS不同,这和NMO存在的血管缺血因素可能有关[7]。仍需更多实验证明,透过血脑屏障的AQP4抗体是否可以攻击视网膜Müller细胞,在轴突病变之外损伤视网膜神经节细胞[15]。
本研究结果提示,RRMS、NMOSD-AQP4抗体阳性及NMOSD-AQP4抗体阴性患者各个象限的pRNFL、GCC厚度均较健康对照组减低,其中NMOSD-AQP4抗体阳性患者损伤最重,女性比例最高。NMOSD-AQP4抗体阴性组患者上方pRNFL厚度变薄明显,与抗体阳性组相似;其余象限损伤较轻,与RRMS组患者相似。提示根据OCT观察的pRNFL及GCC损伤情况,NMOSD-AQP4抗体阳性患者的轴突损伤最明显,RRMS患者损伤最轻,而NMOSD-AQP4抗体阴性患者多介于二者之间,且与RRMS更为相似。OCT测量pRNFL及GCC厚度可以作为MS及AQP4抗体阳性或阴性的NMOSD患者轴突损伤的一项生物结构学指标进行临床应用,为临床鉴别诊断提供辅助依据。
1 Polman CH,Reingold SC, Banwell B,etal. Diagnostic criteria for multiple sclerosis: 2010 revisions tothe McDonald criteria.AnnNeurol2011;69(2):292-302
2 Wingerchuk D, Banwell B, Bennett J,etal.Revised diagnostic criteria for neuromyelitis optica spectrum disorders.Neurology2014;82(10 Supplement):S63-001
3 Lennon VA, Wingerchuk DM, Kryzer TJ,etal.A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis.Lancet2004;364(9451):2106-2112
4 Wingerchuk DM, Banwell B, Bennett JL,etal.International consensus diagnosticcriteria for neuromyelitisoptica spectrum disorders.Neurology2015;85(2):1177-1189
5 Li H,Wang Y,Xu Q,etal.Features of anti-aquaporin 4 antibody-seropositive Chinese patients with neuromyelitis optica spectrum optic neuritis.JNeurol2015;262(10):2293-2304
6 Ratchford JN,Quigg ME,Conger A,etal.Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies.Neurology2009; 73(4):302-308
7 Park KA,Kim J,Oh SY,etal.Analysis of spectral domain optical coherencetomography measurements in optic neuritisdifferences in neuromyelitis optica, multiplesclerosis, isolated optic neuritis and normalhealthy controls.ActaOphthalmol2014;92(1):e57-65
8 Bennett JL,de Seze J,Lana-Peixoto M,etal.Neuromyelitis optica and multiple sclerosis Seeing differences through optical coherence tomography.MultipleSclerosisJ2015;21(6):678-688
9 Jarius S,Ruprecht K,Wildemann B,etal.Contrasting disease patterns in seropositive andseronegative neuromyelitis optica: A multicentre study of 175 patients.JNeuroinflammation2012;9:14
10 徐雁,任海涛,李文涵,等.不同基质的间接免疫荧光法同时检测血清和脑脊液水通道蛋白4抗体在视神经脊髓炎诊断中的应用.中华神经科杂志2014;47(10):676-679
11 中华医学会眼科学分会神经眼科学组.视神经炎诊断和治疗专家共识(2014年).中华眼科杂志 2014;50(6):459-463
12 Fernandes DB,Raza AS,Nogueira RG,etal.Evaluation of inner retinal layers in patients with multiple sclerosis or neuromyelitis optica using optical coherence tomography.Ophthalmology2013;120(2):387-394
13 Lamirel C,Newman NJ,Biousse V,etal.Optical coherence tomography (OCT) in optic neuritis and multiple sclerosis.RevNeurol(Paris) 2010;166(12): 978-986
14 Naismith RT,Tutlam NT,Xu J,etal. Optical coherence tomography differs in neuromyelitis optica comparedwith multiplesclerosis.Neurology2009;72 (12):1077-1082
15 Schneider E,Zimmermann H,Oberwahrenbrock T,etal.Optical Coherence Tomography Reveals Distinct Patterns of Retinal Damage in Neuromyelitis Optica and Multiple Sclerosis.PLoSOne2013;8(6): e66151
16 Monteiro ML,Fernandes DB,Apóstolos-Pereira SL,etal. Quantification of retinal neural loss in patients with neuromyelitis optica and multiple sclerosis with or without optic neuritis using fourier-domain optical coherence tomography.InvestOphthalmolVisSci2012;53(7):3959-3966
17 卢彦,王梅,蓝育,等.视神经脊髓炎和多发性硬化临床分析和眼部特点.中国实用眼科杂志 2010;28(9):949-953
18 黄剑锋,戴虹,张华,等.相干光断层扫描评价多发性硬化患者视神经损伤程度的研究.中华眼科杂志2014;50(12):900-905
19 Weinshenker BG, Bass B, Rice GP,etal. The natural history of multiple sclerosis: a geographically based study.I. Clinical course and disability.Brain1989;112(Pt1):133-146
20 Costello F, Hodge W, Pan YI,etal. Using retinal architecture to help characterize multiple sclerosis patients.CanadianJOphthalmol2010;45(5): 520-526
21 彭春霞,曹珊珊,赵朔,等.水通道蛋白-4抗体阳性视神经炎患者视网膜神经纤维层及黄斑区内层视网膜结构改变观察.中华眼底病杂志2015;31(6):536-540
Assessment of the damage to visual function by optical coherence tomography in patients with multiple sclerosis or neuromyelitis optica spectrum disorders
Mei-Zi Wang, Shu-Ran Wang, Li-Na Wang, Yang Tang, Kun Lei, Min Fang, Liu Yang, Yuan-Zhen Qu
High-level Talent Trainning Project of the Beijing Health System(No.2013-03-051)
Liu Yang. Department of Ophthalmology, Beijing Tian Tan Hospital, Capital Medical University, Beijing 100050, China.yingziyangliu@126.com
2016-03-15Accepted:2016-06-01
•AIM:To evaluate the optic nerve and axon impairment of relapsing-remitting multiple sclerosis (RRMS) and neuromyelitis optica spectrum disorders(NMOSD)via detecting the peripapillary retinal nerve fiber layer(pRNFL)and the ganglion cell complex(GCC) thickness by optic coherence tomography(OCT).
multiple sclerosis; neuromyelitis optica spectrum disorders; anti-aquaporin-4 autoantibody;optical coherence tomography; retinal nerve fiber layer; ganglion cell complex
北京市卫生系统高层次卫生技术人才培养计划基金资助项目(No.2013-03-051)
(100050)中国北京市,首都医科大学附属北京天坛医院眼科
王梅子,毕业于首都医科大学,硕士,住院医师,研究方向:玻璃体及视网膜疾病、神经眼科相关疾病。
杨柳,毕业于中山大学医学院,博士,副主任医师,研究方向:玻璃体及视网膜疾病、神经眼科相关疾病.yingziyangliu@126.com
2016-03-15
2016-06-01
Wang MZ, Wang SR,Wang LN,etal. Assessment of the damage to visual function by optical coherence tomography in patients with multiple sclerosis or neuromyelitis optica spectrum disorders.GuojiYankeZazhi(IntEyeSci) 2016;16(7):1253-1257
10.3980/j.issn.1672-5123.2016.7.12
Department of Ophthalmology, Beijing Tian Tan Hospital, Capital Medical University, Beijing 100050, China
