三七绿紫过渡地上茎的花色苷和皂苷组织定位及其含量分析
2016-11-04赵昶灵陈中坚文国松杨生超魏富刚肖兴磊王崇德
穆 婷,赵昶灵*,陈中坚,文国松,杨生超,魏富刚,肖兴磊,王崇德
(1 云南农业大学 农学与生物技术学院,昆明650201;2 文山学院 三七研究院,云南文山663000;3 云南农业大学 云南省优势中药材规范化种植工程研究中心,昆明650201;4 文山市苗乡三七实业有限公司,云南文山663000;5 云南农业大学 植物保护学院,昆明650201)
三七绿紫过渡地上茎的花色苷和皂苷组织定位及其含量分析
穆婷1,赵昶灵1*,陈中坚2,文国松1,杨生超3,魏富刚4,肖兴磊4,王崇德5
(1 云南农业大学 农学与生物技术学院,昆明650201;2 文山学院 三七研究院,云南文山663000;3 云南农业大学 云南省优势中药材规范化种植工程研究中心,昆明650201;4 文山市苗乡三七实业有限公司,云南文山663000;5 云南农业大学 植物保护学院,昆明650201)
为探究三七绿紫过渡地上茎的花色苷和皂苷组织定位与含量的相关性,采用显微组织化学法研究云南文山三七的一年生植株绿紫过渡地上茎各茎段花色苷和皂苷的组织定位,用分光光度法检测茎段的总花色苷(TAC)和总皂苷含量(TSC),用高效液相色谱检测了茎段的皂苷单体含量。结果表明:(1)在三七绿紫过渡地上茎的中部横截面上,花色苷主要定位在皮层薄壁组织外侧的2层或2~3层细胞中,而皂苷主要定位在维管束中;各茎段的皂苷单体均主要为人参皂苷Rb1。(2)从茎顶向茎基,茎段中TAC、TSC和Rb1的含量总体上分别表现为一条“单峰”、“V形”和“降-升-降三段式”曲线;其中,花色苷主要积累在茎的中、上部,总皂苷在茎的下、基部,Rb1则在茎的上半段,而且TAC最高以及TSC和Rb1含量最低的茎段均恰好定位在中上部的黄金分割点处。(3)不同茎段间的TAC含量差异显著,Rb1含量差异极显著,但TSC含量的差异不显著;不同茎段间的TAC与TSC、Rb1含量呈不同的相关性,整个地上茎的TAC与TSC含量间呈极显著负相关关系、TAC与Rb1含量间呈不显著正相关。研究认为,在三七绿紫过渡地上茎中,花色苷和皂苷的横向组织定位不同,二者含量在纵向上总体呈负相关。
三七;绿紫过渡地上茎;花色苷;皂苷;组织学定位和含量
云南省文山州大田栽培一年生三七(Panaxnotoginseng)植株的地上茎可分为绿茎、绿紫过渡茎和紫茎3种[1]。研究表明,三七地上茎、根状茎及其不定根等出现不同程度的紫色,即发生紫化,均是源于花色苷的合成与积累[2-4],但是,地上茎的紫化出现最早、最明显[5],绿紫过渡茎和紫茎在植株长至约3~4 cm高时即可被肉眼分辨。绿紫过渡茎约1/3茎段呈紫色,且紫色明显集中在茎的中上部,即大约在茎纵向上的黄金分割点处,因此,茎从顶端向基部表现为绿、紫、绿和白4段(图1)。
花色苷的合成与积累导致高等植物花、果、叶、茎和根等出现粉红、红、紫和蓝等色已被普遍证实[6],其中,花色苷可导致整茎为红色,也可仅使茎基部或顶端为红色[7-9],但是,花色苷积累导致植物器官表面颜色图案呈现特定的几何学特征却罕见报道,花环菊(Chrysanthemumcarinatum)舌状花中、下端紫红色的花色苷积累区与非积累区的分界线被观察到恰好定位在花瓣纵向的黄金分割点上[9]。文山州栽培三七一年生植株绿紫过渡地上茎的花色苷集中于茎纵向黄金分割点处的现象至今未引起重视,过渡地上茎花色苷和皂苷组织学定位和含量的纵向变化趋势迄今仍为研究空白。
因此,本研究以文山州栽培三七一年生植株绿紫过渡地上茎为材料,采用显微组织化学法对花色苷和皂苷在组织细胞中的定位进行检测,并分析总花色苷、总皂苷及主要皂苷单体含量的纵向变化,以揭示地上茎花色苷和皂苷的纵向积累规律,为三七器官花色苷和皂苷积累量相关性的研究提供参考。

图1 栽培三七一年生绿紫过渡地上茎植株Fig.1 One-year-old green-purple transitional aerial stemmed plants of cultivated Panax notoginseng
1 材料和方法
1.1材料采集与预处理
三七绿紫过渡地上茎植株于2015年10~11月采于“苗乡三七科技有限公司”苗圃(23°31′48″N,104°19′21″E)。三七以垄作方式种植,棚顶及棚四周覆2层黑色聚乙烯遮阳网。当三七植株长至最高(平均为18 cm)时,随机采50株,分为3份,第1份4株,从茎顶向茎基依次剪取茎段,所有茎均剪得18段,用于花色苷和皂苷的显微组织化学检测;第2份23株,在植株叶柄基部剪取复叶至根状茎之间茎段,将茎段冻存于液氮,再置-80 ℃,用于检测总花色苷含量(Total anthocyanin content,TAC)和总皂苷含量(Total saponin content,TSC);第3份也有23株,在实验室一次性剪取茎段,将茎段冻存于-80 ℃,用于检测主要皂苷单体含量(Saponin monomer content,SMC)。
1.2茎段花色苷和皂苷组织定位的检测
茎段花色苷和皂苷定位的显微组织化学法检测均以徒手切片进行。在新鲜茎段中部横切到2张切片;将第1张切片放载玻片,盖上盖玻片后立刻用Motic BA300 Polarizing Microscope寻找因花色苷存在而导致的红色细胞群以确认花色苷的定位,尽可能将切片完整摄影,并据红色程度比较花色苷积累量[10];在另一载玻片中央加5%香草醛-冰醋酸1滴、再加高氯酸4滴,混匀,将第2张切片放在液滴中央,使其完全浸没,10 min后,盖上盖玻片,寻找因皂苷存在而导致的红、紫或蓝色细胞群以确认皂苷的组织定位,并比较其积累量[11]。
1.3茎段TAC的测定
茎段TAC用“色价”度量[12]。取茎段0.500 g加液氮磨成粉,再加含1%浓盐酸(V/V)的甲醇30 mL磨成匀浆[13],在黑暗中滤入50 mL容量瓶,定容;取4 mL滤液用UNIC 4802 UV/VIS双光束分光光度计在200~700 nm范围、以0.1 nm为梯度扫描,石英杯光径为1 cm,获得一年生三七地上茎花色苷1%浓盐酸-甲醇提取液在可见光区的最大吸收峰波长(λvis-max);检测滤液的Aλvis-max和A657;茎段TAC=(Aλvis-max-0.25A657)/g(FW)[14]。
1.4茎段皂苷含量的测定
1.4.1TSC茎段TSC用“香草醛-高氯酸比色法”测定[15,16]:以人参皂苷Rgl(上海源叶生物科技有限公司)为标样[17];取茎段0.500 g,加液氮磨碎;再加75%乙醇约20 mL磨成匀浆,用50 Hz 100 W超声波(NB-5200型超声波仪,郑州南北仪器设备有限公司)在22 ℃处理30 min[18],过滤、用75%乙醇定容至100 mL;取0.3 mL滤液于70 ℃水浴蒸干,加0.2 mL 5%香草醛-冰乙酸和0.8 mL高氯酸,置60 ℃水浴15 min,冷至室温后加冰醋酸5 mL,摇匀,测A560。

表1 HPLC法检测三七绿紫过渡地上茎 皂苷单体的洗脱梯度Table 1 Elution gradient used to determine the saponin monomer content of the green-purple transitional aerial stems of P. notoginseng by using HPLC
1.4.2SMC茎段SMC用高效液相色谱(High performance liquid chromatography,HPLC)法检测,以人参皂苷Rbl、Re和Rgl及三七皂苷R1和Rd为标样(中国药品生物制品检定所,专供含量测定用混合标样,批号:110870-201002)[19-20]:将茎段解冻,吸去其表面水分,取0.500 g,加约30 mL甲醇研磨成匀浆,用50 Hz 100 W超声波在22 ℃处理30 min[18],定容至100 mL,过滤;将滤液减压浓缩至10 mL,取5 μL上Agilent 1260 HPLC仪(配G1311C四元泵、G1329B自动进样仪、G1315D光电二极管阵列检测器和Agilent ChemStation工作站),柱温20 ℃,色谱柱为Agilent Proshell 120 EC-C18(4.6 mm×100 mm,2.7 μm),流动相为乙腈:水(v/v),梯度洗脱(表1)[21],流速为0.6 mL/min,检测波长203 nm[20]。
1.5数据分析
所有试验均重复2次,方差分析和双因素相关分析用SPSS17.0完成。
2 结果与分析
2.1三七绿紫过渡地上茎花色苷和皂苷组织定位和积累量的纵向变化特征
2.1.1花色苷组织定位和积累量的纵向变化特征在茎段横截面上,花色苷的积累会导致细胞显紫红色,因此,花色苷的主要径向组织定位点为茎皮层薄壁组织外侧的2层或2~3层细胞,这与红茎偃伏棶木(Cornusstolonifera)茎中的花色苷定位在周皮和/或皮层最外层的表现相似[22];因地上茎为非规则的圆柱形,故积累花色苷的细胞群在茎横截面的外侧形成一个不规则的紫红色环(图2,A)。此外,在厚角组织外侧的1~2层细胞和表皮细胞中也有少量花色苷积累,但韧皮部、形成层、木质部和髓中均无花色苷积累。所以,地上茎中积累的花色苷可能是茎皮层薄壁组织合成的,且花色苷没有可移动性,而可能在茎中就地发挥屏蔽可见光、避免强光伤害茎中叶绿体的作用[22,23]。另一方面,因细胞的紫红程度与其花色苷积累量呈正相关[10,22],故积累花色苷较多的茎段为茎段3~13(紫红较浓),即花色苷主要积累在茎的中、上部,近地处茎段(茎段14~18)因被土壤或垄面铺设的松毛遮挡而无光或少光照射且温度略高而几乎无花色苷积累(紫红较淡甚至无),这暗示地上茎的花色苷合成需光和/或低温[24];进一步比较发现,茎段7横截面的紫红色环最浓;因:18-18×0.618(黄金分割率)=6.876≈7,即:茎段7位于地上茎中、上部的黄金分割点;所以,茎的花色苷明显富集于茎的黄金分割点处,这与茎表面的紫色区段出现在茎中上部的现象吻合(图1和2)、成为三七绿紫过渡地上茎“紫化”最明显、最神奇的特征(图2,A)。
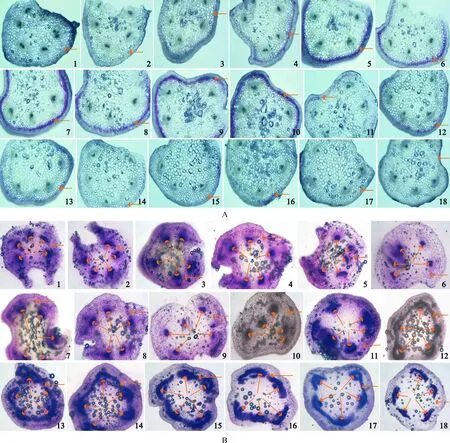
A. 花色苷; B. 皂苷: 1~18. 分别表示从茎顶端向茎基部的18段茎段; A图中的横箭头表示花色苷定位的皮层薄壁组织细胞; B图中的辐射状箭头表示皂苷主要定位的维管束,右侧的横箭头表示皂苷次要定位的皮层薄壁组织图2 三七绿紫过渡地上茎各茎段中间横截面花色苷和皂苷组织定位和积累量的光学显微特征(×40)A. Anthocyanins; B. Saponins; The numbers in the brackets indicated the 18 stem parts ranging from the tips to the basal parts of the stems; In Figure A, the horizontal arrows indicated the cortex parenchyma cells in which the anthocyanins were located; In Figure B, the radial arrows indicated vascular bundles in which the saponins were mainly located and the right horizontal arrows indicated the cortex parenchyma in which the saponins were less locatedFig.2 Light micrographs of the histological locations and accumulation quantities of the anthocyanins and saponins at the middle cross-sections of the stem parts of the green-purple transitional aerial stems of P. notoginseng(×40)
2.1.2皂苷组织定位和积累量的纵向变化特征在茎段横截面上,皂苷与“5%香草醛-冰醋酸和高氯酸(1∶4,V/V)”溶液反应后显淡红、红、紫红、紫和蓝色(图2,B);颜色越偏淡红意味着皂苷积累量越小,越偏蓝则意味着皂苷积累量越大[11]。因此,皂苷在茎段横截面上的主要组织定位点为茎维管束,其次为皮层薄壁组织,髓中则几乎无皂苷积累(图2,B),这意味着,皂苷也许能在地上茎的维管束中运输[11],该特征与花色苷的非移动性特征迥异(图2)。另一方面,在茎纵向上,从茎顶端向茎基部,皂苷的积累量大致表现为“三段式”,即:“高(茎段1~3,偏紫蓝)-低(茎段4~10,偏淡蓝、红)-高(茎段11~18,偏蓝)”,可见,皂苷主要积累于茎的中、下部(茎段11~18),尤其是下部(包括茎段13~18),这意味着,地上茎积累皂苷可能与光强无关,且积累的皂苷可能主要响应来自土壤的胁迫;此外,越往茎上部(茎段1~10),皂苷在皮层薄壁组织出现的趋势越明显,而越往茎下部(茎段11~18),皂苷集中于维管束的趋势越明显(图2,B)。
2.2三七绿紫过渡地上茎TAC的纵向变化特征
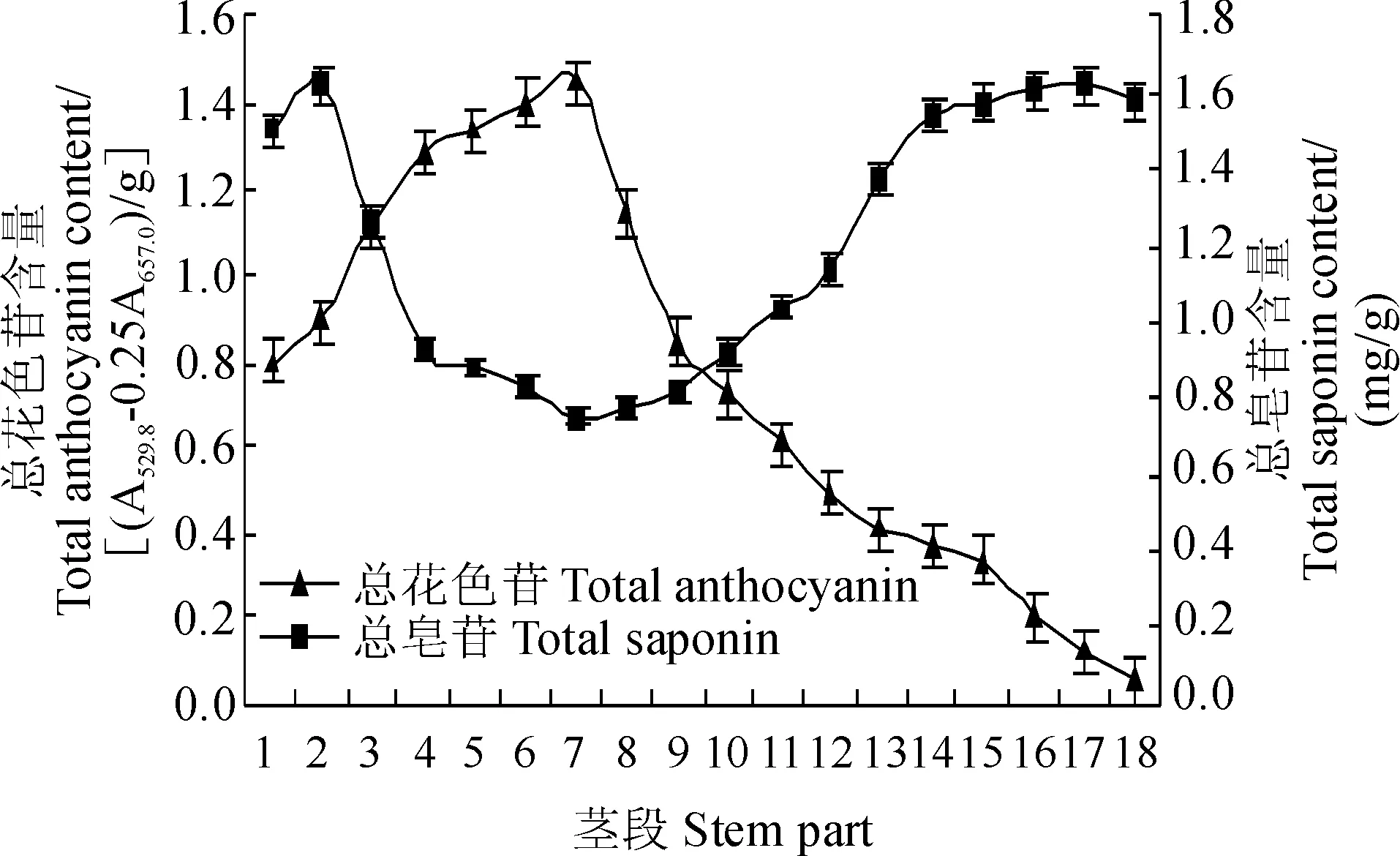
图3 三七绿紫过渡地上茎各茎段的总花色苷和总皂苷含量Fig.3 Contents of the total anthocyanins and saponins of the stem parts of the green-purple transitional aerial stems of P. notoginseng
紫外-可见光谱表明,一年生三七绿紫过渡地上茎花色苷1%浓盐酸-甲醇提取液的λvis-max为529.8 nm,与三年生三七根状茎花色苷的几乎相等[21]。从茎顶向茎基,即从茎段1到18,茎段TAC表现为一条单峰曲线(图3);TAC最高峰出现在茎段7,约为1.448±0.043(A529.8-0.25A657.0)/g,同样,因18-18×0.618=6.876≈7,故TAC最高的茎段7定位在茎中上部的黄金分割点处;TAC最低点出现在茎段18,仅约为0.054±0.002 (A529.8-0.25A657.0)/g,约为茎段7TAC的3.84%。此外,茎段1~11TAC的和约为11.58 (A529.8-0.25A657.0)/g,约占整个茎TAC的85.43%,而茎段12~18TAC的和约为1.98 (A529.8-0.25A657.0)/g,约占整个茎TAC的14.57%,因此,地上茎花色苷主要积累在茎中、上部,与地上茎不同茎段花色苷积累量的显微特征一致(图2,A和图3)。但是,方差分析中,F0.05(17,18)=2.23 2.3三七绿紫过渡地上茎皂苷含量的纵向变化特征 2.3.1TSC的变化特征茎段TSC用回归方程y=0.150 2x-0.158 8(R2=0.999 5)计算,其中,y代表A560,x代表Rg1含量(μg)。从绿紫过渡地上茎的茎顶向茎基,即从茎段1到18,茎段TSC总体表现为一条“V形”曲线(图3);TSC最低点出现在茎段7,约为(0.752±0.023) mg/g,即地上茎最低TSC恰好定位在茎中上部的黄金分割点处,与该处的最高TAC形成鲜明对照,暗示着地上茎花色苷与皂苷含量之间呈负相关;曲线左侧最高TSC点出现在茎段2,约为(1.622±0.047) mg/g,茎段1(与叶柄相连)和茎段3的TSC分别比茎段2的约低7.51%和22.20%;曲线右侧最高TSC点出现在茎段17,约为(1.623±0.049) mg/g,茎段16和茎段18的TSC分别比茎段17的约低0.75%和2.77%(图3)。茎段1~3的TSC之和约为4.385 mg/g,约占整个地上茎TSC总和的20.14%,茎段4~10的TSC之和约为5.916 mg/g,约占整个地上茎TSC总和的27.17%,而茎段11~18的TSC之和约为11.472 mg/g,约占整个地上茎TSC总和的52.69%,因此,地上茎TSC纵向趋势为:下、基部>顶端>上、中部(图3)。但是,方差分析中,F≈0.75<2.23=F0.05(17,18),因此,地上茎不同茎段总皂苷含量间的差异未达到显著水平。 2.3.2SMC的变化特征在地上茎SMC的HPLC法检测中,标样R1、Rg1、Re、Rb1和Rd的保留时间分别为14.603、21.035、23.248、37.037和40.349 min(图4,A),各茎段被HPLC检测到的皂苷单体均主要为人参皂苷Rb1(图4,B),与文献[20]报道的结果一致。图5显示,从茎顶向茎基,即从茎段1到18,各茎段的Rb1含量总体表现为一条“降-升-降三段式”曲线,即从茎段1至茎段7,Rb1含量由最高,即约为(1.300±0.039) mg/g,骤降至最低,即仅约为(0.231±0.007) mg/g,从茎段7至茎段9,含量由最低骤升至第二高,从茎段9至茎段18,含量则由第二高缓慢降至略低,即约为0.244±0.007 mg/g(图5);茎段7即地上茎中上部的黄金分割点处的Rb1含量也恰好最低;茎段1的Rb1含量约为茎段7 Rb1含量的5.634倍;茎段9的Rb1含量居第二高,约为(0.535±0.016) mg/g,约为茎段7 Rb1含量的2.319倍(图5)。茎段1~9的Rb1含量之和约为5.142 mg/g,约占整个地上茎Rb1含量总和的63.18%,茎段10~18的Rb1含量之和约为2.996 mg/g,约占整个地上茎Rb1含量总和的36.82%,即地上茎上半段Rb1含量之和比下半段的Rb1含量之和约高71.62%,可见,Rb1主要积累于地上茎的上半段。此外,方差分析中,F≈7.51>3.16=F0.01(17,18),因此,地上茎不同茎段Rb1含量间的差异达极显著水平。 2.4三七绿紫过渡地上茎花色苷和皂苷含量纵向变化的相关性特征 绿紫过渡地上茎不同茎段的TAC和TSC、MSC变化间呈不同的相关性特征(表2)。一方面,茎段1~3、3~9、9~18、1~7和7~18的TAC和TSC间的Pearson相关系数分别为-0.804、-0.204、-0.944**、-0.975**和-0.913**,但是,整个地上茎,即从茎段1~18,TAC和TSC间的相关系数为-0.767**,即呈极显著负相关,这可能是因花色素和皂苷元成苷时与同一或结构近似的糖缩合而对糖存在竞争效应[25-26]。另一方面,茎段1~7、7~9和9~18的TAC和Rb1含量间的Pearson相关系数分别为-0.965**、-0.942和0969**,整个地上茎TAC和Rb1含量间的相关系数为0.208(表2)。可见,地上茎上半段TAC和Rb1含量间呈极显著或不显著负相关,而下半段则呈极显著正相关,整个地上茎TAC和Rb1含量间呈不显著正相关。 A. 标准品N-R1、G-Rg1、G-Re、G-Rb1和G-Rd的HPLC图谱:N. 三七皂苷; G. 人参皂苷; B. 茎段1甲醇提取液的HPLC图谱, 茎段1的皂苷单体含量最高图4 三七绿紫过渡地上茎茎段1皂苷单体含量的HPLC法检测A. HPLC chromatogram of Standard N-R1, G-Rg1, G-Re, G-Rb1 and G-Rd: N. notoginsenoside; G. ginsenoside; B. HPLC chromatogram of the methanol extracts of the stem part 1, the saponin monomer (Rb1) content of stem part 1 was the highestFig.4 HPLC determination of the saponin monomer content of the stem part 1 of the green-purple transitional aerial stems of P. notoginseng 图5 三七绿紫过渡地上茎各茎段的主要皂苷单体(Rb1)含量Fig.5 Content of the main saponin monomer (Rb1) of the stem parts of the green-purple transitional aerial stems of P. notoginseng表2 三七绿紫过渡地上茎不同茎段总花色苷和总皂苷、 主要皂苷单体(Rb1)含量间的Pearson相关系数Table 2 Pearson correlation coefficients between the total anthocyanin content and the total saponins and main monomer saponin (Rb1) contents of different parts of the green-purple transitional aerial stems ofP. notoginseng 茎段StempartPearson相关系数PearsoncorrelationcoefficientTAC和TSCTACandTSCTAC和Rb1含量TACandRb1content1~3-0.804-1~7--0.965**3~9-0.204-7~9--0.9429~18-0.944**0.969**1~7-0.975**-7~18-0.913**-1~18-0.767**0.208 注: TAC和TSC 分别表示总花色苷和总皂苷含量;**表示在P=0.01水平上相关显著,- 表示没有测算 Note: TAC and TSC indicated total anthocyanin and total saponin contents, respectively;**indicated the correlation significance atP=0.01 level, - stood for not measured 黄金分割是公元前6世纪古希腊哲学家、数学家毕达哥拉斯(Pythagoras)及其学派最早发现的;黄金分割现象在自然界无处不在,绿色植物的分枝、叶片着生模式和花瓣数目等均展示出该现象[27];研究表明,花环菊(C.carinatum)花瓣中、下端紫红色花色苷积累区与白色花色苷非积累区的分界线恰好定位在花瓣纵向的黄金分割点处[9],但是,高等植物器官的花色苷积累导致该器官呈现黄金分割式着色的现象及其意义至今未引起人类的关注。大田调研发现,文山州栽培三七一年生植株绿紫过渡地上茎的紫色明显集中在茎的中、上部,即大约在茎中、上部的黄金分割点处。于是,本研究先将绿紫过渡地上茎约以1 cm为距分为茎段,再检测各茎段的花色苷和皂苷的组织定位和含量,发现:在茎段横截面上,花色苷主要定位在皮层薄壁组织外侧的2或2~3层细胞,而皂苷主要定位在维管束;各茎段的皂苷单体均主要为人参皂苷Rb1;从茎顶向茎基,茎段TAC、TSC和Rb1含量总体上分别表现为一条“单峰”、“V形”和“降-升-降三段式”曲线;花色苷主要积累在茎中、上部,总皂苷在下、基部,Rb1则在上半段;TAC最高及TSC和Rb1含量最低的茎段均恰好定位在茎中、上部的黄金分割点处;不同茎段的TAC和TSC、Rb1含量变化间呈不同的相关性特征,整个地上茎TAC和TSC间呈极显著负相关,而TAC和Rb1含量间则呈不显著正相关。 在普遍发生紫化的三七营养器官中,地上茎的紫化出现得最早,也最明显[5],故紫化的地上茎成为探究三七花色苷合成和生态生理功能的首选器官。但是,三七一年生植株绿紫过渡地上茎上花色苷黄金分割式积累的原因和功能目前是不清楚的[28],该现象显然不是为了实现紫化的“匀称美学属性”[29],因地上茎中、上部积累的花色苷没有向无光照射的茎基部运输,故初步推测,光应是诱导地上茎花色苷合成的第一环境因子[24]。另一方面,本研究发现,与红茎偃伏棶木(C.stolonifera)茎的花色苷定位相似[22],绿紫过渡地上茎的花色苷主要定位在皮层薄壁组织外侧(图2 A),暗示地上茎花色苷的主要功能应是起光保护作用[22,30]。前人研究发现,三七地下部(即根状茎及其不定根)富含原人参二醇和原人参三醇型皂苷,花和叶则只含原人参二醇型皂苷,特别是富含人参皂苷Rc、Rb2和Rb3,但地上茎的皂苷却独立成介于地下部和花和叶之间的“中间簇”[31],同时,根状茎及其不定根的花色苷含量被证实与其总皂苷含量间呈正相关[1,5,21],根状茎及其不定根的皂苷单体含量也与其紫化程度相关[21]。因此,本研究发现的绿紫过渡地上茎TAC和TSC间呈极显著负相关、TAC和Rb1含量间呈不显著正相关可为三七营养器官花色苷与皂苷积累量的相关性增添新的内容,也为这两种苷代谢相关性的研究提出了新的起点。 致谢:云南农业大学2012级学术硕士生唐小华和孙艳、2013级专业硕士生白玉冰和范圆圆参与部分大田试验和样品采集与制备工作,谨此深表谢意! [1]陈中坚,王勇,曾江,等. 三七植株的性状差异及其对三七产量和质量影响的调查研究[J]. 中草药,2001,32(4):357-358. CHEN Z J, WANG Y, ZENG J,etal. Studies on characteristic distinction and its affect on yield and quality ofPanaxnotoginseng[J].ChineseTraditionalandHerbalDrugs, 2001, 32(4): 357-358. [2]赵昶灵,王颖,段承俐,等. 三七块根紫色素的花色苷本质及其含量和总皂苷含量的正相关性[J]. 广西植物,2008,28(5):661-670. ZHAO C L, WANG Y, DUAN C L,etal. Anthocyanin essence of the purple pigment and positive correlation of the anthocyanin content and the total ginsenoside content of the root tuber ofPanaxnotoginseng[J].Guihaia, 2008, 28(5): 661-670. [3]赵昶灵,崔秀明,卢其能. pH对三七块根花色苷颜色呈现和降解的效应[J]. 云南农业大学学报,2008,23(6):765-774. ZHAO C L, CUI X M, LU Q N. Effects of pH on the coloration and degradation of the anthocyanins from the root tuber ofPanaxnotoginseng(Burk) F. H. Chen[J].JournalofYunnanAgriculturalUniversity, 2008, 23(6): 765-774. [4]ZHAO C L, CHEN Z J, CHEN W L,etal. Preliminary identification of red pigment and positive correlation between the contents of red pigment and total saponins ofPanaxnotoginsengfruits[J].AgriculturalScience&Technology, 2012, 13(9): 1 891-1 895. [5]孙玉琴,陈中坚,黄天卫,等. 三七不同变异类型中皂苷的差异研究[J]. 中草药,2010,41(6):993-996. SUN Y Q, CHEN Z J, HUANG T W,etal. Studies on the saponin differences of different variation types ofPanaxnotoginseng[J].ChineseTraditionalandHerbalDrugs, 2010, 41(6): 993-996. [6]KONG J M, CHIA L S, GOH N K,etal. Analysis and biological activities of anthocyanins[J].Phytochemistry, 2003, 64(5), 923-933. [7]WHELDALE M. The Anthocyanin Pigments of Plants[M]. Cambridge: Cambridge University Press, 1916. [8]GOU J Y, FELIPPES F F, LIU C J,etal. Negative regulation of anthocyanin biosynthesis inArabidopsisby a miR156-targeted SPL transcription factor[J].ThePlantCell, 2011, 23(4): 1 512-1 522. [9]汤章城. 花朵中的黄金分割[J]. 自然与科技,2007,(11,12):40-41. TANG Z C. Golden section in flowers[J].NatureandScienceandTechnology, 2007, (11, 12): 40-41. [10]段岩娇,张鲁刚,何琼,等. 紫心大白菜花青素积累特性及相关基因表达分析[J]. 园艺学报,2012,39(11):2 159-2 167. DUAN Y J, ZHANG L G, HE Q,etal. Expression of transcriptional factors and dtructural genes of anthocyanin biosynthesis in purple-heading Chinese cabbage[J].ActaHorticulturaeSinica, 2012, 39(11): 2 159-2 167. [11]TENG H M, FANG M F, CAI X,etal. Localization and dynamic change of saponin in vegetative organs ofPolygalatenuifolia[J].JournalofIntegrativePlantBiology, 2009, 51(6): 529-536. [12]NISHIYAMA Y, YAMAKAWA T. Effect of medium composition on the production of anthocyanins by hairy root cultures ofIpomoeabatatas[J].PlantBiotechnology, 2004, 21(5): 411-414. [13]MARKHAM K R. Techniques of Flavonoid Identification[M]. New York: Academic Press, 1982: 15-61. [14]HORBOWICZ M, KOSSON R, GRZESIUK A,etal. Anthocyanins of fruits and vegetables - their occurrence, analysis and role in human nutrition[J].VegetableCropsResearchBulletin, 2008, 68(1):5-22. [15]KUBO M, TANI T, KATSUKI T,etal. Histochemistry. I. Ginsenosides in ginseng (PanaxginsengC. A. Meyer, root)[J].JournalofNaturalProducts, 1980, 43(2): 278-284. [16]丁艳芬,陈金东,黎福南,等. 三七总皂苷超声波提取工艺研究[J]. 中国现代中药,2012,(1):38-40. DING Y F, CHEN J D, LI F N,etal. The process engineering of ultrasonic extraction of notoginseng saponins[J].ModernChineseMedicine, 2012, (1): 38-40. [17]王振峰,高云涛,张文斌,等. 不同生长年限三七中总皂苷含量的变化特征[J]. 安徽农业科学,2012,40(15):8 458-8 459,8 463. WANG Z F, GAO Y T, ZHANG W B,etal. Variation characteristics of total saponin content inPanaxnotoginsengat different growth ages[J].JournalofAnhuiAgriculturalSciences, 2012, 40(15): 8 458-8 459,8 463. [18]马妮,高明菊,崔秀明,等. 三七皂苷成分的超声波提取研究[J]. 时珍国医国药,2005,16(9):854-855. MA N, GAO M J, CUI X M,etal. Studies on ultrasonic extracting saponins ofPanaxnotoginseng[J].LishizhenMedicineandMateriaMedicaResearch, 2005, 16(9): 854-855. [19]郑丽华,卢昌均,周志昆,等. HPLC测定三七总皂苷中5种皂苷的含量及稳定性考察[J]. 中医药临床杂志,2012,24(1):73-75. ZHENG L H, LU C J, ZHOU Z K,etal. Content determination of 5 saponins ofPanaxnotoginsengsaponins by HPLC and its sability investigation[J].ClinicalJournalofTraditionalChineseMedicine, 2012, 24(1): 73-75. [20]韦荣昌,唐春风,冯世鑫,等. 广西不同年限三七中皂苷含量的HPLC分析[J]. 河南农业科学,2014,43(3):154-157. WEI R C, TANG C F, FENG S X,etal. HPLC analysis of saponin content from different growth years ofPanaxnotoginsengin Guangxi[J].JournalofHenanAgriculturalSciences, 2014, 43(3): 154-157. [21]赵昶灵,杨生超,陈中坚,等. 紫、绿三七的总花色苷和总皂苷含量及皂苷单体组成[J]. 中药材,2014. 37(10):1 749-1 753. ZHAO C L, YANG S C, CHEN Z J,etal. Contents of total anthocyanins and total saponins as well as compositions of saponin monomers of purple and greenRadixnotoginsengetRhizoma[J].JournalofChineseMedicinalMaterials, 2014, 37(10): 1 749-1 753. [22]GOULD K S, DUDLE D A, NEUFELD H S. Why some stems are red: cauline anthocyanins shield photosystem Ⅱ against high light stress[J].JournalofExperimentalBotany, 2010, 61(10): 2 707-2 717. [23]HABERLANDT G. Physiological Plant Anatomy, Botanical Gazette[M]. Chicago: The University of Chicago Press, 1914: 472-475. [24]CHALKER-SCOTT L. Environmental significance of anthocyanins in plant stress responses[J].PhotochemistryandPhotobiology, 1999, 70(1): 1-9. [25]HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis[J].ThePlantCell, 1995, 7(7): 1 071-1 083. [26]黄壮嘉,刘迪秋,葛锋,等. 植物三萜皂苷生物合成中关键后修饰酶研究进展[J]. 西北植物学报,2014,34(10):2 137-2 144. HUANG Z J, LIU D Q, GE F,etal. Advances in studies on key post-modification enzymes in triterpenoid saponin biosynthesis[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014, 34(10): 2 137-2 144. [27]曾兰玲. 树木花卉形态建模研究[D]. 杭州:浙江大学,2009. [28]陈伟钢. “黄金分割”律形成之源探秘[J]. 自然杂志,2004,26(6):357-360. CHEN W G. An exploration of the mystery of the formation of golden section rule[J].ChineseJournalofNature, 2004, 26(6): 357-360. [29]吴全德. 天道崇美人性好美——美妙的黄金分割及发现DNA双螺旋50周年[J]. 科学中国人,2003,(4):18-21. WU Q D. Natural beauty-advocatinghuman beauty-loving——The 50thanniversary of wonderful golden section and DNA helix-discovering[J].ScientificChinese, 2003, (4): 18-21. [30]BOSSARD C C, REJMANEK M. Why have green stems[J].FunctionalEcology, 1992, 6(2): 197-205. [31]WAN J B, YANG F Q, LI S P,etal. Chemical characteristics for different parts ofPanaxnotoginsengusing pressurized liquid extraction and HPLC-ELSD[J].JournalofPharmaceutical&BiomedicalAnalysis, 2006, 41(5): 1 596-1 601. (编辑:潘新社) Histological Locations and Contents of Anthocyanins and Saponins of Green-purple Transitional Aerial Stems ofPanaxnotoginseng MU Ting1, ZHAO Changling1*, CHEN Zhongjian2, WEN Guosong1,YANG Shengchao3, WEI Fugang4, XIAO Xinglei4, WANG Chongde5 (1 College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China; 2 Sanqi Research Institute, Wenshan University, Wenshan, Yunnan 663000, China; 3 Yunnan Research Center on Good Agricultural Practice Engineering for Dominant Chinese Medicinal Materials, Yunnan, Yunnan Agricultural University, Kunming 650201, China; 4 Miaoxiang Sanqi Industrial Corporation Ltd. of Wenshan City, Wenshan 663000, China; 5 College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China) In order to explore the correlations of the histological locations and contents of the anthocyanins and saponins of the green-purple transitional aerial stems ofPanaxnotoginseng, we studied the histological locations of the anthocyanins and saponins of the stem parts of the green-purple transitional aerial stems of the one-year-oldP.notoginsengplants cultivated in Wenshan Prefecture, Yunnan Province by using microscopic histochemical methods.We also determined the total anthocyanin contents (TACs) and total saponin contents (TSCs) of the stem parts by using spectrophotometry, and the saponin monomer contents of the stem parts by using high performance liquid chromatogram (HPLC). The results indicated that: (1) at the middle cross-sections of the stem parts, the anthocyanins were located in the 2 or 2~3 cell layers outside the cortex parenchyma and the saponins mainly in the vascular bundles. (2) The main saponin monomers of the stem parts were all Ginsenoside Rb1. Overall, from the tips to the basal parts of the stems, the TACs, TSCs and Rb1contents of the stem parts displayed a “single-peaked”, “V-shaped” and “decrease-increase-decrease three-staged” curves, respectively. The anthocyanins accumulated mainly at the middle and superior parts of the stems, the saponins at the lower and basal parts and the Rb1at the superior half parts. The stem parts with the highest TAC or the lowest TSC and Rb1contents were just located at the golden section point of the middle and superior parts of the stems. (3) The difference among the TACs of different stem parts only reached significant level, that among the Rb1contents reached extremely significant level, whereas that among the TSCs did not reach significant level. For different stem parts, there were different correlation characteristics between the TAC and TSC or Rb1contents. For the whole aerial stems, the TAC was negatively correlated with the TSC at extremely significant level, whereas the positive correlation between the TSC and Rb1contents did not reach the significant level. Thus, in the green-purple transitional aerial stems ofP.notoginseng, the transversal histological locations of the anthocyanins and saponins are different and, overall and lengthways, the contents of the two compounds display negative correlation. This study could provide a reference for the exploration of the accumulation correlations of the anthocyanins and saponins of the vegetative organs ofP.notoginseng. Panaxnotoginseng; green-purple transitional aerial stem; anthocyanins; saponins; listological location and content 1000-4025(2016)09-1772-09doi:10.7606/j.issn.1000-4025.2016.09.1772 2016-06-01;修改稿收到日期:2016-07-26 国家自然科学基金(31260091,31460065) 穆婷(1990-),女,在读硕士研究生,从事花色苷生态生理功能的研究。E-mail:155245876@qq.com 赵昶灵,博士,教授,硕士生导师,主要从事植物次生产物的生物合成与生态生理功能研究。E-mail: zhaoplumblossom7@163.com Q946.83; Q944.62 A


3 讨 论
