射波刀联合贝伐单抗治疗复发高级别脑胶质瘤临床初步应用探讨*
2016-11-04张余飞康静波温居一张新红
张余飞 康静波* 温居一 杜 锐 张新红
射波刀联合贝伐单抗治疗复发高级别脑胶质瘤临床初步应用探讨*
张余飞①②康静波①②*温居一②杜锐②张新红②

目的:回顾性评价射波刀联合贝伐珠单抗治疗复发高级别脑胶质瘤的疗效与安全性。方法:选取20例复发高级别胶质瘤患者,所有患者确诊胶质瘤后均经标准手术治疗和后续同步辅助放射治疗+替莫唑胺化疗,射波刀治疗剂量为20~37 Gy/次,治疗4~6次,贝伐珠单抗剂量为5 mg/kg,每2周治疗1次;评估治疗期间、治疗后1个月的疗效和不良反应,之后每间隔3个月评估1次。结果:射波刀联合贝伐单抗治疗后1个月时有效率可达60%,中位无进展生存期(PFS)为6.7个月,1年生存率达45%,未出现4~5级不良反应。结论:射波刀联合贝伐单抗治疗复发高级别胶质瘤有较好的疗效和较长的PFS,其神经系统不良反应无明显增加。
胶质瘤;复发;射波刀;贝伐单抗
[First-author’s address] Navy General Hospital Clinical College, Anhui Medical University, Hefei 230032, China.
恶性胶质瘤占颅脑肿瘤的40%~50%,是最常见的颅内恶性肿瘤,其预后极差,初治高级别胶质瘤患者经标准治疗,即最大范围切除肿瘤术后同步辅助放射治疗和替莫唑胺化疗后5年生存率仍<10%,患者中位总生存期为12~15个月[1]。由于其浸润性的性质和对化疗的相关抵抗性,在高级别胶质瘤中难以实现长期的局部控制率,>80%高级别脑胶质瘤会在完成初始治疗后的1年内复发[2-4]。复发高级别胶质瘤的治疗方式包括,再次手术、再程放射治疗和选择有限的全身化疗方案,而立体定向放射治疗(stereotactic body radiation therapy,SBRT)为其中有效的治疗措施之一。
SBRT可提高复发高级别脑胶质瘤的局部控制,其治疗复发高级别脑胶质瘤有效并安全[5-6]。虽然放射治疗通常被认为是破坏肿瘤血管,但可以通过缺氧诱导因子-1α介导的途径刺激肿瘤血管生成[7]。因此,放射治疗与抑制血管生成药物相结合进行治疗能够达到较好的临床效果。贝伐单抗是一种人源化的小鼠单克隆抗体,通过作用于血管内皮生长因子(vascular endothelial growth factor,VEGF)达到抑制血管生成的作用,目前已被美国食品药品监管局批准用于结直肠癌、非小细胞肺癌、肾细胞癌及复发高级别脑胶质瘤的治疗[8-9]。而在4级胶质瘤中VEGF往往为高表达,但一般VEGF高表达的患者提示预后较差[10-11]。贝伐单抗联合伊立替康治疗复发性高级别胶质瘤有效且不良反应小[12-13]。基于此,本研究回顾性评价射波刀联合贝伐单抗治疗复发高级别脑胶质瘤的疗效及安全性。
1 资料与方法
1.1一般资料
选取2013年3月至2014年10月在海军总医院肿瘤诊疗中心行射波刀治疗的20例复发高级别脑胶质瘤患者,其中男性5例,女性15例;男性与女性比例为1∶3,年龄32~74岁,平均年龄55.4岁。所有患者卡氏评分量表(Karnofsky performance scale,KPS)评分为70~90分,平均评分为78分。胶质瘤WHO病理分级标准:Ⅲ级胶质瘤5例,Ⅳ级胶质瘤15例。所有患者均签署射波刀以及贝伐单抗治疗知情同意书。
1.2纳入与排除标准
(1)纳入标准:①病理诊断明确;②初治经过手术及术后放射治疗同步替莫唑胺化疗标准治疗的复发高级别脑胶质瘤;③仅行过1次放射治疗,且距首次放疗时间6个月以上;④KPS评分>70;⑤血常规、肝肾功能及心肺功能正常,无严重基础疾病;⑥射波刀治疗后随访期≥3个月。随访内容包括症状、体征及影像学检查结果、不良反应,随访期内至少有一次可评估的MRI影像学检查;⑦射波刀治疗后未再采取手术等可能局部根治的治疗方案。
(2)排除标准:①无病理诊断;②初治未按照手术及术后放射治疗同步替莫唑胺化疗标准治疗;③已行调强放射治疗2次以上;④KPS评分<70;⑤有严重基础疾病;⑥射波刀治疗后随访期内无可评估的MRI影像学检查;⑦射波刀治疗后采取了手术等可能局部根治的治疗方案。
1.3仪器设备与药物
采用美国Accuray公司生产的射波刀SBRT系统进行治疗,治疗中以6 MV直线加速器为放射源,在计算机的控制下由具有6个关节的机械臂实现非等中心、非共面、多角度以及聚焦式照射。贝伐单抗(上海罗氏制药有限公司)。
1.4射波刀治疗方法
(1)采用热塑记忆型面膜固定。所有患者行定位CT扫描,患者平板床面热塑膜固定,扫描范围颅顶至锁骨,扫描条件双重可视范围(dual field of view,DFOV)30 cm×30 cm,管电压120 kV,管电流350 mA,层厚2 mm。患者经MRI机行T1加权、T2加权增强扫描,扫描范围为全颅,层厚3 mm。医师结合CT和MRI定位图像勾画靶体积和危及器官,给定处方剂量及剂量限值。
(2)治疗剂量为20~37 Gy/次,治疗4~6次,处方等剂量线范围为79%~88%。初次放射治疗剂量均为60 Gy,再次放射治疗总剂量为20~37 Gy,平均剂量为26.4 Gy,治疗4~6次,平均治疗5次;分次剂量为4~7.4 Gy,平均剂量为5.3 Gy;初次放射治疗与再程放射治疗间隔6~24个月,平均间隔8.2个月。10例患者在射波刀治疗前开始静脉输注贝伐单抗,5例患者于治疗过程中开始静脉输注贝伐单抗,5例患者于射波刀治疗后开始静脉输注贝伐单抗。肿瘤直径<3 cm,射波刀的剂量分割为20~25 Gy/次,治疗4~5次,肿瘤直径>3 cm,射波刀的剂量分割为25~37 Gy/次,治疗4~5次。
(3)将图像及勾画好的靶体积和危及器官推至射波刀的SGI服务器(版本C310)。在服务器上将图像及勾画好的靶体积和危及器官加载至计划数据库。在计划系统(版本2.0.1.0)上建立新计划,采用六维颅骨追踪(6D skull),选择适合的摆位中心居中对齐,使得两幅互为正交的参考射野的数字化重建影像(digitally reconstructed radiograph,DRR),图像在前侧和顶部各留1 cm左右的空隙。选择大小恰当的准直器进行优化计算,包绕95%以上靶体积的剂量作为处方剂量,兼顾总跳数(MU)以及射束数。经主管医师确认后方可形成可执行计划。
1.5贝伐单抗治疗方法
在射波刀治疗前对15例患者进行静脉输注贝伐单抗,对5例患者于治疗过程中开始静脉输注贝伐单抗,剂量均为5 mg/kg,每2周1次,28 d为1周期,需完成4个周期。
1.6评价标准
(1)采用实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[14]:瘤体最长径总和全部病灶消失维持4周为完全缓解(CR);缩小>30%维持4周为部分缓解(PR);增加20%为疾病进展(PD);非PR或PD为病情稳定(SD)。治疗观察近期疗效指标为公式1、公式2:

远期疗效为无进展生存期(progression free survival,PFS)1年生存率。
(2)患者射波刀治疗后3个月行增强MRI复查,评价近期疗效并填写癌症患者生命质量测定量表[FACT-G中文版(v4.0)]评估是否有生存质量改善;治疗观察指标:生存质量改善率。
(3)采用肿瘤放射治疗协作组(radiation therapy oncology group,RTOG)急性放射损伤分级标准及研究和治疗癌症的欧洲组织(european organization research and treatment cancer,EORTC)晚期放射损伤分级标准评价放射反应[15]。药物不良反应参照美国国家癌症研究所通用不良反应评定标准第3版(NCICTCAE version 3),分为0~4级。
(4)随访自射波刀治疗结束开始,截止至2015年9月31日,射波刀治疗结束后1周、3个月时随访,以后每隔3个月随访1次,随访率100%。
1.7统计学方法
应用SPSS 22.0统计软件,生存率采用Kaplan Meier法计算、经Log Rank(Mantel-Cox)检验,计数资料用率表示。
2 结果
2.1近期疗效
射波刀治疗后3个月复查MRI评价近期疗效,按照疗效评价标准,20例患者中CR为3例,PR为9例,SD为6例,PD为2例;治疗有效率为60%,临床受益90%。
2.2无进展生存期及1年生存率
中位PFS为6.7个月,1年生存率为45%,生存曲线如图1所示。
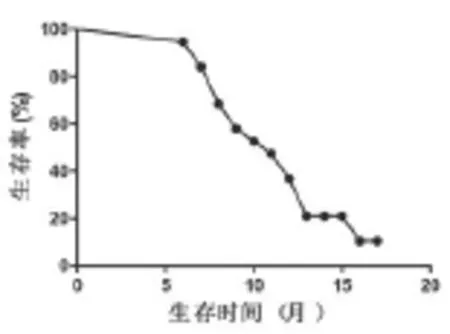
图1 射波刀联合贝伐单抗治疗患者生存曲线图
2.3生存质量改善
射波刀联合贝伐单抗治疗后3个月,患者自身感觉生存质量改善率为66.7%(12/18),其中有2例患者未填写生命质量测定量表。
2.4不良反应
治疗期间和治疗后1周,患者出现不同程度的乏力、食欲不振及恶心等2~3级不良反应症状;均未观察到4~5级不良反应。
(1)神经系统毒性:①出现3级神经系统毒性不良反应共5例,其中1例出现较严重的记忆力损害,占5%,4例出现脑水肿需住院输注甘露醇及激素治疗,占20%;②出现2级神经系统毒性不良反应共6例,占30%,表现为乏力纳差。
(2)药物不良反应:在输注贝伐单抗后出现2级药物不良反应高血压2例,占10%;其中出现轻度皮肤瘀血1例,给予对症治疗可恢复正常;出现蛋白尿1例,占5%;见表1。
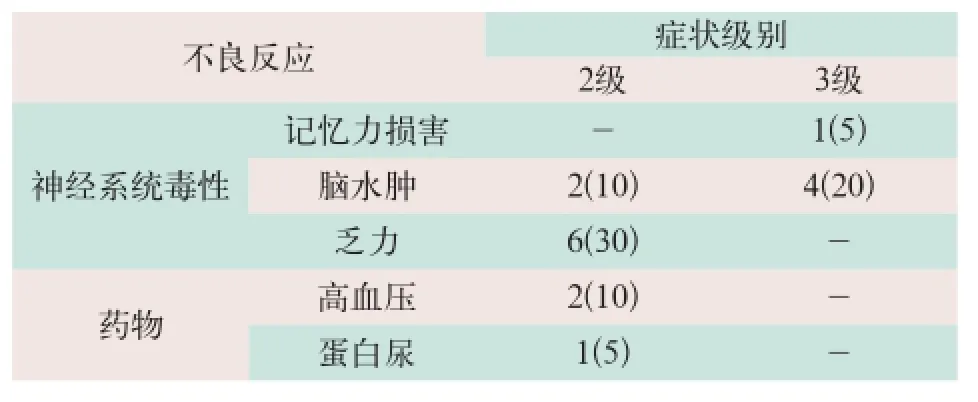
表1 治疗中和治疗后不良反应情况[例(%)]
3 讨论
近年来的多项研究证实,分次立体定向放射治疗(hypofractionated stereotactic radiotherapy,HSRT)相对而言更安全有效,本研究使用HSRT取代SRS系统的原因为:①可以减少患者治疗时间,减轻患者不适;②分次治疗符合放射生物学原理;③可以治疗更大体积的肿瘤而不增加急性或亚急性不良反应;④减少放射性脑坏死的发生率。
综合治疗在复发胶质瘤中的应用越来越多,其中贝伐单抗用于复发胶质瘤通常是与伊立替康联合使用的[12-13]。此外,临床上常用贝伐单抗治疗难治性脑水肿,贝伐单抗临床应用[16]中的主要不良反应有增加出血风险、高血压及蛋白尿等,但单独应用于复发胶质瘤治疗或联合伊立替康治疗胶质瘤耐受性良好,颅内出血发生率低。而利用SBRT治疗复发胶质瘤的相关报道也较多,但不良反应发生率一般均较高。Conti等[17]2012年报道,用SRS治疗了23例复发胶质瘤,中位剂量20 Gy,中位照射次数2次。12例联合替莫唑胺(TMZ),11例单用SRS。中位生存期联合组为12个月、单用SRS组为7个月。6个月PFS联合组66.7%、单用SRS组18%。中位进展时间分别为7个月及4个月。多数患者出现了激素依赖。联合组有1例放射性坏死(4.3%),有>40%的患者出现了3级血液学毒性。Minniti等[18]报道,采用再放射治疗剂量模式HSRT(30 Gy/5次)联合化疗治疗复发恶性胶质瘤,共有54例入组,HSRT同时及随后应用了药物TMZ治疗。入组患者既往均经标准的适形放射治疗(60 Gy/30次)及辅助TMZ至12个周期,两次放射治疗间隔中位时间15.5个月。HSRT后中位生存12.4个月,1年及2年的生存率分别为53%及16%。中位PFS为6个月,1年、2年PFS率为24%及10%。脑坏死率高达7%。而HSRT联合贝伐单抗治疗复发高级别脑胶质瘤目前相关的研究较少。
贝伐单抗治疗脑肿瘤的优势有直接抑制肿瘤相关血管生成,使肿瘤相关血管正常化,直接对抗高级别胶质瘤中高表达VEGF的癌细胞,损坏胶质瘤干细胞周围的微血管,初治胶质瘤联合贝伐单抗的化疗方案并无明显延长患者生存期,而放射治疗脑部肿瘤通常被认为是破坏肿瘤血管,但临床前基础研究表明,放射治疗可以通过缺氧诱导因子-1α-介导的途径刺激肿瘤血管生成。此外,放射性坏死组织中VEGF往往是高表达,而贝伐单抗不仅能有效抗肿瘤血管生成,而且还可有效减轻放射治疗相关不良反应(放射性坏死,水肿等)[19-20]。因此,放射治疗与贝伐单抗或许能达到更大的临床获益,Gutin等[21]报道,治疗25例复发高级别脑胶质瘤放射治疗前给予贝伐单抗10 mg/ kg,每2周1次,28 d为一个周期,用至肿瘤进展,并在第1周期的贝伐单抗后接受30 Gy/5次的HSRT,在高级别患者中有效率为50%,6个月PFS为65%,中位总生存为12.5个月,1年生存率54%。Cabrera等[22]报道的一项前瞻性临床研究证实,SBRT联合贝伐单抗治疗15例复发高级别脑胶质瘤患者安全有效,仅1例患者出现3级神经系统不良反应。与本诊疗中心其他未采用贝伐单抗联合的射波刀治疗复发高级别脑胶质瘤患者初步随访数据对比,联合贝伐单抗有着更好的临床症状改善率,更高的无病生存期,但总体生存期有无增加,尚待进一步随访数据对比。
综上所述,射波刀联合贝伐单抗治疗复发高级别脑胶质瘤有较好疗效和安全性,联合TMZ、贝伐单抗等药物或许会有更好的临床获益,但仍有诸多问题亟待解决:如放射治疗的剂量分割模式、哪些患者是此种治疗模式的获益人群,治疗的最佳剂量和疗程是多少,哪些患者是严重毒性反应的高危人群,影响疗效的预后因素有哪些,这些都需要进行更为深入的研究。故射波刀联合贝伐单抗能否作为复发脑胶质瘤补救治疗方案尚需大型、随机及多中心前瞻性研究证实。
[1]Bonner JA,Harari PM,Giralt J,et al.radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:5-year survival data from a phase 3 randomised trial,and relation between cetuximab-induced rash and survival[J].Lancet Oncol,2010,11(1):21-28.
[2]Brandes AA,Tosoni A,Franceschi E,et al.Recurrence pattern after temozolomide concomitant with and adjuvant to radiotherapy in newly diagnosed patients with glioblastoma:correlation with MGMT promoter methylation status[J].J Clin Oncol,2009,27(8):1275-1279.
[3]Milano MT,Okunieff P,Donatello RS,et al.Patterns and timing of recurrence after temozolomide-based chemoradiation for glioblastoma[J].Int J Radiat Oncol Biol Phys,2010,78(4):1147-1155.
[4]McDonald MW,Shu HK,Curran WJ Jr,et al. Pattern of failure after limited margin radiotherapy and temozolomide for glioblastoma[J]. Int J Radiat Oncol Biol Phys,2011,79(1):130-136.
[5]Cengiz M,Ozyigit G,Yazici G,et al.Salvage reirradiaton with stereotactic body radiotherapy for locally recurrent head-and-neck tumors[J].Int J Radiat Oncol Biol Phys,2011,81(1):104-109.
[6]Vargo JA,Wegner RE,Heron DE,et al. Stereotactic body radiation therapy for locally recurrent,previously irradiated nonsquamous cell cancers of the head and neck[J].Head Neck,2012,34(8):1153-1161.
[7]Moeller BJ,Cao Y,Li CY,et al.Radiation activates HIF-1 to regulate vascular radiosensitivity in tumors:Role of reoxygenation,free radicals,and stress granules [J].Cancer Cell,2004,5(5):429-441.
[8]Kim KJ,Li B,Winer J,et al.Inhibition of vascular endothelial growth factor-induced angiogenesis suppresses tumour growth in vivo[J].Nature,1993,362(6423):841-844.
[9]Presta LG,Chen H,O'Connor SJ,et al.Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders[J].Cancer Res,1997,57(20):4593-4599.
[10]Salmaggi A,Eoli M,Frigerio S,et al. Intracavitary VEGF,bFGF,IL-8,IL-12 levels in primary and recurrent malignant glioma[J].J Neurooncol,2003,62(3):297-303.
[11]Lamszus K,Ulbricht U,Matschke J,et al.Levels of soluble vascular endothelial growth factor(VEGF)receptor 1 in astrocytic tumors and its relation to malignancy, vascularity,and VEGF-A[J].Clin Cancer Res,2003,9(4):1399-1405.
[12]Vredenburgh JJ,Desjardins A,Herndon JE,et al. Bevacizumab plus irinotecan in recurrent glioblastoma multiforme[J].J Clin Oncol,2007,25(30):4722-4729.
[13]Desjardins A,Reardon DA,Herndon JE,et al. Bevacizumab plus irinotecan in recurrent WHO grade 3 malignant gliomas[J].Clin Cancer Res,2008,14(21):7068-7073.
[14]杨学宁,吴一龙.实体瘤治疗疗效评价标准-RECIST[J].循证医学,2004,4(2):90-111.
[15]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:1350-1352.
[16]Cohen MH,Shen YL,Keegan P,et al.FDA Drug Approval Summary:Bevacizumab (Avastin(R))as Treatment of Recurrent Glioblastoma Multiforme[J]. The Oncologist,2009,14(11):1131-1138.
[17]Conti A,Pontoriero A,Arpa D,et al.Efficacy andtoxicity of CyberKnife re-irradiation and "dose dense"temozolomide for recurrent gliomas[J].Acta Neurochirurgica,2012,154(2):203-209.
[18]Minniti G,Scaringi C,De Sanctis V,et al. Hypofractionated stereotactic radiotherapy and continuous low-dose temozolomidein patients with recurrent or progressive malignant gliomas[J].J Neurooncol,2013,111(2):187-194.
[19]Lai A,Tran A,Nghiemphu PL,et al.Phase II study of bevacizumab plus temozolomide during and after radiation therapy for patients with newly diagnosed glioblastoma multiforme[J].J Clin Oncol,2011,29(2):142-148.
[20]Steiner HH,Karcher S,Mueller MM,et al. Autoocnne pathways of the vascular growth factor(VEGF)in gliblastoma multiforme;clinical relevance of radiation-induced increase of VEGF levels[J].J Neurooncol,2003,66(1-2):129-138.
[21]Gutin PH,Iwamoto FM,Beal K,et al.Safety and Efficacy of Bevacizumab With Hypofractionated Stereotactic Irradiation for Recurrent Malignant Gliomas[J].Int J Radiat Oncol Biol Phys,2009,75(1):156-163.
[22]Cabrera AR,Cuneo KC,Desjardins A,et al. Concurrent stereotactic radiosurgery and bevacizumab in recurrent malignant gliomas:a prospective trial[J]. Int J Radiat Oncol Biol Phys,2013,86(5):873-879.
The clinical application of cyberKnife combined with bevacizumab in the treatment of recurrent high-grade glioma
ZHANG Yu-fei, KANG Jing-bo, WEN Ju-yi, et al// China Medical Equipment,2016,13(10):64-68.
Objective: This study was to evaluate the efficacy and safety of cyberknife combine with bevacizumab in the treatment of recurrent high-grade glioma. Methods: from May 2013 to October 2014, 20 cases of recurrent high-grade glioma patients were enrolled(treated initially with surgery followed by radiation therapy and concurrent/adjuvant temozolomide), After prior treatment with standard radiation therapy patients with recurrent high-grade glioma received 20-37Gy/4-6Fx of cyberknife, patients also received bevacizumab (5 mg/kg intravenous) every 2 weeks of 28-day cycles until tumor progression . Toxicity and efficiency was assessed during treatment, and 1 months after cyberknife. Subsequently, patients were evaluated at 2- to 3-month intervals. Results: at 1 months after treatment,the total effective rate was 60%. OS 12 months were 45%, median PFS were 6.7 months. Grade 4 to 5 toxicities were not observed. Conclusion: Treatment of high-grade glioma with concurrent cyberknife and bevacizumab was efficacy and safety,not associated with excessive toxicity.
Glioma; Recurrent; Cyberknife; Bevacizumab
10.3969/J.ISSN.1672-8270.2016.10.019
1672-8270(2016)10-0064-05
R816.1
A
2016-02-20
中华国际医学交流基金会先声抗肿瘤治疗专项(CIMF-F-H001-S001)“恩度联合化疗治疗脑神经胶质细胞瘤”
①安徽医科大学海军总医院临床学院 安徽 合肥 230032
②海军总医院肿瘤诊疗中心 北京 100048
kjbnet@126.com
张余飞,男,(1992- ),硕士研究生。安徽医科大学海军总医院临床学院,海军总医院肿瘤诊疗中心,研究方向:肿瘤放射治疗学。
