热力学促进剂对瓦斯水合物相平衡的影响
2016-11-03张家豪刘传海
吴 强,张家豪,高 霞,刘传海
(1.黑龙江科技大学 安全工程学院,哈尔滨 150022;2.黑龙江科技大学 瓦斯等烃气输运管网安全基础研究实验室,哈尔滨 150022;3.黑龙江科技大学 建筑工程学院,哈尔滨 150022)
热力学促进剂对瓦斯水合物相平衡的影响
吴强1,2,张家豪1,2,高霞3,刘传海1,2
(1.黑龙江科技大学 安全工程学院,哈尔滨 150022;2.黑龙江科技大学 瓦斯等烃气输运管网安全基础研究实验室,哈尔滨 150022;3.黑龙江科技大学 建筑工程学院,哈尔滨 150022)
为研究热力学促进剂对瓦斯水合物相平衡的影响,利用全透明瓦斯水合分离实验装置,获取TBAB、THF和CP三种促进体系中瓦斯水合物生成的相平衡参数,结合Chen-Guo模型计算值分析实验数据。结果表明:三种热力学促进剂均能改善水合物相平衡条件,THF、TBAB和CP平均压降分别为36.5、14.9、5.1 MPa,最大压降分别为38.8、17.2、6.5 MPa,其影响效果由大到小依次为THF、TBAB、CP。
瓦斯混合气; 相平衡; 热力学促进剂; 基础水合物
0 引 言
瓦斯是一种优质高效清洁能源。瓦斯水合物储气量高,稳定性好,但在我国,瓦斯抽采利用率不高,大量低浓度瓦斯直接排放到大气中,造成环境破坏和能源浪费。鉴于此,吴强等提出运用水合分离技术提纯煤矿瓦斯[1]。
瓦斯与水形成水合物条件苛刻,寻求一种能有效改善瓦斯水合物相平衡条件的途径十分必要。国内外科研工作者进行许多实验,认为气体组分浓度[2]、液体构成[3-4]以及介质添加作用[5]等都能影响瓦斯水合物相平衡条件,其中化学方法研究较为广泛。Atsadawuth Siangsai等[6]在固定体积结晶器内做甲烷水合物生成实验,发现THF的加入能够降低水合物生成压力;赵建忠等[7]分析认为THF能够有效降低含煤层气的水合物生成平衡压力;Yang等[8]研究了多孔介质中THF和SDS混合溶液对CO2+H2混合气形成水合物的热力学和动力学影响,发现THF浓度增大可以有效缩短水合物形成诱导时间,它的存在大大降低水合物生成压力;Mosayyeb Arjmandi等[9]研究总结TBAB能够改善水合物生成条件,使水合物更加稳定,且不同浓度TBAB溶液对水合物稳定性影响不同;Mohammadi等[10]研究TBAB对混合气(CO2+H2/CH4)水合物相平衡影响,发现TBAB能显著降低水合物生成压力;Sun等[11]实验数据表明相同条件下甲烷在CP溶液体系生成水合物相平衡压力低于纯水体系;詹昊等[12]利用TBAB和CP双添加剂水合物法分离烟气中的CO2,研究发现CP能降低CO2水合物和N2水合物的生成相平衡条件。综上,THF、TBAB和CP对水合物生成都有影响,均能有效降低水合物生成压力。
基于此,笔者分别向同等浓度的三种促进剂溶液中通入相同气体组分的瓦斯气,结合恒容温度搜索法探索热力学促进剂对水合物相平衡的影响。
1 实验材料与方法
1.1实验仪器
针对研究内容,实验室自主研制一套瓦斯水合物实验装置,如图1所示。该装置主要由150 mL透明高压反应釜、恒温控制箱、压力传感器、耐高压温度传感器、气体进样增压系统、光纤摄像系统和数据采集系统等组成。其中高压反应釜温度使用范围-10~50 °C,承压极限20 MPa;恒温控制箱恒温范围-15~90 ℃,控温精度±0.2 ℃;压力传感器测量精度±0.01 MPa;耐高压温度传感器测量精度±0.01 ℃。
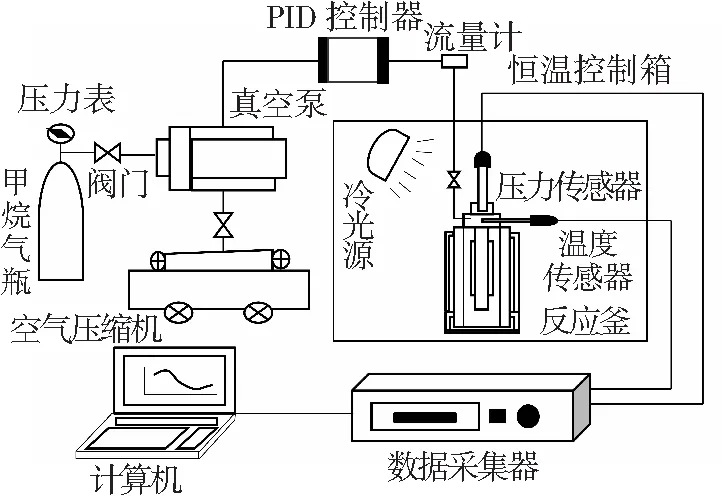
图1 瓦斯水合物高压实验装置系统
Fig.1High pressure experimental equipment for gas hydrate test
1.2实验体系
实验用自制蒸馏水,TBAB药剂由天津市光复精细化工研究所生产,分析纯试剂;THF药剂由天津市富宇精细化工有限公司生产,分析纯试剂;CP药剂由温州市东升化工试剂厂生产,分析纯试剂;瓦斯气样G1:φ(CH4)=70.0%、φ(N2)=23.7%、φ(O2)=6.3%,由哈尔滨通达气体有限公司配制。促进剂浓度均为0.6 mol/L,实验体系见表1。
表1瓦斯水合物相平衡实验初始条件
Table 1Parameters of experimental systems for gas hydrate phase equilibrium experiments
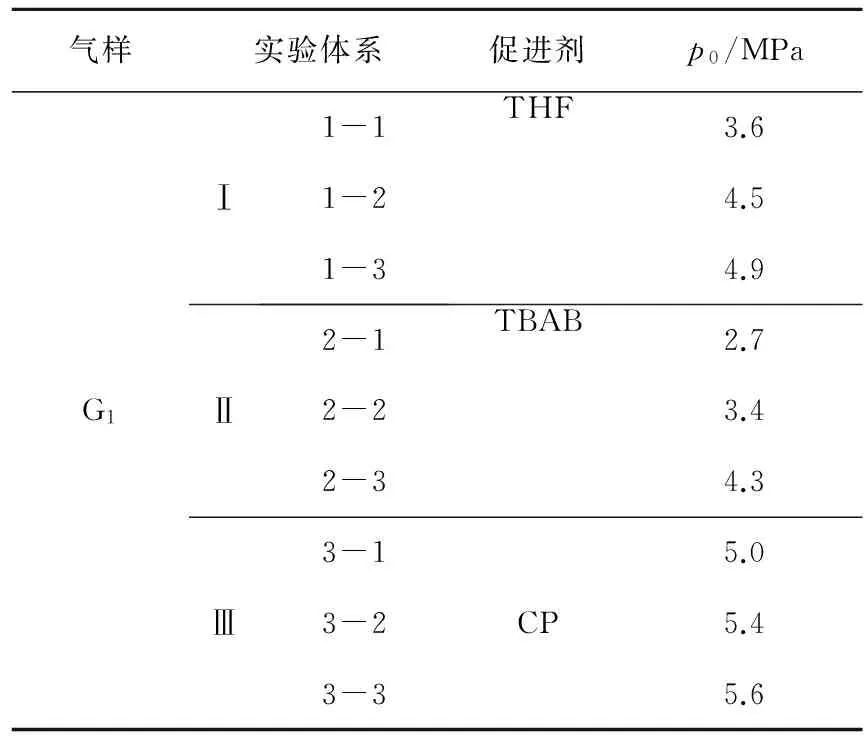
气样实验体系促进剂p0/MPaG1Ⅰ1-11-21-3THF3.64.54.9Ⅱ2-12-22-3TBAB2.73.44.3Ⅲ3-13-23-3CP5.05.45.6
2 结果与讨论
2.1相平衡参数的确定
实验采用的反应装置是全透明高压反应釜,利用恒容温度搜索法确定不同溶液体系中瓦斯水合物生成时的相平衡参数,能够使误差相对较小。测定步骤为:先降温,随着温度的下降,釜内压力逐渐降低,气体先溶于水达到饱和状态,而后气体分子溶于液相形成亚稳态团簇结构,此过程压降缓慢,且在液相表面出现一团白色冰片状水合物,见图2a;随着团簇聚集凝结形成稳定晶核,便进入晶核快速生长时期,白色半透明水合物沿釜壁大量生成,见图2b,压力下降显著,且压降达到一定值后趋于稳定,长期不再发生变化,若继续降温,釜内压力紧随温度的下降而下降;水合物反应基本结束后,系统开始逐步升温使水合物分解,见图2c,由于水合物具有铠甲效应,分解前期压力上升缓慢,随着温度不断升高,压力上升速率加快,直至完全分解变为透明液体,此时温度为t,压力为p,待压力保持一段时间仍稳定不变后,降低温度,液相中生成些许丝绸状透明水合物,见图2d,温度上升至t,水合物又完全分解,如此反复三次,现象一致,则t、p即为相平衡参数,由此得到水合物相平衡温度压力值。鉴于要分析各种促进剂对水合物相平衡条件改善大小,需要以纯水体系下各相平衡温度所对应的压力为参照对象,使用Chen-Guo热力学模型计算出各个体系相平衡温度对应的纯水理论压力值。各个体系实验值和计算值如表2所示。

a b

c d
Fig.2Formation and dissociation process of hydrates in 2-3 system
表2瓦斯气体水合物相平衡实验测定参数与计算结果
Table 2Experimental data of gas hydration parameters of phase equilibrium
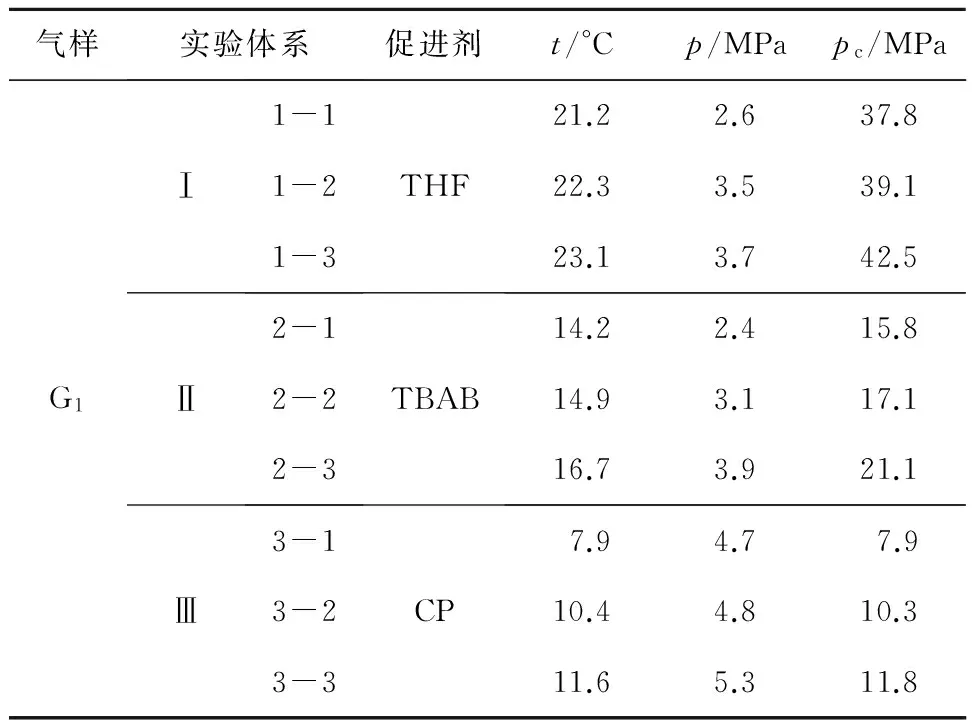
气样实验体系促进剂t/°Cp/MPapc/MPaG1Ⅰ1-11-21-3THF21.22.637.822.33.539.123.13.742.5Ⅱ2-12-22-3TBAB14.22.415.814.93.117.116.73.921.1Ⅲ3-13-23-3CP7.94.77.910.44.810.311.65.311.8
2.2促进剂对瓦斯水合物相平衡的影响
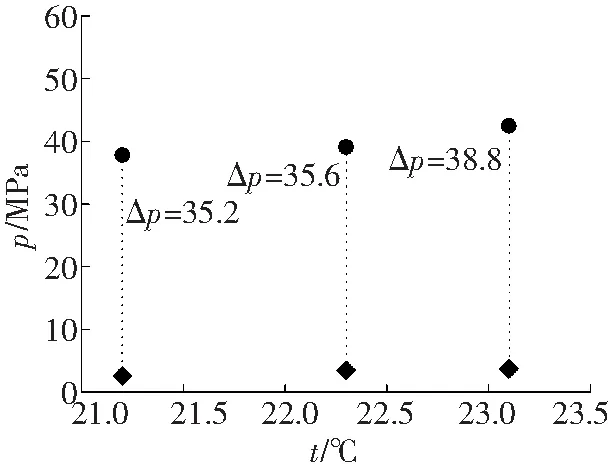
为了分析添加热力学促进剂溶液体系中水合物相平衡参数对纯水体系下所对应的水合物相平衡参数改善幅度,绘制温度-压力二维坐标系,如图3所示。
添加热力学促进剂的溶液体系生成水合物时的相平衡温度和压力值与纯水体系下同等温度对应的相平衡压力值相差很大,THF平均降幅为36.5 MPa,TBAB为14.9 MPa,CP为5.1 MPa,说明纯水体系下水合物的生成条件比添加促进剂的溶液体系生成水合物条件要苛刻许多,这也验证了之前科研工作者实验推论的准确性[13]。
分析认为,气体水合物形成过程分为成核阶段和生长阶段,成核阶段为生长阶段提供物质生长基础,生长阶段主要以吸附过程为主。添加热力学促进剂THF和CP溶液体系形成过程比较类似[14],都是均匀溶解在水溶液中的促进剂分子与周围水分子形成分子簇,分子簇互相联结生成基础水合物[14],基础水合物为体系中其他笼型结构搭建提供物质基础,依此形成更多孔穴,促进剂分子尺寸较大,占据大孔,甲烷分子被吸附至小孔。该过程中促进剂自身较易形成水合物,而未添加促进剂的纯水体系中水分子与氢键形成基础笼型结构需要消耗的能量比前者多,所以瓦斯气形成水合物所需压力较大。含促进剂TBAB溶液体系,生成的水合物构型为A型或B型,是溴离子与水分子氢键相连形成半笼型水合物晶格,TBA+充当客体分子进入大笼(51262或51263)[13],大分子不能进入小笼,则小笼由甲烷分子进入,且大笼为甲烷分子需要进入的其他笼型结构搭建提供物质基础,降低甲烷水合物形成的能垒,减少能量消耗,降低甲烷水合物生成压力。
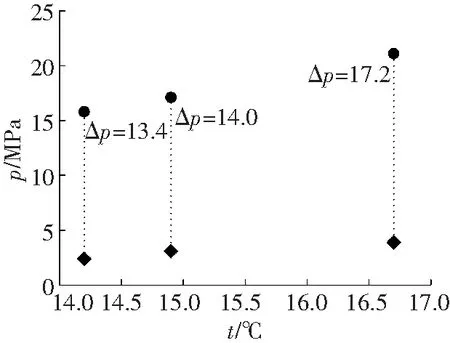
a TBAB溶液体系
b THF溶液体系
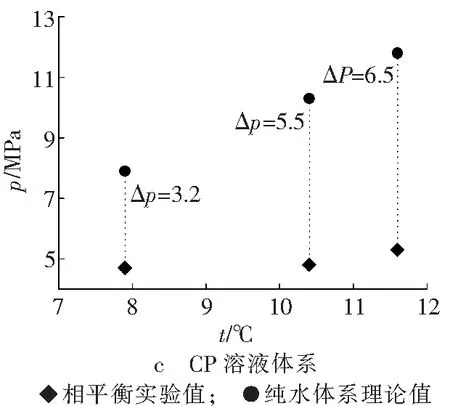
图3 不同溶液体系相平衡条件
Fig.3Phase equilibrium conditions of different solution systems
在实验范围内,每个组别的三组实验数据差值变化趋势一致,都是随着相平衡温度的增加,两种体系下相平衡压力差值越来越大。由表2可得,THF和TBAB溶液体系生成水合物的相平衡压力在2.4~4.0 MPa之间波动时,THF溶液体系水合物生成的相平衡温度平均为22.2 °C,TBAB溶液体系为15.3 °C,两种促进剂的添加都使水合物生成条件变得十分温和,而TBAB溶液体系水合物生成的相平衡温度比THF低约7 °C,其改善效果不如THF溶液体系;CP溶液体系水合物相平衡压力在4.7~5.3 MPa时,水合物相平衡温度最高为12 °C,明显小于THF和TBAB溶液体系水合物生成时的相平衡温度,且压力值也明显高于THF和TBAB溶液体系水合物生成相平衡压力。从图3可以看出,三组添加不同热力学促进剂的实验体系相较于纯水体系其相平衡压力下降值不同,THF溶液体系压降最大值为38.8 MPa,TBAB溶液体系压降最大值为17.2 MPa,CP溶液体系压降最大值为6.5 MPa。由此可见,在三种热力学促进剂中,THF对瓦斯在水溶液中的水合物生成热力学条件改善效果最为显著,CP最弱。由于三种热力学促进剂对水合物的影响机理较为复杂,要进一步揭示其作用规律需要更广泛的理论和实验研究。
3 结 论
(1)在实验范围内,THF和TBAB溶液体系生成水合物的相平衡压力介于2.4~4.0 MPa之间时,THF溶液体系水合物生成的相平衡温度平均为22.2 °C,TBAB溶液体系为15.3 °C。
(2)CP溶液体系水合物相平衡压力在4.7~5.3 MPa范围内时,水合物相平衡温度最高为12 °C,而THF和TBAB在相平衡压力分别为3.7和3.9 MPa时,其相平衡温度为23.1和16.7 °C,压力和温度都优于CP体系。
(3)THF、TBAB和CP均能有效改善瓦斯水合物相平衡参数,其平均压降分别为36.5、14.9、5.1 MPa,影响效果由大到小依次为THF、TBAB、CP。
致谢:
该研究获得黑龙江省普通高等学校青年学术骨干支持计划及黑龙江省普通本科高等学校创新人才培养计划项目支持。
[1]吴强,张保勇,孙登林,等.利用水合原理分离矿井瓦斯实验[J].煤炭学报,2009,34(3):361-365.
[2]YANG M J,SONG Y C,LIU Y,et al.Influence of pore size,salinity and gas composition upon the hydrate formation conditions[J].Chinese Journal of Chemical Engineering,2010,18(2):292-296.
[3]SAW V K,AHMAD I,MANDAL A,et al.Methane hydrate formation and dissociation in synthetic seawater[J].Journal of Natural Gas Chemistry,2012,21(6):625-632.
[4]宋永臣,杨明军,刘瑜,等.离子对甲烷水合物相平衡的影响[J].化工学报,2009,60(6):1362-1366.
[5]魏厚振,颜荣涛,韦昌富,等.含天然气水合物沉积物相平衡问题研究综述[J].岩土力学,2011,32(8):2287-2294,2306.
[6]SIANGSAI A,RAMGSUNVIGIT P,KITIYANAN B,et al.Improve methane hydrate formation rate using treated activated carbon and tetrahydrofuran[J].Journal of Chemical Engineering of Japan,2014,47(4):352-357.
[7]赵建忠,赵阳升,石定贤.THF溶液水合物技术提纯含氧煤层气的实验[J].煤炭学报,2008,33(12):1419-1424.
[8]YANG M J,SONG Y C,LIU W G,et al.Effects of additive mixtures(THF/SDS) on carbon dioxide hydrate formation and dissociation in porous media[J].Chemical Engineering Science,2013,90(10):69-76.
[9]MOSAYYEB A,ANTONIN C,BAHMAN T.Equilibrium data of hydrogen,methane,nitrogen,carbon dioxide,and natural gas in semi-clathrate hydrates of tetrabutyl ammonium bromide[J].Journal of Chemical and Engineering Data,2007,52(6):2153-2158.
[10]MOHAMMADI A H,ESLAMIMANESH A,RICHON D.Semi-clathrate hydrate phase equilibrium measurements for the CO2+H2/CH4+tetra-n-butylammonium bromide aqueous solution system[J].Chemical Engineering Science,2013,94(5):284-290.
[11]SUN Z G,FAN S S,GUO K H,et al.Gas hydrate phase equilibrium data of cyclohexane and cyclopentane[J].Journal of Chemical and Engineering Data,2002,47(2):313-315.
[12]詹昊,徐纯刚,李小森,等.TBAB和CP双添加剂水合物法分离烟气中的CO2[J].化学进展,2012,31(7):1442-1448.
[13]张保勇,程远平,吴强,等.TBAB溶液中高浓度CO2瓦斯水合分离效果实验[J].煤炭科学技术,2014,42(3):42-48.
[14]张保勇,吴强,朱玉梅.THF对低浓度瓦斯水合化分离热力学条件促进作用[J].中国矿业大学学报,2009,38(2):203-208.
(编辑徐岩)
Effect of thermodynamics promoters on phase equilibrium of mine gas hydrate
WU Qiang1,2,ZHANG Jiahao1,2,GAO Xia3,LIU Chuanhai1,2
(1.School of Safety Engineering,Heilongjiang University of Science &Technology,Harbin 150022,China; 2.National Centeral Laboratory of Hydrocarbon Gas Transportation Pipeline Safety,Heilongjiang University of Science &Technology,Harbin 150022,China;3.School of Civil Engineering,Heilongjiang University of Science &Technology,Harbin 150022,China)
This paper is an effort to investigate the influence of thermodynamics promoters on the gas hydrate phase equilibrium.The investigation is performed by obtaining gas hydrate phase equilibrium parameters in three kinds of promotion system used in THF,TBAB and CP using a transparent experiment device for gas hydrate phase equilibrium;and analyzing the experimental data in combination with the calculated values of Chen-Guo model.Results show that the three thermodynamics promoters leads to an improvement in the conditions of hydrate phase equilibrium,suggesting an average pressure reductions of 36.5,14.9 and 5.1 MPa and the maximum pressure drops of 38.8,17.2 and 6.5 MPa respectively in the of THF,TBAB and CP,as occurs when the three thermodynamics promoters have an impact on the gas hydrate phase equilibrium in a descending order of THF,TBAB and CP.
gas mixture;phase equilibrium;thermodynamics promoters;gas hydrate
2015-12-14;
2016-03-16
国家自然科学基金重点项目(51334005);国家自然科学基金项目(51334005;51174264;51274267)
吴强(1959-),男,山东省临沭人,教授,博士,博士生导师,研究方向:安全科学与工程,E-mail:wq0160@sina.com。
10.3969/j.issn.2095-7262.2016.03.001
TD712
2095-7262(2016)03-0235-05
A
