G试验和GM试验对侵袭性真菌病诊断价值的Meta分析
2016-11-03于书娴崔学范贾亮亮黄燕华
于书娴 崔学范 马 婷 贾亮亮 黄燕华 华 檬
·论著·
G试验和GM试验对侵袭性真菌病诊断价值的Meta分析
于书娴崔学范马婷贾亮亮黄燕华华檬
目的探讨血浆1,3-β-D葡聚糖(G试验)和血清半乳甘露聚糖(GM试验)单独及联合检测对侵袭性真菌病(IFD)的诊断价值。 方法检索Pubmed、Embase、Cochrane Library、万方、维普、中国知网等数据库,按照纳入和排除标准筛选文献,收集血浆G试验和血清GM试验用于IFD诊断的特征信息,通过Meta分析拟合SROC曲线,合并诊断效应量,比较G试验和GM试验对IFD的诊断效能。 结果本次Meta分析共纳入13篇文献,累计患者2 226例,其中IFD患者613例,非IFD患者1 613例。G试验和GM单独检测的合并敏感度分别为0.74和0.65,合并特异度为0.85和0.86,合并的阳性似然比为4.13和5.36,合并的阴性似然比为0.35和0.39,合并诊断价值比为14.07和13.06,SROC曲线下面积为0.8757和0.8522。G试验和GM试验并联和串联检测的合并敏感度分别为0.88和0.77,合并特异度为0.71和0.81,合并的阳性似然比为3.28和7.35,合并的阴性似然比为0.15和0.25,合并诊断价值比为17.73和64.32,SROC曲线面积为0.8777和0.9490。 结论G试验和GM试验对IFD具有诊断价值,单独检测时两者诊断能力相似,G试验敏感度更高,GM试验特异度稍高;联合检测时对IFD的诊断能力较单独检测高,并联时敏感度更高,串联时特异度较高,二者联合应用可使其应用价值进一步提高。
真菌感染;1,3-β-D葡聚糖;血清半乳甘露聚糖;Meta分析
侵袭性真菌病(invasive fungal disease, IFD),系指在宿主免疫功能低下或缺陷时,由于条件致病性真菌侵入人体,在组织、器官或血液中生长、繁殖,并导致炎症反应及组织损伤的疾病。IFD在血液病、恶性肿瘤、器官移植及长期应用广谱抗生素、糖皮质激素、免疫抑制剂等患者中的发病率和病死率呈上升趋势[1-2]。
由于缺乏特异的临床表现且传统诊断方法如组织病理、影像学、真菌培养、镜检等因有创、耗时长、敏感度差,难于满足IFD的早期诊断及早期治疗的需求。近年来,真菌抗原检测方法如血浆1,3-β-D葡聚糖((1-3)-β-D-glucan)和血清半乳甘露聚糖(galactomannan, GM),因其无创、敏感、特异等优势应用最广,并已成为真菌感染早期诊断的标准之一。
G试验和GM试验对IFD的诊断价值哪个更有优势,尚未得到一致的认识;G试验和GM试验联合检测优于单独检测,各研究结果较为一致,但并联(一者为阳性结果为阳性)和串联(二者均为阳性结果为阳性)检测方法哪个诊断价值更高,目前无大样本的多中心研究予以证明。本研究通过Meta分析,综合评价G试验和GM试验单独及联合检测对IFD的诊断价值,为临床应用提供更有效的依据。
材料与方法
一、文献检索
检索Pubmed、Embase、Cochrane Library、万方、维普、中国知网等数据库,收集2015年4月之前公开发表的G试验与GM试验对IFD诊断有关的文献。使用的检索词包括:invasive fungal disease、 IFD、invasive fungal infection、IFI、invasive aspergillosis、Invasive aspergillus、invasive candidiasis、1,3-β-D-Glucan、BG、galactomannan、GM、真菌感染、侵袭性真菌感染、侵袭性曲霉菌感染、侵袭性念珠菌感染、1,3-β-D葡聚糖、血清半乳甘露聚糖等。检索语言为英语与汉语。
二、文献纳入与排除准
纳入标准:①研究类型为含有G试验和GM试验对IFD诊断价值的前瞻性或回顾性研究;②采用病理诊断为金标准,研究组为IFD、对照组为非IFD或其它病理类型;③文章提供了G试验及GM试验在各病例组的真阳性、真阴性、假阳性、假阴性例数或通过文章提供的数据可以计算;④每组患者病例数均>20。
排除标准:①对照组仅有正常人;②G试验或GM试验的检测方法不是定量检测;③不能有效提取四格表数据的;④重复性实验中,发表较早或样本量较小的文献排除。
三、资料提取和质量评价
由2名评价者独立按照预先制定的纳入排除标准筛选文献,根据QUADAS量表的14个条目对纳入文献进行质量评价(表1),提取数据并交叉核对,意见不统一时协商解决或参考第三方意见[3]。缺乏的资料通过与作者联系予以补充。提取的资料包括文献基本信息、实验设计及实验原始数据(真阳性、假阳性、真阴性及假阴性的例数)。
四、 统计学方法
采用Q检验分析纳入研究之间是否存在异质性,以I2估算分析异质性的大小,<25%表示异质性较小,25%~50%表示中度异质性,>50%表示存在高度异质性。若存在异质性,则采用随机效应模型对原始数据进行汇总处理,反之采用固定效应模型进行后续的Meta分析,各效应量均用95%CI表示。
结 果
一、 检索结果及纳入文献
通过设定的检索词进行初步检索,共找到131篇文献。阅读文题和摘要排除113篇,初步纳入文献18篇。进一步阅读全文,排除未达到纳入标准的文献5篇,重复文献2篇,无法获得所需全部原始数据的文献3篇,最终纳入文献共13篇。文献的纳入过程,见图1。
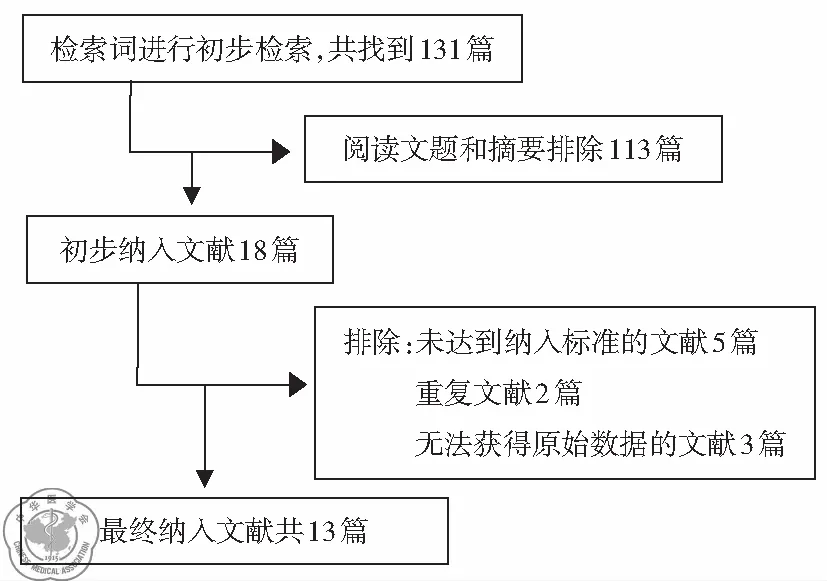
图1选择文献流程图
二、纳入研究的基本特征和质量评价
本研究共纳入13篇文献,累计患者病例2 226例,其中IFD 613例,非IFD 1 613例。各研究的研究设计见表1及表2(G试验和GM试验的检测方法、cutoff值及真阳性、假阳性、假阴性、真阴性的例数)。
三、 异质性检验
以DOR作为效应量,分析G试验和GM试验的异质性,Q检验显示Cochran-Q分别为62.01和64.83,P均<0.05,I2分别为80.6%和81.5%;分析联合检测的异质性,并联和串联的Q检验显示Cochran-Q分别为57.95和23.63,P均<0.05,I2分别为87.9%和70.4%,纳入的13篇研究文献间均存在异质性,故以下分析均选用随机效应模型。
四、 Meta分析的结果
1. G试验和GM试验单独检测的结果:图2是G试验和GM诊断敏感度和特异度的森林图,合并敏感度分别为0.74(0.71~0.77)和0.65(0.62~0.69),合并特异度为0.85(0.83~0.87)和0.86(0.84~0.88)。此外,G试验和GM试验诊断IFD的合并阳性似然比为4.13(3.60~4.74)和5.36(4.51~6.36),合并阴性似然比为0.35(0.31~0.39)和0.39(0.35~0.44),合并诊断价值比DOR分别为14.07(11.03~17.96)和13.06(10.25-16.65),数据见表3。图3为G试验和GM试验诊断IFD的SROC曲线下面积AUC为0.8757和0.8522。
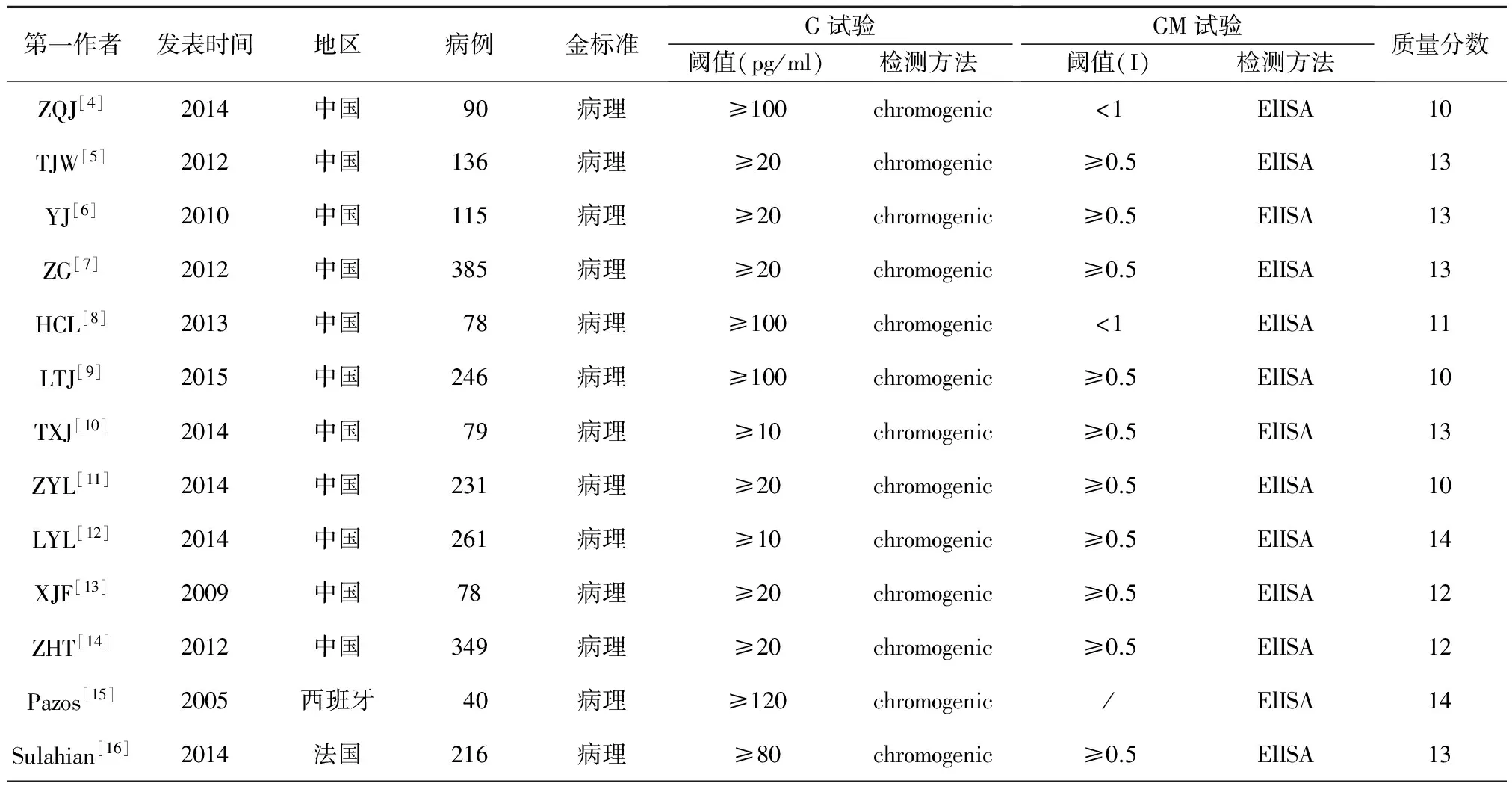
表1 纳入文献的基本特征
注:G试验:1,3-β-D 葡聚糖;GM试验:血清半乳甘露聚糖;chromogenic:比色法;ELISA:酶联免疫吸附测定

表2 纳入研究中的G试验、GM试验及其并联、串联检测的实验数据
注:TP:真阳性;FP:假阳性;FN:假阴性;TN:真阴性;G:(1-3)-β-D-glucan 1,3-β-D葡聚糖;GM:galactomannan血清半乳甘露聚糖

表3 G试验和GM试验的合并敏感度、合并特异度、合并似然比
注:AUC:曲线下面积;CI: confidence interval可信区间

图2G试验和GM试验敏感度、特异度森林图

图3G试验和GM试验的SROC曲线
2.G试验和GM试验联合检测的结果:图4是G试验和GM试验并联、串联诊断敏感度和特异度的森林图,合并敏感度分别为0.88(0.85~0.91)和0.77(0.72~0.81),合并特异度为0.71(0.68~0.74)和0.81(0.79~0.84)。此外,G试验和GM试验并联、串联诊断IFD的合并阳性似然比分别为3.28(2.91~3.69)和7.35(5.74~9.42),合并阴性似然比为0.15(0.11~0.19)和0.25(0.20~0.31),合并诊断价值比DOR为17.73(12.67~24.82)和64.32(32.69~126.56),数据见表3。图5为G试验和GM试验联合诊断IFD的SROC曲线下面积AUC为0.8777和0.9490。
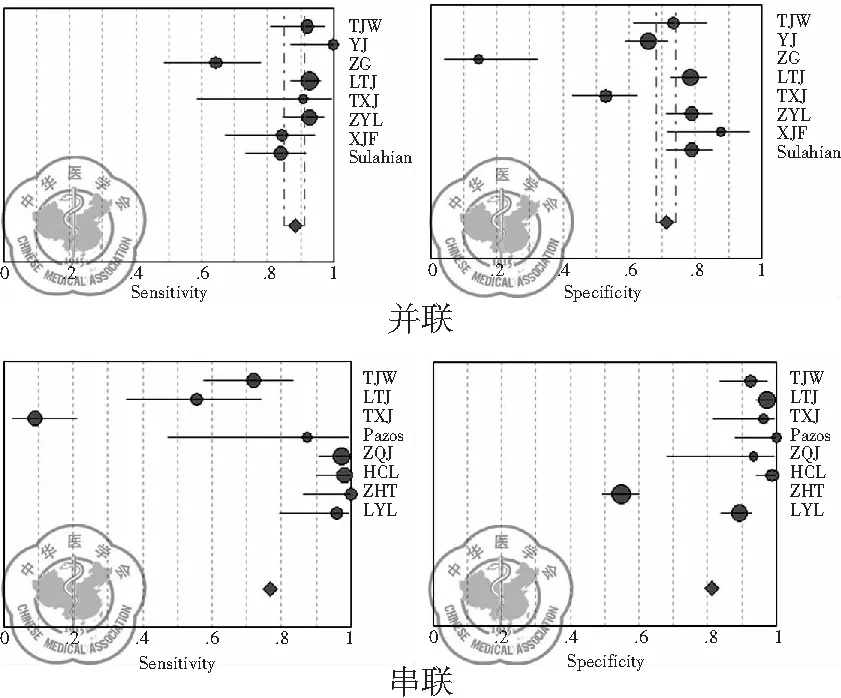
图4G试验和GM试验联合检测敏感度、特异度森林图
五、研究间异质性的来源分析
由G试验和GM试验单独或联合诊断IFD的SROC曲线可见(图3,图5),各研究对应的点散在分布,不呈“肩臂状”外观,计算灵敏度对数与(1-特异性)对数的Spearman相关系数ρ,单独检测G试验和GM试验的Spearman相关系数分别为0.291和-0.443,P均>0.05;并联、串联检测的Spearman相关系数分别为0和0.071,P均>0.05,提示不存在阈值效应。

图5G试验和GM试验联合检测的SROC曲线
六、敏感度分析
以每次减少1篇文献的方法进行敏感性分析,计算的合并DOR及其95%CI,评估单个研究对本次Meta分析的影响,见表4。单独检测时,无论剔除哪篇文献,剔除之后的合并DOR均未发生明显变化,提示分析结果并未过分依赖于某个研究,结论稳定;并联检测时剔除郑罡[7],DOR值明显上升,提示分析结果可能会受该研究影响,结论较稳定;串联时剔除涂军伟[5]、谭心娟[10],DOR值上升,提示分析结果可能会受这2项影响,总体结论较稳定。
七、发表偏倚
以DOR对数的标准误(SE LogDOR)为纵坐标,以Log(DOR)为横坐标,绘制DEEK漏斗图,如图6所示,G试验和GM试验单独或联合诊断IFD时的P>0.05,未发现发表偏倚。
讨 论
G试验检测的是一种广泛存在于多种真菌细胞壁中的多糖成分1,3-β-D葡聚糖(除了接合菌和隐球菌),它可以激活G因子,并激发凝血级联反应,形成凝固蛋白后通过比色法或比浊法进行定量检测[17-18]。在真菌感染过程中,1,3-β-D葡聚糖可释放入血液及其他体液中,G试验对侵袭性深部真菌感染的早期诊断有重大意义,可用于念珠菌属、曲霉属、毛孢子菌等所致侵袭性感染的诊断,局限性是不能确定菌种[19-21]。

图6G试验和GM试验的漏斗图
GM试验检测的是半乳甘露聚糖,因曲霉菌特有的细胞壁多糖成分是β(1-5)呋喃半乳糖残基,菌丝生长时,半乳甘露聚糖从薄弱的菌丝顶端释放,是最早释放的抗原。GM释放量与菌量成正比,因此可以反映感染程度。主要适用于侵袭性曲霉菌感染的早期诊断,通过ELISA进行定量测量,美国FAD推荐敏感阈值为0.5 ng/ml[22]。

表4 各研究对Meta分析结果的敏感度分析[诊断价值比(95%CI)]
G试验和GM试验都存在假阳性和假阴性的情况。G试验已知的假阳性有[23-25]:①静脉制剂中含有葡聚糖,如白蛋白、免疫球蛋白、血液制品或凝血因子等;②医疗材料中含有葡聚糖,如血透时应用的纤维素膜、纱布等;③链球菌败血症患者[26];④多糖类的抗癌药物等。而假阴性可能是浅部真菌感染或定制时,1,3-β-D葡聚糖未被释放出来使体液中的量不增高,故其血浆检测呈阴性[27]。GM试验已知的假阳性有:①使用半合成青霉素尤其是哌拉西林/他唑巴坦;②食用污染的谷类及牛奶等高蛋白食物;③某些葡萄糖酸盐制剂;④自身免疫性肝病、新生儿和儿童等[7,28-31]。其假阴性与取材时间、病情严重程度、体内分解代谢、试验最低限度等有关。临床上,大多数时候造成G试验和GM试验假阳性、假阴性的原因不明,两者联合检测可在一定程度上提高血清学检查的敏感性或特异性,文献报道,联合检测可明显降低假阳性或假阴性[8,32]。
本研究对纳入的13篇研究文献进行Meta分析,包括呼吸、血液、肿瘤、ICU、风湿免疫、感染等科室,通过合并诊断效应量、拟合SROC曲线比较G试验和GM试验对IFD的诊断效能,通过分析研究间异质性及其来源查找可能影响研究结果的因素,最后通过敏感度分析和检测发表偏倚评估本次Meta分析的可信度。
本次评价结果显示,G试验和GM试验的合并DOR分别为14.07和13.06,提示二者均与IFD有明显的相关性,且G试验的相关性稍高,用于诊断IFD时,G试验的敏感性优于GM试验,特异性相似,这与国外有关研究结果趋势一致[33]。并联和串联的合并DOR分别为17.73和64.32,提示联合检测时与IFD有更明显的相关性,且串联检测的相关性更高,并联的敏感性优于串联,串联的特异性优于并联。
SROC曲线的AUC值是反映诊断性试验的准确性大小,≤0.5时全无价值,0.5~0.7时诊断的准确性较低,0.7~0.9时诊断的准确性中度,0.9以上时有较高的准确性,越接近1诊断效果越好。本研究提示,G试验和GM试验单独检测时的AUC值分别为0.8757和0.8522,并联和串联时的AUC值分别为0.8777和0.9490。单独检测时,G试验和GM试验诊断效果相似;联合检测比单独检测有较高的诊断效果,且串联时诊断效果最好。
本研究纳入的研究文献间存在高度异质性。经Spearman相关系数检验,异质性与阈值效应无关。因此我们进一步做Meta回归,探寻G试验和GM试验异质性的可能来源。结果显示,发表年限、样本量、研究类型、患者的选择是否随机、是否采用盲法均不是异质性的来源,说明试验设计的差异不会造成研究结果的明显变化。由于纳入的研究G试验检测方法均为比色法,GM试验均为ELISA,因此方法学上也无法解释异质性。种族或许是异质性的来源,但纳入的文献均未详细报告纳入人群的种族,因此本次研究无法进行分析。
本次Meta分析的局限性:①检索的文献不全面,局限在已发表的研究,可能漏检一些灰色文献(未公开发表的研究,如会议论文无法获取),检索语种局限于中文和英文,本文中文较多,可能导致纳入的研究受国别和地域的限制;②纳入研究的局限性,G试验和GM试验作为诊断性试验,均未报告是否采用盲法检测,存在测量偏倚的可能性。
总之,GM试验和G试验检测的物质不同,代谢规律、影响因素也有差异,二者虽不能互相取代,确可取长补短,联合应用可明显提高对侵袭性真菌感染的诊断能力。本研究中联合试验灵敏度可以达到0.88,特异度可达到0.81,AUC可达到0.9490。因此,可采取联合检测以提高检出率、降低误诊率及漏诊率,并结合病原学诊断、临床诊断及其他实验诊断技术以作出准确的判断,改善患者预后,提高生存率及治愈率。
1Krüger WH, Rüssmann B, de Wit M, et al. Haemopoietic cell transplantation of patients with a history of deep or invasive fungal infection during prophylaxis with liposomal amphotericin B[J]. Acta Haematol, 2005, 113(2): 104-108.
2Lass-Flörl C. The changing face of epidemiology of invasive fungal disease in Europe [J]. Mycoses, 2009, 52(3): 197-205.
3Whiting P, Rutjes AW, Reitsma JB. The development of Q.UADAS:
a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews[J]. BMC Medical Research Methodology, 2003, 3: 1-13.
4赵秋剑. 危重症患者血浆(1,3)-β-D葡聚糖及血清半乳甘露聚糖联合检测对侵袭性真菌感染的意义分析[J]. 中国医师进修杂志, 2014, 37(13): 61-62.
5涂军伟, 朱芳, 朱以军. 血清半乳甘露聚糖联合1,3-β-D葡聚糖在侵袭性肺曲霉病诊断中的价值[J]. 中华临床感染病杂志, 2012, 5(5): 261-263.
6余进, 李若瑜, 高露娟, 等. 血清半乳甘露聚糖和血浆(1,3)β-D-葡聚糖检测诊断侵袭性真菌感染[J]. 中华医学杂志, 2010, 90(6): 371-374.
7郑罡, 余进, 李雪迎, 等. (1,3)-β-D-葡聚糖检测和半乳甘露聚糖抗原检测在侵袭性真菌病诊断中的价值探讨[J]. 中国真菌学杂志, 2012, 07(3): 132-135.
8何成禄, 何增品, 徐从琼, 等. 血浆(1,3)-β-D葡聚糖和血清半乳甘露聚糖检测对重症患者侵袭性真菌感染的早期诊断价值[J]. 现代检验医学杂志, 2013, 28(2): 54-56.
9李泰阶, 李萌, 郭世辉, 等. G 试验和 GM 试验对儿童恶性血液病侵袭性真菌感染的诊断价值[J]. 山东医药, 2015, (5): 4-6.
10谭心娟, 苏小芬, 邢秋云. G试验和 GM 试验对慢性阻塞性肺疾病急性加重期患者侵袭性肺真菌感染的早期诊断价值[J]. 广东医学, 2014, (17): 2682-2685.
11朱义玲, 崔娟娟, 甘建和.(1-3)-β-D葡聚糖和半乳甘露聚糖抗原检测在侵袭性真菌病诊断中的临床意义[J]. 中国血液流变学杂志, 2014, (1): 142-143.
12刘永林, 赵金方, 陈婷婷, 等. 血清半乳甘露聚糖联合血浆1,3-β-D葡聚糖在诊断侵袭性真菌感染中的应用价值[J]. 中华临床感染病杂志, 2014, 7(2): 133-135.
13徐金富, 李惠萍, 瞿介明. 两种抗原联合检测对诊断侵袭性肺曲霉病的诊断价值[J]. 中华结核和呼吸杂志志, 2009, 32(9): 709-710.
14张海涛, 郝锦霞, 郭桂丽. G试验联合 GM 试验在恶性血液病侵袭性真菌感染的诊断价值[J]. 现代肿瘤医学, 2012, 20(10): 2161-2163.
15张红宇, 孟庆祥, 柳金, 等. 血清1,3-β-D葡聚糖和半乳甘露聚糖抗原联合检测对血液肿瘤患者侵袭性真菌感染的早期诊断价值[J]. 临床血液学杂志, 2009, 22(3): 253-255.
16Pazos C, Pontón J, Del Palacio A. Contribution of (1->3)-beta-D-glucan chromogenic assay to diagnosis and therapeutic monitoring of invasive aspergillosis in neutropenic adult patients: a comparison with serial screening for circulating galactomannan[J]. J Clin Microbiol, 2005, 43(1): 299-305.
17Sulahian A, Porcher R, Bergeron A, et al. Use and limits of (1-3)-β-D-glucan assay (Fungitell), compared to galactomannan determination (Platelia Aspergillus), for diagnosis of invasive aspergillosis[J]. J Clin Microbiol, 2014, 52(7): 2328-2333.
18Marty FM, Koo S. Role of 1,3-β-D-glucan in the diagnosis of invasive aspergillosis[J]. Med Mycol, 2009, 47(1): 233-240.
19Theel ES, Doern CD. β-D-glucan testing is important for diagnosis of invasive fungal infections[J]. J Clin Microbiol, 2013, 51(11): 3478-3483.
20Hope WW, Walsh TJ, Dennimg DW. Laboratory diagnosis of invasive aspergillosis[J]. Lancet Infect Dis, 2005, 5(10): 609-622.
21Senn L, Robinson JO, Schmidt S, et al. 1,3-B-Dglucan antigenemia for early diagnosis of invasive fungal infections in neutropenic patients with acute leukemia[J]. Clin Infect Dis, 2008, 46(6): 878-885.
22Ostrosky-Zeichner L, Alexander BD, Kett DH, et al. Multicenter clinical evaluation of the (1,3)-β-D-glucan assay as an aid to diagnosis of fungal infections in humans[J]. Clin Infect Dis, 2005, 41(5): 654-659.
23Ogawa M, Hori H, Niiguchi S, et al. False-positive plasma (1,3)-beta-D-glucan test following immunoglobulin product replacement in an adult bone marrow recipient[J]. Int J Hemato1, 2004, 80: 97-98.
24Usami M, Ohata A, Horiuchi T, et al. Positive (1,3)-β-D-glucan in blood components and release of(1,3)-beta-D-glucan from depth-type membrane filters for blood processing[J]. Transfusion, 2002, 42: 1189-1195.
25Kato A, Takita T, Furuhashi M, et al. Elevation of blood (1,3)-beta-D-glucan concentrations in hemodialysis patients[J]. Nephron, 2001, 89: 15-19.
26Digby J, Kalbfleisch J, Glenn A, et al. Serum glucan levels are not specific for presence of fungal infections in intensive care units[J]. Clin Diagn Lab Immunol, 2003, 10:882-885.
27Fontana C, Gaziano R, Favaro M, et al. (1,3)-β-D-Glucan vs Galactomannan Antigen in Diagnosing Invasive Fungal Infections(IFIs)[J]. Open Microbiol J, 2012, 6: 70,73.
28Niimi K, Shepherd MG, Cannon RD. Distinguishing Candida species by beta-N·acetyl hexosaminidase activity[J]. J Clin Microbiol, 2001, 39(6): 2089-2097.
29Aubry A, Porcher R, Bottero J, et al. Occurrence and kinetics of false-positive Aspergillus galactomannan test results following treatment with β-glucan antibiotics in Patients with hematological disorders[J]. J Clin Microbiol, 2006, 44(2): 389,394.
30Chambon-Pautas C, Costa JM, Chaumete MT, et al. Galactomarman and polymerase chain reaction for the diagnosis of primary digestive aspergillosis in a patient with acute myeloid leukaemia[J]. J Infect, 2001, 43: 213, 214.
31Surmont I, Stockman W. Glueonate-containing intravenous solutions:another cause of false-positive galactomannan assay reactivity[J]. J Clin Microbiol, 2007, 45: 1373.
32Acosta J, Catalan M, del Palacio-Peréz-Medel A, et al. Prospetive study in critically ill non-neutropenic patients:diagnostic potentional of 1,3-β-d-glucan assay and circulating galactomannan for the diagnosis of invasive fungal disease[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(5): 721-731.
33Sav H, Atalay MA, Unal E, et al. The importance of bronchoalveolar lavage sample for galactomannan, 1,3-β-d-glucan and PCR tests [J]. Mikrobiyol Bul, 2012, 46(4): 695-701.
(本文编辑:黄红稷)
于书娴,崔学范,马婷,等. G试验和GM试验对侵袭性真菌病诊断价值的Meta分析[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 164-170.
Diagnostic value of (1-3)-β-D-glucan and galactomannan for invasive fungal disease: a Meta-analysis
Yushuxian,Cuixuefan,Mating,Jialiangliang,Huangyanhua,Huameng.
Thefirstaffiliatedhospitalofnanjingmedicaluniversity,Nanjing210029,ChinaCorrespondingauthor:Cuixuefan,Email:xuefancui@163.com
ObjectiveTo evaluate and compare the diagnostic value of (1-3)-β-D-glucan and galactomannan in IFD by Meta-analysis. MethodsAll the English and Chinese literatures for differential diagnosis of (1-3)-β-D-glucan and galactomannan in IFD were collected by searching Pubmed, Embase, Cochrane Library, Wanfang, Whipple, CNKI databae. Sensitivity, specificity, likelihood ratio and diagnostic odds ratio were pooled using random-effect model. Summary receiver operating characteristic curve analysis was used to evaluate the diagnostic value of (1-3)-β-D-glucan and galactomannan. ResultsAll 13 studies were included in the Meta-analysis, with a total of 2226 cases. The pooled sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, diagnostic odds ratio and SROC curve of (1-3)-β-D-glucan in the diagnosis of IFD were 0.74, 0.85, 4.13, 0.35, 14.07 and 0.8757, and those of galactomannan were 0.65, 0.86, 5.36, 0.39, 13.06 and 0,8522 respectively. The parallel and series in the diagnosis of IFD were 0.88, 071, 3.28, 0.15, 17.73, 0.8777 and 0.77, 0.81, 7.35, 0.25, 64.32, 0.9490. ConclusionsCompared to (1-3)-β-D-glucan, galactomannan has higher specificity, lower sensitivity and similar discrimination ability in the diagnosis of IFD. The combination of them has higher discrimination ability, higher sensitivity in series and higher specificity in parallel.
Fungal infection;(1-3)-β-D-glucan;Galactomannan;Meta-analysis
10.3877/cma.j.issn.1674-6902.2016.02.011
江苏省呼吸病临床医学研究中心基金资助项目(BL2012012)江苏省高校优势学科基金资助项目(PDPA)
210029 江苏,南京医科大学第一附属医院
崔学范,Email: xuefancui@163.com
R563
A
2015-05-27)
