氢键作用对基于异佛尔酮发光材料的荧光性能的影响
2016-11-03白清云陈柳青赵浩成施琨雁席昭洋王忠强刘旭光许并社
白清云, 陈柳青*, 赵浩成, 施琨雁,席昭洋, 王忠强, 刘旭光,4, 王 华, 许并社
(1. 太原理工大学 新材料界面科学与工程教育部重点实验室, 山西 太原 030024;2. 太原理工大学 材料科学与工程学院, 山西 太原 030024;3. 山西煤炭管理干部学院, 山西 太原 030600; 4. 太原理工大学 化学化工学院, 山西 太原 030024)
氢键作用对基于异佛尔酮发光材料的荧光性能的影响
白清云1,2, 陈柳青1,2*, 赵浩成3, 施琨雁1,2,席昭洋1,2, 王忠强1, 刘旭光1,4, 王华1,2, 许并社1,2
(1. 太原理工大学 新材料界面科学与工程教育部重点实验室, 山西 太原030024;2. 太原理工大学 材料科学与工程学院, 山西 太原030024;3. 山西煤炭管理干部学院, 山西 太原030600;4. 太原理工大学 化学化工学院, 山西 太原030024)
合成了3种基于异佛尔酮的新型单晶荧光材料: 3-二丙烯腈基-5,5-二甲基-1-苯乙烯基环己烯 (DCDSC)、3-二丙烯腈基-5,5-二甲基-1-(3-羟基苯乙烯基)环己烯(DCDH3C)及3-二丙烯腈基-5,5-二甲基-1-(4-羟基苯乙烯基)环己烯(DCDH4C)。通过氢核磁共振谱和元素分析确定了它们的分子结构。通过单晶X射线衍射获得了3种材料的晶体结构数据。DCDSC、DCDH3C和DCDH4C的紫外吸收光谱依序分布在长波区的390,398,424 nm,短波区分布在268,269,283 nm。DCDSC、DCDH3C和DCDH4C在THF中的最大发射峰分别位于522,549,567 nm。与DCDSC相比,3位羟基取代的DCDH3C的发射波长红移了27 nm,而4位取代羟基的DCDH4C的发射波长红移了45 nm。其主要原因在于DCDSC、DCDH3C和DCDH4C存在不同的氢键作用,当然,取代基的类型及位置等也可能对材料的发射波长产生一定作用。
异佛尔酮; 发光; 取代基; 氢键
1 引 言
自从 1852 年 Stokes[1]首次发现荧光后,有机化合物的荧光现象被广为研究。可在光、电等激发下发出荧光的材料被称之为有机荧光材料。有机荧光材料不仅可以应用于塑料、纸张和油墨等传统工业,还被广泛地应用于多种新兴的领域,如有机发光材料、有机场效应晶体管以及荧光分子探针等。为了改善材料的荧光性能,人们常常构筑大的共轭π键结构,还可通过增加有机分子的刚性平面结构来提高荧光的产生。此外,增加如—NR2、—OH、—OR 等这样的助色基团,往往也会起到改善荧光的作用。在很多领域,材料在实现功能时往往体现的是分子聚集体的行为与特性,而不是单个自由分子的作用,因此,材料分子的堆积特性往往对其发光性质有决定性影响[2-3]。这是因为,虽然决定自由分子的是化学键,而影响分子聚集态结构及功能的却是分子间的非共价键作用。π-π相互作用作为最常见的一种分子间的非共价键作用,在有机固体领域已有相关报道,如Alq3[4]、齐聚噻吩[5-8]和并五苯[9-10]的发光性能与构成该材料的分子聚集态结构有必然的联系。除了π-π相互作用,氢键则是另一种非共价相互作用的类型,但是目前关于氢键作用对材料荧光性能的影响的报道较少。而通过培养单晶,可以获知分子的聚集行为。因此单晶荧光材料是目前的研究热点,不但可深入认识材料的结构,还在有机光电子器件方面有广泛的应用前景。
本文拟通过在基于异佛尔酮的荧光材料的不同位置引入助色基团—OH,通过单晶结构分析,得出氢键的存在对分子聚集态结构及发光波长的影响规律,由此来丰富有机光电子材料领域中的分子堆积结构理论,以便更好地总结规律,从而达到通过调控分子结构调控分子堆积结构的目的。
2 实 验
2.1材料的制备
2.1.13-二丙烯腈基-5,5-二甲基-1-苯乙烯基环己烯 (DCDSC)的制备
将丙二腈(1.87 g,28.3 mmol)、异佛尔酮(3.90 g,28.3 mmol)加入到28 μL乙酸、18 μL乙酸酐、380 μL哌啶和10 mL二甲基甲酰胺的混合溶液中。混合物先室温搅拌1 h,再在80 ℃温度下继续搅拌1 h。然后,在氮气气氛下加入苯甲醛3.39 g,80 ℃搅拌1 h,将反应物倒入含有6 mL浓盐酸的200 mL水中搅拌。将所得物真空抽滤,并用去离子水多次洗涤,得到黄褐色固体。将该固体溶于乙腈中进行重结晶,得到浅红色柱状晶体, 收率为65.3%。
1H NMR(400 MHz, CDCl3)δ: 7.68(d, 2H), 7.47(m, 2H), 7.33(m, 1H), 7.01(d, 1H), 6.84(d, 1H), 6.73(s, 1H), 2.56(s, 2H), 2.44(s, 2H), 1.07(s, 6H)。元素分析: 计算值(C19H18N2): C 83.18,H 6.61,N 10.21;测试值: C 83.07,H 6.60,N 10.24。
2.1.23-二丙烯腈基-5,5-二甲基-1-(3-羟基苯乙烯基)环己烯(DCDH3C)的制备
将28.3 mmol丙二腈(1.87 g)、28.3 mmol 异佛尔酮(3.90 g)加入到28 μL乙酸、18 μL乙酸酐、380 μL哌啶和10 mL二甲基甲酰胺的混合溶液中。混合物先室温搅拌1 h,再在80 ℃温度下继续搅拌1 h。然后,在氮气气氛下加入3-羟基苯甲醛3.45 g,80 ℃搅拌1 h。趁热将反应物倒入含有6 mL浓盐酸的200 mL水中,搅拌。将所得物真空抽滤,并用去离子水多次洗涤,得到淡褐色固体。将固体溶于乙腈重结晶,得到淡黄色柱状晶体DCDH3C,收率41.8%。1H NMR(400 MHz, CDCl3)δ: 7.05(d, H),7.08(d, H), 6.96(m, 2H), 6.95(m, 1H), 6.83(d, 1H), 6.82(d, 1H), 4.77(s, 1H), 2.59(s, 2H), 2.45(s, 2H),1.07(s,6H)。元素分析:计算值(C19H18N2O):C 78.59,H 6.25, N 9.65;测试值: C 78.51,H 6.28,N 9.65。
2.1.33-二丙烯腈基-5,5-二甲基-1-(4-羟基苯乙烯基)环己烯(DCDH4C)的制备
将28.3 mmol丙二腈(1.87 g)和28.3 mmol异佛尔酮(3.90 g)加入到28 μL乙酸、18 μL乙酸酐、380 μL哌啶和10 mL二甲基甲酰胺的混合溶液中。混合物先室温搅拌1 h,再在80 ℃温度下继续搅拌1 h。然后,在氮气气氛下加入3-羟基苯甲醛3.45 g,80 ℃搅拌1 h。趁热将反应物倒入含有6 mL浓盐酸的200 mL水中,搅拌。将所得物真空抽滤,并用去离子水多次洗涤,得到淡褐色固体,将固体溶于乙腈重结晶,得到淡红色柱状晶体,DCDH4C收率34.9%。1H NMR(400 MHz, CDCl3)δ: 7.40(d, 2H), 7.04(m, 2H), 7.98(m, 1H), 6.96(d, 1H), 6.79(d, 1H), 5.46(s, 1H), 2.59(s, 2H), 2.45(s, 2H), 1.07(s, 6H)。元素分析: 计算值( C19H18N2O):C 78.59,H 6.25,N 9.65;测试值: C 78.53,H 6.20,N 9.62。
2.2测试方法
样品的红外光谱采用FTIR-1730型红外光谱仪,单晶X射线衍射测试在Brucker Smart APEX CCD X射线单晶衍射仪上进行。吸收光谱和荧光光谱分别由Lambda Bio 40紫外可见分光光度计和LS-50B荧光分光光度计记录。
3 结果与讨论
3.1单晶结构
为了进一步验证实验所得产物的结构,更深入地研究和分析产物的晶体学特征以及分子堆积行为,我们做了单晶结构分析。DCDSC、DCDH3C和DCDH4C的分子结构和晶胞堆积图如图3、4、5所示。
从DCDSC、DCDH3C和DCDH4C的晶体解析数据可以发现:DCDSC为三斜晶系,P-1空间群,a=0.885 62(18) nm,b=0.940 00(19) nm,c= 0.986 1(2) nm,α=89.23(3)°,β=68.66(3)°,γ=85.46(3)°;DCDH3C为单斜晶系,C2/c空间群,a=0.158 20(3) nm,b=0.827 32(17) nm,
c=0.244 21(5) nm,α=90°,β=101.60(3)°,γ=90°;DCDH4C为正交晶系,Pna21空间群,a=0.154 06(3) nm,b=0.107 84(2) nm,c=0.959 19(19) nm,α= 90°,β=90°,γ= 90°。在3种化合物中,除了—C(CH3)2基团,分子的整个非氢原子几乎都在同一平面,而含二取代的环己烯呈信封折叠状。其中,DCDSC的晶胞堆积图中没有出现氢键,这是由于DCDSC中氢的电子云比较集中,没有过多的偏向,不易与其他电负性较强的原子形成氢键。而在DCDH3C和DCDH4C中,羟基中的氧电负性较强,O与H的共价键电子云强烈偏向O的一边;而H原子核外只有一个电子,其电子云向O偏离的结果就使得它几乎要呈质子状态,这个半径很小、无内层电子的带部分正电荷的氢原子,使附近另一个分子中含有孤电子对并带部分负电荷的N原子有可能充分靠近它,从而产生静电吸引作用,形成氢键。从表1可知, DCDH3C的H...N的距离为2.03,DCDH4C的H...N的距离为2.08,所以3位取代的DCDH3C的氢键作用更大。
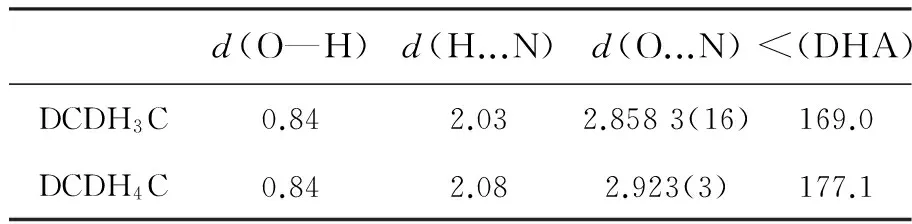
表1 DCDH3C和DCDH4C的氢键数据
3.2红外光谱分析
为了更好地证实氢键的存在,我们对DCDSC、DCDH3C和DCDH4C的红外光谱进行了进一步分析。DCDSC IR (KBr, cm-1)ν:3 447,2 962,2 224,1 617,1 574,1 522,1 470,1 436,1 322,1 158,1 088,975,880,845,776;DCDH3C IR (KBr, cm-1)ν:3 374,2 955,2 222,1 611,1 556,1 510,1 395,1 369,1 327,1 274,1 200,1 163,960,845,643;DCDH4C IR (KBr, cm-1)ν:3 367,2 960,2 224,1 657,1 604,1 559,1 510,1 398,1 326,1 274,1 235,1 212,1 195,1 165,960,845,642。
Fig.6IR spectra of DCDSC, DCDH3C and DCDH4C, respectively.
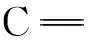
3.3紫外可见吸收光谱
DCDSC在THF溶液中的UV-Vis吸收光谱中的紫外吸收峰主要位于390 nm和268 nm处,DCDH3C的紫外吸收峰主要位于398 nm和269 nm处,DCDH4C的紫外吸收峰主要位于424 nm和283 nm处。其中,268,269,283 nm处的吸收主要源于各自分子内部的π-π*跃迁,而长波吸收峰390,398,424 nm主要源于分子内部的n-π*跃迁。采用文献[12]的方法,利用图7(a)的UV-Vis吸收光谱数据可计算在THF溶液体系中的DCDSC、DCDH3C和DCDH4C的光学带隙,本文做的(hνA)2-hν曲线如图7(b)、(c)、(d)所示,将吸收边的线性关系延伸到与能量轴相交,所得到的THF溶液体系中的DCDSC、DCDH3C和DCDH4C的光学带隙分别为2.86,2.84,2.64 eV。
3.4荧光发射光谱
从图8中可以看出: DCDSC的最大发射峰位于522 nm,DCDH3C和DCDH4C的最大发射峰分别位于549 nm 和567 nm。3位羟基取代的DCDH3C比DCDSC发射峰红移了27 nm,而4位取代羟基的DCDH4C的发射峰红移了45 nm。很明显,DCDH3C和DCDH4C中环外的—OH上的电子激发转移到环上而产生荧光,由于—OH的电子云与芳香环的轨道几乎平行,共享了共轭电子结构,同时扩大了其共轭键体系,因此,DCDH3C和DCDH4C的吸收光与发射光的波长都比DCDSC的波长红移。由于DCDH4C的氢键作用力较弱,因此荧光发射光谱比DCDH3C红移了18 nm。此外,影响材料荧光性能的因素很多,比如取代基效应等也可能对材料的发射波长产生一定作用。
图8DCDSC、DCDH3C和DCDH4C在THF溶液中的荧光发射光谱。
Fig.8Fluorescent emission spectra of DCDSC, DCDH3C and DCDH4C in THF, respectively.
4 结 论
合成了3种基于异佛尔酮的荧光材料:3-二丙烯腈基-5,5二甲基-1-羟基苯乙烯基环己烷 (DCDSC)、 3-二丙烯腈基-5,5二甲基-1-(3-羟基苯乙烯基)环己烯(DCDH3C)和3-二丙烯腈基-5,5二甲基-1-(4-羟基苯乙烯基)环己烯(DCDH4C)。通过氢核磁共振谱和元素分析确定了分子结构,同时获得了它们的单晶结构,X射线衍射图谱表明3种化合物中的环己烯呈信封折叠状;同时,在晶胞堆积图中发现DCDH3C和 DCDH4C存在分子间氢键。通过红外光谱进一步证实了这种氢键,并对氢键对于荧光发光性能的影响进行了研究。DCDSC、DCDH3C 和DCDH4C在THF中的最大发射峰分别位于522,549,567 nm,与DCDSC相比,3位羟基取代的DCDH3C红移了27 nm,而4位取代羟基的DCDH4C的发射波长红移了45 nm。由于DCDH4C的氢键作用力较弱,因此荧光发射光谱比DCDH3C红移了18 nm。
[1] STOKES G G. On the composition and resolution of streams of polarized light from different sources [J].Trans.CambridgePhilos.Soc., 1852, 9:399-416.
[2] BRAUN M, GMEINER J, TZOLOV M,etal.. A new crystalline phase of the electroluminescent material tris(8-hydroxyquinoline) aluminum exhibiting blueshifted fluorescence [J].J.Chem.Phys., 2001, 114(21):9625-9632.
[3] C LLE M, DINNEBIER R E, BRüTTING W. The structure of the blue luminescent δ-phase of tris(8-hydroxyquinoline)-aluminium(Ⅲ) (Alq3) [J].Chem.Commun., 2002, (23):2908-2909.
[4] C LLE M, GMEINER J, MILIUS W,etal.. Preparation and characterization of blue-luminescent tris(8-hydroxyquinoline)-aluminum (Alq3) [J].Adv.Funct.Mater., 2003, 13(2):108-112.
[5] TEDESCO E, SALA F D, FAVARETTO L,etal.. Solid-state supramolecular organization, established directly from powder diffraction data, and photoluminescence efficiency of rigid-core oligothiophene-S, S-dioxides [J].J.Am.Chem.Soc., 2003, 125(40):12277-12283.
[6] ANTOLINI L, TEDESCO E, BARBARELLA G,etal.. Molecular packing and photoluminescence efficiency in odd-membered oligothiophene S, S-dioxides [J].J.Am.Chem.Soc., 2000, 122(37):9006-9013.
[7] BARBARELLA G, ZAMBIANCHI M, ANTOLINI L,etal.. Solid-state conformation, molecular packing, and electrical and optical properties of processable β-methylated sexithiophenes [J].J.Am.Chem.Soc., 1999, 121(38):8920-8926.
[8] BARBARELLA G, FAVARETTO L, SOTGIU G,etal.. Rigid-core oligothiophene-S, S-dioxides with high photoluminescence efficiencies both in solution and in the solid state [J].Chem.Mater., 2001, 13(11):4112-4122.
[9] SAUTTER A, SCHMID D G, JUNG G,etal.. A triangle-square equilibrium of metallosupramolecular assemblies based on Pd(Ⅱ) and Pt(Ⅱ) corners and diazadibenzoperylene bridging ligands [J].J.Am.Chem.Soc., 2001, 123(23):5424-5430.
[10] WüRTHNER F, SAUTTER A, SCHILLING J. Synthesis of diazadibenzoperylenes and characterization of their structural, optical, redox, and coordination properties [J].J.Org.Chem., 2002, 67(9):3037-3044.
[11] 刘海林,马晓燕,袁莉,等. 分子自组装研究进展 [J]. 材料科学与工程学报, 2004, 22(2):308-311.
LIU H L, MA X Y, YUAN L,etal.. Molecule self-assembly technology and its research advances [J].J.Mater.Sci.Eng., 2004, 22(2):308-311. (in Chinese)
[12] 武聪伶,陈柳青,景姝,等. 非掺杂式电荷生成层的结构设计及其在叠层OLED器件中的应用 [J]. 发光学报, 2015, 36(6):679-684.
WU C L, CHEN L Q, JING S,etal.. Structure design of charge generation layer without doping and its application in tandem OLED devices [J].Chin.J.Lumin., 2015, 36(6):679-684. (in Chinese)
白清云(1991-),男,山西忻州人,硕士研究生,2013年于长春理工大学获得学士学位,主要从事有机光电材料及器件的研究。
E-mail: 717077642@qq.com陈柳青(1975-),女,山西原平人,博士,副教授,2009年于太原理工大学获得博士学位,主要从事有机光电材料及器件的研究。
E-mail: chenliuqingluck@163.com.com
Hydrogen Bond Effect on Luminescence Properties of Isophorone-based Emitter
BAI Qing-yun1,2, CHEN Liu-qing1,2*, ZHAO Hao-cheng3, SHI Kun-yan1,2, XI Zhao-yang1,2, WANG Zhong-qiang1, LIU Xu-guang1,4, WANG Hua1,2, XU Bing-she1,2
(1.KeyLaboratoryofInterfaceScienceandEngineeringinAdvancedMaterialsofMinistryofEducation,TaiyuanUniversityofTechnology,Taiyuan030024,China;2.CollegeofMaterialsScienceandEngineering,TaiyuanUniversityofTechnology,Taiyuan030024,China;3.ShanxiCoalMiningAdministratorsCollege,Taiyuan030600,China;4.CollegeofChemistryandChemicalEngineering,TaiyuanUniversityofTechnology,Taiyuan030024,China)
,E-mail:chenliuqingluck@163.com
Three luminescence materials, 3-(dicyanomethylene)-5,5-dimethyl-1-styryl-cyclohexene (DCDSC), 3-(dicyanomethylene)-5,5-dimethyl-1-(3-hydroxy-styryl)cyclohexene(DCDH3C) and 3-(dicyanomethylene)-5,5- dimethyl-1-(4-hydroxy-styryl)cyclohexene (DCDH4C), were designed and synthesized, respectively. These compounds were confirmed by1H NMR and elemental analysis, and their crystal structures were confirmed by single-crystal X-ray diffraction (XRD). UV-Vis absorption peaks of DCDSC, DCDH3C and DCDH4C materials in THF solutions in turns are at about 268 and 390 nm, 269 and 398 nm, as well as 283 and 424 nm. Their maximum emission peaks are at 522, 549 and 567 nm in liquid state, respectively, which may be mainly ascribed to difference between their hydrogen bond besides substituent effect.
isophorone; luminescence; substituent group; hydrogen bond
1000-7032(2016)08-0899-07
2016-03-28;
2016-04-19
教育部长江学者与创新团队发展项目(IRT0972);国家国际科技合作专项(2012DFR50460);国家自然科学基金(21071108,60976018,21101111,61274056,61205179); 山西省科技攻关项目(20120321019)资助
O63
ADOI: 10.3788/fgxb20163708.0899
