小细胞肺癌的药物治疗进展Δ
2016-11-02曹邦伟姚小军
王 政,俞 静,曹邦伟,姚小军
(1.首都医科大学附属北京友谊医院肿瘤科,北京 100050; 2.澳门科技大学中药质量研究国家重点实验室,澳门 999078)
小细胞肺癌的药物治疗进展Δ
王政1*,俞静1,曹邦伟1,姚小军2#
(1.首都医科大学附属北京友谊医院肿瘤科,北京100050; 2.澳门科技大学中药质量研究国家重点实验室,澳门999078)
在恶性肿瘤中,肺癌的发病率居第1位、病死率居第2位[1],每年有超过160万例新发肺癌病例、130万例死亡病例[2-3]。肺癌主要分为2大类:非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)。SCLC仅约占全部肺癌的15%,但其恶性程度相对较高,危险因素除遗传因素外,还包括接触离子辐射、铀、氯气和氯甲醚等[4-5]。临床常使用美国退伍军人肺癌协会的两期分类法,局限期定义为该病仅出现于同侧胸腔,可以包含在1个放射视野中;广泛期定义为病变超出同侧胸腔,除明显远距离血行转移外,同时包括对侧肺门或锁骨上淋巴结肿大、恶性胸腔或心包积液。大部分SCLC患者确诊时已为广泛期。由于SCLC恶性程度高、倍增时间较短、全身转移快,因此手术的机会不多,而目前尚无有效的筛查方法可用于检测早期SCLC[6]。目前,SCLC的治疗仍以传统化疗为主,但已有诸多临床研究使用靶向药物治疗SCLC。本文就目前临床治疗SCLC的化疗药及针对SCLC的靶向治疗药物的临床研究进行综述。
1 化疗药
1.1铂类药物
顺铂于1979年被用于临床,至今仍为应用最广泛的抗肿瘤药之一,其抗肿瘤谱广、效果显著,为多肿瘤化疗提供了有力支持[7]。铂类药物属重金属络合物,通过跨膜转运进入细胞生成水合配离子,定向迁移到细胞核内,作用于DNA嘌呤和嘧啶碱基,影响链间及链内交链,与核内DNA配合形成铂类-DNA复合物,限制DNA的解旋而抑制DNA的复制[8];由于肿瘤细胞增殖速度高于正常组织细胞,且应对受损DNA的修复机制不完善,因此,肿瘤细胞的增殖受到了较大干扰,进而起到了抑制肿瘤生长作用。铂类药物根据研发过程分为3代,第1代如顺铂,第2代如奈达铂、卡铂等,第3代包括洛铂、奥沙利铂等。其中,顺铂、卡铂、奥沙利铂被临床广泛使用,而奈达铂、洛铂仅在部分亚洲地区用于临床[9-11]。目前,顺铂与依托泊苷联合应用是美国国家综合癌症网络(national comprehensive cancer network,NCCN)指南推荐的一线标准化疗方案。顺铂在我国临床使用时间较长,但其胃肠道反应、肾毒性、耳毒性、骨髓抑制等情况较为严重,故其在老年患者中的应用受限[12]。在使用顺铂的过程应密切关注患者情况,给予恰当的药学监护,出现不良反应应及时对症处理。其他新一代铂类药物的不良反应较少,被广泛用于SCLC的治疗[13]。
1.2依托泊苷
依托泊苷是鬼臼脂中分离出的有效成分,属于细胞周期S期或G2期特异性抗肿瘤药,其作用于DNA拓扑异构酶Ⅱ,形成稳定的药物-酶-DNA可逆性复合物,阻碍DNA复制,从而抑制肿瘤生长[14]。依托泊苷在同类药物中毒性较低、耐受性好,同时不良反应及死亡的发生率较低,为NCCN指南推荐的SCLC化疗一线用药。研究结果显示,该复合物可随药物的清除而逆转,使正常组织损伤的DNA得到修复,降低了细胞毒作用,因此,延长药物的给药时间可提高抗肿瘤活性。依托泊苷口服制剂吸收后,于0.5~4.0 h达到血药浓度峰值,生物利用度为50%,主要分布于胆汁、腹水、尿液、胸水和肺组织中,极少进入脑脊液[15]。依托泊苷的不良反应主要为血液学和消化道毒性,口服制剂呕吐发生率比静脉制剂低;极少数患者可能发生严重过敏反应,在临床中须予以重视。
1.3伊立替康
伊立替康为半合成喜树碱衍生物,以盐酸盐形式存在,克服了喜树碱类药物水溶性差的缺点,主要作用于DNA拓朴异构酶Ⅰ,阻碍 DNA复制和 RNA转录,引起不可逆的DNA键断裂,最终导致细胞死亡。由于在增生和静止的肿瘤细胞中拓朴异构酶Ⅰ的含量均增高,故伊立替康对缓慢和迅速生长的肿瘤细胞均有杀伤作用。SCLC对于初始治疗非常敏感,顺铂联合依托泊苷的一线联合化疗方案的有效率较高,但由于SCLC的生物学特性,大多数患者在初始治疗后出现复发及化疗抵抗[16]。因此,NCCN将伊立替康联合顺铂作为SCLC的二线治疗方案,并指出二线化疗能明显缓解大多数患者的症状。迟发性腹泻与中性粒细胞减少症是伊立替康的主要不良反应,迟发性腹泻的中位时间为滴注伊立替康后第5日,患者需补液并使用洛哌丁胺抗腹泻治疗;中性粒细胞减少症是伊立替康剂量限制性不良反应,可逆转并属于非蓄积性,需密切关注、对症治疗。
1.4紫杉醇
紫杉醇属于植物类抗肿瘤药,是1963年美国国家癌症研究所从红豆杉树皮和木质部分分离出的一种化合物,也是紫杉烷类化合物中第一个经美国食品药品监督管理局(U.S.food and drug administration,FDA)批准使用的药物。紫杉醇可打破微管与微管蛋白之间的动态平衡,诱导和促进微管蛋白聚合,防止解聚,稳定微管结构[17]。这些作用最终导致细胞在有丝分裂时不能形成纺锤体和纺锤丝,抑制了细胞的有丝分裂和增殖,使肿瘤细胞停止在G2期和M期,进而死亡。紫杉醇属于SCLC治疗的二、三线用药,对于SCLC复发患者,NCCN推荐首选入组临床试验。
1.5其他药物
SCLC的1种病理类型呈现出典型的神经内分泌特征,为高级别神经内分泌癌,患者可分泌胃泌素释放钛前体、神经降压素、缩胆囊素、神经特异性烯醇化酶、染色颗粒素、抗利尿激素、突触囊泡蛋白及乙酰胆碱等物质[18]。部分患者常合并低钠血症,考虑为SCLC导致抗利尿激素分泌失调综合征[19]。除针对原发病治疗、限制水摄入补充钠盐外,临床亦使用长效生长抑素(奥曲肽)进行治疗[20]。因此,生长抑素也属于治疗SCLC的常用药物之一。在治疗初始阶段,SCLC对化疗药非常敏感,但大多数患者在初始治疗后出现复发及耐药,NCCN推荐复发患者首选入组临床试验。若无合适的临床试验,亦推荐使用紫杉醇、多西他赛、拓扑替康、替莫唑胺、吉西他滨、长春瑞滨、异环磷酰胺等单药治疗。另外,拓扑替康现已作为复发SCLC患者后续治疗的推荐药物,可以口服或静脉给药,疗效和毒性与其他拓朴异构酶抑制剂无显著差异[21]。
2 靶向治疗
2.1靶向药物在SCLC的应用受限
靶向药物(也称作靶向制剂)是指被赋予了针对肿瘤细胞靶向驱动基因的药物或其制剂,最重要的2类靶向治疗药物分别为单克隆抗体和小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)。单抗、TKI与传统的细胞毒性化疗药的区别在于前者能够抑制肿瘤细胞特定传导通路,达到精准靶点治疗、降低对正常细胞的损伤。针对血管内皮生长因子、表皮生长因子受体、雷帕霉素靶向基因信号通路的靶向药物研发开启了肿瘤治疗新的时代[22]。在过去的十年中,已有多种靶向药物被批准用于肺癌的治疗,给NSCLC患者带来了生存获益。但其中吉非替尼、厄洛替尼、克唑替尼等尚未开展SCLC的相关临床试验,或小规模人群的临床研究未达到预期的临床效果[23]。相关Ⅱ期临床试验对未经治疗的广泛期SCLC患者采用化疗联合贝伐珠单抗与化疗联合安慰剂进行比较,以无进展生存期为首要终点、总生存期为次要终点。结果显示,与安慰剂组比较,贝伐珠单抗的使用延长了4周的无进展生存期(5.5个月 vs. 4.4个月),但总生存期却缩短(9.4个月 vs.10.9个月)。可见,这些已在NSCLC取得成功的靶向药物在SCLC的治疗上不尽如人意[24]。此外,由于食管瘘的发生率较高,2016年NCCN指南中不推荐SCLC患者使用贝伐珠单抗。
2.2进行中的临床试验
临床试验通常代表了目前SCLC患者治疗的水平,因此,应大力鼓励患者参与临床试验。过去靶向药物的研发仅以抗表皮生长因子受体、抗血管生成或其下游信号通路为靶点[25]。近十年来,随着肿瘤基础免疫学研究的突破,肿瘤的靶向治疗进入了新时代。针对程序性死亡受体-1(programmed death-1,PD-1)/程序性死亡配体-1(programmed death ligand-1,PD-L1)通路的抑制剂治疗是目前备受瞩目的靶向药物[26]。Nivolumab、Pembrolizumab是经FDA批准用于黑色素瘤的免疫检查点抑制剂。查询Clinical Trials可知,目前正在进行中的这2种PD-1抑制剂针对SCLC的临床试验仍在初始阶段招募中(见表1)。PD-1抑制剂的作用机制为:T细胞表面PD-1与肿瘤细胞的PD-L1结合,导致T细胞失能而无法杀伤肿瘤细胞;而抗PD-1单克隆抗体竞争性结合PD-1,解除了肿瘤细胞对T细胞的抑制,恢复了其杀伤肿瘤细胞的能力,具有治疗多种类型肿瘤的潜力,有望实质性改善患者总生存期[27]。期待未来免疫检查点抑制剂能给SCLC患者的生存带来获益。
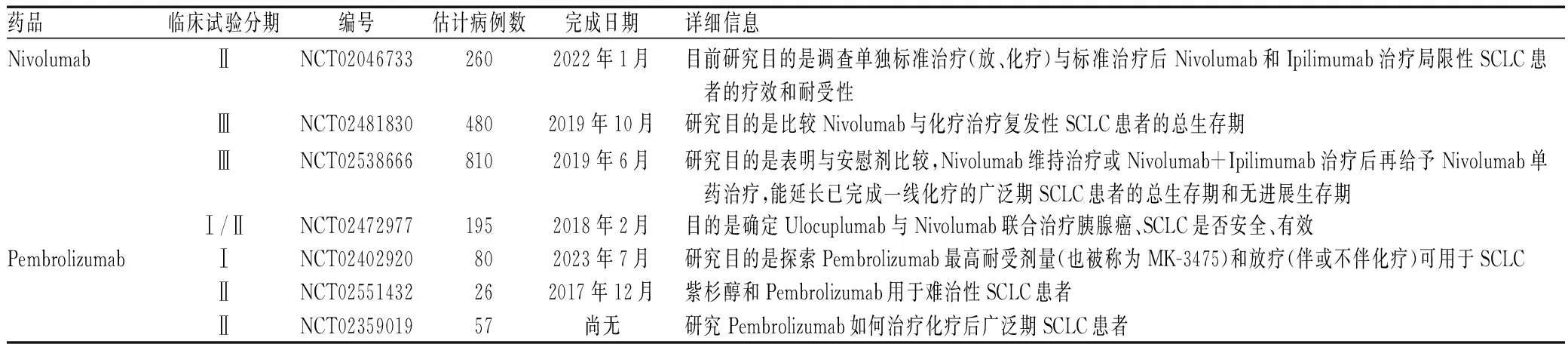
表1 正在进行的针对SCLCPD-1/PD-L1抑制剂的临床试验
综上所述,尽管初始治疗阶段SCLC对传统化疗药十分敏感,但终会出现耐药现象。因此,在初始治疗期间可有计划地采取联合化疗,以期将肿瘤尽可能暴露在细胞毒药物下;也期待未来细胞毒药物的研发能减少不良反应发生,提高机体对药物的耐受性,给SCLC患者带来更大的生存获益。SCLC的信号通路有独特之处,提示未来的靶向药物研发应建立在对SCLC更深入的基础研究之上。同时,期待PD-1/PD-L1抑制剂在SCLC的临床研究能够获得阳性结果,为SCLC的临床治疗带来一个崭新的局面。
[1]Koinis F,Kotsakis A,Georgoulias V.Small cell lung cancer(SCLC):no treatment advances in recent years[J].Transl Lung Cancer Res,2016,5(1):39-50.
[2]Priyanka K,Normand B,Pierre G,et al.Immunotherapy comes of age in lung cancer[J].Clin Lung Cancer,2016,7(25):7302-7304.
[3]姚晓军,刘伦旭.肺癌的流行病学及治疗现状[J].现代肿瘤医学,2014,22(8):1982-1986.
[4]Yuankai S,Puyuan X,Yun F,et al.Current small cell lung cancer treatment in China[J].Thoracic Cancer,2015,6(1):233-238.
[5]王冬梅,陈勃江,李为民,等.肺癌危险因素的Meta分析[J].中国循证医学杂志,2010,10(12):1446-1449.
[6]Kamiyama H,Sakamoto K,Niwa K,et al.Unusual false-positive mesenteric lymph nodes detected by PET/CT in a metastatic survey of lung cancer[J].Case Rep Gastroenterol,2016,10(2):275-282.
[7]Alvarado G,Morales D.Treatment for small cell lung cancer,where are we now?[J].Transl Lung Cancer Res,2016,5(1):26-38.
[8]Hatfield LA,Huskamp HA,Lamont EB.Survival and toxicity after cisplatin plus etoposide versus carboplatin plus etoposide for extensive-stage small-cell lung cancer in elderly patients[J].J Oncol Pract,2016,12(7):666-730.
[9]Karam I,Jiang SY,Khaira M,et al.Outcomes of small cell lung cancer patients treated with cisplatin-etoposide versus carboplatin- etoposide[J].Am J Clin Oncol,2013,38(1):51-54.
[10]杨柳青,秦叔逵.第三代铂类药物洛铂的研究新进展[J].临床肿瘤学杂志,2009,14(12):1134-1135.
[11]Salgia R,Hensing T,Campbell N,et al.Personalized treatment of lung cancer[J].Sermin Oncol,2011,38(2):274-276.
[12]Rossi A,Di Maio M,Chiodini P,et al.Carboplatin-or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer:the COCIS meta-analysis of individual patient data[J].J Clin Oncol,2012,30(14):1692-1698.
[13]Dilruba S,Kalayda GV.Platinum-based drugs:past,present and future[J].Cancer Chemother Pharmacol,2016,77(6):1103-1124.
[14]汪晓洁,李丽华,寿涛,等.IP与EP方案治疗广泛期小细胞肺癌的临床疗效比较[J].实用医学杂志,2012,28(17):2946-2947.
[15]Kalemkerian GP.Advances in pharmacotherapy of small cell lung cancer[J].Expert Opin Pharmacother,2014,15(16):2385-2396.
[16]张琴阳,周永青,丁海斌,等.伊立替康联合顺铂与紫杉醇联合顺铂治疗难治性小细胞肺癌的临床观察[J].现代肿瘤医学,2010,18(10):1974-1976.
[17]Hansen O,Srensen P,Hansen KH.The occurrence of hyponatremia in SCLC and the influence on prognosis:a retrospective study of 453 patients treated in a single institution in a 10-year period[J].Lung Cancer,2010,68(1):111-114.
[18]张实,吴学玲.小细胞肺癌神经内分泌起源标志物的研究进展[J].中华肺部疾病杂志,2014,7(2):212-215.
[19]刘平,魏子白,于俊岩,等.生长抑素治疗小细胞肺癌引起的顽固性低钠血症1例[J].临床肿瘤学杂志,2012,8(17):767-768.
[20]马芳,刘先领,胡春宏.小细胞肺癌合并低钠血症的临床特点及预后分析[J].中南大学学报:医学版,2011,36(1):64-67.
[21]Nakayama S,Yokote T,Kobayashi K,et al.Syndrome of inappropriate antidiuretic hormone secretion associated with acute myeloid leukemia with multilineage dysplasia[J].Endocrine,2014,35(3):290-292.
[22]Paleiron N,Bylicki O,André M,et al.Targeted therapy for localized non-small-cell lung cancer:a review[J].Onco Targets Ther,2016,5(9):4099-4104.
[23]Bombardelli L,Berns A.The steady progress of targeted therapies,promising advances for lung cancer[J].E Cancer Medical Science,2016,28(10):638-640.
[24]Roviello G,Zanotti L,Cappelletti MR.No advantage in survival with targeted therapies as maintenance in patients with limited and extensive-stage small cell lung cancer:a literature-based meta-analysis of randomized trials[J].Clin Lung Cancer,2016,6(2):1525-1528.
[25]Govindan R,Page N,Morgensztern D,et al.Changing epidemiology of small-cell lung cancer in the United States over the last 30 years:analysis of the surveillance,epidemiologic,and end results database[J].J Clin Oncol,2006,2(4):4539-4544.
[26]Massarelli E,Papadimitrakopoulou V,Welsh J.Immunotherapy in lung cancer[J].Transl Lung Cancer Res,2014,3(1):53-63.
[27]Reck M,Heigener D,Reinmuth N.Immunotherapy for small-cell lung cancer:emerging evidence[J].Future Oncol,2016,12(1):931-943.
国家自然科学基金资助(No.81101737)
教授。研究方向:抗肿瘤药物的前药研发。E-mail:xjyao@must.edu.mo
R979.1
A
1672-2124(2016)09-1159-03
10.14009/j.issn.1672-2124.2016.09.003
2016-08-03)
*硕士研究生。研究方向:临床药理。E-mail:zhengwangccmu@hotmail.com
