表皮生长因子受体酪氨酸激酶抑制剂联合化疗治疗晚期非小细胞肺癌的有效性及安全性Δ
2016-11-02王德林曹玉娟李兆鑫曹邦伟
曹 凤,王德林,曹玉娟,李兆鑫,曹邦伟,颜 博
(1.北京大学首钢医院肿瘤科,北京 100041; 2.首都医科大学附属北京友谊医院肿瘤科,北京 100050; 3.德克萨斯大学圣安东尼奥健康科学中心微生物与免疫学系,德克萨斯州 圣安东尼奥 78284,美国)
·本期特稿·
表皮生长因子受体酪氨酸激酶抑制剂联合化疗治疗晚期非小细胞肺癌的有效性及安全性Δ
曹凤1*,王德林1,曹玉娟1,李兆鑫2,曹邦伟2,颜博3#
(1.北京大学首钢医院肿瘤科,北京100041; 2.首都医科大学附属北京友谊医院肿瘤科,北京100050; 3.德克萨斯大学圣安东尼奥健康科学中心微生物与免疫学系,德克萨斯州 圣安东尼奥78284,美国)
目的:观察表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)与化疗联合治疗晚期非小细胞肺癌的疗效,并对其预后及安全性进行探讨。方法:选取2013年2月—2014年11月收治的晚期非小细胞肺癌患者48例,按随机数字表法平均分为研究组和对照组,对照组患者采用单纯化疗,研究组患者在单纯化疗的基础上联合使用EGFR-TKI,治疗结束后评估2组患者的治疗效果与安全性。结果:2组患者有效率和总生存时间的差异无统计学意义(P>0.05);研究组患者的疾病控制率和无疾病进展时间均明显高于对照组,差异均有统计学意义(P<0.05);2组患者均出现一定级别的不良反应,但不良反应发生率较低,且2组间的差异无统计学意义(P>0.05)。结论:相对于单纯化疗,使用EGFR-TKI联合化疗治疗晚期非小细胞肺癌,更有利于疾病的控制、延缓肿瘤进展时间,且安全性较好。
EGFR-TKI; 非小细胞肺癌; 化疗
在我国,肺癌属于高发的恶性肿瘤,患病率和病死率日益上升,非小细胞肺癌(non small cell lung cancer,NSCLC)为肺癌最为常见的病理类型[1,2]。近年来,对分子靶向治疗的研究日益深入,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)是一类毒副作用小、疗效确切的靶向治疗药物,其治疗晚期NSCLC的疗效显著[3]。本研究对比观察了EGFR-TKI联合化疗与单纯化疗治疗ISCLC的疗效,报告如下。
1 资料与方法
1.1资料来源
选取2013年2月—2014年11月就诊的NSCLC患者48例,均诊断明确且分期处于ⅢB~Ⅳ期;男性19例,女性29例;有吸烟史者15例,均为男性;体力活动状态(performance status,PS)评分为0~1分者18例,≥2分者30例;鳞癌16例,腺癌30例,腺鳞癌及大细胞癌各1例;一线治疗者16例,二线或二线后治疗者32例。所有患者的随访依存性好,病历资料记录完整。纳入与排除标准:无其他原因引起的肺部疾病;无心、肺等多器官功能衰竭的症状;1个月内未服用过其他与本研究所用药物疗效相似或同类的药物;经组织病理学确诊[4]。本研究通过医院医学伦理委员会批准,治疗前与所有患者或家属均进行沟通,患者或家属均签署了知情同意书。采用随机数字表法平均分为研究组和对照组各24例。研究组患者中,男性10例,女性14例;年龄37~79岁,平均(62.51±0.32)岁;对照组患者中,男性9例,女性15例;年龄38~76岁,平均(61.92±0.89)岁。2组患者的性别、年龄、吸烟情况、PS评分、病理类型等基线资料相近,具有可比性,见表1。

表1 2组患者基线资料比较Tab 1 Comparison of general data between two groups
1.2方法
患者入院后首先进行必要的支持治疗。(1)对照组患者采用单纯化疗方案,给予培美曲塞(腺癌)或多西他赛(鳞癌)联合顺铂。培美曲塞:剂量为500 mg/m2,静脉滴注,治疗3周;用药前1周开始口服叶酸0.4 mg/d,直至治疗结束后3周;用药前1周肌内注射维生素B121 mg,用药前1 d开始口服地塞米松4 mg,服用3 d后停药。多西他赛:剂量为80 mg/m2,静脉滴注,治疗3周;用药前1 d开始口服地塞米松6 mg,服用3 d后停药。顺铂:剂量为75 mg/m2,经0.9%氯化钠注射液配成溶液后静脉注射,同时连续补液水化3 d,每日补液量≥2 000 ml,常规给予预防性止吐治疗。(2)研究组患者在对照组基础上联用EGFR-TKI,其中10例口服吉非替尼(250 mg/d,1日1次),3例口服厄洛替尼(150 mg/d,1日1次),11例口服盐酸艾克替尼(450 mg/d,1日3次),餐前1.5 h或餐后2 h服用,维持治疗直至肿瘤进展或出现难以耐受的不良反应。治疗前l周完成基线检查,用药期间密切监测并随访患者状况,出现不良反应立即进行停药等处理。
1.3观察指标与疗效评定标准
按照实体瘤疗效评价标准评定客观疗效:(1)完全缓解(complete response,CR),所有靶病灶均消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm;(2)部分缓解(partial response,PR),靶病灶的最大直径总和至少比基线水平减少30%;(3)疾病进展(progressive disease,PD),以整个研究过程中所有测量的靶病灶直径之和的最小值为参考,直径和相对增加至少20%,或出现新病灶,除此之外,必须满足直径之和的绝对值增加至少5 mm;(4)疾病稳定(stable disease,SD),靶病灶减小的程度未达到PR,增加的程度也未达到PD,介于两者之间;以上需维持4周以上。客观缓解率(objective remisson rate,ORR)=(CR病例数+PR病例数)/总病例数×100%,疾病控制率(disease control rate,DCR)=(CR病例数+PR病例数+SD病例数)/总病例数×100%。开始化疗至肿瘤进展的时间为肿瘤无进展生存期(progression-free surviva,PFS);开始化疗至患者死亡的时间为总生存期(overall survival,OS)。按照世界卫生组织抗肿瘤药毒性对不良反应进行判定,分为5级。Ⅰ级:轻度不良反应;Ⅱ级:中度不良反应;Ⅲ级:严重不良反应;Ⅳ级:威胁生命的或尚失能力的不良反应;Ⅴ级:与不良反应相关的死亡。
1.4统计学方法

2 结果
2.12组患者的临床疗效与生存时间比较
研究组患者的ORR略优于对照组,但差异无统计学意义(P=0.821);研究组患者的DCR明显高于对照组,差异有统计学意义(P=0.048),见表2。长期随访观察患者,直至病情出现进展或死亡,无1例患者失访。2组患者中位PFS的差异有统计学意义(P=0.035),但中位OS的差异无统计学意义(P=0.721),见表2、图1—2。
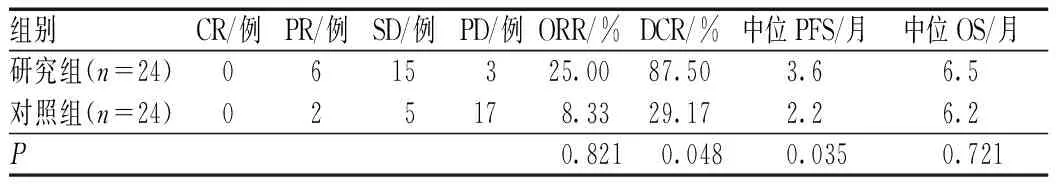
表2 2组患者的临床疗效与生存时间比较Tab 2 Comparison of clinical efficacy and survival time between two groups

图1 2组患者的PFS曲线比较Fig 1 Comparison of PFS curves between two groups
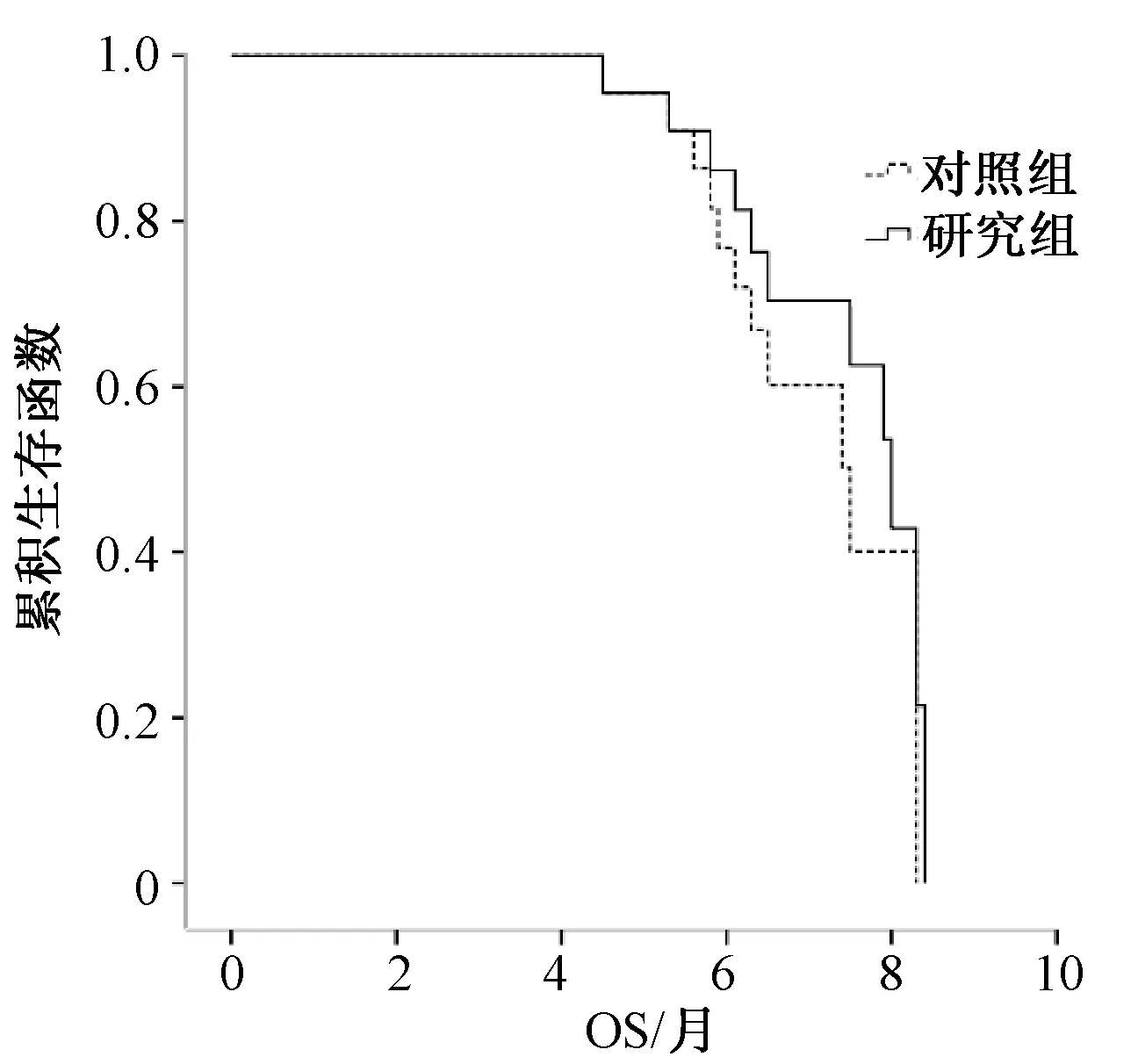
图2 2组患者的OS曲线比较Fig 2 Comparison of OS curves between two groups
2.22组患者不良反应发生情况比较
2组患者的不良反应以痤疮样皮疹(22例,占45.83%)、皮肤瘙痒(13例,占27.08%)及恶心、呕吐等消化道症状(21例,占43.75%)为主,见表3。研究组患者痤疮样皮疹、皮肤瘙痒的发生率高于对照组,但2组患者总体不良反应发生率的差异无统计学意义(P>0.05)。

表3 2组患者不良反应发生情况比较(例)Tab 3 Comparison of adverse drug reactions between two groups(cases)
3 讨论
肺癌的预后与其病理分型密切相关,其中最常见的类型为NSCLC,包括鳞癌、腺癌、大细胞肺癌等,由于缺乏早期症状以及早期诊断困难,易引发咳嗽、咯血、体质量减轻、副癌综合征等全身性表现[5]。传统含铂二药化疗方案在一定程度上延长了患者生存期,但经多周期化疗后,绝
大部分晚期NSCLC患者的疗效已到达平台期,最终均因产生耐药性或严重不良反应而导致治疗失败[6]。近年来,EGFR-TKI治疗晚期NSCLC的疗效显著,其作用机制是通过竞争性结合EGFR的ATP结合位点,从而抑制酪氨酸残基磷酸化过程而阻止EGFR信号通路的传导,最终抑制肿瘤细胞生长并促进肿瘤细胞凋亡。与传统化疗比较,EGFR-TKI的优点在于生物利用度高、不良反应小、对晚期NSCLC患者具有显著疗效[7]。
本研究结果显示,2组患者ORR、OS的差异无统计学意义(P>0.05);但研究组患者的DCR、中位PFS均明显优于对照组,差异有统计学意义(P<0.05)。提示EGFR-TKI有利于延缓肿瘤进展时间、改善患者生活质量。安全性方面,2组患者均出现了不同程度的不良反应,研究组患者不良反应发生率略低于对照组,但差异无统计学意义(P>0.05);所有不良反应均经过及时处理后缓解,未出现因不良反应不能耐受而停止治疗的病例。
综上所述,使用EGFR-TKI联合化疗治疗晚期NSCLC,有利于提高疗效、延缓肿瘤进展时间。但本研究样本量较少,没有对纳入患者的EGFR突变及间变性淋巴瘤激酶基因融合状态进行亚组分析,所得结果有待大型临床试验的进一步验证。
[1]Kuribayashi K,Funaguchi N,Nakano T.Chemotherapy for advanced non-small cell lung cancer with a focus on squamous cell carcinoma[J].J Cancer Res Ther,2016,12(2):528-534.
[2]Zappa C,Mousa SA.Non-small cell lung cancer: current treatment and future advances[J].Transl Lung Cancer Res,2016,5(3):288-300.
[3]Chuang JC,Shrager JB,Wakelee HA,et al.Concordant and discordant EGFR mutations in patients with multifocal adenoc-arcinomas: implications for EGFR-targeted therapy[J].Clin Ther,2016,38(7):1567-1576.
[4]李俭杰,曲莉莉,卫星,等.EGFR-TKI一线治疗EGFR基因突变的晚期非小细胞肺癌临床观察[J].中国肺癌杂志,2012,15(5):299-304.
[5]Blackhall F,Thatcher N,Booton R,et al.The impact on the multidisciplinary team of molecular profiling for personalized therapy in non-small cell lung cancer[J].Lung Cancer,2013,79(2):101-103.
[6]Tomasini P,Barlesi F,Mascaux C,et al.Pemetrexed for advanced stage nonsquamous non-small cell lung cancer: latest evidence about its extended use and outcomes[J].Ther Adv Med Oncol,2016,8(3):198-208.
[7]Ellis PM,Coakley N,Feld R,et al.Use of the epidermal growth factor receptor inhibitors gefitinib,erlotinib,afatinib,dacomitinib,and icotinib in the treatment of non-small-cell lung cancer: a systematic review[J].Curr Oncol,2015,22(3):e183-e215.
Efficacy and Safety of Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitor Combined with Chemotherapy in Treatment of Advanced Advanced Non-small Cell Lung CancerΔ
CAO Feng1, WANG Delin1, CAO Yujuan1, LI Zhaoxin2, CAO Bangwei2, BO Yan3
(1.Dept.of Oncology,Peking University Shougang Hospital, Beijing 100041, China; 2.Dept.of Oncology, Beijing Friendship Hospital Affiliated to Capital Medical University, Beijing 100050, China; 3.Dept.of Microbiology and Immunology, University of Texas Health Science Center of San Antonio, TX, San Antonio 78284, USA)
OBJECTIVE:To observe the efficacy of epidermal growth factor receptor tyrosine kinase inhibitor(EGFR-TKI) combined with chemotherapy in treatment of advanced advanced non-small cell lung cancer(NSCLC), and to probe into the prognosis and safety. METHODS: 48 patients with NSCLC admitted from Feb. 2013 to Nov. 2014 were selected to be divided into observation group and control group via the random number table. The control group were treated with simple chemotherapy, while the observation group were additionally given EGFR-TKI based on the control group. The treatment effects and safety of two groups were evaluated after treatment. RESULTS: There was no statistical significance between two groups in effective rate and overall survival time(P>0.05). The disease control rate and progression-free survival of observation group were significantly higher than those of control group, with statistically significant difference(P<0.05). There were adverse drug reactions in both groups, yet the incidence was relatively low, and the difference was not significant(P>0.05). CONCLUSIONS: Compared with simple chemotherapy, EGFR-TKI combined with chemotherapy in treatment of NSCLC can effective control the diseases and delay the tumor progression of time with high safety.
EGFR-TKI; NSCLC; Chemotherapy
国家自然科学基金资助(No.81272615)
副教授。研究方向:恶性肿瘤的放化疗。E-mail:radiotherapy@aol.com
R979.1
A
1672-2124(2016)09-1153-03
10.14009/j.issn.1672-2124.2016.09.001
2016-08-03)
*主治医师。研究方向:肺癌及消化道肿瘤。E-mail:qhcfbj@sina.com
