逆流色谱研究进展
2016-11-01吴大同潘远江
吴大同 潘远江
(浙江大学化学系,杭州 310027)
评述与进展
逆流色谱研究进展
吴大同 潘远江*
(浙江大学化学系,杭州 310027)
逆流色谱(Counter-current chromatography,CCC)是以分析物在液-液两相溶剂中的分配差异为核心的快速分离技术。近年来,逆流色谱对复杂样品的分离,尤其是对天然产物的分离已获得广泛的关注。本文综述了近年来逆流色谱在仪器改进、溶剂体系筛选等领域的研究进展,并介绍了CCC在分离手性化合物中的应用前景。最后,对该领域未来的研究内容进行了展望。
逆流色谱;仪器改进;溶剂体系;手性分离;评述
1 逆流色谱简介
20世纪70年代,美国国家健康研究院Ito博士发明了逆流色谱。逆流色谱(Counter-current chromatography,CCC)是一种连续液-液分配色谱技术,无需任何固态支撑体,依托于两相溶剂连续有序的重复混合实现分析物高效分离。经过40多年的发展与完善,逆流色谱作为一种高效的制备或半制备分离技术已广泛用于分离复杂样品,如天然产物[1~10],生物蛋白[11~15],纳米粒子[16]等。与以固相载体作为固定相的色谱技术相比,其具有样品损失小、无不可逆吸附、分辨率高等优点[17]。因此,逆流色谱正被越来越多的分离工作者接纳。至今,已经建立了快速分析型CCC,半制备型CCC,大分子蛋白质分离用的CCC以及pH区带制备型CCC。众多的应用实例表明,逆流色谱凭借其独特的优势,已成为现代分离技术不可缺少的手段之一。
本文主要对近5年逆流色谱在仪器改进、溶剂体系筛选等领域的研究进展进行综述,重点介绍了围绕提高固定相保留值而进行的仪器改进,并对CCC在分离手性化合物中的应用做了简要介绍。
2 逆流色谱仪器的优化和改进
发展快速、高效的色谱分离技术是分离工作者不断追求的目标。经过多年发展,特别是2000年以来,制备或半制备型逆流色谱在仪器改进、设计方面已取得较大的突破,主要包括以下几个方面:(1)色谱柱几何构型的设计;(2)多重色谱柱的串、并联设计;(3)多维逆流色谱以及逆流色谱与制备液相色谱联用技术。围绕这三方面,研究人员做了大量的系统工作。设计出多种独具特色且高效的逆流色谱,显著提高了复杂样品的分离效率,大大缩短了分离时间。
其中,对色谱柱的改进,即是增加其固定相保留值。固定相保留值是逆流色谱的一个重要参数。通常,保留值越高,分离得到的峰分辨率就越好。但是,传统逆流色谱普遍存在着固定相保留值较低的缺点(<40%)。近年来,针对这个问题,研究人员对色谱柱几何构型进行了改进。
Liang等[18]构建了新型圆锥体色谱柱的逆流色谱(图1),并在理论上得到了最优的圆锥体构造关系,他们发现,不同于传统的圆柱体色谱柱,该型色谱柱能显著提高固定相保留值,最高可达71.56%。此外,Cao等[19]设计了螺旋管圆盘柱,使固定相保留值提高了10%,并成功应用于对大极性化合物的分离。这些设计都有效地提高了逆流色谱的分离能力,证明了对色谱柱的优化是一种可靠的方案。
改进多重色谱柱的串、并联设计是提高逆流色谱分离效率的另一种重要途径。如今广泛使用的高速逆流色谱[20~24],就是利用螺旋管的一种特殊的同步行星式运动模式(J型模式),能够实现快速、高效分离。然而,由于其运动模式的限制,大极性溶剂体系很难在色谱柱中得到保留,因此对多肽、糖类以及蛋白质等大极性化合物分离效果很差。
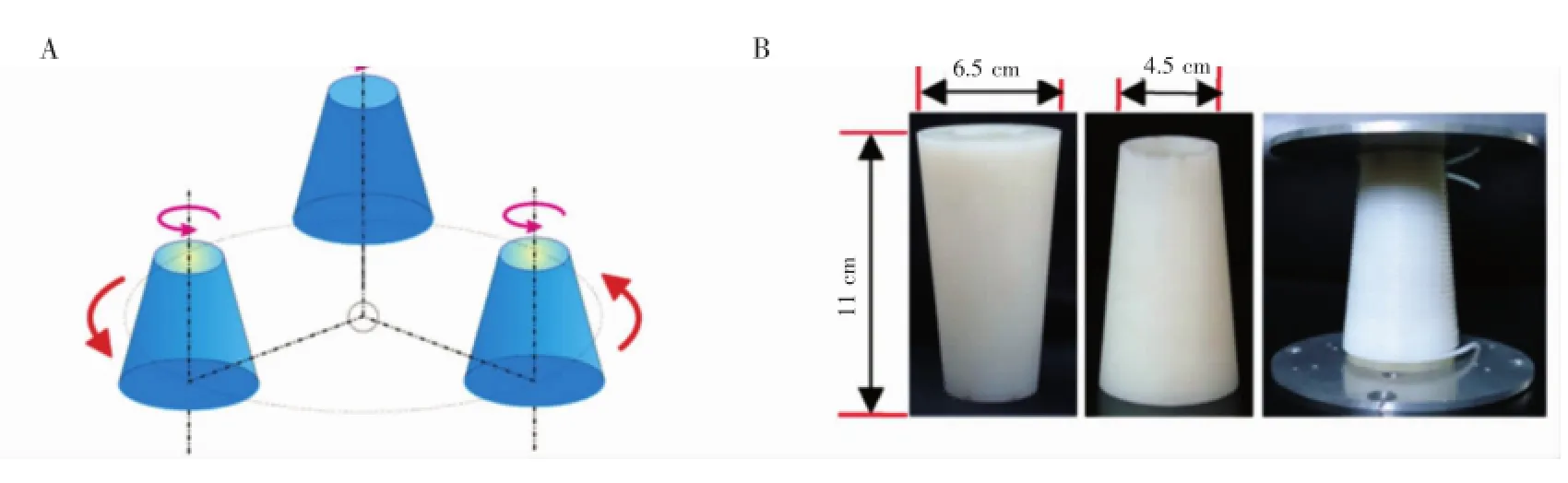
图1 (A)圆锥体色谱柱设计示意图和(B)实物图[18]Fig.1 (A)Schematic illustration of upright conical coils and(B)photographs of the product[18]
Shinomiya等[25]以主、从动轴不同的转动方式构建了交叉轴螺旋管式离心型逆流色谱(图2),具体运动方式为支撑轴在水平方向转动,从动轴在竖直方向转动。与传统的J型螺旋管式离心型逆流色谱相比,其对大极性溶剂体系具有较好的固定相保留值,能够显著提高大极性化合物的分离效率。实验表明,该型逆流色谱可以基于双水相系统成功分离5种多糖类似物。此外,该设计极大地丰富了逆流色谱色谱柱的设计思路,为仪器的改进提供了较佳方案。

图2 (A)J-型螺旋管和交叉轴型螺旋管运动模式设计示意图及(B)实物图[25]Fig.2 (A)Schematic illustration of planetary motions of the type-J coil planet centrifuge(CPC)and cross-axis CPC and(B)photograph of the product[25]
其后,该研究小组又利用4个偏心轴将同步行星式运动模式(J型模式)与非同步离心模式(I型模式)结合,构建了新型四柱并联逆流色谱(图3)[26],并分别测试了以头到尾和尾到头洗脱方式分离复杂样品。无论是以上相或下相为固定相,都具有较高的固定相保留值和较好的分离度。该方法既能保留两种不同运动模式的优点,又能扩大其应用范围,适用于分离极性差别大的复杂样品。
多重色谱联用技术是提高分离效率的有效手段之一。近年来,Qiu等[27,28]利用独特的接口技术和不间断分离模式,发展了逆流色谱与制备型液相色谱联用技术(图4)。以逆流色谱为第一维分离,制备液相色谱为第二维分离,一次性分离得到12种化合物,且纯度达到90%以上。该结果表明,多维色谱技术能有效的结合每个色谱的技术特点,综合利用其优势使分离效率达到最优化。
为了进一步优化二维逆流色谱系统,本课题组设计了一种新型二维逆流色谱接口技术[29]。如图5所示,该系统结合了固相萃取技术,用固相萃取小柱除去一维产生的大量溶剂,同时将目标样品吸附在固相萃取柱上。通过少量的流动相即可将固相萃取柱上的样品引入二维分离。该逆流色谱系统通过特殊的接口及色谱联用设计实现了两柱并联集成化,大大提高了逆流色谱的分离效率。其后,本课题组又利用该二维逆流色谱系统开发出两种不同类型溶剂体系,同时在线分离大黄提取物中的4种蒽醌类化合物[30]。具体操作步骤如下:正己烷-乙酸乙酯-甲醇-水(1∶1∶1∶1,V/V)作为第一维逆流色谱溶剂体系;甲基叔丁基醚-乙腈-水(2∶2∶3,V/V),上相加入三氟乙酸(10 mmol/L),下相加入三乙胺(10 mmol/L)的酸碱溶剂体系作为第二维逆流色谱溶剂体系,实现了对复杂样品的高效、快速分离。
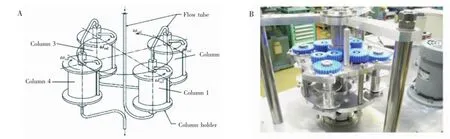
图3 (A)J型模式和I型模式并联设计示意图和(B)实物图[26]Fig.3 (A)Schematic illustration of type-J forward and type-I backward columns and(B)photograph of the product[26]

图4 CCC和制备型HPLC联用设计示意图[27]Fig.4 Scheme for flow programming CCC×preparative HPLC system[27]CCC:Counter-current chromatography.
综上所述,无论是对色谱柱的几何构型优化设计,还是对多重色谱柱的串、并联设计,均是为了增加固定相保留值,提高逆流色谱的分离度。此外,合理的多维色谱联用设计能综合不同色谱的技术优点,显著提高分离效率。
3 溶剂体系的选择和优化
选择合适的溶剂体系是逆流色谱分离化合物最为关键一步,占全部工作量的90%以上。因此,建立合理的溶剂筛选策略,选择合适的溶剂体系无疑是极其重要的。近年来,研究者陆续开发了新的溶剂筛选策略。针对四元溶剂体系:正己烷-乙酸乙酯-甲醇-水,Margraff定义了其中的23种溶剂体系,并用字母命名A~Z定义了这23个溶剂体系(除E,I和O外),这些溶剂体系又被命名为Arizona体系。每个溶剂体系中正己烷/乙酸乙酯的比例与甲醇/水的比例必须保持一致。本课题组首先研究了溶质的分配系数以及Arizona体系从亲水性的溶剂体系(乙酸乙酯-水)到疏水性溶剂体系(正己烷-甲醇)的极性变化关系[31],以此提出了新的筛选策略(图6),AZ系统被分成4个部分:Ⅰ亲水性,A~H;Ⅱ弱亲水性,J~M;Ⅲ弱疏水性,N~S;Ⅳ疏水性,T~Z。结果表明,利用三柱并联分析型逆流色谱。仅需3次即可获得最佳溶剂体系。该策略显著缩短了获得合适的溶剂体系所需要的时间,极大地提高了分离效率。

图5 二维逆流色谱设计示意图[29]Fig.5 Scheme of two-dimensional counter-current chromatography[29]
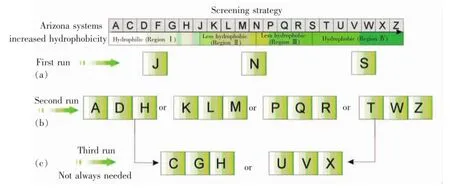
图6 基于AZ两相体系的复杂物物质快速筛选策略[31]Fig.6 Rapid screening strategy of a complex mixture based on liquid compositions of the AZ liquid system[31]
最近,研究人员发现利用建模的方法归纳出两相体系中溶质的分配系数规律具有一定的可行性。具体步骤如下:首先,利用少量实验数据得出溶质分配系数的一定规律,并用相应的数学方程式表示;其次,根据已建立的数学模型,寻找最佳的溶剂筛选体系。Hopmann等[32,33]基于非平衡溶剂化能数值计算的类导体屏蔽模型(COSMO-RS)对逆流色谱的溶剂体系进行筛选。结果表明,该模型可以准确地预测两相溶剂系统的变化对溶质分配系数的影响,并以此筛选出合适的溶剂体系。Ren等[34,35]创新性地引入热力学模型(非随机两相液体模型,NRTL),其可对逆流色谱常用的两相溶剂系统的液-液平衡组成成分进行准确估算。具体筛选过程如图7所示:根据实验测定的溶质分配系数及其相应的溶剂体系计算NRTL模型参数,并用标准品数据证明该参数模型的可行性。其中,活度系数是非常重要的中间参数,该值的准确性将决定该模型能否准确预测合适的溶剂体系。
此外,传统的溶剂体系(正己烷-乙酸乙酯-甲醇-水,甲基叔丁醚-乙腈-水等)适用于分离极性较小或中等极性的化合物。但对于一些大极性、容易失活的样品,此类溶剂体系并不能满足分离要求。因此,一些新的溶剂体系被开发用于分离多糖、多肽、蛋白质等样品。Yin等[36]利用双水相系统PEG1000-MgSO4-H2O(12∶16∶72,w/w)实现一步分离3种不同分子量的多糖。Bezold等[37]开发新型的溶剂体系[Emim]Cl-K2HPO4/KH2PO4-H2O,成功实现3种蛋白质(即溶解酵素、肌红蛋白和牛血清蛋白)的分离。研究表明,含有离子液体的双水相系统具有对样品不易失活、对大极性化合物具有较好的分配系数等优点。Wu等[38]以正己烷-乙酸甲酯-乙腈-水(4∶3∶4∶4,V/V)三相系统为基础,以上层为固定相,下层为流动相。分离得到白芷提取物中8种香豆素类化合物;以上层为固定相,中间层为流动相,分离达到高良姜提取物中6种二芳基庚烷类衍生物;以中间层为固定相,下层为流动相,分离得到知母提取物中3种化合物。综上所述,合适的溶剂体系有助于扩大逆流色谱的分离对象,增加其应用范围。表1列举了近年开发的新型溶剂体系。

图7 NRTL模型的设计流程图[34]Fig.7 Scheme of procedure of NRTL model[34]

表1 近年开发的新型溶剂体系Table 1 Novel liquid-liquid solvent systemin recent years
4 基于逆流色谱对手性化合物的拆分及其展望
手性对映体是一类具有特殊光学性质的化合物,其在精细化学品、生命科学以及医药中间体等领域占有及其重要的地位。大量制备单构型手性化合物一直是分离工作者不断追求的目标。然而,现有的色谱分离技术,如液相色谱、气相色谱和毛细管电泳,存在着样品容量小和成本高等缺点,限制了其在手性拆分中的应用。
逆流色谱分离手性物质无疑还处于实验阶段。近年来,环糊精及其衍生物、蛋白质等都被尝试作为基于逆流色谱分离方法的手性拆分剂。Han等[44,45]以环糊精和铜(II)络合物为手性拆分剂,成功拆分D/L-扁桃酸及其类似物。实验结果表明,温度、溶剂pH值和被分析物浓度都会对分离效率产生影响。Ito等[46]首次尝试以牛血清蛋白为手性拆分试剂,基于螺旋管式逆流色谱双水相体系分离单构型的D/L-色氨酸。他们比较了液相色谱和逆流色谱在手性拆分中的优缺点,其以羟丙基-β-环糊精为手性拆分剂分离苯基丙酸对映体[47,48]。结果表明,液相色谱和逆流色谱对手性拆分都各有其优势,制备型液相色谱适用于高效分离少量的手性化合物;逆流色谱更适用于大量制备高纯度手性化合物。
然而,基于逆流色谱分离手性物质仍存在以下几个问题:(1)CCC分离柱理论塔板数相对较低;(2)所用溶剂体系会破坏主、客体分子间的相互作用;(3)缺乏合适的手性配体。因此,仍需逆流色谱工作者不断努力找到合适的解决办法。但是,可以相信,对于大制备量分离手性化合物,逆流色谱是一个可以信赖的分离技术。
5 总结与展望
经过几十年的不断发展和完善,无论是仪器构造,还是新型溶剂体系的筛选,逆流色谱均有显著进步。如今,CCC凭借其独具特色的技术特点,已被越来越多的分离工作者作为制备或半制备分离技术,广泛用于复杂样品的分离,并成功得到高纯度的化合物,如:生物碱、黄酮类、蛋白质等。大量分离实例证明了逆流色谱对复杂样品具有高效分离的优势。然而,与其它分离技术相比,逆流色谱还存在着一些问题亟需解决。例如,其较低的理论塔板数,限制了其进一步应用;分离工作者需要花费较长的时间和精力筛选得到合适的溶剂体系。这些问题的存在使得逆流色谱仍有进一步优化的空间。
对此,提出以下几点展望:(1)由于逆流色谱可以有效避免死吸附,因此可以针对一些高附加值对象(如紫杉醇)进行分离,实现高回收率低消耗的分离过程。(2)逆流色谱是以分配比为基础的分离技术,通过控制不同对象的分配比实现化合物的精确分段。随着逆流色谱的不断发展完善,它将发展成为一种更加成熟的、可产业化的高效分离技术。
1 Wu D F,Cao X J,Wu S H.J.Chromatogr.A,2012,1223:53-63
2 LI Huan,LIU Xiao,CAI Hao,XU Zi-Sheng,CAI Bao-Chang.Chinese J.Anal.Chem.,2010,38(12):1703-1707
李嬛,刘晓,蔡皓,徐自升,蔡宝昌.分析化学,2010,38(12):1703-1707
3 Dai X J,Hu R L,Sun C R,Pan Y J.J.Chromatogr.A,2012,1226:18-23
4 LU Ying,LI Jia-Yin,LUO Jin,LI Mi-Lu,LIU Zhong-Hua.Chinese J.Anal.Chem.,2011,39(6):851-856
陆英,李佳银,罗晋,李觅路,刘仲华.分析化学,2011,39(6):851-856
5 JIN Zai-Su,TIAN Hong-Mei,TANG Lan,RAO Gui-Wei,FANG Ying-Guo,LI Cheng-Ping.Chinese J.Anal.Chem.,2011,39(6):867-871
金再宿,田红梅,唐岚,饶桂维,方应国,李成平.分析化学,2011,39(6):867-871
6 de Beer D,Malherbe C J,Beelders T,Willenburg E L,Brand D J,Joubert E.J.Chromatogr.A,2015,1381:29-36
7 Liang X J,Zhang Y P,Chen W,Cai P,Zhang,S H,Chen X Q,Shi S Y.J.Chromatogr.A,2015,1385:69-76
8 Liang J L,Meng J,Wu D F,Guo M Z,Wu S H.J.Chromatogr.A,2015,1400:27-39
9 Sun C L,Li J,Wang X,Duan W J,Zhang T Y,Ito Y.J.Chromatogr.A,2014,1370:156-161
10 JIA Jing,LI Yu-Lin,ZHAO Xiao-Hui,XIAO Yuan-Can,CHEN Gui-Chen,YOU Jin-Mao,WEI Li-Xin.Chinese J.Anal. Chem.,2011,39(4):584-587
贾静,李玉林,赵晓辉,肖远灿,陈桂琛,尤进茂,魏立新.分析化学,2011,39(4):584-587
11 Li Y N,Yin L H,Zheng L L,Xu L N,Xu Y W,Zhao Y Y,Qi Y,Yao J H,Han X,Liu K X,Peng J Y.J.Chromatogr.B,2012,895:77-82
12 Wang X,Dong H J,Liu Y Q,Yang B,Wang X,Huang L Q.J.Chromatogr.B,2011,879(11):811-814
13 Shibusawa Y,Takeuchi N,Sugawara K,Yanagida A,Shindo H,Ito Y.J.Chromatogr.B,2006,844(2):217-222
14 Yang Y,Gu D Y,Aisa H A,Ito Y.J.Chromatogr.B,2011,879(32):3802-3805
15 Shibusawa Y,Fujiwara T,Shindo H,Ito Y.J.Chromatogr.B,2004,799(2):239-244
16 Shen C W,Yu T I.J.Chromatogr.A,2009,1216(32):5962-5967
17 Hu R,Pan Y.Trends Anal.Chem.,2012,40:15-27
18 Liang J,Meng J,Guo M,Yang Z,Wu S.J.Chromatogr.A,2013,1288:35-39
19 Cao X L,Pei H P,Huo L S,Hu G H,Ito Y.J.Sep.Sci.,2011,34:2611-2617
20 Du Q B,Jiang H Y,Yin J F,Xu Y Q,Du W K,Li B,Du Q Z.J.Chromatogr.A,2013,1271:62-66
21 Weisz A,Ridge C D,Mazzola E P,Ito Y.J.Chromatogr.A,2015,1380:120-129
22 Jerz G,Elnakady Y A,Braun A,Jäckel K,Sasse F,Al Ghamdi A A,Omar M,Winterhalte P.J.Chromatogr.A,2014,1347:17-29
23 Weisz A,Ridge C D,Roque J A,Mazzola E P,Ito Y.J.Chromatogr.A,2014,1343:91-100
24 Yuan Z Q,Xiao X H,Li G K.J.Chromatogr.A,2013,1317:203-210
25 Shinomiya K,Tokura K,Kimura E,Takai M,Harikai N,Yoshida K,Yanagidaira K,Ito Y.J.Chromatogr.A,2015,1392:48-55
26 Shinomiya K,Sato K,Yoshida K,Tokura K,Maruyama H,Yanagidaira K,Ito Y.J.Chromatogr.A,2013,1322:74-80
27 Liu J L,Wang X Y,Zhang L L,Fang M J,Wu Y L,Wu Z,Qiu Y K.J.Chromatogr.A,2014,1374:156-163
28 Qiu Y K,Yan X,Fang M J,Chen L,Wu Z,Zhao Y F.J.Chromatogr.A,2014,1331:80-89
29 Lu Y B,Hu R L,Pan Y J.Anal.Chem.,2010,82(7):3081-3085
30 Hu R L,Dai X J,Xu X,Sun C R,Pan Y J.J.Chromatogr.A,2011,1218(36):6085-6091
31 Lu Y B,Berthod A,Hu R L,Ma W Y,Pan Y J.Anal.Chem.,2009,81(10):4048-4059
32 Hopmann E,Arlt W,Minceva M.J.Chromatogr.A,2011,1218(2):242-250
33 Hopmann E,Frey A,Minceva M.J.Chromatogr.A,2012,1238:68-76
34 Ren D B,Qin Y H,Yun Y H,Lu H M,Chen X Q,Liang Y Z.J.Chromatogr.A,2014,1355:80-85
35 Ren D B,Yang Z H,Liang Y Z,Ding Q,Chen C,Ouyang M L.J.Chromatogr.A,2013,1301:10-18
36 Yin J Y,Jiang Z H,Yu H,Xie M Y,Hsiao W L,Lu A P,Han Q B.J.Chromatogr.A,2012,1262:92-97
37 Bezold F,Goll J,Minceva M.J.Chromatogr.A,2015,1388:126-132
38 Wu X,Chao Z,Wang C,Yu L.J.Chromatogr.A,2015,1384:107-114
39 Zhou X Y,Zhang J,Xu R P,Ma X,Zhang Z Q.J.Chromatogr.A,2014,1362:129-134
40 Yin H,Zhang S,Long L J,Yin H,Tian X P,Luo X M,Nan H H,Sha He.J.Chromatogr.A,2013,1315:80-85
41 Liu D,Zou X W,Gao M Z,Gu M,Xiao H B.J.Chromatogr.A,2014,1356:157-162
42 Spórna-Kucaba A,Garrard I,Ignatova S,Wybraniec S.J.Chromatogr.A,2015,1380:29-37
43 Zeng Y,Liu G,Ma Y,Chen X Y,Ito Y.J.Chromatogr.A,2011,1218(48):8715-8717
44 Han C,Luo J G,Xu J F,Zhang Y Q,Zhao Y C,Xu X M,Kong L Y.J.Chromatogr.A,2015,1375:82-91
45 Han C,Xu J F,Wang X B,Xu X M,Luo J G,Kong L Y.J.Chromatogr.A,2014,1324:164-170
46 Tong S Q,Ito Y,Ma Y.J.Chromatogr.A,2014,1374:77-84
47 Tong S Q,Zheng Y,Yan J Z.J.Chromatogr.A,2013,1281:79-86
48 Tong S Q,Zheng Y,Yan J Z,Guan Y X,Wu C Y,Lei W Y.J.Chromatogr.A,2012,1263:74-83
This work was supported by the National Natural Science Foundation of China(Nos.21532005 )
Recent Development in Counter-current Chromatography
WU Da-Tong,PAN Yuan-Jiang*
(Zhejiang University,Department of Chemistry,Hangzhou 310027,China)
Counter-current chromatography(CCC)is a quick preparative separation technique based on the different partition coefficient in liquid-liquid solvent systems.This paper reviews recent research progress in the region of solvent systems,instruments improvement of CCC.Moreover,some application prospects about enantioseparation of racemic compounds by CCC are also discussed.Finally,the contents and goal of further research in this field is discussed.
Counter-current chromatography;Instruments improvement;Solvent systems;Chiral separation;Review
20 September 2015;accepted 2 December 2015)
10.11895/j.issn.0253-3820.150746
2015-09-20收稿;2015-12-02接受
本文系国家自然科学基金资助项目(No.21532005)
*E-mail:panyuanjiang@zju.edu.cn
