超高效液相色谱-串联质谱测定动物肌肉组织中32种β-激动剂、β-阻滞剂和糖肽类抗生素药物残留
2016-11-01韩婉清吴楚森吴玉銮冼燕萍罗海英
韩婉清 吴楚森 吴玉銮 董 浩 王 莉 王 斌 冼燕萍 罗海英
(广州质量监督检测研究院,国家加工食品质量监督检验中心(广州),广州市食品安全检测技术重点实验室,广州市食品安全风险动态监测与预警研究中心,广州 510000)
超高效液相色谱-串联质谱测定动物肌肉组织中32种β-激动剂、β-阻滞剂和糖肽类抗生素药物残留
韩婉清 吴楚森 吴玉銮 董 浩 王 莉 王 斌 冼燕萍 罗海英*
(广州质量监督检测研究院,国家加工食品质量监督检验中心(广州),广州市食品安全检测技术重点实验室,广州市食品安全风险动态监测与预警研究中心,广州 510000)
建立了同时测定动物肌肉组织中27种β-激动剂、3种β-阻滞剂和2种糖肽类抗生素的超高效液相色谱-串联质谱(UPLC-MS/MS)方法。样品经酶解、蛋白沉淀后,以乙酸乙酯-异丙醇(6∶4,V/V)提取,Starata-X-C固相萃取净化,BEH C18色谱柱分离,乙腈-0.1%甲酸梯度洗脱,串联质谱ESI+电离,多反应监测模式检测,外标法定量。结果表明,32种目标物在线性范围内相关性良好(R2>0.995),多巴胺、瑞普特罗、万古霉素和去甲万古霉素的方法检出限为5 μg/kg,其它目标物的检出限为3 μg/kg;平均加标回收率为83.6% ~103%,相对标准偏差(n=6)为3.9%~10.4%,日间精密度为4.5%~9.8%。结果表明,本方法准确、灵敏,适用于动物肌肉组织中β-激动剂、β-阻滞剂,以及糖肽类抗生素的高通量测定。
β-激动剂;β-阻滞剂;糖肽类抗生素;动物肌肉;超高效液相色谱-串联质谱法
1 引言
β-激动剂俗称“瘦肉精”,主要作为促生长剂被添加到动物饲料中,长期食用含此类药物残留的畜禽产品可能会引起肌肉振颤、心悸、紧张等症状[1,2],多个国家和地区已禁止将β-激动剂用于畜禽生产[3~5]。β-阻滞剂是一类能拮抗神经递质和儿茶酚胺对β-受体激动作用的药物,常在动物运输或屠宰前数小时内使用,以降低动物因应激而造成的突然死亡率及对动物肉质的影响,残留风险较大,欧盟和国际食品安全法典委员会已对动物组织中β-阻滞剂卡拉洛尔的残留做了限量规定[6,7](猪肌肉为5 μg/kg,猪肝、肾为25 μg/kg)。万古霉素和去甲万古霉素属于糖肽类抗生素,用于治疗细菌感染,我国农业部第560号公告规定万古霉素为禁用兽药[8]。
虽然目前已有动物尿液、血液和肌肉组织中β-激动剂[9~13]、β-阻滞剂[14]和糖肽类抗生素[15]残留的检测方法研究,但检测对象多为单一的一类药物,没有同时检测这3类药物的研究。因此,建立了同时检测动物肌肉中β-激动剂、β-阻滞剂和糖肽类抗生素的高通量方法,有利于提高检测效率,降低检测成本。
本研究以动物肌肉组织为基质,经酶解和蛋白沉淀后,以乙酸乙酯-异丙醇混合溶剂提取,固相萃取技术净化,超高效液相色谱-串联质谱检测,建立同时测定动物肌肉组织中27种β-激动剂、3种β-阻滞剂和2种糖肽类抗生素的高通量方法。本方法具有较高的灵敏度和选择性,不易受基质干扰,能实现准确的定性和定量分析,可满足对肉类食品中β-激动剂、β-阻滞剂和糖肽类抗生素监管[3~8]的要求。
2 实验部分
2.1 仪器与试剂
ACQUITYTM超高效液相色谱和Waters XevoTMTQ MS三重四极杆串联质谱仪(UPLC-MS/MS,美国Waters公司);5418高速离心机(德国Eppendorf公司);T18均质器(德国IKA公司,);MS3 basic漩涡混合器(德国IKA公司);N-EVAP 112水浴氮吹仪(美国OA公司);Milli-Q去离子水发生器(美国Millipore公司);20pos固相萃取装置(美国Waters公司,);Strata-X-C固相萃取柱(200 mg/3 mL,美国Phenomenex公司)。
β-激动剂(多巴胺、奥西那林、卡布特罗、齐帕特罗、特布他林、沙丁胺醇、西马特罗、丙卡特罗、瑞普特罗、非诺特罗、赛布特罗、克伦塞罗、莱克多巴胺、氯丙那林、克伦普罗、福莫特罗、妥布特罗、克伦特罗、溴代克伦特罗、班布特罗、溴布特罗、苯氧丙酚胺、马布特罗、马喷特罗、苯乙醇胺A、沙美特罗、喷布特罗),β-阻滞剂(美托洛尔、卡拉洛尔、普萘洛尔),糖肽类抗生素(万古霉素、去甲万古霉素),纯度均大于98. 0%(德国Dr.Ehrenstorfer公司)。β-葡糖醛酸苷肽酶(98000 unit/mL,美国Sigma公司);甲醇、乙腈、乙酸乙酯、异丙醇、甲酸(色谱纯,ThermoFisher公司);HClO4,NaOH,NaCl(分析纯,广州化学试剂厂)。
准确称取10.0 mg标准物质,用甲醇溶解并定容至10.0 mL,配成单标标准储备液(1.0 mg/mL),-18℃恒温避光保存。分别吸取适量的单标标准储备液,用甲醇逐级稀释成1.0 mg/L的混合标准溶液,置于4℃恒温避光保存,临用时,用甲醇稀释成所需浓度的混合标准工作液。
2.2 样品提取[16]
称取已均质的试样2.0 g于50 mL塑料离心管中,加入8 mL乙酸-乙酸钠缓冲液(pH=5.2)和50 μL β-葡糖醛酸苷肽酶,涡旋混匀,37℃振荡酶解16 h。取出冷却至室温,8000 r/min离心5 min,转移上清液并加入5 mL 0.1 mol/L HClO4,用HClO4调节至pH 1.0±0.2,8000 r/min离心5 min后转移上清液,并用10 mol/L NaOH溶液调节pH至9.5±0.5,加入2 g NaCl和10 mL乙酸乙酯-异丙醇(6∶4,V/V),涡旋振荡10 min,8000 r/min离心5 min,收集上清液,40℃水浴氮吹至近干,用5 mL 2%甲酸复溶残渣,待净化。
2.3 样品净化
依次用3 mL甲醇、水、2%甲酸溶液活化Strata-X-C固相萃取柱,待净化液过柱后,依次用3 mL 2%甲酸溶液、甲醇淋洗柱子,负压抽干,用6 mL 3% 氨水-甲醇溶液洗脱,收集洗脱液,40℃水浴氮吹至近干,0.1%甲酸甲醇溶液复溶残渣并定容至1 mL,过0.22μm滤膜,供UPLC-MS/MS测定。
2.4 测定条件
BEH C18色谱柱(100 mm ×2.1 mm,1.7μm);流动相:A.0.1%甲酸(体积分数),B.乙腈,梯度洗脱程序:0.0~1.0 min,95%A;1.0~2.5 min,95%~75%A;2.5~6.0 min,75%~10 A;6.0~7.0 min,10%A;7.0~7.1 min,10% ~95%A;7.1~10 min,95%A。流速:0.25 mL/min;进样量:2 μL;柱温:35℃。32种待测物的保留时间见表1。
质谱条件:ESI正模式分段扫描,毛细管电压1.0 kV;离子源温度150℃;去溶剂气温度400℃;去溶剂气:氮气,13.3 L/min;锥孔气:氮气,0.83 L/min;碰撞气:高纯氩气,0.15 mL/min;检测模式:多反应监测(MRM);其它质谱参数见表1,离子对驻留时间0.01 s。
3 结果与讨论
3.1 质谱条件的优化
根据目标物的化学结构,选择ESI(+)的电离模式,对目标物进行一级质谱扫描,β-激动剂和β-阻滞剂可获得较高响应的母离子[M+H]+,糖肽类抗生素则产生双电荷离子[M+2H]2+。对确定的母离子进行二级质谱扫描,通过优化碰撞电压,使选定的特征碎片离子强度达到最大,经优化的质谱条件见表1。根据目标物的保留时间设定分段扫描,以增加采集点数。分析目标物的二级离子碎片可见,β-激动剂和β-阻滞剂产生包括与羟基、叔丁基、异丙基、异丙氨基基团相关的中性丢失碎片,产生[M+H-18]+、[M+H-56]+、[M+H-74]+等碎片离子;β-阻滞剂结构中均含有-CH2-CH (OH)-CH2-NH-CH-(CH3)2,因此都有m/z=116离子峰。
3.2 液相条件的优化
β-激动剂和β-阻滞剂为碱性化合物,万古霉素和去甲万古霉素为两性化合物,实验比较了BEH C18(100 mm×2.1 mm,1.7μm)、BEH HILIC(100 mm×2.1 mm,1.7μm)和Phenomenex PFP(50 mm×3 mm,2.6μm)色谱柱的分离效果。HILIC柱对含有酚羟基的苯酚型β-激动剂分离效果较好,但其它目标物的峰型较差,部分目标物出现严重的拖尾现象,且万古霉素和去甲万古霉素的响应较低;PFP柱虽能满足目标物的分离,但沙丁胺醇、苯氧丙酚胺和莱克多巴胺出现色谱峰分裂现象;BEH C18柱以桥式亚乙基杂化硅胶为基质,可避免硅醇残基与目标物的叔胺基发生氢键相互作用而导致色谱峰拖尾、保留时间不稳定等现象。因此,本实验采用BEH C18色谱柱,各目标物的峰型和响应都较理想。
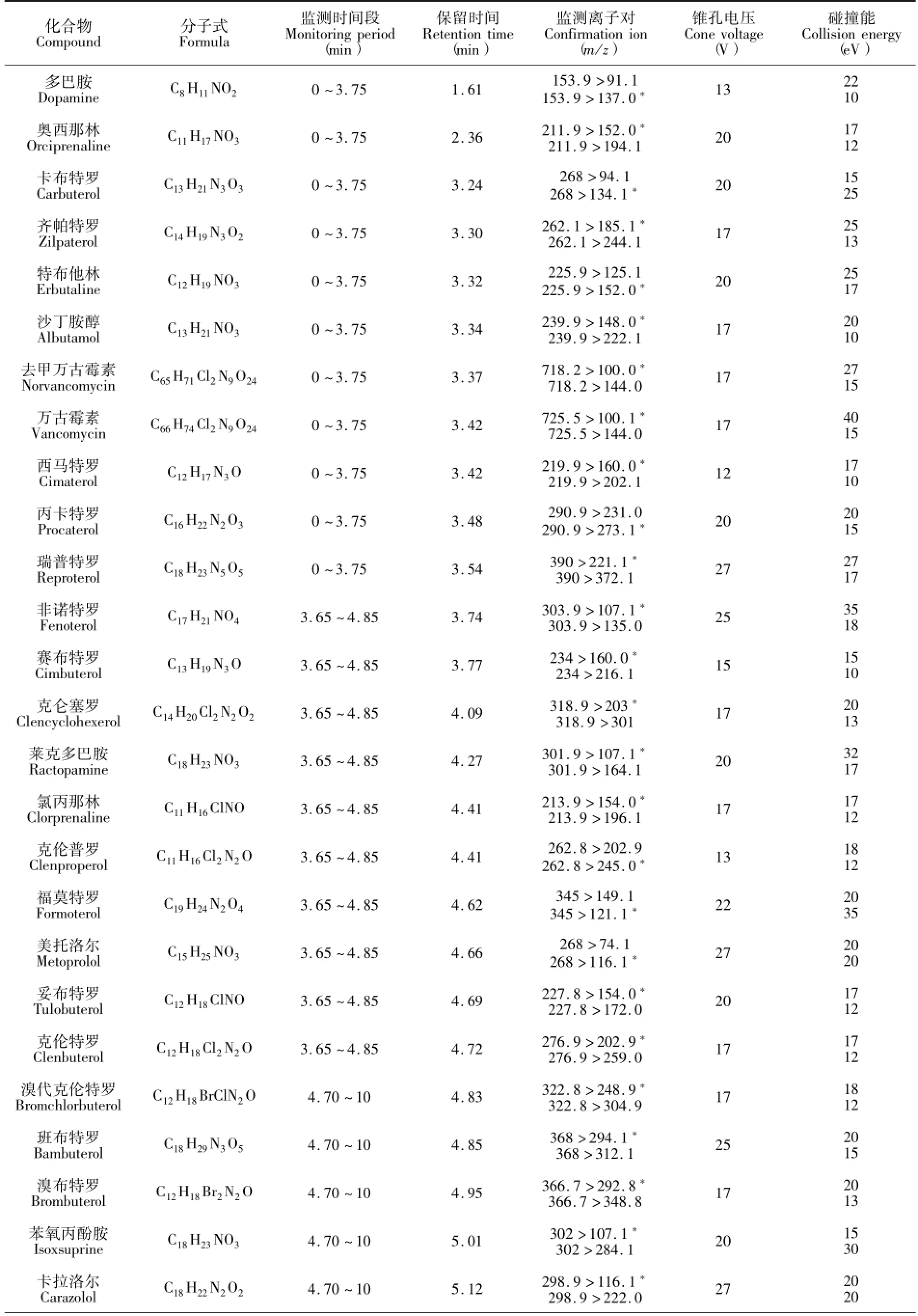
表1 32种待测物的保留时间和质谱分析条件Table 1 Retention time and MS parameters for the analysis of 32 target compounds
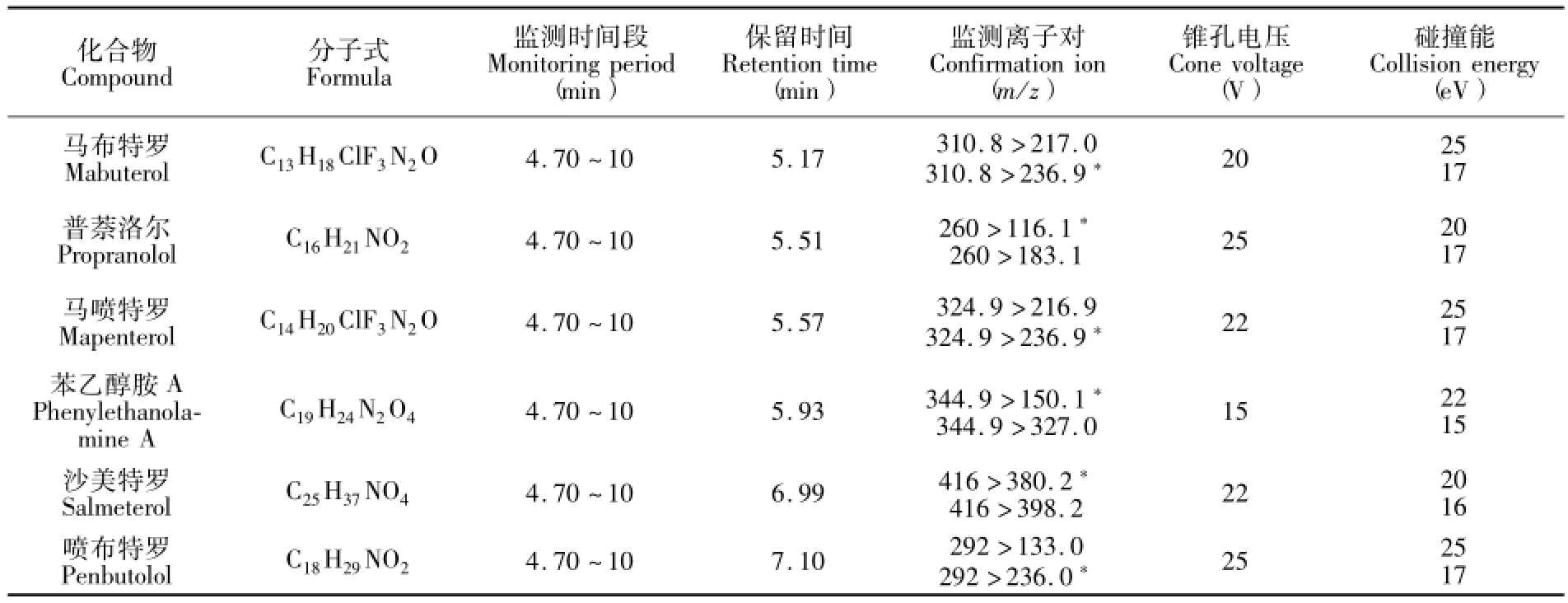
续表1(Continued to Table 1)
流动相的有机相选择乙腈,各目标物的响应和分离效果比甲醇更理想。水相中加入适当浓度的甲酸(0.1%,V/V),可提高离子化效率。通过优化梯度洗脱程序使各目标物的峰型和响应值满足检测要求。
3.3 提取条件的优化
3.3.1 水解方式的选择动物组织中β-激动剂以游离和轭合物两种形式存在,其中苯胺型β-激动剂极性中等,轭合反应率较低,可直接用溶剂提取;而苯酚型β-激动剂由于含有胺基和酚羟基,极性高,主要以轭合物形式存在,难以被有机溶剂提取,样品需先水解,使待测物游离。本实验比较了葡萄糖醛酸酶和5%三氯乙酸的水解效果,结果表明,酶解和酸解对β-激动剂和β-阻滞剂的加标回收率没有明显影响;但对于糖肽类抗生素,酶解的加标回收率更好(酶解为75%~86%,酸解为23%~34%),因此本实验选择酶解。
3.3.2 提取溶剂的选择体系用HClO4沉淀蛋白后,β-激动剂以盐形式存在,提取前需调节体系至碱性,使目标物游离[17]。实验比较了pH 7~13时,加标20 μg/kg的阴性猪肉基质的提取效率(见图1)。结果表明,对于苯胺型β-激动剂(图1A),当pH=8~12时,提取效率均大于75%;对于苯酚型β-激动剂(图1B),尤其是特布他林等二酚型药物,只有在pH 9~10间提取效率才能高于80%;对于其它目标物(图1C),当pH<10时,提取效率受溶液pH值影响较小。因此,为获得满意的提取效率,提取前先调节体系至pH 9.5±0.5。

图1 目标物在不同pH值条件下的萃取效率Fig.1 Extraction effect of target compounds at different pH value
实验比较了10mL乙酸乙酯(EtAC)、乙酸乙酯-异丙醇(EtAC-IPA,6∶4,V/V)和乙酸乙酯-叔丁基甲醚(EtAC-MTBE,5∶54,V/V)作为提取溶剂对加标20 μg/kg的阴性猪肉样品的提取效率(见图2),结果表明,异丙醇-乙酸乙酯的提取效率优于其它两种溶剂,尤其对沙丁胺醇、特布他林等强极性化合物。因此,本实验采用乙酸乙酯-异丙醇(6∶4,V/V)作为提取溶剂。提取前在体系中加入NaCl至饱和,可防止体系乳化,促进水相和有机相的分层。

图2 不同溶剂对目标物(20μg/kg)的提取效率,体系pH=9.5±0.5Fig.2 Extraction effects of different kinds of solvent.Spiked concentration of targets(20 μg/kg),pH 9.5±0.5
3.4 净化条件的选择
比较了固相萃取柱Oasis HLB(Waters,150 mg/3 mL)、Strata-X-C(Phenomenex,200 mg/3 mL)和AROMATIC SULFONIC ACID(J.T Baker,200 mg/3 mL)对加标20 μg/kg的阴性猪肉样品的净化回收率(见图3)。结果表明,糖肽类抗生素在HLB柱的回收率最好,β-激动剂和β-阻滞剂经Strata-X-C净化后的总体回收率最理想。Strata-X-C是混合型阳离子交换反相柱,在酸性条件下,具有苯乙醇胺母核结构的β-激动剂和β-阻滞剂能与H+结合形成阳离子,被Strata-X-C柱的填料吸附,从而具有较高的选择性,回收率都较好。因此,综合考虑,本实验采用Strata-X-C柱进行净化。
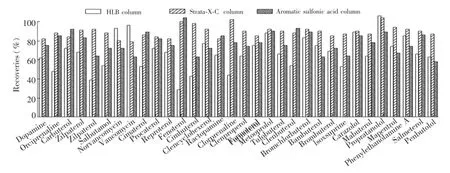
图3 目标物(20 μg/kg)经不同固相萃取柱净化的回收率。淋洗液:HLB柱为2%甲酸-甲醇,Strata-X-C 和Aromatic Sulfonic Acid柱为3%氨水-甲醇溶液Fig.3 Recoveries of target compounds(20 μg/kg)after purification with different SPE cartridges.Eluent:methanol with 2%formic acid for HLB column,methanol with 3%ammonium hydroxide for Strata-X-C and Aromatic sulfonic acid columns
3.5 线性关系,方法检出限、回收率与精密度
本实验采用Matusewaki等建立的基质效应确认方法[18]显示存在基质增强效应,因此采用基质匹配校准曲线进行定量分析。用阴性猪肉样品基质提取液配制系列基质匹配标准工作液,其中多巴胺、瑞普特罗、万古霉素和去甲万古霉素的浓度为10,20,50,100,200和500 μg/L,其它目标物的浓度为5,10,20,50,100和200 μg/L,按优化的仪器条件进行检测,以质量浓度为横坐标(x),目标物定量离子对峰面积为纵坐标(y)作标准曲线,得到各目标物的线性方程和相关系数(R2),并计算方法检出限(LOD,S/N=3)。32种目标物的线性回归方程和相关系数见表2。结果表明,各目标物线性相关系数大于0.995。多巴胺、瑞普特罗、万古霉素和去甲万古霉素的线性范围为10~500 μg/L,方法检出限为5 μg/kg,其它目标物的线性范围为5~200 μg/L,方法检出限为3 μg/kg,能满足限量检测[6,7]要求。
取阴性猪肉样品进行2个水平的加标回收实验,6次平行实验的结果见表2。各目标物的平均回收率为83.6%~103%;相对标准偏差(RSD,n=6)为3.9%~10.4%,日间精密度为4.5%~9.8%。

表2 回收率和精密度测定结果Table 2 Determination results of recoveries and precisions

续表2(Continued to Table 2)
3.6 实际样品的分析
采用本方法测定了当地市场销售的猪、牛、羊、鸡肌肉各5例,均未检出上述32种目标化合物。
4 结论
本实验建立了超高效液相色谱-串联质谱(UPLC-MS/MS)同时测定动物肌肉中27种β-激动剂、3种β-阻滞剂和2种糖肽类抗生素残留的方法,样品经酶解、蛋白沉淀后,以乙酸乙酯-异丙醇(6∶4,V/V)混合溶液提取,Strata-X-C固相萃取净化,通过优化色谱、质谱条件,获得较高的灵敏度和准确度,本方法回收率和精密度良好,适用于动物肌肉中β-激动剂、β-阻滞剂、糖肽类抗生素的同时测定。
1 Willams P EV,Pagliani L,Innes G M,Pennie K,Harris C I,Garthwaite P.Br.J.Nutr.,1987,57(3):417-428
2 Brockway J M,MacRae J C,Williams P EV.Vet.Rec.,1987,20:381-383
3 Ministry of Agricultrue.No.176 Bulletin of the Ministry of Agriculture of the People′s Republic of China.http://www.moa. gov.cn/zwllm/tzgg/gg/201104/t20110422_1976307.htm
农业部.中华人民共和国农业部公告第176号
4 Ministry of Agriculture.No.1519 Bulletin of the Ministry of Agriculture of the People′s Republic of China.http://www. moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976294.htm
农业部.中华人民共和国农业部公告第1519号.
5 European Community.Council Directive 96/23/EC of 29 April 1996 on Measures to Monitor Certain Substances and Residues Thereof in Live Animals and Animal Products and Repealing Directives 85/358/EEC and 86/469/EEC and Decisions 89/187/EEC and 91/664/EEC
6 CODEX Alimentarus.Veterinary Drug Residues in Food.http://www.codexalimentarius.net/vetdrugs/data/vetdrugs/ index.html
7 Commission Regulation(EU)37/2010
8 Ministry of Agriculture.No.1519 Bulletin of the Ministry of Agriculture of the People′s Republic of China.http://www. moa.gov.cn/zwllm/tzgg/gg/200511/t20051117_496523.htm
农业部.中华人民共和国农业部公告第560号
9 LI Xiao-Min,GAO Yan,SU Xiao-Ou,LI Yang,WANG Rui-Guo,ZHANG Yu,FU Jian-Jie.Chinese J.Anal.Chem.,2014,42(12):1779-1784
李晓敏,高燕,苏晓鸥,李阳,王瑞国,张瑜,傅建捷.分析化学,2014,42(12):1779-1784
10 Sheu S Y,Lei Y C,Tai Y T,Chang T H,Kuo T F.Anal.Chim.Acta,2009,654(2):148-153
11 BIAN Kui,LIN Tao,LIU Min,YANG Jian-Wen,WANG Zong-Nan,HE Li-Min.Chinese Journal of Chromatography,2014,32(2):162-168
卞愧,林涛,刘敏,杨建文,王宗楠,贺利民.色谱,2014,32(2):162-168
12 LIU Jia,XIE Yun-Feng,REN Dan-Dan,CUI Xing-Pin,LIANG Gui-Rong,YANG Yong-Tan.Chinese J.Anal.Chem.,2014,42(10):1486-1492
刘佳,谢云峰,任丹丹,崔兴品,梁桂荣,杨永坛.分析化学,2014,42(10):1486-1492
13 Mauro D,Ciardullo S,Civitareale C,Fiori M,Pastorelli A A,Stacchini P,Palleschi G.Microchem.J.,2014,115:70-77
14 ZHANG Hong-Wei,XU Hui,GAO Jian-Guo,LIANG Cheng-Zhu,XU Biao,GENG Juan,WANG Feng-Mei,ZHANG Xiao-Mei,CHENG Gang.Chinese Journal of Chromatography,2014,32(6):573-581
张鸿伟,徐辉,高建国,梁成珠,徐彪,耿娟,王凤美,张晓梅,程刚.色谱,2014,32(6):573-581
15 XIAN Yan-Ping,CHEN Li-Wei,LUO Hai-Ying,GUO Xin-Dong,WU Yu-Luan,LUO Dong-Hui,HOU Xiang-Chang. Journal of Instrumental Analysis,2013,32(2):162-167
冼燕萍,陈立伟,罗海英,郭新东,吴玉銮,罗东辉,侯向昶.分析测试学报,2013,32(2):162-167
16 GB/T 22952-2008,Determination of amoxicillin,ampicillin,piperacillin,penicillin G,penicillinV,oxacillin,cloxacillin,nafcillin,dicloxacillin,residues in fugu and eel-LC-MS-MS method.National Standards of the People′s Republic of China
河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林残留量的测定液相色谱-串联质谱法.中华人民共和国国家标准.GB/T 22952-2008
17 ZHU Jian,LI Bo,FANG Xiao-Ming,CHEN Jia-Hua,YANG Jing-Xian.J.Chinese Mass Spectr.Soc.,2005,26(3):129-137
朱坚,李波,方晓明,陈家华,杨景贤.质谱学报,2005,26(3):129-137
18 Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal.Chem.,2003,75(13):3019-3030
The work was supported by the International Science and Technology Cooperation Projects of National(No.2013DFH30070)
Analysis of 32 Kinds of β-Agonists,β-Blockers and Glycopeptide Antibiotics in Animal Meat by UPLC-MS/MS
HAN Wan-Qing,WU Chu-Sen,WU Yu-Luan,DONG Hao,WANG Li,WANG Bin,XIAN Yan-Ping,LUO Hai-Ying*
(Guangzhou Quality Supervision and Testing Institute,National Centre for Quality Supervision and Testing of Processed Food(Guangzhou),Guangzhou Key Laboratory of Detection Technology for Food Safety,Guangzhou Research Centre of Risk Dynamic Detection and Early Warning for Food Safety,Guangzhou 510000,China)
A high-throughput method was established for the simultaneous determination of 27 kinds of β-agonists,3 kinds of β-blockers and 2 kinds of glycopeptide antibiotics in animal meat by ultra-high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS).The sample underwent enzymolysis and the protein precipitation treatment was extracted with a mixture of ethyl acetate-isopropanol (6∶4,V/V),and cleaned up at a Strata-X-C solid phase extraction cartridge.The 32 targets were separated on a Waters BEH C18column by gradient elution with acetonitrile-0.1%formaic acid as mobile phase,ionized with positive electrospray ionization(ESI+),detected under multiple reaction monitoring mode,and quantified with external standard method.The results showed that the target compounds displayed excellent linearity in the concentration of 5-500 μg/L with correlation coefficients larger than 0.995.The limits of detection were 5 μg/kg for dopamine,reproterol,vancomycin and norvancomycin,and were 3 μg/kg for the others.The average recoveries were in the range of 83.6%-103.0%at two spiked levels.The intra-day RSDs were ranged from 3.9%to 10.4%,and the inter-day RSDs were no more than 9.8%.The developed method was accurate and sensitive,and was suitable for the high-throughput quantitative and qualitative analysis of β-agonists,β-blockers and glycopeptide antibiotics in animal meat.
β-Agonist;β-Blocker;Glycopeptide antibiotic;Animal meat;Ultra-high performance liquid chromatography-tandem mass spectrometry
20 October 2015;accepted 13 November 2015)
10.11895/j.issn.0253-3820.150830
2015-10-20收稿;2015-11-13接受
本文系国家科技部港澳台科技合作专项基金资助(No.2013DFH30070)
*E-mail:tio2yy@126.com
