惠州地区妇女宫颈感染高危型人乳头瘤病毒调查*
2016-11-01刘宇鹏余小燕吴立红刘瑞玉
刘宇鹏,余小燕,吴立红,刘瑞玉
(1.南方医科大学第二临床医学院,广州 510515;2.广东省惠州市中心人民医院检验中心 516001;3.广东医科大学检验系,广东湛江 524001)
·经验交流·doi:10.3969/j.issn.1671-8348.2016.26.029
惠州地区妇女宫颈感染高危型人乳头瘤病毒调查*
刘宇鹏1,余小燕2#,吴立红3,刘瑞玉2△
(1.南方医科大学第二临床医学院,广州 510515;2.广东省惠州市中心人民医院检验中心516001;3.广东医科大学检验系,广东湛江 524001)
目的研究高危型HPV-DNA检测负荷量与宫颈病变程度的相关性。方法分析2013年1月至2014年12月就诊于惠州市中心人民医院妇科(门诊和住院)并采用第二代基因杂交捕获法检测高危型HPV-DNA的患者9 917例,从中筛选出1 209例检测结果为阳性的患者,并同时行液基细胞学检查(TCT)。结果(1)9 917例样本中,HPV感染率12.19%,21~50岁年龄段感染率总体高于其他年龄段(P<0.05)。(2)1 209例高危型HPV-DNA阳性患者中,细胞学诊断:未见上皮内病变835例(69.07%),炎性反应细胞改变179例(14.81%),ASC 33例(2.73%),LSIL 59例(4.88%),HSIL 103例(8.52%)。将高危型HPV-DNA检测结果阳性负荷量分为1~100、101~300、301~600、601~1 000、>1 000 pg/mL组,看不同TCT结果的负荷量分布情况,可见每组的比率并不完全随宫颈病变的加重而呈递增趋势。(3)宫颈细胞学病变程度与HR-HPV-DNA负荷量相关系数r=0.245(P<0.01)。结论高危型HPV-DNA负荷量与宫颈病变程度并不完全相符,高危型HPV-DNA负荷量并不能作为预测宫颈病变严重程度的指标。
人乳头瘤病毒;液基细胞学检查;高危型HPV-DNA负荷量;宫颈病变程度;第二代基因杂交捕获法
人乳头瘤病毒(HPV)与许多疾病有关,包括湿疣、Bowen氏病样丘疹及宫颈、阴道和外阴内上皮瘤病变和癌瘤[1]。宫颈癌约居女性最常见的癌症中第二位。全球每年的新发病例约52.98万,死亡病例约25.51万,85%发生在发展中国家[2]。研究认为高危型人乳头瘤病毒(HR-HPV)的持续感染是宫颈癌的主要致病因素,其中HPV16和HPV18是最常见的高危型别,70%~75%的浸润性宫颈癌与其有关[3]。目前,杂交捕获法Ⅱ(hybrid capture Ⅱ,HCⅡ)在临床上已经得到普及。HPV分型技术成为国内外的研究热点,而我国宫颈癌的发病率和死亡人数约占全世界1/3~1/4。HPV中引起高度病变的HR-HPV是公认的引起宫颈癌的危险因素[4-5]。检测宫颈HR-HPV已成为预防女性宫颈癌的关键之一。本文通过对9 917例14~96岁妇女行第2代基因杂交捕获技术(HC2-HPV-DNA),从中筛选出1 209例检测结果为阳性的患者,并同时行液基细胞学检查(TCT)。两种方法联合检测,以研究本地区妇女HR-HPV感染与宫颈病变的相关性,现将检测结果报道如下。
1 资料与方法
1.1一般资料病例来源于2013年1月至2014年12月于惠州市中心人民医院妇科就诊的女性患者(包括门诊及住院)9 917例,年龄14~96岁,平均(36.6±5.2)岁,采用HCⅡ法进行高危型HPV-DNA检测,从中筛选出1 209例HR-HPV阳性、并同时行薄层液基细胞学检查的患者进行分析。
1.2仪器与试剂
1.2.1HPV-DNA高危型检测试剂盒(购自惠州市卫康中西药业有限公司),采用HCⅡ-HPV-DNA检测法,按说明书操作,基因杂交捕获仪DML2000均购自美国Digene公司;指示剂染料、变性试剂、探针稀释剂、高危型HPV探针、低危型HPV质控样本、高危型质控样本、阴性对照、高危型HPV校准品、捕获酶标板、检测试剂1、检测试剂2和洗涤用缓冲浓缩液。
1.2.2液基细胞沉降式自动制片染色系统LBP-2601型购自广州安必平公司;试剂分别有细胞保存基液、细胞分离提取液、黏液稀释液、细胞黏附剂和抗凝剂。
1.3方法
1.3.1HR-HPV-DNA检测一次性检测13种HR-HPV-DNA(包括16、18、31、33、35、39、45、51、52、56、58、59和68型),但不能单一分型。任何1种HR-HPV-DNA高于阈值均视为检测阳性。检测步骤:(1)碱性溶液破坏病毒DNA双链,释放并分解为核苷酸单链;(2)DNA单链与RNA探针结合为RNA-DNA杂交复合体;(3)第一抗体(特异性抗体)将RNA-DNA杂交复合体固定在微孔壁上;(4)结合有碱性磷酸酶的多个第二抗体与RNA-DNA杂交复合体结合是信号放大;(5)碱性磷酸酶使酶底物发光,判读荧光强弱可确定碱性磷酸酶的水平从而确定RNA-DNA的水平;(6)结果判定,以标本的相对荧光光度值(relative light unit,RLU)与阳性定标阈值(cut off,CO)的比值表示,RLU/CO≥1.0 pg/mL为阳性,<1.0 pg/mL为阴性 。
1.3.2薄层液基细胞学检查将宫颈刷插入宫颈管,外侧毛刷抵住宫颈外口,力度适中的推向宫颈,并按顺时针方向旋转3~5圈。把宫颈刷取下放入装有保存液的小瓶中,标明患者姓名、年龄、取样日期(常温下能保存1个月)。经“振荡-不同转速离心两次-振荡-静置”后,置于自动制片机上制成片,制成的涂片用H-E染色,用中性树胶封片并干燥,显微镜下观察细胞改变。按宫颈细胞学报告结果命名(TBS)分级标准,宫颈病变分为良性反应性细胞改变和宫颈上皮内病变,宫颈鳞状上皮内病变包括:未明确意义的非典型鳞状细胞(atypical squamous cells,ASC)、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)。
1.4统计学处理所有资料经SPSS17.0软件进行统计分析。采用多个样本率比较的χ2检验对不同年龄段HPV感染阳性率差别进行统计分析。采用多个独立样本比较的Kruskal-WallisH检验(秩转换的非参数检验)对HR-HPV阳性患者不同TCT组别的HPV-DNA负荷量的分布情况进行比较。另外,采用Spearman等级相关分析(线性趋势检验)对宫颈细胞病理病变程度与HR-HPV-DNA负荷量之间相关性进行分析,并计算等级相关系数(rs),检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1HPV感染率与年龄的关系9 917份患者样本中HR-HPV-DNA阳性1 209例,占12.19%;HPV感染年龄(37.4±10.2)岁,其中>20~50岁年龄段HPV(+)感染人数占总感染人数的90.32%。14~20岁和>60岁这两组HPV感染率最高,均大于21.05%,>20~60岁较低,占9.72%~16.78%,呈“正U字形”双峰分布,各年龄组间的HPV感染率差异有统计学意义(χ2=61.12,P<0.01)。由于14~20、>50~55、>55~60、>60岁这4组人数较少不便评价,其他各年龄组比较,经χ2检验,>20~50岁组间的HPV感染率差异有统计学意义(χ2=20.153,P<0.05)。见表1。
2.2不同级别宫颈细胞病理学改变与HR-HPV-DNA负荷量的相关性1 209例HR-HPV阳性患者中,未见上皮内病变(negative for intraepi-thelial lesion,NILM)者为835例(69.07%),炎性反应细胞改变者为179例(14.81%),ASC 33例(2.73%),LSIL 59例(4.88%),HSIL 103例(8.52%)。将HR-HPV-DNA检测结果阳性负荷量分为1~100、101~300、301~600、601~1 000、>1 000 pg/mL组,看不同TCT结果的负荷量分布情况。NILM 组、炎症组、ASC组、LSIL组和HSIL组的HPV病毒负荷量差异具有统计学意义(χ2=111.0,P<0.01)。TCT各组平均秩为NILM 组(563.15),炎症组(576.2),ASC组(714.62),LSIL组(823.35)与HSIL组(834.04)间比较HR-HPV-DNA负荷量平均秩差异有统计学意义(P<0.05),其负荷量平均秩从小到大排列顺序为NILM组、炎症组、ASC组、LSIL组、HSIL组。因此HR-HPV-DNA负荷量随宫颈病变的加重而呈递增趋势,HR-HPV-DNA负荷量与宫颈病变程度并不完全相符。见表2。
2.3宫颈病变程度与HR-HPV-DNA负荷量相关性分析将宫颈细胞病理学检查结果NILM 组、炎症组、ASC组、LSIL组与HSIL组按病变分级程度与HR-HPV-DNA负荷量进行Spearman等级相关分析(线性趋势检验),经χ2检验,线性回归分量差异有统计学意义(χ2=100.11,P<0.01)。等级相关系数rs=0.245(P<0.01),说明HR-HPV-DNA负荷量与细胞病理学不同病变程度之间有一定相关性,但相关程度不显著。

表1 不同年龄HPV感染率
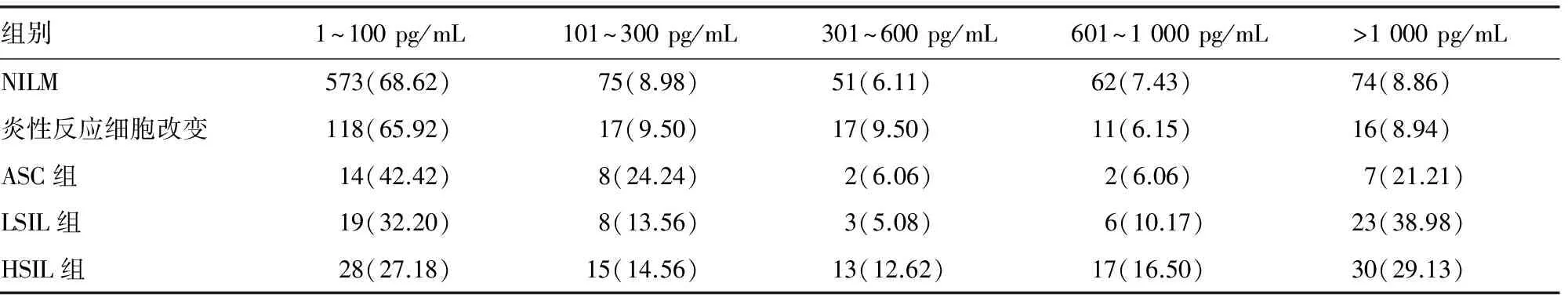
表2 高危型HPV阳性患者不同TCT组别的HPV-DNA负荷量的分布情况[n(%)]
3 讨 论
高危型HPV感染已成为当前最常见的性传播疾病,宫颈癌是妇科肿瘤中仅次于乳腺癌的第二大恶性肿瘤,HPV已明确为宫颈癌的病因,因此HR-HPV 感染已逐渐受到人们的极大关注[6-7]。HR-HPV感染与宫颈癌的发生有直接的联系,由于HR-HPV感染引起的疾病通常有很长的潜伏期,如果能及早发现HR-HPV感染,并及时治疗,则可有效预防和控制宫颈癌的发生。目前,HPV筛查仍是预防和控制宫颈癌的主要手段。HCⅡ是目前唯一获美国FDA 认证的HPV-DNA检测方法,可以同时检测引起子宫颈癌的13个HR-HPV。是目前检测HR-HPV 感染的主要方法,也是筛查宫颈癌及癌前病变发生的重要指标[8]。采用HCⅡ检测HR-HPV 感染能直观发现宫颈疾病患者,还能筛选出其中的高危人群。
本文研究9 917例患者样本中HR-HPV-DNA阳性1 209例,占12.19%,其中21~50岁年龄段HPV(+)感染人数占总感染人数的90.32%。各年龄段HPV感染率,14~20岁和>60岁这两组最高均大于21.05%,>20~60岁这8组较低占9.72%~16.78%,呈“正U字形”双峰分布。结果与朱木华等[9]研究的结果相近。但由于14~20岁、>50~55、>55~60、>60岁这4组人数较少不便评价,所以根据HPV阳性率分析,>20~50岁年龄段为HPV-DNA阳性感染的优势年龄,这可能与该年龄段女性的性生活最活跃有关。
HPV-DNA病毒具有嗜上皮性、高度组织和宿主特异性,与多种人类肿瘤的发生相关,HR-HPV的持续感染是宫颈上皮恶性转化的最重要危险因素,它能使宫颈癌的发生风险提高250倍,是宫颈癌及癌前病变发生发展的必要条件,HPV感染检测已成为宫颈癌防治中必不可少的筛查内容[10]。HC-Ⅱ检测仅能相对半定量地报告HR-HPV的阳性或阴性,无法鉴别出具体的感染HPV的类型及是否为混合感染。在对HPV阳性的报告进行解读和对HPV阳性患者进行分流时常常给临床医生和HPV感染者带来一定的困惑,但是,HC-Ⅱ检测有着高度的敏感性和阴性预测值,作为HR-HPV的筛查具有重要意义[11]。
HCⅡ本质是基因杂交信号放大技术,无需基因扩增,属于线性级数放大。HCⅡ发现HSIL的灵敏度为95%,明显优于液基细胞学,但是特异度为85%,略低于液基细胞学。对于HPV-DNA负荷量与宫颈病变程度是否正相关这一问题尚无定论,现已知的是HPV-DNA负荷量与治疗后的愈后有关。很多研究表明宫颈病变的演进与高危型HPV 持续感染有明显关系[12-13]。部分研究支持HPV-DNA的检出率随着宫颈病变的加重而增加这一观点[14]。有研究则发现HPV-DNA负荷量与宫颈病变程度无显著相关性Andersson[15]应用PCR在176例CIN患者中检测了高危型HPV-DNA负荷,发现HR-HPV病毒负荷与CIN病变级别没有关系。喻垚等[16]对1 343例患者的统计数据表明,与病理组织结果对照,CIN超过Ⅰ期患者的HSIL和SCC以及HPV-DNA阳性率均较高,并且伴随着病变程度的增高,阳性率也随之增加。然而在HPV阴性患者中,有28%宫颈鳞癌患者,同时在小于或等于ASCUS中仍然也有少量的CINⅡ/Ⅲ,说明单独采用TCT或HPV 检测均有一定的漏检率。2种方法学比较,TCT 具有更高的灵敏度和阳性预测值,而HR-HPV检测具有较高的特异性和阴性预测值。2种方法联合检测其灵敏度、特异性、阴性预测值以及阳性预测值较单独检测均有不同程度的提高。
有研究显示,TCT检测假阴性率仅为0.26%,TCT采用特制颈管刷收集脱落的细胞,几乎保存了所有标本,经程序化处理后制成细胞涂片,固定染色后显微镜下阅片诊断,该法易于观察不正常细胞,且细胞核结构清晰,易于鉴定,大大降低了假阴性率,提高了灵敏度和特异性[17]。本文研究1 209例高危型HPV阳性患者中,未见上皮内病变(NILM)者为835例(69.07%),炎性反应细胞改变者为179例(14.81%),ASC 33例(2.73%),LSIL 59例(4.88%),HSIL 103例(8.52%)。经多个独立样本比较的Kruskal-WallisH检验(秩转换的非参数检验),χ2=111.0,P<0.01。按α=0.05水准,可以认为不同TCT组别(NILM组、炎症组、ASC组、LSIL组和HSIL组)的HPV病毒负荷量差异具有统计学意义(平均秩)。NILM组、炎症组、ASC组、LSIL组与HSIL组间比较HR-HPV-DNA负荷量差异有统计学意义(P<0.05),其负荷量(平均秩)从小到大排列顺序为NILM 组、炎症组、ASC组、LSIL组、HSIL组。将宫颈细胞病理学检查结果按病变分级程度与HR-HPV-DNA负荷量进行Spearman等级相关分析(线性趋势检验),经χ2检验,线性回归分量差异有统计学意义(χ2=100.11,P<0.01)。等级相关系数rs=0.245(P<0.01),提示HR-HPV-DNA负荷量与细胞病理学不同病变程度之间有一定相关性,但相关程度不显著。因此,HR-HPV-DNA负荷量并不完全随宫颈病变程度的加重而呈递增趋势,HR-HPV-DNA负荷量与宫颈病变程度并不完全相符。HPV-DNA阳性的负荷量范围十分广,在ASC、LSIL和HSIL中HPV-DNA负荷量虽然分布重叠较大,但却无法定义高病毒负荷水平。
朱木华等[9]采用PCR方法和TCT检测方法对惠州地区7 796例流动人口育龄妇女HPV感染及宫颈病变的调查研究发现,HPV感染率7.29%,其研究主要感染类型为HPV16、58、52、18型,感染年龄以15~24岁人群最高,宫颈病变发生率及病程度随感染者年龄增加而增加,与本研究结果相近。
综上所述,不同年龄结构之间HR-HPV感染情况不同,且HR-HPV感染病毒负荷量和阳性率呈相关性。HR-HPV-DNA感染检出率具有年龄、地域、种族等也有差异性。通过TCT 和HR-HPV-DNA联合检测可提高宫颈病变诊断的准确性,降低漏诊率,做到早发现,早预防和治疗具有重要价值。HR-HPV-DNA的检出率可能随着宫颈病变程度的加重而增加,但HR-HPV-DNA负荷量并不完全随宫颈病变程度的加重而呈递增趋势,HR-HPV-DNA负荷量与宫颈病变程度并不完全相符,HR-HPV-DNA负荷量并不能作为预测宫颈病变严重程度的指标。
[1]倪颖华,施幼豪.高危型HPV-DNA检测负荷量及其最佳阈值在宫颈癌前病变中的应用研究[J].检验医学,2014,29(5):501-504.
[2]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3]De Sanjose S,Quint WG,Alemany L,et al.Human papillomavirus genotype attribution in invasive cervical cancer:a retrospective cross-sectional worldwide study[J].Lancet Oncol,2010,11(11):1048-1056.
[4]Ylitalo N,Sørensen P,Josefsson AM,et al.Consistent high viral load of human papillomavirus 16 and risk of cervical carcinoma in situ:a nested case-control study[J].Lancet,2000,355(9222):2194-2198.
[5]Dalstein V,Riethmuller D,Prétet JL,et al.Persistence and load of high-risk HPV are predictors for development of high-grade cervical lesions:a longitudinal French cohort study[J].Int J Cancer,2003,106(3):396-403.
[6]杨君,周德平,陈凤娴,等.重庆地区2497例妇科就诊患者HPV感染状况分析[J].重庆医科大学学报,2012,37(4):347-349.
[7]陈琬玲,杨承刚,杨宏英,等.高危型HPV感染与宫颈癌组织中IDO表达的相关性研究[J].山东医药,2010,50(12):23-25.
[8]谢建渝,余娟,董国强.762例妇女宫颈高危型HPV感染与宫颈病变的相关性研究[J].检验医学与临床,2012,20(20):2533-2535.
[9]朱木华,林彩菊,叶淑英,等.广东省惠州地区流动人口育龄妇女人乳头瘤病毒感染及宫颈病变的流行病学调查[J].中国计划生育和妇产科,2014,6(6):25-28.
[10]Parkin DM.The global health burden of infection-associated cancers in the year 2002[J].Int J Cancer,2006,118(12):3030-3044.
[11]程娇影,卞美璐,马莉,等.不同方法检测HPV的临床效果评价[J].中华妇产科杂志,2013,48(8):589-594.
[12]Petry K.HPV and cervical cancer[J].Scand J Clin Lab Invest Suppl,2014,74(2):59-62.
[13]亚力坤·穆罕默德,刘开江.HPV在宫颈炎、宫颈癌前病变、宫颈癌中的检测及意义[J].新疆医科大学学报,2010,33(2):160-162.
[14]严园,周晓.重庆市9 328例宫颈上皮内病变HPV感染型别及危险因素调查[J].重庆医学,2014,43(27):3608-3610,3613.
[15]Andersson S,Safari H,Mints M,et al.Type distribution,viral load and integration status of high-risk human papillomaviruses in pre-stages of cervical cancer (CIN)[J].Br J Cancer,2005,92(12):2195-2200.
[16]喻垚,郭变琴,罗光丽,等.液基细胞学与高危型HPV-DNA联合检测在宫颈病变筛查中的意义[J].检验医学与临床,2015,12(11):1550-1551,1554.
[17]颜萍,龚旭华.高危型 HPV 结合液基细胞学技术在宫颈癌前病变诊断中的应用[J].实用癌症杂志,2014,29(5):519-521.
广东省惠州市科技计划项目(2013y031)。作者简介:刘宇鹏(1993-),本科,主要从事临床医学研究。#共同第一作者:余小燕(1973-),副主任技师,本科,主要从事产前诊断研究。△
,E-mail:liuruiyu301@163.com。
R737
B
1671-8348(2016)26-3694-04
2016-03-11
2016-05-16)
