金骨莲胶囊对兔膝骨关节炎软骨保护作用的研究*
2016-11-01王胜民仲鹤鹤孙鹏鹏
王胜民,刘 毅△,刘 波,桑 鹏,仲鹤鹤,孙鹏鹏
(1.遵义医学院附属医院骨一科,贵州遵义 563000;2.济仁骨科医院关节外科,贵州铜仁 555200)
论著·基础研究doi:10.3969/j.issn.1671-8348.2016.26.004
金骨莲胶囊对兔膝骨关节炎软骨保护作用的研究*
王胜民1,刘毅1△,刘波2,桑鹏1,仲鹤鹤1,孙鹏鹏1
(1.遵义医学院附属医院骨一科,贵州遵义 563000;2.济仁骨科医院关节外科,贵州铜仁 555200)
目的研究中药金骨莲胶囊对兔膝骨关节炎(OA)关节软骨中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)表达水平的影响,探讨其可能作用机制。方法40只家兔分为4组:空白对照组(10只)、模型对照组(10只)、金骨莲胶囊组(10只,74.4 mg·kg-1·d-1)、氨基葡萄糖组(10只,150 mg·kg-1·d-1)。除空白对照组外其余均按改良Hulth法复制OA模型,术后当天开始药物灌胃,对照组仅灌服等量生理盐水,1次/天,连用8周。8周后处死家兔取右膝股骨髁及胫骨平台大体观察。采用Mankin评分评价关节软骨退变情况;采用实时荧光定量PCR(RT-qPCR)法检测股骨内侧髁负重区关节软骨IL-1β、IL-6和TNF-α的mRNA相对表达量。结果空白对照组、金骨莲胶囊组、氨基葡萄糖组和模型对照组Mankin评分分别为(1.380±0.183)、(2.580±0.464)、(5.250±0.143)、(10.380±0.183)分,Mankin评分依次升高,组间比较差异均有统计学意义(P<0.05)。金骨莲胶囊组和氨基葡萄糖组3种炎性因子mRNA表达量均明显低于模型对照组,差异均有统计学意义(P<0.05);中药金骨莲胶囊在下调IL-1βmRNA方面与氨基葡萄糖作用相当,差异无统计学意义(P=0.271)。金骨莲胶囊在降低IL-6和TNF-α mRNA方面优于氨基葡萄糖作用,差异均有统计学意义(P<0.05)。结论中药金骨莲胶囊可不同程度下调关节软骨中IL-1β、IL-6和TNF-α炎症因子的表达,使软骨退变的部分因素得到控制,从而起到保护关节软骨的作用。
骨关节炎;白细胞介素-1β;白细胞介素-6;肿瘤坏死因子-α;金骨莲胶囊
随着社会老龄化,骨关节炎(osteoarthritis,OA)的发生率逐渐升高[1]。OA是以关节软骨的退变、破坏及骨赘形成为主要特征的慢性关节病[2]。西医治疗OA主要是药物、玻璃酸钠注射、手术等治疗,临床上药物治疗主要以氨基葡萄糖为代表来保护关节软骨。OA在祖国医学中属“痹症”范畴[3],肝肾亏损、风寒湿邪、痰淤痹阻为其主要病因;民间治疗OA的药物多为传统中草药组方,效果显著,因此挖掘传统中草药治疗OA是目前研究的焦点。传统中药金骨莲胶囊是一个经典苗药组方,主要由透骨香、汉桃叶和金铁锁等制成,具有消炎、镇痛、软骨基质保护等疗效[4]。目前对金骨莲胶囊的研究大多为其化学成分、药理作用、组织培养等,关于其对OA的保护作用少见报道。2015年1~12月,笔者观察了中药金骨莲胶囊对兔膝OA的软骨保护作用,并探讨其可能作用机制。

表1 引物序列
1 材料与方法
1.1材料
1.1.1动物及仪器健康成年家兔40只,清洁级,体质量2.3~2.9 kg,雌雄不限,由遵义医学院动物实验基地提供;SM2000R型病理组织切片机(德国Leica公司),Olympus LX71-A21PH光学显微镜(北京世纪科信科学仪器有限公司),MICRO 21R型高速冷冻离心机(美国Thermo Scientific公司),ND1000型核酸蛋白测量仪(美国Nanodrop公司),C1000型PCR扩增仪(美国BIO-RAD公司),iCycler iQ荧光定量PCR仪(美国BIO-RAD公司)。
1.1.2主要药物及试剂ZP404离心柱型动物组织/细胞总RNA提取试剂盒(北京庄盟国际生物基因科技有限公司);逆转录试剂盒(PrimeScriptTMRT Reagent Kit),实时荧光定量PCR试剂盒(SYBR Premix Ex TaqTMⅡ)均购于日本TaKaRa公司。金骨莲胶囊(批号:150707,规格:0.25 g×24粒/盒,贵州益佰制药股份有限公司),盐酸氨基葡萄糖片(批号:150905,规格:0.75 g×6片×2片/盒,江苏正大清江制药有限公司),EDTA脱钙液(pH=7.2,北京Solarbio公司)。
1.2方法
1.2.1分组及造模40只健康成年家兔适应性喂养5 d后分为4组:空白对照组、模型对照组、金骨莲胶囊组、氨基葡萄糖组,每组10只。除空白对照组外其余均改良Hulth法造模[5-7]。耳缘静脉注射3%戊巴比妥钠28 mg/kg,术区备皮,常规消毒,行右膝内侧切口,暴露右膝关节腔,切除前交叉韧带及内侧半月板,行抽屉实验确认前交叉韧带已完全断裂;缝合关节腔及皮肤。术后每组每天肌肉注射青霉素钠(20 MU/kg),连用6 d。单笼饲养并每日驱赶1.5 h。
1.2.2动物给药及取材按照《药理实验方法学》体表面积计算方法来折算给药剂量,兔等效剂量为人剂量3.1倍,金骨莲胶囊组和氨基葡萄糖组对应剂量74.4、150.0 mg·kg-1·d-1,总量均为20 mL,分别于造模当天药液灌胃;空白对照组和模型对照组仅灌服等量的生理盐水,1次/天。术后8周空气栓塞处死家兔并取兔右膝股骨髁及胫骨平台,生理盐水冲洗干净大体观察后分别放于液氮(-196 ℃)及10%福尔马林固定,备用。
1.2.3关节软骨Mankin评分标准[8-9]苏木精-伊红(HE)染色:(1)软骨结构评分,关节软骨结构光整如常,0分;软骨结构表面不规则裂隙,1分;软骨血管翳形成,2分;裂隙深达移形层,3分;裂隙深达放射层,4分;裂隙深达钙化层,5分;软骨全层脱落,6分。(2)细胞数量评分,软骨细胞数量如常,0分;数量弥漫性增多,1分;出现大量簇集样细胞团,2分;数量逐渐减少,3分。番红染色:(1)基质评分,关节软骨基质染色正常,0分;染色轻度减退,1分;染色中度减退,2分;染色重度减退,3分;关节软骨基质不着色,4分。(2)潮线评分,关节软骨潮线完整,0分;多重潮线,1分。
1.2.4HE和番红染色10%福尔马林固定右膝胫骨平台7 d,继续用EDTA脱钙液脱钙30 d。常规脱水、剥离关节软骨、石蜡包埋、行5 μm厚度切片,二甲苯Ⅰ、Ⅱ、Ⅲ梯度脱蜡,乙醇梯度水化。HE染色:苏木精染色6 min,盐酸乙醇分化15 s,伊红染色5 min;番红染色:番红染色5 min。二甲苯透明,中性树胶封片,镜检。根据Mankin评分标准评估软骨退变情况。
1.2.5IL-1β、IL-6和TNF-α mRNA的检测[10]总RNA的提取:液氮环境下剥离及研磨关节软骨,严格按照试剂盒说明书操作提取RNA,用ND1000型核酸蛋白测量仪测RNA浓度和纯度。cDNA的合成:按照5×Prime Script Buffer(for Real Time) 4 μL,Prime Script RT Enzyme Mix Ⅰ 1 μL,Oligo dT Primer 1 μL,Random 6 mers 1 μL,总RNA 6μL,Rnase Free ddH2O 7 μL;总反应体系20 μL,在37 ℃,15 min;85 ℃,5 s,4 ℃ Forever的条件下逆转录成cDNA。基因扩增:以cDNA为模板进行实时荧光定量PCR(RT-qPCR),严格按照SYBR Green qPCR Master Mix 试剂盒说明书进行);反应体系:Rnase Free ddH2O 6.4 μL,SYBR Premix Ex Taq Ⅱ (2×) 10.0 μL,cDNA 2.0 μL,上、下游引物(上海生工公司合成,表1)各0.8 μL,总体积20.0 μL;扩增条件:95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,循环40次。实验数据采用2-ΔΔCt法(Ct为荧光达到阈值时所需PCR的循环数)分析IL-1β、IL-6和TNF-α的mRNA相对表达量。

2 结 果
2.1膝关节大体情况空白对照组右膝关节无肿大,体质量无明显增减,关节软骨透明,表面光滑、平整,色泽正常。模型对照组右膝关节肿胀明显,体质量明显减轻,关节软骨表面粗糙,部分可见明显骨赘形成,色泽灰暗,部分软骨剥脱并显露软骨下骨。金骨莲胶囊组右膝关节稍肿胀,体质量减轻不明显,关节软骨表面稍粗糙,未见明显骨赘形成,色泽稍灰暗。氨基葡萄糖组右膝关节肿胀轻于模型对照组,体质量稍微减轻,关节软骨表面欠光泽,部分可见极少量骨赘形成。见图1。
2.2关节软骨退变情况空白对照组关节软骨结构光整,细胞数量如常,基质染色正常,潮线完整。模型对照组软骨表面较粗糙,有不规则裂隙形成,细胞数量明显减少,基质中度或重度失染,潮线不完整。金骨莲胶囊组关节软骨表面稍粗糙,局部见裂隙,细胞数量轻度减少,基质染色轻度减退,潮线欠完整。氨基葡萄糖组软骨表结构欠光整,局部见不规则裂隙,细胞数量减少,基质染色轻、中度减退,潮线欠完整。HE、番红染色见图2。关节软骨Mankin评分数据分析显示,模型对照组比空白对照组关节软骨退变严重,差异有统计学意义(P<0.05);金骨莲胶囊组和氨基葡萄糖组分别与模型对照组比较,差异均有统计学差异(P<0.05);金骨莲胶囊组和氨基葡萄糖组比较,差异有统计学意义(P<0.05),见表2。
2.3兔膝关节软骨中IL-1β、IL-6、TNF-α的mRNA相对表达量所有扩增曲线均无非特异性荧光,融解曲线呈单峰,产物特异性好。见表2。OA模型IL-1β、IL-6、TNF-α mRNA相对表达量,模型对照组3种炎性因子均明显高于空白对照组,差异均有统计学意义(P<0.05),说明复制OA模型成功;金骨莲胶囊组和氨基葡萄糖组3种炎性因子表达量均明显低于模型对照组,差异均有统计学意义(P<0.05),说明两种药物均有不同程度软骨保护作用;中药金骨莲胶囊在降低IL-1βmRNA方面作用与氨基葡萄糖相当,差异无统计学意义(P>0.05)。中药金骨莲胶囊在降低IL-6和TNF-αmRNA方面作用优于氨基葡萄糖,差异均有统计学意义(P<0.05)。

A:空白对照组;B:模型对照组;C:氨基葡萄糖组;D:金骨莲胶囊组。
图1各组兔膝关节大体标本图
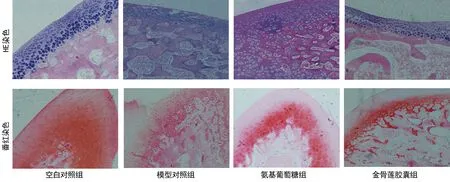
图2 各组关节软骨HE染色(×200)和番红染色(×200)

组别Mankin评分(分)IL⁃1βIL⁃6TNF⁃α空白对照组1.380±0.1831.000±0.3001.000±0.3001.000±0.300模型对照组10.360±0.183a8.420±0.785a12.600±0.226a10.800±0.521a金骨莲胶囊组2.580±0.464abc2.550±0.169ab5.020±0.216abc2.580±0.464abc氨基葡萄糖组5.250±0.143ab2.350±0.031ab7.430±0.114ab5.250±0.143abF155.40067.280842.700146.000P0.0000.0000.0000.000
a:P<0.05,与空白对照组比较;b:P<0.05,与模型对照组比较;c:P<0.05,与氨基葡萄糖组比较。
3 讨 论
膝OA是多种生物因素与机械损伤因素相互作用所致生物力学紊乱而引起的病理改变,中老年人多发[11]。多项研究表明,成功造模后的膝OA炎症变化包括关节液渗出及滑膜增生,这也许是OA患者关节疼痛的重要机制之一[12-13]。OA模型的建立是本实验成功的前提,故采用改良Hulth法复制OA模型。关节软骨Mankin评分得出模型对照组较空白对照组软骨退变严重,提示造模成功。研究证实,氨基葡萄糖在治疗膝OA中效果肯定,在本实验中作为阳性药物对照[14]。
从大体标本角度出发得知,金骨莲胶囊组和氨基葡萄糖组均比模型对照组的关节软骨表面光整,并没有明显骨赘形成;中药金骨莲胶囊组和氨基葡萄糖组肉眼观没有明显差别。从病理组织学角度得知,金骨莲胶囊组和氨基葡萄糖组均比模型对照组的关节软骨结构规则、细胞数量多、基质轻度失染、潮线完整,说明两种药物均有不同程度软骨保护作用;金骨莲胶囊组和氨基葡萄糖组比较,差异有统计学意义(P<0.05),说明在病理组织学水平上金骨莲胶囊疗效优于氨基葡萄糖。
IL-1β、TNF-α在OA病程中均是典型的致炎细胞因子[15-16],可通过一系列级联反应引起关节软骨的破坏和炎症反应,在膝OA中呈高表达,并与病情呈正相关[17]。IL-1β可调节蛋白水解酶的合成与分泌,促进软骨细胞和滑膜细胞分泌基质金属蛋白酶并加速胶原蛋白及聚蛋白多糖的降解[18]。近期研究表明,金骨莲胶囊能够降低类风湿性关节炎大鼠血清中的IL-1β、TNF-α,因此推测金骨莲胶囊抑制炎症因子IL-1β、TNF-α是治疗类风湿关节炎的机制之一[19]。本实验发现,金骨莲胶囊和氨基葡萄糖均可不同程度的下调膝OA中IL-1β、TNF-α炎症因子,但是金骨莲胶囊在降低IL-1βmRNA方面作用与氨基葡萄糖相当,差异无统计学意义(P>0.05),而在降低TNF-αmRNA方面作用优于氨基葡萄糖,差异有统计学意义(P<0.05)。
IL-6在OA中的作用仍存在很大争议。有研究认为,在OA 中晚期的关节软骨中有过量的IL-6表达[20-21],进而刺激更多的基质金属蛋白酶(MMP)表达[22-23],大量软骨基质被降解,软骨进一步加重。最新研究表明,IL-6可能是TNF-α和IL-1β作用于其他细胞重要的中介物质;TNF-α和IL-1β通过IL-6的产生将OA的疾病进程放大与延续,三者的协同作用可加速OA的进展[24]。IL-6在OA软骨下骨成骨细胞中表达较高,并与OA软骨破坏紧密相关[25]。有研究表明,IL-6也可以刺激产生金属蛋白酶组织抑制剂(TIMP),从而负反馈抑制MMP,因此可认为IL-6在OA中影响是双向的[26]。从分子水平得知,中药金骨莲胶囊和氨基葡萄糖均可不同程度的下调膝OA中IL-6炎症因子,但是中药金骨莲胶囊作用优于氨基葡萄糖,差异有统计学意义(P<0.05)。
综上所述,中药金骨莲胶囊和氨基葡萄糖均可不同程度的下调膝OA中IL-1β、IL-6、TNF-α炎症因子,而中药金骨莲胶囊在降低IL-6和TNF-α mRNA方面作用优于氨基葡萄糖;从而达到中药金骨莲胶囊抑制软骨基质破坏和延缓关节软骨退变的目的,对关节软骨起保护作用。
[1]Hui W,Young DA,Rowan AD,et al.Oxidative changes and signalling pathways are pivotal in initiating age-related changes in articular cartilage[J].Ann Rheum Dis,2016,75(2):449-458.
[2]Visser AW,de Mutsert R,le CS,et al.The relative contribution of mechanical stress and systemic processes in different types of osteoarthritis:the NEO study[J].Ann Rheum Dis,2015,74(10):1842-1847.
[3]肖晓金,包侠萍,陈文列,等.透骨消痛胶囊对兔膝骨关节炎模型血清与关节液炎症因子的影响[J].风湿病与关节炎,2013,2(11):35-38.
[4]汪洪,吴昊旻.关节注射联合金骨莲胶囊治疗骶髂关节炎疗效观察[J].中国中医骨伤科杂志,2014,22(6):10-12.
[5]Hulth A,Lindberg L,Telhag H.Experimental osteoarthritis in rabbits.Preliminary report[J].Acta Orthop Scand,1970,41(5):522-530.
[6]Rogart JN,Barrach HJ,Chichester CO.Articular collagen degradation in the Hulth-Telhag model of osteoarthritis[J].Osteoarthritis Cartilage,1999,7(6):539-547.
[7]Kadri A,Ea HK,Bazille C,et al.Osteoprotegerin inhibits cartilage degradation through an effect on trabecular bone in murine experimental osteoarthritis[J].Arthritis Rheum,2008,58(8):2379-2386.
[8]Szychlinska MA,Trovato FM,Di RM,et al.Co-Expression and Co-Localization of Cartilage Glycoproteins CHI3L1 and Lubricin in Osteoarthritic Cartilage:Morphological,Immunohistochemical and Gene Expression Profiles[J].Int J Mol Sci,2016,17(3):359.
[9]Mankin HJ,Dorfman H,Lippiello L,et al.Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips.Ⅱ.Correlation of morphology with biochemical and metabolic data[J].J Bone Joint Surg Am,1971,53(3):523-537.
[10]Sgamma T,Pape J,Massiah A,et al.Selection of reference genes for diurnal and developmental time-course real-time PCR expression analyses in lettuce[J].Plant Methods,2016(12):21.
[11]Davis AM,Palaganas M,Li LC.Public opinion on community-based education and exercise programs for managing hip and knee osteoarthritis-like symptoms:results of a survey[J].Patient Prefer Adherence,2016(10):283-290.
[12]Jay GD,Elsaid KA,Kelly KA,et al.Prevention of cartilage degeneration and gait asymmetry by lubricin tribosupplementation in the rat following anterior cruciate ligament transection[J].Arthritis Rheum,2012,64(4):1162-1171.
[13]Kato T,Miyaki S,Ishitobi H,et al.Exosomes from IL-1β stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes[J].Arthritis Res Ther 2014,16(4):R163.
[14]Bruyère O,Altman RD,Reginster JY.Efficacy and safety of glucosamine sulfate in the management of osteoarthritis:Evidence from real-life setting trials and surveys[J].Semin Arthritis Rheum,2016,45(4 Suppl):S12-17.
[15]Blasioli DJ,Kaplan DL.The roles of catabolic factors in the development of osteoarthritis[J].Tissue Eng Part B Rev,2014,20(4):355-363.
[16]Li ZC,Han N,Li X,et al.Decreased expression of microRNA-130a correlates with TNF-α in the development of osteoarthritis[J].Int J Clin Exp Pathol,2015,8(3):2555-2564.
[17]Swärd P,Frobell R,Englund M,et al.Cartilage and bone markers and inflammatory cytokines are increased in synovial fluid in the acute phase of knee injury (hemarthrosis)——a cross-sectional analysis[J].Osteoarthritis Cartilage,2012,20(11):1302-1308.
[18]Park JS,Kim DK,Shin HD,et al.Apigenin Regulates Interleukin-1β-Induced Production of Matrix Metalloproteinase Both in the Knee Joint of Rat and in Primary Cultured Articular Chondrocytes[J].Biomol Ther (Seoul),2016,24(2):163-170.
[19]杜茂端,邱德文,许建阳.金骨莲胶囊对类风湿性关节炎(RA)病理作用的研究——模型血清神经递质、IL-1β、TNFα、VEGF、Cor等含量调控作用机理[J].世界中医骨科杂志,2005,6(2):63-68.
[20]Marks PH,Donaldson ML.Inflammatory cytokine profiles associated with chondral damage in the anterior cruciate ligament-deficient knee[J].Arthroscopy,2005,21(11):1342-1347.
[21]Laragione T,Shah A,Gulko PS.The vitamin D receptor regulates rheumatoid arthritis synovial fibroblast invasion and morphology[J].Mol Med,2012(18):194-200.
[22]Yan ZW,Dong J,Qin CH,et al.Therapeutic Effect of Chenodeoxycholic Acid in an Experimental Rabbit Model of Osteoarthritis[J].Mediators Inflamm,2015(2015):780149.
[23]Xu Y,Liu Q,Liu ZL,et al.Treatment with SiMiaoFang,an anti-arthritis chinese herbal formula,inhibits cartilage matrix degradation in osteoarthritis rat model[J].Rejuvenation Res,2013,16(5):364-376.
[24]Papathanasiou I,Michalitsis S,Hantes ME,et al.Molecular changes indicative of cartilage degeneration and osteoarthritis development in patients with anterior cruciate ligament injury[J].BMC Musculoskelet Disord,2016(17):21.
[25]Sakao K,Takahashi KA,Mazda O,et al.Enhanced expression of interleukin-6,matrix metalloproteinase-13,and receptor activator of NF-kappaB ligand in cells derived from osteoarthritic subchondral bone[J].J Orthop Sci,2008,13(3):202-210.
[26]沈鹏飞.关节液中IL-6、LDH含量与骨关节炎诊断研究[J].长春中医药大学学报,2009,25(1):121-122.
Experimental study on protective effects of psammosilene tunicoides on knee osteoarthritis in rabbits*
Wang Shengmin1,Liu Yi1△,Liu Bo2,Sang Peng1,Zhong Hehe1,Sun Pengpeng1
(1.DepartmentofOrthopaedics,theAffiliatedHospitalofZunyiMedicalCollege,Zunyi,Guizhou563000,China;2.DepartmentofJointSurgery,JirenHosptialDepartmentofOrthopedics,Tongren,Guizhou555200,China)
ObjectiveStudy of Golden Lotus capsule and psammosilene tunicoides protective of knee osteoarthritis in domestic rabbits.MethodsA total of 50 healthy domestic rabbits were randomly and equally divided into A,B,C,D,E group,group A was the control group,group B:model control group,group C to give the drug of Psammosilene tunicoides,D group to give Golden Lotus capsule,group E to give the glucosamine drug(n=10).Except for A group,the other 4 groups of domestic rabbits were induced right knee osteoarthritis models by the modified Hulth′s modeling method.After modeling,the experimental group began taking the drug,A and B group were fed with normal saline,once a day.All rabbits were kills by gas embolism at the eighth week.The articular cartilage of medial malleolus of femur split into two and the right knee joints were obtained.One hematoxylin eosin staining and safranin o staining Mankin score of articular cartilage,the other with real-time fluorescent quantitative PCR technique to detect articular cartilage of IL-1β,IL-6 and TNF-α of the mRNA relative expression level.ResultsMankin score of group A,B,D and E were(1.38±0.183),(2.58±0.464),(5.25±0.143)and(10.38±0.183)respectively,and it increased in order(P<0.05).mRNA expression of group D and E were significantly lower than group B(P<0.05).Psammosilene tunicoides,Golden Lotus capsule and glucosamine have different levels of protection effect for IL-1β,IL-6 and TNF-α in the articular cartilage of medial malleolus of femur.Compared with control group,the difference between Psammosilene tunicoides and Golden Lotus capsule groupthe was statistically significant (P<0.05).ConclusionPsammosilene tunicoides and Golden Lotus capsule could decrease the expression of IL-1β,TNF-α and IL-6 in different degree.
osteoarthritis;Interleukin-1β;Interleukin-6;tumor necrosis factor alpha-α;golden lotus capsule
贵州省科技厅社发攻关基金资助项目(黔科合SY[2010]3091号);硕士启动基金项目(院字[2013]20号)。作者简介:王胜民(1988-),硕士,主要从事骨关节炎及关节镜的研究。△
,E-mail:13308529536@163.com。
R684.3
A
1671-8348(2016)26-3611-05
2016-03-05
2016-05-26)
