透性化处理对酵母细胞谷胱甘肽分泌能力的影响
2016-10-31牛书操段学辉
牛书操,段 超,张 倩,段学辉
(南昌大学食品科学与技术国家重点实验室食品学院,江西南昌 330047)
透性化处理对酵母细胞谷胱甘肽分泌能力的影响
牛书操,段超,张倩,段学辉*
(南昌大学食品科学与技术国家重点实验室食品学院,江西南昌 330047)
酵母细胞一般具有谷胱甘肽(GSH)的合成能力和储存稳定性。为了考察和促进酵母细胞的GSH分泌能力,实验研究了低pH胁迫、冻融、细胞干燥、渗透压冲击和有机溶剂等透性化处理对酵母细胞膜通透性的影响。结果显示:冻融法对酵母GSH的胞外分泌作用效果不明显;低pH胁迫、细胞干燥、渗透压冲击和有机溶剂处理都能一定程度地改变酵母细胞膜通透性,促使GSH分泌到细胞外,其中低pH胁迫和渗透压效果不稳定,有机溶剂处理效果最好。在细胞酶催化前体氨基酸合成GSH的反应液中加入8%(v/v)的丙酮,酶催化合成48 h,GSH总产量达到551 mg/L,比对照组提高了51%,表明合适的透性化处理能够促进酵母细胞内GSH的胞外分泌和积累。
酵母,细胞膜通透性,谷胱甘肽,分泌,酶催化
谷胱甘肽(glutathione,GSH)是由L-谷氨酸、L-半胱氨酸和甘氨酸三种氨基酸缩合而成的具有γ-谷氨酰基和巯基的生物活性三肽,对维持生物体内适宜的氧化还原环境起着至关重要的作用[1]。GSH是细胞内产物,积累到一定浓度时,GSH合成酶系受到反馈抑制[2],所以通常情况下菌体内GSH含量都比较低(占细胞干重的0.5%~1.0%)[3]。通过物理化学或基因方法可以提高细胞通透性,有利于细胞内合成的GSH分泌到胞外,如Nie[4]等研究发现产朊假丝酵母在强酸胁迫下具有将GSH分泌到胞外的能力;Yamada[5]等研究发现热带假丝酵母PK233在含有低浓度乙醇的培养基中生长时能在细胞外积累GSH;Rollini[6]等研究发现一定浓度的表面活性剂或冻干处理可使菌体内大部分GSH分泌到胞外积累。此外,利用基因工程在细胞内超表达如Gex1p、Gex2p或Gxa1p基因也可以促进细胞内GSH分泌到细胞外积累[7-8]。
本文选用实验室保藏的絮凝酵母SP5,通过调控细胞生长和处理的环境条件,考察低pH胁迫、冻融、细胞干燥、渗透压冲击和有机溶剂处理对培养酵母细胞的活性和GSH通透性的影响,探讨改变酵母细胞GSH胞外分泌能力的环境条件,提高酵母细胞酶系催化合成GSH的效率,为促进细胞内GSH产物的稳定合成和胞外分泌积累提供研究数据。
1 材料与方法
1.1材料与仪器
絮凝酵母SP5,本实验室保藏;酵母粉、蛋白胨、琼脂粉等 生化试剂;蔗糖、氯化钠、葡萄糖、硫酸铵、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、氢氧化钠、硫酸镁、氯化镁、柠檬酸、硫酸,甲苯、三氯甲烷、四氢呋喃、乙酸乙酯、甲醇、乙醇、乙二醇甲醚、石油醚、丙酮、正丁醇、正己烷、环己烷、谷氨酸、半胱氨酸、甘氨酸、谷胱甘肽、肌醇、四氧嘧啶等试剂分析纯。
生物安全柜苏净集团安泰公司;多用途水浴恒温振荡器江苏太仓市实验设备厂;生化培养箱、超级恒温水浴槽上海精宏实验设备有限公司;紫外可见分光光度计上海光谱仪器有限公司;离心机Thermo公司;电子天平Mettler Toledo公司;高压灭菌锅上海申安医疗器械厂;雷磁pH计上海仪电科学仪器股份有限公司;冰箱Hair集团。
1.2菌体培养
参考Chen等[9]的方法。
1.3胞内GSH提取
参考Chen等[9]的方法,具体步骤为:取适量菌液于3000 r/min离心10 min,上清液用于测定胞外GSH含量,菌体去离子水洗三次,加入适量蒸馏水,混匀,95 ℃热水浴中抽提15 min,冷却至室温,3000 r/min离心10 min,取上清液测定细胞内GSH含量,换算为mg/L。
1.4GSH测定
四氧嘧啶法[10]和四氧嘧啶补偿法[11]测定GSH。
1.5细胞干重(DCW)测定
取10 mL发酵液于3000 r/min离心10 min,弃上清液,用去离子水洗涤菌体3次,置于65 ℃烘箱中干燥至恒重。
1.6细胞处理方法
1.6.1对照培养按10%(v/v)接种量将种子液接入装有50 mL发酵液(不额外添加任何物质)的250 mL摇瓶中,30 ℃,160 r/min培养条件下菌体生长和GSH合成情况。
1.6.2低pH胁迫法参考文献[4]的方法,酵母细胞培养24 h后,将发酵液pH分别调低至3.0、2.5、2.0、1.5,胁迫处理4 h。
1.6.3渗透压冲击法参考文献[12]的方法,将酵母细胞充分悬浮在含10% NaCl或20%蔗糖的10 mmol/L Tris-HCl溶液(pH8.0)中,4 ℃冰箱中维持30 min,离心收集菌体,用一定量的10 mmol/L Tris-HCl溶液(pH 8.0)悬浮,4 ℃冰箱中维持30 min,3000 r/min离心收集菌体。
1.6.4冻融法参考文献[13-14]的方法,将加水量为20%(g/g)的酵母细胞置于-20 ℃冰箱中冷冻保存1 h,30 ℃水浴融化30 min,反复冻融3次。
1.6.5干燥法参考文献[15]的方法,将酵母湿细胞吸干表面水分,置于-20 ℃冰箱或室温(25 ℃)中干燥一周。
1.6.6有机溶剂法发酵24 h后在装有55 mL发酵液的250 mL摇瓶加入不同种类不同浓度的甲苯、三氯甲烷、四氢呋喃、乙酸乙酯、甲醇、乙醇、乙二醇甲醚、石油醚、丙酮、正丁醇、正己烷或环己烷处理2.5 h,离心收集细胞。
1.7细胞存活率测定
采用平板涂布计数法[16]。
1.8酶法合成GSH反应条件
参考Chen等[9]的方法,具体步骤为:将4 g酵母湿细胞加入到装有40 mL酶法合成反应液的250 mL摇瓶中,30 ℃,160 r/min振荡培养。
2 结果与分析
2.1对照条件下絮凝酵母SP5的生长和GSH合成情况
对照培养条件下絮凝酵母SP5的生长和GSH合成情况如图1所示。

图1 对照条件下絮凝酵母SP5生长(a)和GSH合成(b)情况Fig.1 Flocculation yeast SP5 growth(a) and GSH synthesis(b)in natural culture conditions
从图1a可以看到,在对照培养条件下絮凝酵母SP5的生长随发酵时间延长而迅速增加,发酵到24 h时细胞浓度达到最高,细胞干重为7.49 g/L;发酵液的pH由初始的6.0逐渐降低并维持在4.5左右;图1b显示在对照培养条件下,絮凝酵母SP5合成的GSH主要在细胞内积累,并随着发酵时间增加GSH积累浓度提高,当发酵时间达到20 h后细胞内积累的GSH浓度趋于稳定,发酵到24 h时GSH的合成总量达到53.9 mg/L;发酵液中不能明显检测到细胞外积累的GSH。
2.2低pH对GSH胞外分泌的影响
发酵液的pH会影响底物和产物的解离状态,影响培养微生物细胞膜的带电状态,改变细胞膜流动性和通透性,促进细胞对营养物质的吸收利用和代谢产物的分泌[4]。酵母细胞培养24 h后将发酵液pH从4.5分别调低至3.0、2.5、2.0、1.5,继续培养4 h后检测其发酵液和培养细胞内的GSH含量,结果如图2所示。
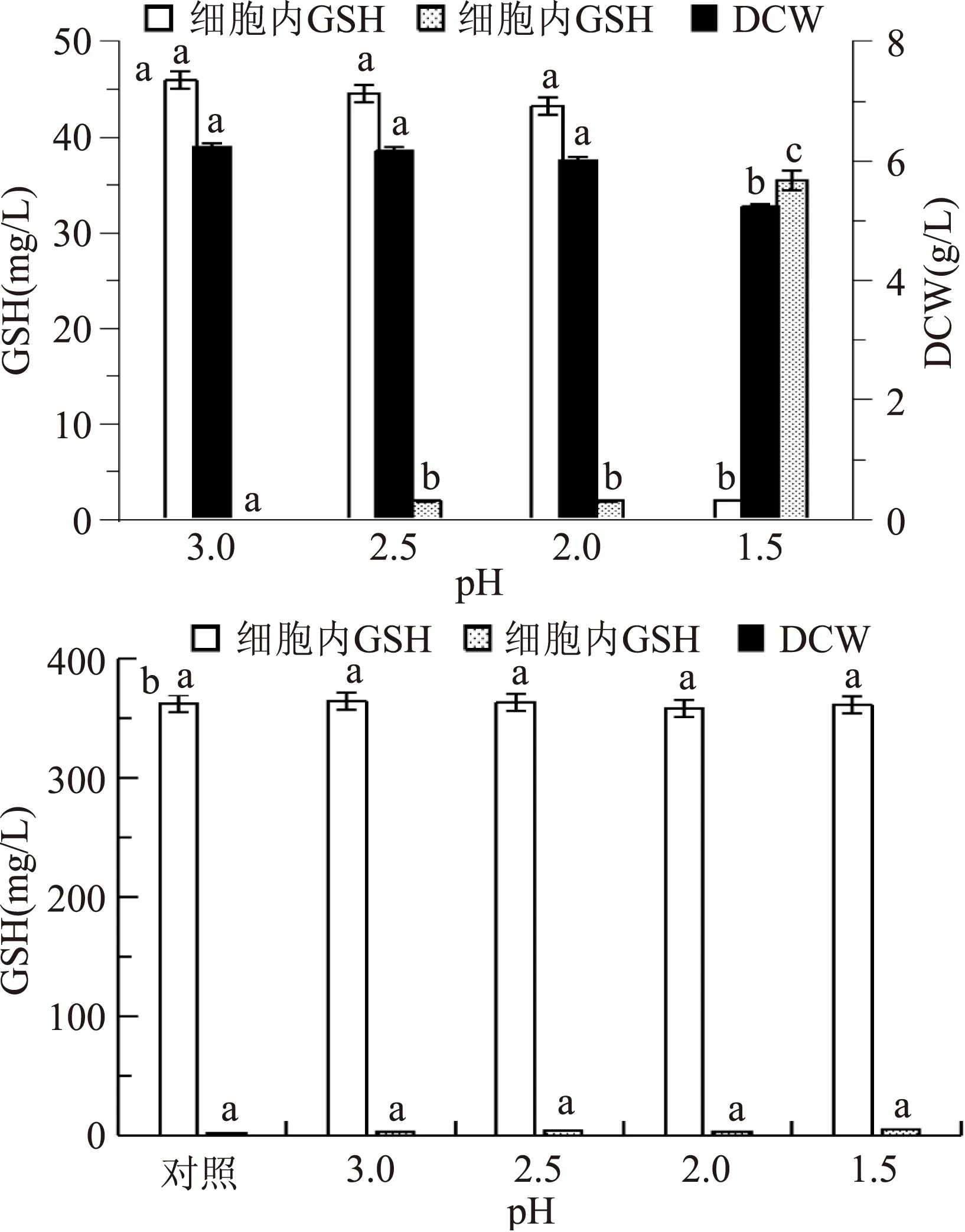
图2 低pH处理后细胞内外GSH含量变化Fig.2 Changes of GSH content in cells after low pH treatment注:同一类别不同小写字母表示差异显著(p<0.05),图3~6同。
从图2a可以看到,随pH从3.0降低至2.0,细胞的GSH合成活性和生长量有所下降,合成的GSH主要积累在细胞内;当发酵液pH降低至1.5时,细胞合成的GSH有将近95%积累在细胞外,发酵液中细胞量明显降低,表明低pH胁迫能够改变酵母细胞膜通透性,促使细胞内GSH分泌到细胞外;但长时间处于过低pH环境(pH低于2)会降低细胞活性,甚至导致细胞自溶死亡,Nei等[4]在研究强酸胁迫促进产朊假丝酵母细胞内GSH的胞外分泌时也有类似现象。
分别取不同低pH胁迫处理过的酵母湿细胞4 g和未处理的对照组pH 4.5培养细胞4 g,进行酶法合成GSH发酵,图2b结果显示,低pH处理过的酵母细胞合成GSH浓度在363 mg/L左右,与对照组的浓度差别不大;pH1.5~3.0发酵液处理过的酵母细胞合成的GSH主要在细胞内积累,表明低pH胁迫处理对酵母细胞膜通透性的改善可能不稳定,环境pH改变(回到正常pH),透性化细胞的GSH分泌能力会明显下降,甚至可以恢复到对照组细胞的生理结构状态。
2.3冻融法、干燥法和渗透压冲击法处理对酵母细胞分泌GSH能力的影响
一定的物理处理可以造成细胞壁和细胞膜的结构性损伤,提高细胞膜通透性[12-15]。用冻融法、干燥法和渗透压冲击法处理酵母细胞,检测细胞内外GSH含量变化(图3a),并用处理后的酵母细胞在与对照组细胞同样条件下酶法合成GSH,结果如图3b所示。
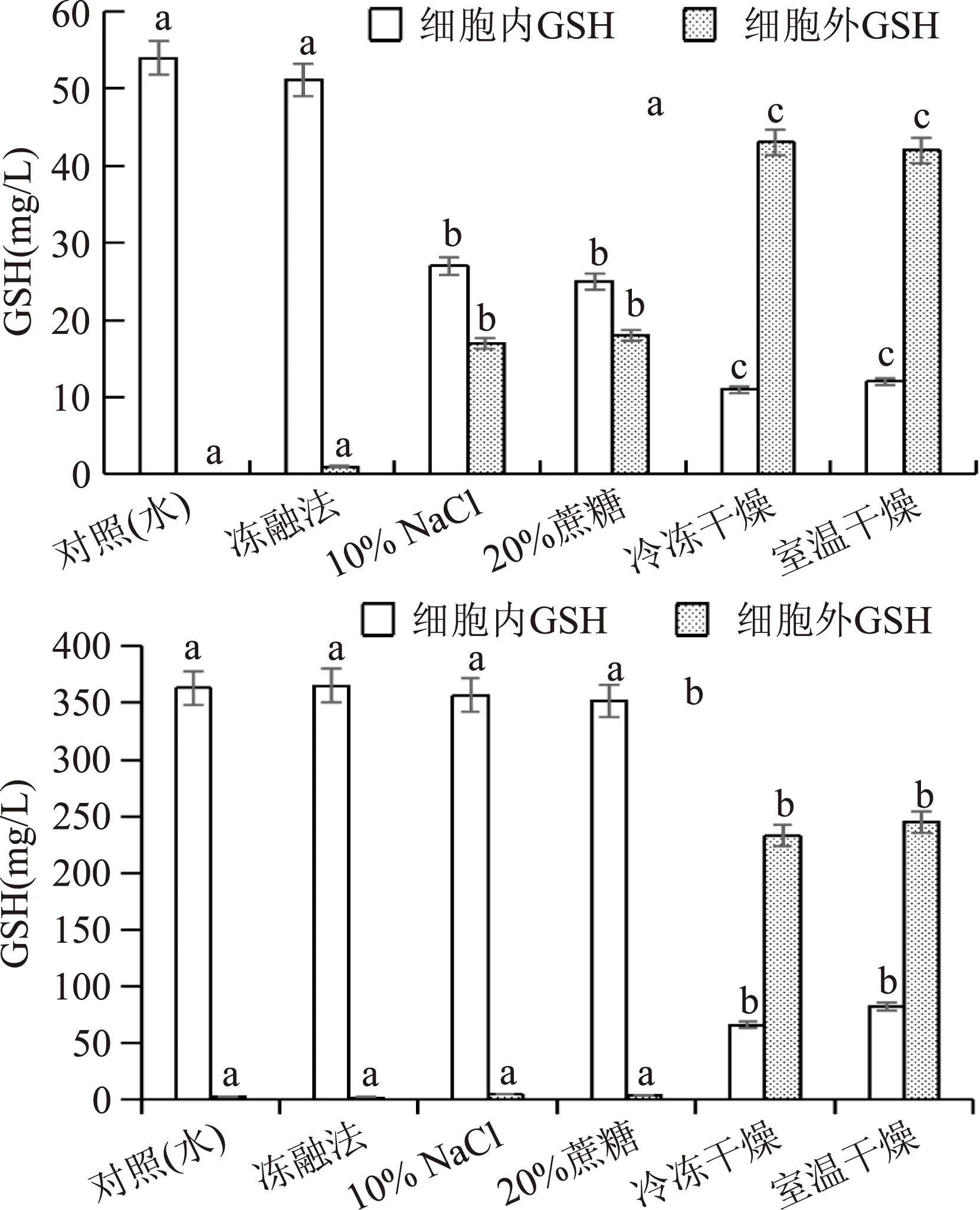
图3 不同方法处理后细胞酶法合成GSH情况Fig.3 Enzymatic synthesis of GSHby yeast cells treated with different methods
从图3a中可以看到,冻融法处理后酵母细胞内GSH含量变化不大;渗透压冲击法(10%NaCl和20%蔗糖)处理后细胞内近50%的GSH释放到胞外;干燥法(冷冻干燥和室温干燥)处理后细胞内GSH含量降低了80%。表明渗透压冲击法和干燥法可以明显提高酵母细胞通透性,促使胞内GSH释放到胞外。
从图3b中可以看出,冻融法处理的酵母细胞胞内合成的GSH量与未处理的对照组细胞的合成量接近,主要在细胞内积累,胞外分泌不明显;干燥法(冷冻干燥和室温干燥)处理的细胞在复水活化后细胞膜通透性改变明显,可将细胞内80%的GSH释放到细胞外,处理细胞酶法合成的GSH大部分在胞外积累;渗透压冲击法处理酵母细胞合成GSH,在反应液中很难检测到GSH,合成的GSH主要在细胞内积累,表明渗透压冲击法处理细胞的膜通透性改变不稳定,透性化细胞GSH分泌能力可能很快丧失。
2.4不同有机溶剂处理对细胞分泌GSH能力的影响
有机溶剂可以在细胞膜中积累,破坏细胞被膜上脂类物质之间的相互作用,导致细胞膜通透性发生改变[5]。对照条件下培养24 h的酵母细胞,分别选择不同的有机溶剂进行处理,考察细胞的耐受性和GSH的分泌水平,检测处理后细胞内GSH含量,实验结果如表1所示(log P是溶剂在辛醇和水中分配系数的对数值,用来表征溶剂的极性)。

表1 不同有机溶剂处理后细胞内GSH含量

图4 不同有机溶剂对GSH发酵的影响Fig.4 Effect of different organic solvents on GSH fermentation
从表1中可以看到,有机溶剂丙酮、四氢呋喃、乙酸乙酯、正丁醇、三氯甲烷、甲苯等都可以改变细胞膜的通透性,导致细胞内GSH外泄;甲醇、乙醇、乙二醇甲醚、环己烷、正己烷、石油醚处理,细胞内GSH含量变化不大,胞外分泌不明显,表明不仅有机溶剂的化学特性影响酵母细胞膜的通透性,还可能与其极性有关(极性低于3时对细胞膜通透性影响较大)[17]。
分别用2%、4%、6%、8%、10%(v/v)浓度的丙酮、四氢呋喃、乙酸乙酯、正丁醇、三氯甲烷、甲苯处理,继续发酵2.5 h,检测酵母细胞活性和细胞膜的通透性,结果如图4 所示。
从图4中可以看到,丙酮和甲苯处理细胞膜浓度越高,细胞膜通透性改变越大,胞内GSH分泌到细胞外越多(实际胞外GSH含量略低于胞内GSH减少量);浓度在2%~10%(v/v)的丙酮对细胞生长和细胞活性影响不大,但浓度达到6%(v/v)的甲苯就能明显抑制细胞生长,浓度继续升高甚至会使细胞失去活性。
图4中显示乙酸乙酯、四氢呋喃、三氯甲烷和正丁醇对絮凝酵母细胞膜通透性的改变存在临界浓度现象(有机溶剂在细胞膜内积累到一定浓度时才会使细胞膜通透性发生改变),其中乙酸乙酯和四氢呋喃在达到临界浓度(6%和8%)后细胞内GSH含量明显下降;较低浓度三氯甲烷(2%)和正丁醇(2%)会严重抑制细胞生长和细胞活性,达到各自临界浓度(6%和4%)后细胞内GSH含量急剧下降,细胞基本失去活性,甚至自溶死亡。
不同有机溶剂处理的酵母细胞用于酶法合成GSH,反应24 h检测反应液和细胞内的GSH含量,结果如图5所示。

图5 不同有机溶剂处理后细胞酶法合成GSH情况Fig.5 Enzymatic synthesis of GSH by yeast cells treatment with different organic solvents
从图5中可以看到,甲醇、乙醇、乙二醇甲醚、环己烷、正己烷和石油醚对酵母细胞膜通透性的改变作用不明显,细胞酶法合成GSH胞内外含量与对照组差别不大;正丁醇、三氯甲烷和甲苯处理的细胞依然可以将细胞内部分GSH释放到细胞外积累,但GSH总量明显降低,表明这三种有机溶剂不但可能对细胞膜损伤较大,还可能会降低GSH合成酶系活性;丙酮、四氢呋喃和乙酸乙酯处理的酵母细胞膜具有一定的通透性,合成的GSH胞内积累为主,少量分泌细胞外,显示反应液中加入一定量的丙酮、四氢呋喃或乙酸乙酯有利于酵母细胞内的GSH分泌到细胞外。
在酶法合成GSH反应液中分别加入丙酮(8%)、四氢呋喃(8%)或乙酸乙酯(6%),合成反应至24 h和48 h分别取样,检测反应液中、细胞内以及总的GSH含量,并与对照组比较,结果如图6所示。
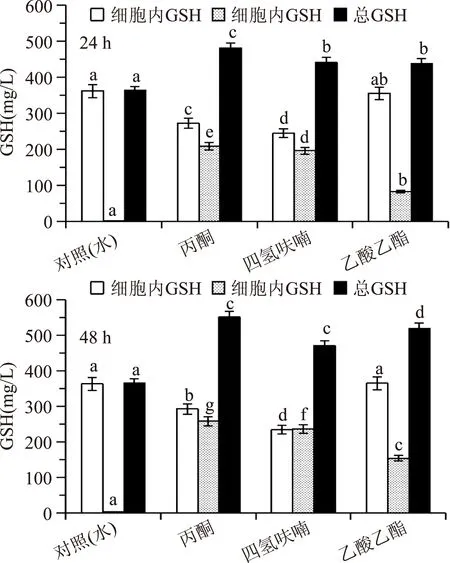
图6 不同有机溶剂对酶催化合成GSH的影响Fig.6 Effect of different organic solvents on the synthesis of GSH by enzyme catalysis
从图6看出,在酶合成反应液中加入一定量的丙酮、四氢呋喃或乙酸乙酯能够改善酵母细胞膜通透性,促使细胞内GSH分泌,从而有利于减轻产物的反馈抑制,提高GSH的总产量。结果同时显示,丙酮效果明显比四氢呋喃和乙酸乙酯好,GSH总产量提高最多,酶法合成48 h时比24 h产量高;添加8%丙酮反应48 h,合成积累的GSH细胞内、反应液和总产量分别达到293、258和551 mg/L,比对照组的总产量366 mg/L提高了51%。
3 结论
一般情况下酵母细胞中的GSH主要在胞内合成积累,胞外分泌量很少。本研究采用物理或化学方法对酵母细胞进行透性化处理和胁迫刺激,以使细胞内的GSH分泌到胞外积累,提高GSH合成酶系催化效率。结果表明,冻融法对酵母GSH胞外分泌作用效果不明显;低pH胁迫、渗透压冲击法、干燥法和有机溶剂法都能不同程度地改变酵母细胞膜通透性,增强GSH的胞外分泌能力,但是低pH胁迫和渗透压冲击法处理后酵母细胞膜通透性改变不稳定,干燥法对细胞膜破损严重,影响GSH总合成量;有机溶剂法效果最好,在酶合成反应液中加入一定量的丙酮、四氢呋喃或乙酸乙酯可使胞内胞外同时积累GSH,既能减轻对合成酶系的反馈抑制,又能使GSH总合成量明显提高。综上所述,合适的透性化处理可实现GSH的胞外积累,有利于减少下游操作,降低生产成本,具有工业化胞外连续生产GSH的巨大潜力。
[1]Meister A,Andersen M E. Glutathione[J]. Ann. Rev. Biochem.,1983,52:711-760.
[2]Mehdi K,Penninckx M. An important role for glutathione andγ-glutamyl-transpeptidase in the supply of growth requirements during nitrogen starvation of the yeastSaccharomycescerevisiae[J]. Microbiology,1997,143:1885-1889.
[3]Penninckx M J. An overview on glutathione in Saccharomyces versus non-conventional yeasts[J]. FEMS Yeast Research,2002,2(3):295-305.
[4]Nie W,Wei G Y,Du G C,et al. Enhanced intracellularglutathione synthesis and excretion capability ofCandidautilisby using a low pH-stress strategy[J]. Lett. Appl. Microbiol.,2005,40(5):378-384.
[5]Yamada Y,Tani Y,Kamihara T. Production of extracellular glutathione by Candida tropicalis PK 233[J]. Journal of General Microbiology,1984,130(12):3275-3278.
[6]Rollini M,Musatti A,Manzoni M. Production of glutathione in extracellular form bySaccharomycescerevisiae[J]. Process Biochemistry,2010,45(4):441-445.
[7]Dhaoui M,Auchere F,Blaiseau P L,et al. Gex1 is a yeast glutathione exchanger that interferes with pH and redox homeostasis[J]. Mol. Biol. Cell,2011,22(12):2054-2067.
[8]Kiriyama K,Hara K Y,Kondo A. Extracellular glutathione fermentation using engineeredSaccharomycescerevisiaeexpressing a novel glutathione exporter[J]. Appl. Microbiol. Biotechnol,2012,96(4):1021-1027.
[9]Chen J L,Xie L,Cai J J,et al. Enzymatic synthesis of glutathione using engineeredSaccharomycescerevisiae[J]. Biotechnology Letters,2013,35(8):1259-1264.
[10]刘娟,王雅琴,刘刚,等. 发酵液中还原型谷胱甘肽三种测定方法的改进及其比较[J]. 北京化工大学学报:自然科学版,2004,03:35-38.
[11]郑希帆,沈江涛,段超,等. 分光光度法结合抗干扰补偿检测谷胱甘肽[J]. 分析测试学报,2015,34(6):670-675.
[12]Rodriguez M,Guereca L,Valle F,et al. Penicillin acylase extraction by osmotic shock[J]. Process Biochemistry,1992,27(4):217-223.
[13]韩春然,马永强,苏蕾蕾. 谷胱甘肽对酵母抗冻能力的影响[J]. 食品工业科技,2010,(5):311-312.
[14]Kamaly K M,Marth E H. Enzyme activities of cell-free extracts from mutant strains of lactic streptococci subjected to sublethal heating or freeze-thawing[J]. Cryobiology,1989,26(5):496-507.
[15]段学辉,叶勤,张嗣良. 增强细胞渗透性对酿酒酵母ATP合成活力的作用研究[J]. 南昌大学学报:工科版,2001,23(3):86-91.
[16]Chesney J,Eaton J W,Mahoney J R. Bacterial glutathine:a sacrificial defense against chlorine compounds[J]. Journal of Bacterial,1996,178(7):2131-2135.
[17]赵伟睿,柯丕余,胡升,等. 有机溶剂透性化处理谷氨酸脱羧酶工程菌制备γ-氨基丁酸的研究[J]. 高校化学工程学报,2015,29(1):138-144.
Effects of permeabilized treatment on the secretion of glutathione in yeast cells
NIU Shu-cao,DUAN Chao,ZHANG Qian,DUAN Xue-hui*
(State Key Laboratory of Food Science and Technology,School of Food Science, Nanchang University,Nanchang 330047,China)
Yeast cells generally possess the ability of synthesis and storage stability of GSH. In order to investigate and promote GSH secreting ability of yeast cells,the effects of low pH stress,dry,freezing and thawing,osmotic shock and organic solvent on the membrane permeability of yeast cells was studied. The results showed that the cell membrane permeability of yeast cells changed not obvious after treated with freezing and thawing,but could be changed to a certain extent by low pH stress,osmotic shock and organic solvent treatment,which prompted GSH to be secreted into the cell. The effects of low pH stress and osmotic shock was not stable,while organic solvent was the most effective,8%(v/v)acetone was added to the enzymatic synthesis reaction solution,enzyme catalyzed synthesis of 48 h,the total yield of GSH reached 551 mg/L,which increased by 51% compared with the control. These results showed that permeabilized treatment could promote the secretion and accumulation ability of GSH in yeast cells.
yeast;membrane permeability;glutathione;secretion;enzyme catalysis
2016-02-26
牛书操 (1987-),男,硕士研究生,研究方向:生物催化与转化,E-mail:15727658138@163.com。
段学辉(1958-),男,博士,教授,研究方向:食品生物技术,E-mail:xhduan@ncu.edu.cn。
南昌大学食品科学与技术国家重点实验室自由探索课题(201113)。
TS201
A
1002-0306(2016)17-0175-06
10.13386/j.issn1002-0306.2016.17.026
