酶解虾副产物制备抗氧化肽的研究
2016-10-31刘亚楠王延辉亚力坤江阿山钱炳俊姚晓敏张建华钟耀广
刘亚楠,王延辉,亚力坤江·阿山,钱炳俊,姚晓敏,张建华,钟耀广,*
(1.上海海洋大学食品学院,上海 201306;2.上海交通大学农业与生物学院,上海 200240)
酶解虾副产物制备抗氧化肽的研究
刘亚楠1,王延辉2,亚力坤江·阿山2,钱炳俊2,姚晓敏2,张建华2,钟耀广1,*
(1.上海海洋大学食品学院,上海 201306;2.上海交通大学农业与生物学院,上海 200240)
以虾副产物为原料,采用α-胰凝乳蛋白酶和嗜热菌蛋白酶进行酶解制备抗氧化肽。酶解液经透析、Sephadex G-15凝胶过滤层析、离子交换色谱和反向高效液相色谱分离,以1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力和铁离子还原能力(FRAP)为指标进行纯化,得到了高抗氧化活性组分F1。质谱分析结果表明组分F1中有三个肽,对这三个肽进行序列合成并测定其活性,发现十肽GCKVALIVVG的活性最高,其DPPH自由基清除能力按抗坏血酸当量计(AAE)为(16.10±0.02) μmol AAE/g pro,铁离子还原能力为(245.37±0.03) μmol AAE/g pro。本实验研究制备并分离纯化得到高活性的抗氧化肽,为虾副产物的生产应用提供了理论依据。
虾副产物,酶解,分离纯化,抗氧化肽
氧化反应会对食品和生物系统产生很多不利的影响,是引起食品腐败,营养品质下降和食品安全的重要原因[1]。近些年,抗氧化剂在国内外得到蓬勃的发展,用途越来越广泛。不仅用于含脂肪食品的抗氧化防御,而且作为功能因子用于保健食品及化妆品等的开发[2]。人工合成的抗氧化剂因具有潜在的副作用而受到限制[3],因此天然、无毒副作用的食源性抗氧化肽的研究成为热点。
我国虾类资源极为丰富,2015年我国对虾养殖产量超过120万t。在虾仁加工业飞速发展的同时,产生了大量副产物,这既造成了生物资源的浪费,又污染了环境。虾副产物中蛋白质含量较高,如果能选用合适的酶对其进行酶解制备抗氧化肽,将提高虾副产物的利用价值[4],变废为宝。
抗氧化肽构效关系(QSAR)的研究发现,抗氧化活性强的肽链N端氨基酸大多高度疏水且电荷数较低,比如丙氨酸、甘氨酸、缬氨酸和亮氨酸[5];中心位置氨基酸可以形成较多的氢键,如精氨酸,赖氨酸和组氨酸[6]。另外,酪氨酸、甲硫氨酸、组氨酸、赖氨酸和色氨酸都与抗氧化功能有关,其中C末端为酪氨酸或色氨酸等芳香族氨基酸的小肽有很强的抗氧化活性[7]。α-胰凝乳蛋白酶优先剪切羧基端为酪氨酸、色氨酸和苯丙氨酸的肽键,嗜热菌蛋白酶则从疏水性氨基酸残基的N-侧水解。因此,选择这两种酶组合水解应能够获得抗氧化活性较高的肽段。本实验借鉴QSAR研究成果,选择α-胰凝乳蛋白酶和嗜热菌蛋白酶对虾副产物进行酶解,并通过透析、凝胶过滤层析、离子交换色谱和反相高效液相色谱(RP-HPLC)进行分离纯化,制备得到活性高的抗氧化肽。实现了虾副产物资源的充分利用,为抗氧化肽的制备提供新途径。
1 材料与方法
1.1材料与仪器
南美白对虾上海海旭水产有限公司;α-胰凝乳蛋白酶(10000 U/mg protein)、嗜热菌蛋白酶(175 U/mg protein)、三硝基苯磺酸(TNBS)、HPLC标准肽混合物H2016、1,1-二苯基-2-三硝基苯肼(DPPH)购自美国Sigma-Aldrich公司;透析袋美国Spectrum公司;Sephadex G-15、DEAE Sephacel美国GE公司;乙腈(色谱级)德国Merck Millipore公司;三氟乙酸(TFA)、邻苯二甲醛(OPA)国药集团化学试剂有限公司。
多功能粉碎机上海正慧工贸公司;恒温水浴锅上海齐欣仪器公司;恒温干燥箱德国Binder公司;台式pH计瑞士Mettler-Toledo公司;5424型高速冷冻离心机德国Eppendorf公司;UVmini-1240型分光光度计日本Shimadzu公司;旋转蒸发器、电脑数显恒流泵、自动部份收集器上海沪西分析仪器厂;高效液相色谱系统(600 Controller 泵;717 plus自动进样器;2996紫外检测器;Anpel LAG-5000G无油空气发生器)美国Waters公司;酶标仪瑞士帝肯公司;纳升液相色谱-四极杆飞行时间串联质谱联用仪德国Bruke Dionex公司。
1.2实验方法
1.2.1原料准备将南美白对虾剥除虾仁后将剩余的虾头与虾壳洗净,放于恒温干燥箱中60 ℃烘16 h,用多功能粉碎机粉碎,并过60目筛。
1.2.2虾副产物总蛋白最佳提取时间的确定称取0.4 g的虾壳粉,加入6 mL磷酸盐缓冲液(0.05 mol/L,pH8.0)中,37 ℃摇床分别孵育0.25、0.5、0.75、1、1.5、2、3、4和6 h。利用Bradford试剂盒测定总蛋白液浓度[8]。
1.2.3最佳酶解时间的确定采用α-胰凝乳蛋白酶和嗜热菌蛋白酶依次水解上述虾副产物蛋白提取液。首先添加1.12%(w/w)的α-胰凝乳蛋白酶于pH8.0、37 ℃条件下对蛋白液分别酶解0.25、0.5、1、2、4和6 h,测定蛋白水解度(DH)。确定α-胰凝乳蛋白酶的最佳酶解时间。然后,对其酶解液进行第二步酶解。添加0.56%(w/w)的嗜热菌蛋白酶于pH8.0,70 ℃分别酶解1、2、4、6、8 h,以DH为指标选取最佳酶解时间。
DH的测定参考Adler-Nissen[9]方法并进行修改:取0.1 mL酶解液样品于试管中,加入2.2 mL磷酸盐缓冲液(0.05 mol/L,pH 8.2)和2 mL 0.1% TNBS溶液混匀,50 ℃避光水浴1 h。加入4 mL 0.1 mol/L盐酸终止反应,室温静置30 min,于340 nm测定混合液吸光值。以不同浓度的L-亮氨酸替代样品,作标准曲线。按照下式计算[10]:
式中:ht为反应后氨基态氮浓度(mmol/g);h0为反应前氨基态氮浓度(mmol/g);htot为每克原料蛋白的肽键毫摩尔数(mmol/g),虾副产物的htot=8.073 mmol/g[11]。
1.2.4抗氧化肽的分离纯化
1.2.4.1透析将上述酶解液依次利用1000 u和500 u的CE透析袋于去离子水中进行透析12 h,每4 h换液1次。取<500 u和500~1000 u两种组分,分别测定两组分的抗氧化活性,方法见1.2.6。选择活性较高的组分进行下一步分离纯化。
1.2.4.2凝胶过滤层析将上述组分经旋转蒸发浓缩后,用Sephadex G-15(1.6 cm×90 cm)凝胶柱层析分离,上样量为1 mL。洗脱液为去离子水,流速为0.5 mL/min,每管按3 mL收集,共收集100管,于214 nm检测[12]。测定各洗脱峰的抗氧化活性,选取抗氧化活性高的组分,进行下一步分离纯化。
1.2.4.3离子交换色谱将洗脱峰收集后浓缩,用于离子交换色谱,上样量为2 mL。洗脱液为NaCl溶液(溶解在0.05 mol/L,pH8.0 Tris-HCl缓冲液中),流速为0.8 mL/min,每管收集4 mL,按表1进行洗脱,于214 nm检测其吸光值。收集各峰,旋转蒸发浓缩后检测活性,选取活性较高的组分进行下一步分离纯化。

表1 DEAE Sephacel离子交换色谱洗脱程序
1.2.4.4RP-HPLC将抗氧化活性较强的洗脱峰收集后,采用RP-HPLC进一步分离。色谱条件:C18反相色谱柱Inersil ODS-3(4.5 nm×250 nm),检测波长215 nm;流动相:A液,0.05% TFA超纯水;B液,0.05% TFA+100% CH3CN,以A、B液各50%进行洗脱,流速0.5 mL/min。
1.2.4.5质谱分析采用纳升液相色普-四极杆飞行时间串联质谱联用仪对抗氧化肽组分G1-2-1进行鉴定,实验条件如下:色谱条件:使用Thermofisher Dionex C18柱(150 mm×75 um,3 μm)作为色谱柱,流动相分别为含0.1%叶酸的乙腈溶液和含0.1%叶酸的双蒸水(过0.22 μm的水系滤膜),实验采用梯度洗脱的方式,流速为250 nL/min;柱后按分流比为1∶50进行分流;监测和记录205~400 nm范围内的紫外光谱;柱温为58 ℃。质谱条件:负离子模式检测;检测范围350~1500 m/z;样品孔电压20 V;源毛细管电压2100 V;MCP检测电压2100 V;喷雾气流量设为2 L/min;脱溶剂的气流量设为350 L/h;脱溶剂温度设为150 ℃;离子源温度是100 ℃;序列搜索软件:mascot2.4。
1.2.5多肽含量的测定根据Church[13]的OPA方法进行改进:将40 mg OPA溶于1 mL甲醇中,与2.5 mL 20%(w/w)SDS溶液和25 mL 0.1 mol/L四硼酸钠溶液混合,并添加0.1 mLβ-羟基乙醇,最后用去离子水定容至50 mL,制成OPA溶液。将50 μL组分与2 mL OPA液混合,室温反应2 min,立即于340 nm下测定吸光值。
1.2.6抗氧化活性的测定
1.2.6.1DPPH自由基清除率参照Saiga等[14]的方法进行测定,并将结果表示为抗坏血酸(AAE)当量。
1.2.6.2铁离子还原能力(FRAP)参照Benzie等[15]的方法进行测定。
1.2.7多肽的合成确认抗氧化肽的氨基酸序列之后,通过吉尔生化上海有限公司按测定多肽序列进行合成,方法采用固相多肽合成技术[16]。合成多肽后,对其进行抗氧化活性鉴定。
1.2.8数据统计分析实验均至少重复了三次平行实验,每次平行实验设置三组平行。利用IBM SPSS 19.0软件对数据进行单因素方差分析,p<0.05表示具有显著性差异。
2 结果与讨论
2.1虾副产物总蛋白提取时间优化
选取不同浓度的小牛血清蛋白(BSA)在562 nm处测定吸收值,绘制标准曲线见图1,虾副产物总蛋白浓度随时间变化见图2。结果显示,随着提取时间的增长,水溶性虾蛋白浓度逐渐上升,1.5 h时水溶性虾蛋白浓度达到23.14%±0.01%,2 h时水溶性虾蛋白浓度为23.49%±0.01%,此后3、4、6 h得到的水溶性虾蛋白浓度无显著增长(p>0.05)。故选取2 h为虾蛋白提取时间。
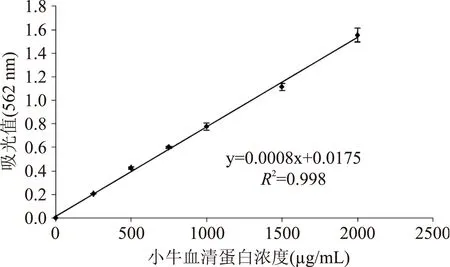
图1 BSA标准曲线Fig.1 Standard curve of BSA concentration

图2 不同时间下虾副产物总蛋白浓度曲线Fig.2 Protein concentration at different times
2.2酶解时间的确定
蛋白质水解度是指蛋白质酶解过程中,被裂解的肽键占总肽键数的百分比。亮氨酸浓度的标准曲线见图3。一个亮氨酸分子被认为含有一个α-氨基,因此以亮氨酸的浓度表示α-氨基的浓度,从而计算出相应的水解度。

图3 亮氨酸标准曲线Fig.3 Standard curve of Leucine
用α-胰凝乳蛋白酶对虾副产物提取液进行酶解,得到虾副产物水解度随时间变化的曲线见图4。如图所示,随着时间的增长,DH逐渐增大,在4 h时DH达到16.43%,6 h时为16.49%,两者无显著差异(p>0.05)。故选用4 h作为α-胰凝乳蛋白酶最佳水解时间,对虾副产物进行批量水解,供第二步酶解使用。

图4 虾副产物α-胰凝乳蛋白酶水解度曲线Fig.4 Effect of enzymolysis time on the DH of α-chymotrymotrypsin hydrolysate
用嗜热菌蛋白酶对α-胰凝乳蛋白酶酶解液进行第二步酶解,得到DH变化如图5所示。由图可知,随着时间的增长,DH逐渐上升,6 h时DH达到5.50%,8 h时为5.60%,6 h后变化不大(p>0.05)。因此选6 h为嗜热菌蛋白酶最佳酶解时间,批量制备酶解液,进行下一步分离纯化。第二步酶解的水解度低于第一步酶解,这可能与虾副产物蛋白的自身氨基酸序列和酶的特异性切割位点组成有关。

图5 嗜热菌蛋白酶水解度曲线Fig.5 Effect of enzymolysis time on the DH of Thermolysin hydrolysate
2.3抗氧化肽的分离纯化
2.3.1透析已报道的生物活性肽的相对分子质量(Mw)大多在3000 u以下,抗氧化肽多是2000 u以下的短肽[17]。故选用1000 u和500 u的CE透析袋依次对酶解液进行透析,得到<500 u和500~1000 u两种组分。为比较不同组分的抗氧化活性,需确定其肽浓度。首先,以HPLC标准肽混合物H2016作为参照,绘制了肽浓度的标准曲线(见图6)。所得标准曲线中,肽标准物浓度和吸光度值的相关系数R2=0.9999,线性相关性较强,可用公式y=0.2904 x+0.001计算透析后各组分的浓度。然后,建立了抗坏血酸DPPH自由基清除能力标准曲线(如图7)和FRAP体系测抗氧化能力所用的标准曲线(如图8)。

图6 多肽浓度标准曲线Fig.6 Standard curve of peptide mixture concentration

图7 抗坏血酸的DPPH自由基清除能力标准曲线Fig.7 Standard curve of DPPH radical scavenging ability of AAE
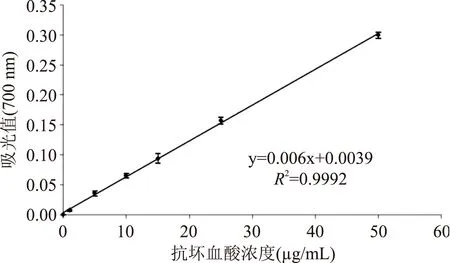
图8 抗坏血酸的铁离子还原能力标准曲线Fig.8 Standard curve of ferric reducing antioxidant power of AAE
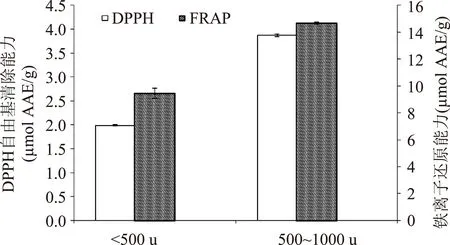
图9 两种组分的抗氧化活性Fig.9 The antioxidant activity of two components
如图9所示,两种不同相对分子质量的虾副产物水解组分均显示出一定的DPPH自由基清除能力和铁离子还原能力。其中<500 u组分的DPPH自由基清除能力为(1.99±0.01) μmol AAE/g,铁离子还原能力为(9.46±0.37) μmol AAE/g;500~1000 u组分表现出较强的抗氧化活性,上述两指标值分别为(3.87±0.03) μmol AAE/g和(14.65±0.08) μmol AAE/g。选择500~1000 u的组分进行下一步分离纯化。
2.3.2凝胶过滤层析所得500~1000 u的组分经Sephadex G-15凝胶过滤层析色谱柱分离,洗脱曲线和抗氧化活性分别如图10和图11所示。由结果可知,通过凝胶层析,共得到3个分离组分(G1至G3)。活性鉴定表明G1具有最强的抗氧化活性,其DPPH自由基清除能力为(7.96±0.06) μmol AAE/g,铁离子还原能力为(53.11±0.21) μmol AAE/g,因此选择G1进行下一步的分离纯化。

图10 Sephadex G-15凝胶过滤色谱Fig.10 Elution profile of peptides on Sephadex G-15 chromatography

图11 Sephadex G-15洗脱组分的抗氧化活性Fig.11 The antioxidant activity of components purified by Sephadex G-15 chromatography

图12 G1的DEAE Sephacel离子交换色谱图Fig.12 Elution profile of fraction G1through DEAE Sephacel chromatography

图13 DEAE Sephacel洗脱组分的抗氧化活性Fig.13 The antioxidant activity of components purified by DEAE Sephacel chromatography
2.3.3离子交换色谱多次收集组分G1进行旋转蒸发浓缩,所得浓缩液用DEAE Sephacel离子色谱柱分离,结果见图12。其中H1是未吸附组分,H2、H3和H4是吸附组分。收集各组分测定其抗氧化活性,见图13。由结果可知,H2具有最高的清除活性,DPPH自由基清除能力为(10.54±0.03) μmol AAE/g,FRAP为(89.29±0.01) μmol AAE/g。因此选择H2进行下一步的分离纯化。
2.3.4RP-HPLC将经旋转蒸发浓缩、透析脱盐后的组分H2,用Inersil ODS-3柱反相高效液相色谱进行分离,结果如图14所示。
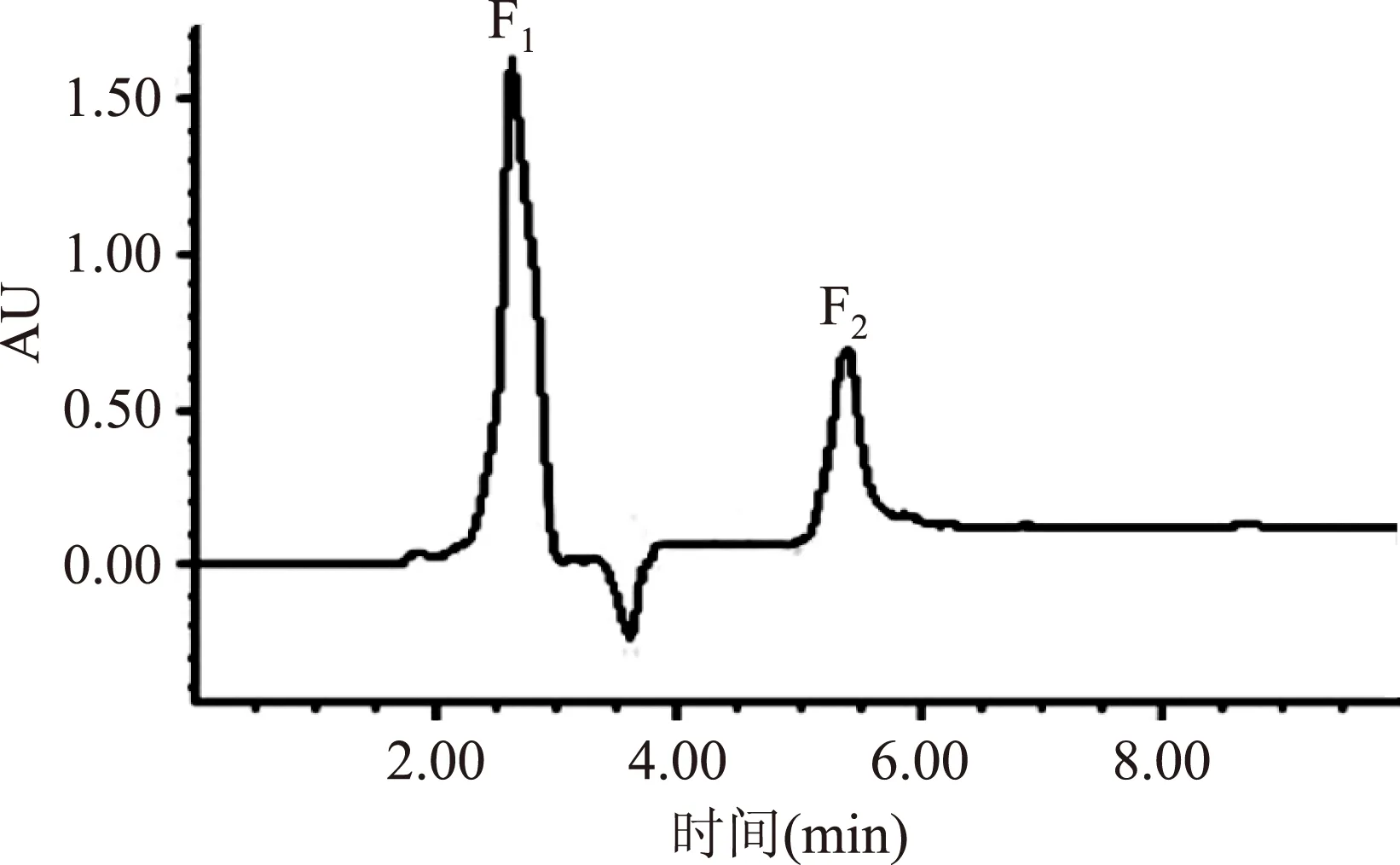
图14 H2的RP-HPLC色谱图Fig.14 Elution profile of fraction H2 by RP-HPLC
分离后共得到F1和F2两个峰,多次收集两个峰进行旋转蒸发浓缩,所得两组分浓缩液肽浓度稀释至同一水平,分别测定其抗氧化活性,结果如图15所示。F1具有较高的抗氧化活性,其DPPH自由基清除能力为(14.91±0.09) μmol AAE/g,铁离子还原能力为(112.53±0.54) μmol AAE/g。

图15 HPLC洗脱组分的抗氧化活性Fig.15 Antioxidative activities of the fractions isolated by RP-HPLC
2.3.5质谱分析及活性鉴定由表2可知,通过α-胰凝乳蛋白酶和嗜热菌蛋白酶两步酶解之后,组分F1中含有3个主要的肽,分别为十四肽YSLKMGGVSVVVIA,十三肽DISHNQRGAILVR,十肽GCKVALIVVG。确认抗氧化肽的氨基酸序列后,对多肽进行合成。分别测定三种不同多肽的抗氧化活性,结果如表2,由测定结果可知,十肽GCKVALIVVG具有最高的抗氧化性,其DPPH自由基清除能力为(16.10±0.02) μmol AAE/g,铁离子还原能力为(245.37±0.03) μmol AAE/g。通过测定短肽的DPPH自由基清除能力和铁离子还原能力,发现结果具有一致性,当一种活性指标高时,另外一个活性指标也高。其DPPH自由基清除能力与Faithong[18]等人从泰国传统发酵磷虾产品中和Jiang[19]等人酶解蓝圆鲹肌肉获得的抗氧化肽测定结果相近。铁离子还原能力高于Ajibola等人[20]研究的非洲山药豆水解组分,低于Bougatef等人[21]从美国星鲨肌肉获得的组分。

表2 三种多肽抗氧化活性测定
3 结论
本实验选用α-胰凝乳蛋白酶与嗜热菌蛋白酶在优化条件下依次对虾副产物进行酶解,经过透析、凝胶层析色谱、离子交换层析和RP-HPLC分离纯化得到抗氧化活性高的组分,经质谱分析,其抗氧化能力较强组分为十肽GCKVALIVVG,该肽的DPPH自由基清除能力为(16.10±0.02) μmol AAE/g pro,铁离子还原能力为(245.37±0.03) μmol AAE/g pro。
[1]Mendis E,Rajapakse N,Kim SK. Antioxidant properties of a Radical-Scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agriculture and Food Chemistry,2005,53(3):581-587.
[2]任清,张晓平. 酶解燕麦蛋白质制备抗氧化肽工艺研究[J]. 中国食品学报,2014(12):65-72.
[3]茅宇虹,杨文鸽,徐大伦,等. 秘鲁鱿鱼皮明胶抗氧化肽的制备及其分子质量分布[J]. 中国食品学报,2014(9):48-55.
[4]左琦,吴秉宇,张建华,等. 特异性蛋白酶酶解虾副产物制备 ACE 抑制肽[J]. 食品工业科技,2014,35(10):181-185.
[5]LI Yaowang,LI Bo,HE Jiguo,et al. Quantitative structure-activity relationship study of antioxidative peptide by using different sets of amino acids descriptors[J]. Journal of Molecular Structure,2011,998(1):53-61.
[6]LI Yaowang,LI Bo,HE Jiguo,et al. Structure-activity relationship study of antioxidative peptides by QSAR modeling:the amino acid next to C‐terminus affects the activity[J]. Journal of Peptide Science,2011,17(6):454-462.
[7]Sarmadi B H,Ismail A. Antioxidative peptides from food proteins:a review[J]. Peptides,2010,31(10):1949-1956.
[8]GB 5009.5-2010,食品中蛋白质的测定[S].
[9]Adler-Nissen J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry,1979,27(6):1256-1262.
[10]Benjakul,S. and M.T. Morrissey,Protein hydrolysates from Pacific whiting solid wastes. Journal of Agricultural and Food Chemistry,1997. 45(9):p. 3423-3430.
[11]Adler-Nissen J. Enzymic hydrolysis of food proteins[M]. Elsevier Applied Science Publishers,1986.
[12]吴秉宇,左琦,钱炳俊,等. 羧肽酶 A/B 水解虾副产物制备ACE抑制肽[J]. 上海交通大学学报:农业科学版,2015,33(5):54-59.
[13]Church F C,Swaisgood H E,Porter D H,et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[14]Saiga A I,Tanabe S,Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry,2003,51(12):3661-3667.
[15]Benzie I F F,Strain J J. The ferric reducing ability of plasma(FRAP)as a measure of “antioxidant power”:the FRAP assay[J]. Analytical biochemistry,1996,239(1):70-76.
[16]程云辉,曾知音,郭建伟,等. 抗氧化肽的酶法制备及其构效关系的研究进展[J]. 食品与机械,2009(6):174-180.
[17]Faithong N,Benjakul S,Phatcharat S,et al. Chemical composition and antioxidative activity of Thai traditional fermented shrimp and krill products[J]. Food Chemistry,2010,119(1):133-140.
[18]Jiang H,Tong T,Sun J,et al. Purification and characterization of antioxidative peptides from round scad(Decapterus maruadsi)muscle protein hydrolysate[J]. Food Chemistry,2014,154:158-163.
[19]Ajibola C F,Fashakin J B,Fagbemi T N,et al. Effect of peptide size on antioxidant properties of African yam bean seed(Sphenostylis stenocarpa)protein hydrolysate fractions[J]. International Journal of Molecular Sciences,2011,12(10):6685-6702.
[20]Stewart J M,Young J D. Solid phase peptide synthesis[M]. Pierce Chemical Company,1984.
[21]Bougatef A,Hajji M,Balti R,et al. Antioxidant and free radical-scavenging activities of smooth hound(Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J]. Food Chemistry,2009,114(4):1198-1205.
Preparation of antioxidant peptides from Shrimp byproducts by enzymolysis
LIU Ya-nan1,WANG Yan-hui2,Yalikunjiang Ashan2,QIAN Bing-jun2, YAO Xiao-min2,ZHANG Jian-hua2,ZHONG Yao-guang1,*
(1. College of Food Science & Technology,Shanghai Ocean University,Shanghai 201306,China; 2. School of Agriculture & Biology,Shanghai JiaoTong University,Shanghai 200240,China)
To prepare antioxidant peptides by specific enzyme hydrolysis,using shrimp byproducts as raw material. Alpha-chymotrypsin and thermolysin were chosen to hydrolysis the shrimp byproducts. The fractions showing high antioxidative activity were isolated from the hydrolysates by dialysis and using consecutive chromatographic methods including Sephadex G-15 gel filtration,DEAE Sephacel ion exchange chromatography,and Inersil ODS-3 reverse phase high-performance liquid chromatography. The antioxidant activity was assayed based on 1,1-diphenyl-2-picrylhydrazyl(DPPH)radical scavenging ability and ferric-reducing antioxidant power(FRAP). The fraction(F1)obtained after a series of separation showed high antioxidant activity. Three peptides were found in fraction F1by time-of-flight mass spectrometry analysis. The decapeptide had the highest concentration and antioxidant activity. Its DPPH radical scavenging activity was(16.10±0.02) μmol AAE/g protein and FRAP was(245.37±0.03) μmol AAE/g protein. The peptide which showed high antioxidant activity were obtained from shrimp byproducts,the results provided theoretical basis for the production and application of the byproduct of shrimp.
Shrimp byproducts;enzymatic hydrolysis;separation and purification;antioxidant peptides
2016-04-08
刘亚楠(1990-),女,硕士研究生,研究方向:食品工程,E-mail:Liu_Yanan1990@163.com。
钟耀广(1965-),男,博士,教授,研究方向:食品安全,E-mail:ygzhong@shou.edu.cn。
国家海洋局公益性行业科研专项经费项目(201205031)。
TS201.1
A
1002-0306(2016)17-0090-06
10.13386/j.issn1002-0306.2016.17.009
