海参精多糖提取工艺优化及其体外抗肿瘤活性
2016-10-31刘京熙赵云苹井月欣王共明王茂剑
王 婷,刘京熙,张 健,3,刘 昕,赵云苹,井月欣,王共明,王茂剑,3,4,*
(1.上海海洋大学食品学院,上海 200000;2.山东省海洋资源与环境研究院,山东烟台 264006;3.山东省海洋生态修复重点实验室,山东烟台 264006;4.山东省淡水渔业研究院,山东济南 250013)
海参精多糖提取工艺优化及其体外抗肿瘤活性
王婷1,2,刘京熙2,张健2,3,刘昕2,赵云苹2,井月欣2,王共明2,王茂剑2,3,4,*
(1.上海海洋大学食品学院,上海 200000;2.山东省海洋资源与环境研究院,山东烟台 264006;3.山东省海洋生态修复重点实验室,山东烟台 264006;4.山东省淡水渔业研究院,山东济南 250013)
为确定海参精多糖(SCSP)提取的最佳条件,并评价其体外抗肿瘤活性,在酶筛选和单因素实验的基础上,以多糖得率为指标,选择加酶量、酶解温度和酶解时间为影响因素进行响应面优化实验,并通过MTT法检测海参精粗多糖(SCSCP)及其纯化组分(SCSP A1、SCSP A2)对人子宫颈癌Hela细胞和人肝癌HepG2细胞的体外生长抑制作用。结果表明,SCSCP的最佳提取条件为:木瓜蛋白酶、加酶量3%、酶解温度49 ℃、酶解时间6 h,在此条件下其得率可达10.643‰。MTT法体外评价显示,SCSCP及其纯化组分对培养不同时间的Hela细胞和HepG2细胞表现出不同的抑制效果,其中SCSP A2对两种细胞的抑制率最高。当SCSP A2浓度为10 mg/mL时,对培养72 h的Hela细胞和HepG2细胞的抑制率分别为80.28%和83.11%,表明SCSP具有显著的体外抗肿瘤活性。
海参精,多糖,酶解,响应面法,抗肿瘤
海参为棘皮动物门海参纲动物,分布于热带区和温带区,其生存历史悠久[1],具有较高的食用和药用价值,自古就是一种重要的滋补保健品,被列于“海八珍”之首[2]。随着人们认识和科学技术水平的提高,海参中越来越多的活性物质受到广泛关注,其中海参多糖作为重要的活性物质之一,对其研究正在逐渐系统和深入。有研究表明,海参多糖具有抗血栓[3]、抗凝血[4]、抗氧化[5]等活性作用[3-5]。
通常,海参多糖以与蛋白非共价结合的方式存在于海参体壁、内腔以及其生殖腺中,其中生殖腺包括海参卵和海参精。海参多糖的获得需要采用适当的提取方法将海参多糖从蛋白多糖中释放[6]。目前海参多糖提取方法多采用酶解法和化学水解法[7],两种方法都是以破坏蛋白和多糖的结合为前提,化学水解法通过稀NaOH 或KOH破坏蛋白质分子,再进一步利用海参多糖的水溶性和醇不溶性获得多糖,但通过化学水解法提取多糖可能会引起海参多糖的降解,破坏其结构。相比而言,酶解法是提取海参多糖的有效方法,其作用条件温和且酶解效果理想[8]。
目前关于海参多糖提取工艺和活性评价的研究多集中在海参体壁[9]、海参肠道[10],对海参生殖腺多糖鲜有报道,且未见关于海参精多糖的研究报道。因此,本研究以海参精为研究对象,对酶解法提取海参精多糖工艺进行响应面法优化实验设计,通过体外抗肿瘤实验分析海参精多糖的抗肿瘤活性,进一步提高海参副产物利用率,旨在为海参精的开发和综合利用提供参考。
1 材料与方法
1.1材料与仪器
海参精购自烟台山水海产有限公司,取自仿刺参;木瓜蛋白酶(100万 U/g)南宁庞博生物工程有限公司;复合蛋白酶(1.5 AU/g)丹麦诺维信公司;人子宫颈癌Hela细胞、人肝癌HepG2细胞中国科学院上海细胞库;DEAE-纤维素、噻唑蓝(MTT)、二甲基亚砜(DMSO)、小牛血清美国Sigma公司;DMEM高糖培养基美国Gibco公司;96孔细胞培养板Costar公司;苯酚、硫酸、氯化钠、无水乙醇国药集团化学试剂有限公司。
DS-1高速组织捣碎机上海标本模型厂;TGL-16M台式高速冷冻离心机湖南湘仪仪器有限公司;TU-1810SPC紫外可见分光光度计北京普析通用仪器有限公司;Hel-VAP旋转蒸发仪德国Heidolph公司;FD-2A真空冷冻干燥机北京博医康实验仪器有限公司;切向流超滤系统Pall Minimate美国Pall公司;GalaxyB CO2培养箱英国RS Biotech公司。
1.2实验方法
1.2.1SCSCP提取工艺流程海参精→匀浆→酶解→离心(取上清液)→抽滤→超滤(取大于10 ku)→滤液浓缩(旋转蒸发)→TCA除蛋白[11]→醇沉多糖→烘干→海参精粗多糖SCSCP。
1.2.2酶的筛选取10 g海参精匀浆液,选用木瓜蛋白酶和复合蛋白酶的不同混合比例,在加酶量3%、酶解温度50 ℃、酶解时间7 h条件下,测定酶解液中SCSCP的含量,比较两种酶不同混合比例对SCSCP提取效率的影响,选择最佳用酶。
1.2.3SCSCP含量测定采用苯酚-硫酸法[12]测定酶解液中多糖浓度,并计算SCSCP得率。
多糖得率(%)=酶解液多糖浓度×稀释倍数/样品质量×酶解液体积×1000
1.2.4SCSCP提取工艺优化
1.2.4.1单因素实验设计取10 g海参精匀浆液,选取加酶量(0.5%、1%、2%、3%、4%、5%)、酶解温度(20、30、40、50、60、70 ℃)、酶解时间(3、4、5、6、7、8 h)三个因素分别进行单因素实验考察各个因素对酶解法提取SCSCP的影响,测定多糖含量并计算得率。
1.2.4.2响应面优化实验设计根据单因素实验结果和Box-Behnken实验设计原理为基础进行三因素三水平的17组(每组三个平行)实验,以SCSCP得率为响应值研究加酶量、酶解温度、酶解时间三个因素对SCSCP得率的影响,预测SCSCP提取的最佳条件,优化SCSCP的提取工艺。实验设计因素与水平见表1。

表1 响应面设计因素与水平
1.2.5SCSCP的纯化将SCSCP用蒸馏水复溶,进一步进行DEAE-离子交换层析分离。DEAE-纤维素凝胶装柱平衡后,称取200 mg SCSCP溶于6 mL去离子水中上样,分别用水和不同浓度的NaCl溶液(0.25、0.5、0.75、1 mol/L)依次洗脱,每个梯度洗脱液用自动部分收集器分开收集于试管中,用苯酚-硫酸法检测各管在490 nm处的吸光值,将每个梯度较高吸光值对应的流出液合并收集,透析、浓缩,真空冷冻干燥后获得多糖组分[13-14]。
1.2.6体外抗肿瘤活性的测定
1.2.6.1细胞培养从液氮中取出细胞冻存管,立即放于37 ℃水浴中不停摇晃使其迅速融化,将冻存管消毒后转移至无菌超净台中,将冻存管中的细胞加入含有培养基的离心管中离心后收集细胞,加入新鲜的DMEM完全培养基于37 ℃、5% CO2培养箱中培养,待生长至覆盖培养瓶底80%时进行传代。
1.2.6.2抗肿瘤活性测定MTT比色法体外检测肿瘤细胞的存活率[15]。取对数生长期的人子宫颈癌细胞Hela和人肝癌细胞HepG2,经0.25%胰蛋白酶消化后,用DMEM完全培养基制成单细胞悬液,用血球计数板计数,调整细胞浓度为 0.8~1.0×105个/mL,接种于96孔细胞培养板内,每孔100 μL,96孔板四周加相同体积的灭菌的PBS,于37 ℃、5% CO2及饱和湿度条件下培养12 h,之后弃去原培养液。实验设置样品组、阴性对照组、空白组、阳性对照组,向阴性对照组中加入新鲜的DMEM完全培养液100 μL,样品组依次加入多糖浓度为10、5、2.5、1.25、0.626、0.3125 mg/mL的DMEM培养液100 μL,空白组无细胞只有DMEM完全培养液,阳性对照组为20 μg/mL的5-氟尿嘧啶100 μL[16],每组6个平行孔,分别培养24、48、72 h。
培养结束后,每孔加入20 μL MTT(5 mg/mL)试剂,于37 ℃培养箱中继续孵育4 h后吸去上清液,每孔加入100 μL DMSO,振荡摇匀后避光反应20 min,用酶标仪于570 nm波长处测定各孔的吸光度值(OD570)。
细胞生长抑制率(%)=(1-样品组OD值-空白组OD值/阴性对照组OD值-空白组OD值)×100
1.3数据处理与统计分析
采用Excel 2003、OriginPro 8.6 和Design-Expert 8.05软件对实验数据进行整理。整理后的数据应用SPSS 17.0对数据进行单因素方差分析、多重比较,显著性水平为α=0.05。
2 结果与分析
2.1酶的筛选
木瓜蛋白酶和复合蛋白酶是水产食品酶解实验最常用的两种酶,其最适pH接近于海参生殖腺组织的初始pH,因此选取这两种酶进行实验。由图1可知,木瓜蛋白酶的比重越大SCSCP得率越高,当木瓜蛋白酶和复合蛋白酶的混合比例为1∶0时,SCSCP得率最高,因此选用木瓜蛋白酶单酶进行单因素实验。

图1 不同混合比例多糖得率比较Fig.1 Polysaccharide yield comparation of different blending ratio
2.2酶解法提取SCSCP的单因素实验结果
2.2.1加酶量对SCSCP得率的影响由图2可知,随着加酶量(0.5%~3%)的增多,SCSCP得率逐渐提高,因为当加酶量增加时酶与底物充分接触,促进了酶解反应进行。当加酶量达到3%时,多糖得率达到最高值,随后当加酶量大于3%后,多糖得率没有显著变化(p>0.05)。这主要是因为酶与底物达到饱和,以至于提高加酶量并没有提高得率。综合考虑,选择加酶量2%~4%作为响应面优化实验的因素值。

图2 加酶量对SCSCP得率的影响Fig.2 Effect of enzyme dosage on the yield of SCSCP
2.2.2酶解温度对SCSCP得率的影响由图3可知,在酶解温度20~50 ℃时,多糖得率随酶解温度的升高而提高,多糖得率在50 ℃时达到最高值;当温度继续升高时,多糖得率呈下降趋势,这可能是因为温度在高于60 ℃时,木瓜蛋白酶的活性受到影响而下降,这与陈涛等[17]研究得到的温度对木瓜蛋白酶提取海参肠道多糖的影响规律一致。因此将提取温度设定在40~60 ℃范围作为响应面优化实验的因素值。

图3 酶解温度对SCSCP得率的影响Fig.3 Effect of extraction temperature on the yield of SCSCP
2.2.3酶解时间对SCSCP得率的影响由图4可知,随着酶解时间的延长,酶与底物逐渐充分反应,SCSCP得率随之增加,酶解时间为6 h时多糖得率最高;随后增加酶解时间,多糖得率稍有下降,但通过单因素方差分析得知,在6 h后差异不显著(p>0.05),因此选择酶解时间为5~7 h作为响应面优化实验的因素值。
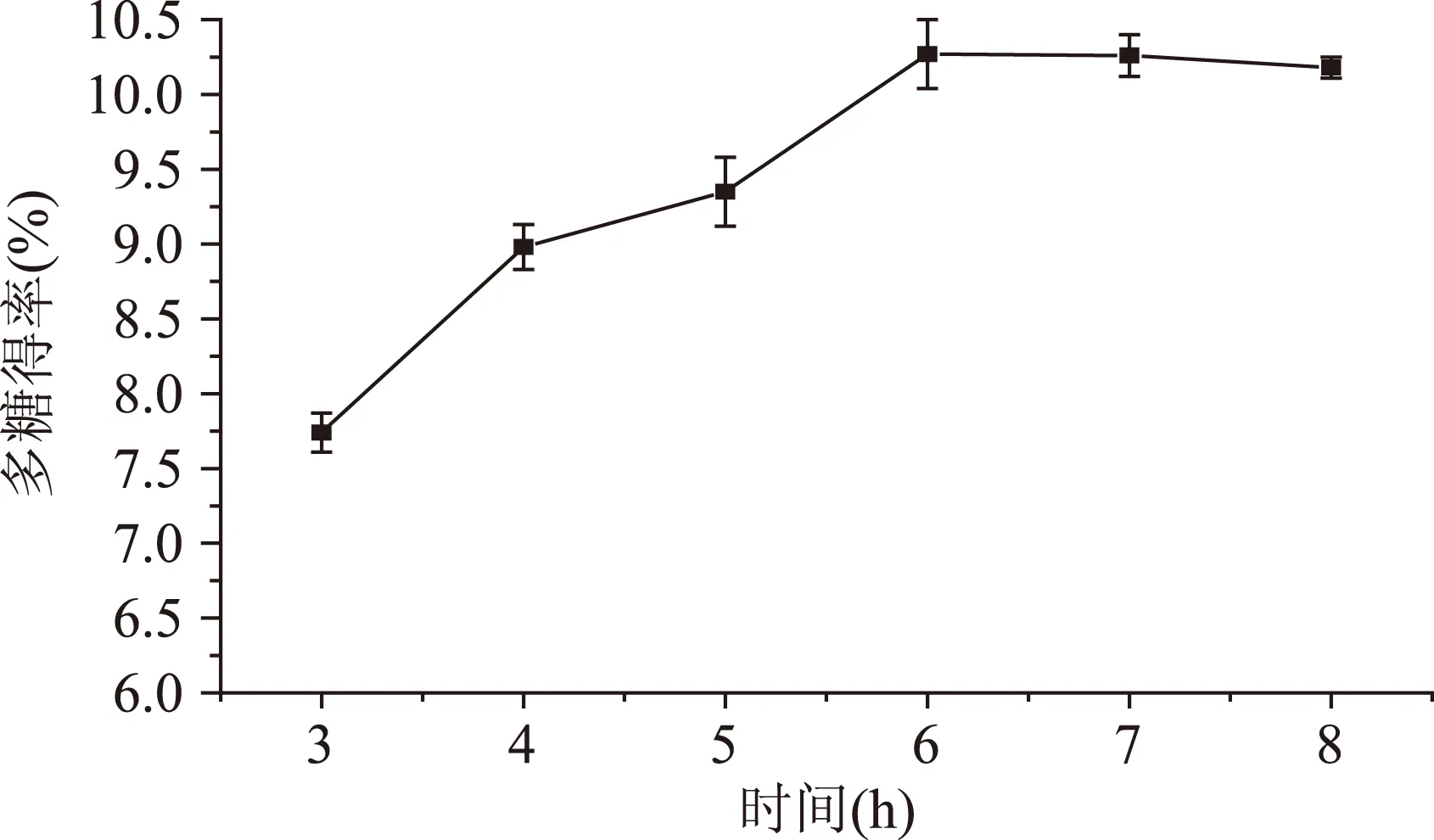
图4 酶解时间对SCSCP得率的影响Fig.4 Effect of extraction time on the yield of SCSCP
2.3酶解法提取SCSCP的响应面优化实验结果
2.3.1响应面实验设计与结果在单因素实验的基础上,以加酶量(A)、酶解温度(B)、酶解时间(C)三个因素为自变量,SCSCP得率为响应值寻找最佳测试条件,实验结果见表2。对表2中的实验数据进行二次多项式回归拟合得到回归模型方程为:
多糖得率=10.64-0.011A-0.12B+0.058C-0.29AB-0.27AC+0.38BC-1.28A2-0.53B2-1.00C2


表2 响应面实验设计与结果

表3 回归方程方差分析表
注:**p<0.01,差异极显著;*p<0.05,差异显著。
2.3.2响应曲面分析响应面图可直观的反映因素之间的交互作用,响应面有明显的倾斜度表明因素对响应值影响大。由图5的三个响应面图可知,温度的变化曲面比时间和加酶量的曲面更陡峭,加酶量的变化曲面相对来说最平缓,这与方差分析结果相符合,且三个等高线为椭圆,表示三个因素两两交互作用显著也与方差分析结果符合。
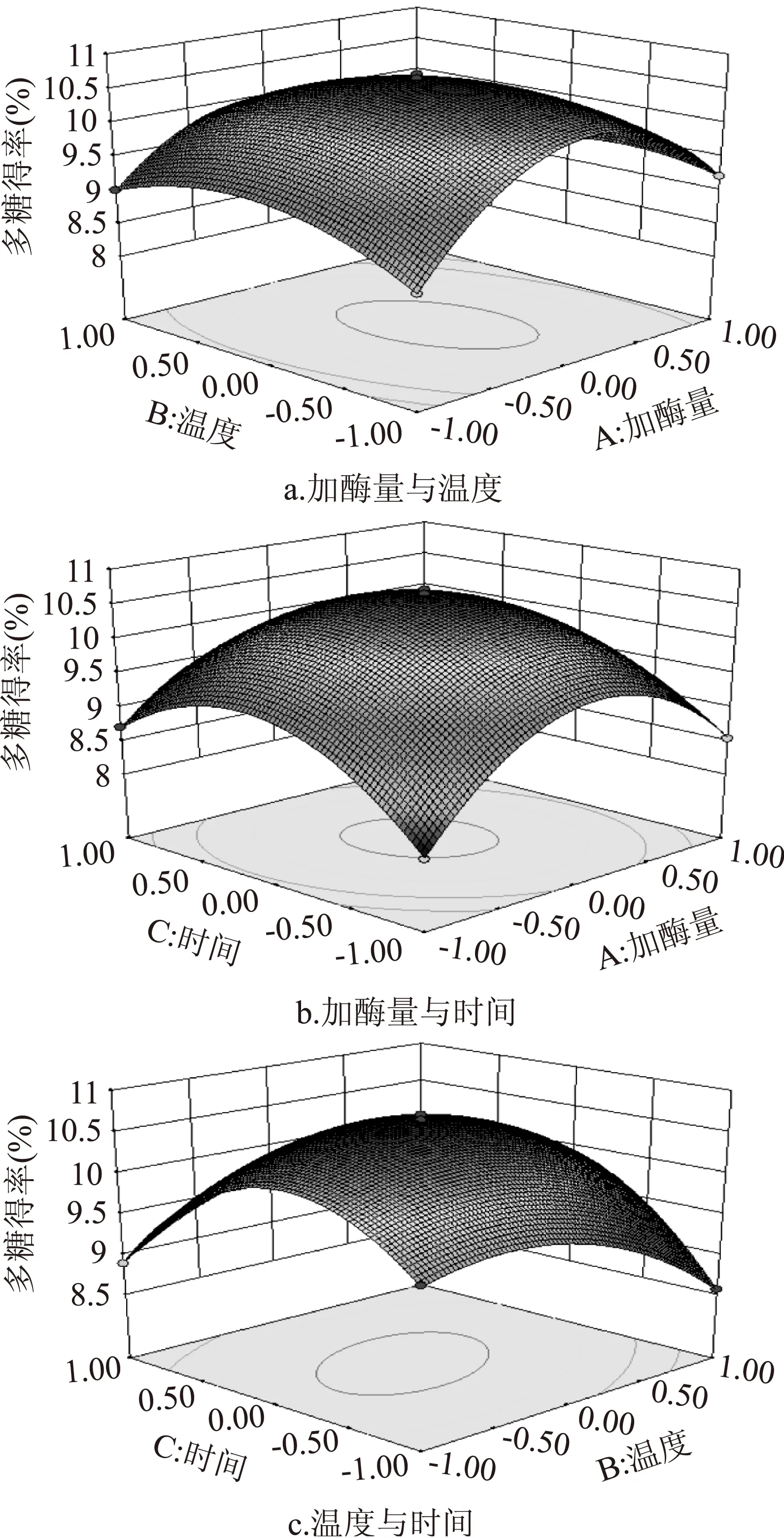
图5 各因素交互作用对多糖得率影响的响应面和等高线图Fig.5 Response surface and contour plots showing the interactive effects of independent variables on polysaccharide yield
2.3.3最佳酶解工艺条件验证实验通过回归模型预测得到的最佳工艺条件为加酶量3.01%、酶解温度48.86 ℃、酶解时间6.01 h,结合实际中的可操作性将酶解条件修改为加酶量3%、酶解温度49 ℃、酶解时间6 h,通过三次平行实验得到多糖得率为10.643‰,和模型预测值10.649‰接近,说明该模型具有指导意义。
2.4DEAE-离子交换层析结果
用去离子水和不同浓度NaCl溶液洗脱后的流出液用苯酚-硫酸法检测得到两个多糖组分,SCSP A1和SCSP A2,结果如图6所示。

图6 DEAE-离子交换层析分离结果Fig.6 Separation results of DEAE-cellulose chromatography
SCSP A1为0.25 mol/L NaCl溶液洗脱得到,其中多糖含量为40.03%,SCSP A2为0.5 mol/L NaCl溶液洗脱得到,其中多糖含量为45.27%。SCSP A1和SCSP A2都集中在盐相中,表明得到的组分为酸性多糖[19]。有研究表明,海参体壁中的多糖是由-N-乙酰氨基半乳糖、D-葡萄糖醛酸和L-岩藻糖构成的分支杂多糖或直接由L-岩藻糖所构成的直链多糖,而且糖链上的部分羟基被硫酸酯化[20-21],说明海参精多糖糖链构成单位和化学修饰基团可能与海参体壁中多糖相似。通过获得SCSP A1和SCSP A2的洗脱液浓度对比可知,SCSP A1组分在离子交换柱中的综合吸附效果低于SCSP A2组分,这也间接说明SCSP A2中羧酸基团和硫酸根的含量总和要高于SCSP A1。
2.5SCSP体外抗肿瘤活性分析
2.5.1SCSCP对Hela细胞和HepG2细胞增殖的影响由图7可知,SCSCP对Hela细胞和HepG2细胞均具有一定的增殖抑制效果,且呈现明显的剂量和时间依赖关系。对同一培养时间,抑制率随SCSCP浓度的提高而逐渐增加,其对Hela细胞和HepG2细胞的抑制分别在5 mg/mL和2.5 mg/mL前比其后的增幅大;相同添加浓度下,抑制率随培养时间的延长而逐渐升高,说明多糖浓度越高和培养时间越长,其抑制率越高,在多糖浓度为10 mg/mL,培养时间为72 h时,对Hela细胞和HepG2细胞的抑制率可以达到63.36%和67.02%。由上可知,SCSCP可有效抑制Hela细胞和HepG2细胞的生长。

图7 SCSCP对Hela细胞和HepG2细胞抑制率的影响Fig.7 Effect of SCSCP on the inhibition rates of Hela cells and HepG2 cells
2.5.2SCSP A1和SCSP A2对Hela细胞和HepG2细胞增殖的影响图8、图9为不同浓度SCSP A1和SCSP A2对Hela细胞和HepG2细胞抑制率的影响图,由图8可知,随着SCSP A1浓度的升高,其对Hela细胞和HepG2细胞的抑制率均上升,存在明显的量效关系。在同一添加浓度下,不同的培养时间得到的结果有所不同,总体上随着时间的延长,其抑制作用越来越强。在图9中,SCSP A2与SCSP A1得到的趋势图类似,表明SCSP A1和SCSP A2均具有良好的体外抗肿瘤作用。当浓度为10 mg/mL时,SCSP A1对培养72 h的Hela细胞和HepG2细胞抑制率分别达到75.97%和80.62%,SCSP A2对培养72 h的Hela细胞和HepG2细胞抑制率分别达到80.28%和83.11%,阳性对照组对培养72 h的Hela细胞和HepG2细胞抑制率分别为75.64%和79.75%。

图8 SCSP A1对Hela细胞和HepG2细胞存活率的影响 Fig.8 Effect of SCSP A1 on the inhibition rates of Hela cells and HepG2 cells

图9 SCSP A2对Hela细胞和HepG2细胞存活率的影响Fig.9 Effect of SCSP A2 on the inhibition rates of Hela cells and HepG2 cells
综上所述,SCSCP及其纯化组分对Hela细胞和HepG2细胞均有不同程度的抑制作用,但SCSP A1、SCSP A2对细胞的抑制作用高于SCSCP。SCSP A2的肿瘤抑制效果比SCSP A1更好,这可能是由于SCSP A2中阴离子含量高于SCSP A1,相关研究也有类似结果表明不同多糖组分的硫酸基含量、单糖组成、具体结构等不同影响其抗肿瘤活性[22]。海参精多糖对HepG2细胞的抑制作用比对Hela细胞略强,表明HepG2细胞对其敏感性更高。有研究表明不同来源的多糖对Hela细胞和HepG2细胞抑制机理可能是通过肿瘤凋亡因子基因的调节和线粒体途径诱导细胞凋亡[23-27],推测可能SCSP对Hela细胞和HepG2细胞抑制机理有所区别。
3 结论
具有抗肿瘤活性的多糖广泛存在于动物、植物和微生物中,是目前抗肿瘤药物研究的热点,相比于细胞毒类等传统的肿瘤临床治疗药物,其具有对人体的毒副作用相对较小的特点,是治疗肿瘤的潜在药物[28]。研究表明,海参体内含有多种抗肿瘤活性多糖,王宝磊[29]研究发现,刺参酸性粘多糖对人干癌细胞HepG2的抑制作用呈现时间和剂量的依赖关系,Dong等[30]从海参体壁中提取的多糖组分及其降解片段对人胃癌SGC-7901细胞均具有良好的体外抗肿瘤活性。
本研究利用单因素实验和响应面实验数据建立数学模型,优化出酶解法提取SCSCP的最优组合:木瓜蛋白酶、加酶量3%、酶解温度49 ℃、酶解时间6 h,此条件下其得率为10.643‰,接近模型预测值。选择不同梯度的NaCl洗脱液对SCSCP进行DEAE-离子交换层析得到两种多糖组分SCSP A1、SCSP A2,体外抗肿瘤活性实验证明其对Hela细胞和HepG2细胞均具有一定的抑制作用,且存在明显的量效关系,表明海参精多糖对新型抗肿瘤药物的开发具有潜在的重要意义。因此,应进一步研究海参精多糖的理化性质、结构组成及其构效关系,以期促进海参精的深度开发和利用。
[1]廖玉麟. 我国的海参[J]. 生物学通报,2001,36(9):1-3.
[2]Kiew P L,Don M M. Jewel of the seabed:sea cucumbers as nutritional and drug candidates[J]. International Journal of Food Sciences and Nutrition,2012,63(5):616-636.
[3]Chen S G,Li G Y,Wu N,et al. Sulfation pattern of the fucose branch is important for the anticoagulant and antithrombotic activities of fucosylated chondroitin sulfates[J]. Biochimica et Biophysica Acta,2013,1830(4):3054-3066.
[4]Wu M Y,Huang R,Wen D D,et al. Structure and effect of sulfated fucose branches on anticoagulant activity of the fucosylated chondroitin sulfate from sea cucumber Thelenata ananas[J]. Carbohydrate Polymers,2012,87(1):862-868.
[5]Zou S M,Pan R J,Dong X D,et al. Physicochemical properties and antioxidant activities of two fucosylated chondroitin sulfate from sea cucumber Acaudina molpadioidea andHolothurianobilis[J]. Process Biochemistry,2015.
[6]盛文静. 不同海参多糖提取分离及化学组成分析比较[D].青岛:中国海洋大学,2007.
[7]Dong X D,Pan R J,Deng X Y. Separation,purification,anticoagulant activity and preliminary structural characterization of two sulfated polysaccharides from sea cucumberAcaudinamolpadioideaandHolothurianobilis[J]. Process Biochemistry,2014,49(8):1352-1361.
[8]张军瑞,陈健. 木瓜蛋白酶酶解白底辐肛参提取多糖的研究[J]. 现代食品科技,2009,05:542-545.
[9]Chang Y G,Hu Y F,Yu L,et al. Primary structure and chain conformation of fucoidan extracted from sea cucumber Holothuria tubulosa[J]. Carbohydrate Polymers,2016,136:1091-1097.
[10]林威威,张健,王茂剑,等. 仿刺参肠道多糖的纯化及理化分析[J]. 食品科学,2011,17:118-122.
[11]Kale V,Freysdottir J,Paulsen B S,et al. Sulphated polysaccharide from the sea cucumber Cucumaria frondosa affect maturation of human dendritic cells and their activation of allogeneic CD4(+)T cellsinvitro[J]. Bioactive Carbohydrates and Dietary Fibre,2013,2(2):108-117.
[12]李亚辉,马艳弘,黄开红,等. 芦荟多糖的超声波辅助纤维素酶提取及抗肿瘤活性研究[J]. 中国食品学报,2015,15(11):91-97.
[13]Lou Y J,Huang G,Zhao Y L,et al. Protective role of the polysaccharides from sea cucumber,acaudina molpadioidea,in cecal ligation and puncture-induced sepsis[J]. Current Topics in Nutraceutical Research,2013,11(1/2):29-344.
[14]陈志刚,朱泉,王芬. 百合多糖纯化及分子质量测定[J]. 食品科学,2013,34(17):1-4.
[15]张莘莘. 黑灵芝多糖的抗肿瘤活性及其分子机制初探[D]. 南昌:南昌大学,2014.
[16]彭勤,彭惠,骆云鹏,等. 顺铂、5-氟尿嘧啶对人宫颈肿瘤细胞(Hela细胞)的相互作用[J]. 重庆医科大学学报,2001,28(1):45-47.
[17]陈涛,张健,王茂剑. 木瓜蛋白酶提取仿刺参消化道多糖[J]. 食品科学,2010,20:226-229.
[18]王占一,郑丹丹,王京龙,等. 响应面实验优化超声波辅助提取石榴皮中三萜类化合物工艺及动力学分析[J]. 食品科学,2015,36(22):11-17.
[19]蒋长兴. 青蛤多糖分离鉴定、硫酸酯化及其生物活性研究[D]. 南京:南京农业大学,2011.
[20]Sheng X H,Li M,Song S L,et al. Sulfated polysaccharide isolated from the sea cucumber stichopus japonicus promotes neurosphere migration and differentiation via up-regulation of n-cadherin[J]. Cellular and Molecular Neurobiology,2012,32(3):435-442.
[21]Matsuhiro B,Osorio-Roman I O,Torres R. Vibrational spectroscopy characterization and anticoagulant activity of a sulfated polysaccharide from sea cucumber Athyonidium chilensis[J]. Carbohydrate Polymers,2012,88(3):959-965.
[22]吴春华,陈艺勤,邱恬,等. 多糖微观构象与抗肿瘤活性关系研究进展[J]. 中国粮油学报,2011,26(4):123-128.
[23]何洪. 百合多糖诱导肿瘤细胞凋亡作用机制的研究[D]. 吉林:延边大学,2013.
[24]彭玲. 刺参粘多糖对Hela细胞增殖分化的影响及其机制的探讨[D]. 青岛:青岛大学,2008.
[25]余磊. 五味子多糖诱导肿瘤细胞凋亡及其分子机制研究[D]. 吉林:吉林大学,2012.
[26]陈玲. 刺参粘多糖诱导人宫颈癌细胞株凋亡及其作用机制[D]. 青岛:青岛大学,2009.
[27]牛娟娟,宋扬. 海洋刺参多糖对宫颈癌细胞周期的影响及其机制[J]. 齐鲁医学杂志,2010,05:386-388.
[28]林俊,李萍,陈靠山. 近5年多糖抗肿瘤活性研究进展[J]. 中国中药杂志,2013,38(8):1116-1125.
[29]王宝磊. 刺参酸性粘多糖体外诱导人肝癌细胞HepG2凋亡的实验研究[D]. 青岛:青岛大学,2009.
[30]Dong X D,Pan R J,Zou S M,et al. Oxidative degradation of the sulfated polysaccharide isolated from sea cucumberHolothurianobilis[J]. Process Biochemistry,2015,50(2):294-301.
Optimization of extraction of sea cucumber sperm polysaccharide and its antitumor activityinvitro
WANG Ting1,2,LIU Jing-xi2,ZHANG Jian2,3,LIU Xin2,ZHAO Yun-ping2, JING Yue-xin2,WANG Gong-ming2,WANG Mao-jian2,3,4,*
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai 200000,China; 2.Shandong Marine Resource and Environment Research Institute,Yantai 264006,China; 3.Shandong Provincial Key Laboratory of Restoration for Marine Ecology,Yantai 264006,China; 4.Shandong Freshwater Fisheries Research Institute,Ji’nan 250013,China)
This study was aimed to optimize the extraction process of sea cucumber sperm polysaccharide(SCSP),and evaluate its antitumor activityinvitro. After enzyme screen and single factor experiments,factors such as enzyme dosage,extraction temperature and extraction time were taken into account to perform response surface experiment optimization according to polysaccharide yield. Theinvitrogrowth inhibition effects of sea cucumber sperm crude polysaccharide(SCSCP)and its purified components(SCSP A1,SCSP A2)on human cervical cancer Hela cells and human liver cancer HepG2 cells were measured with MTT assay. The results showed that the optimum extraction conditions of SCSCP were as follows:papain,enzyme dosage of 3%,extraction temperature of 49 ℃,extraction time 6 h. Under these conditions the yield of SCSCP was 10.643‰. The MTT results indicated that SCSCP and its purified components inhibited the survival rates of Hela cells and HepG2 cells. SCSP A2exhibited a higher inhibition rate than SCSP A1. At the concentration of 10 mg/mL,inhibition rates of SCSP A2on Hela and HepG2 at 72 h were 80.28% and 83.11%,respectively,implying that SCSP had a remarkableinvitroantitumor activity.
sea cucumber sperm;polysaccharide;enzymatic hydrolysis;response surface methodology;antitumor activity
2016-03-01
王婷 (1990-),女,硕士研究生,研究方向:食品科学与工程,E-mail:twinstingying@163.com。
王茂剑(1964-),男,本科,研究员,研究方向:食品科学与工程,E-mail:wangmaojian@126.com。
山东省自然科学基金培养基金(ZR2014CP030);山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-08);山东省农业重大应用技术创新项目;烟台市科技发展计划项目(2014ZH081)。
TS254.1
A
1002-0306(2016)17-0068-07
10.13386/j.issn1002-0306.2016.17.005
