caveolin-1和P21在罗红霉素抑制哮喘离体气道平滑肌细胞增殖中的作用
2016-10-31王瑞丽戴威戴元荣
王瑞丽,戴威,戴元荣
(温州医科大学附属第二医院,浙江 温州 325027,1.重症医学科;2.呼吸内科)
·论著·
caveolin-1和P21在罗红霉素抑制哮喘离体气道平滑肌细胞增殖中的作用
王瑞丽1,戴威1,戴元荣2
(温州医科大学附属第二医院,浙江温州325027,1.重症医学科;2.呼吸内科)
目的:探讨caveolae/caveolin-1和P21在罗红霉素抑制离体哮喘大鼠气道平滑肌细胞(ASMCs)增殖中的作用。方法:复苏冻存的哮喘ASMCs,CCK-8法检测不同浓度罗红霉素[A组(无罗红霉素)、R10组(罗红霉素10 μg/mL)、R25组(罗红霉素25 μg/mL)、R50组(罗红霉素50 μg/mL)、R100组(罗红霉素100 μg/mL)]干预哮喘ASMCs后细胞的增殖情况,透射电镜观察各组caveolae的表达,Western Blot法检测各组caveolin-1、P21的蛋白表达。结果:罗红霉素抑制哮喘ASMCs的增殖作用具有浓度依赖性,随罗红霉素浓度增加,caveolae的表达逐渐增加,caveolin-1、P21的蛋白表达亦逐渐增加,且R50组或R100组与A组、R10组相比差异有统计学意义(P<0.05)。相关分析示哮喘ASMCs增殖活性与caveolin-1、P21蛋白表达呈负相关(r= -0.881、r=-0.951,P<0.05),caveolin-1蛋白表达与P21蛋白表达呈正相关(r=0.957,P<0.01)。结论:罗红霉素可能通过上调caveolae/caveolin-1的表达,引起P21蛋白表达增加,从而抑制离体哮喘ASMCs的增殖。
哮喘;气道平滑肌细胞;caveolae;caveolin-1;P21;罗红霉素
哮喘是一种慢性气道炎症性疾病,持续气道炎症可引起气道重塑。气道重塑可导致哮喘患者不完全可逆的气流受限和进行性肺功能下降,与哮喘的严重程度相关[1]。研究[2]表明,气道平滑肌细胞(airway smooth muscle cells,ASMCs)增殖是哮喘气道重塑的重要特征之一。微囊(caveolae)是细胞质膜上内陷的烧瓶样结构,微囊蛋白-1(caveolin-1)是caveolae的重要标记蛋白。研究[3]表明,caveolae、caveolin-1的缺失,与细胞的过度增殖有关。P21Waf1/Cip1是重要的细胞周期负性调节因子,可以调控真核细胞有丝分裂过程中的G1/S限制点。罗红霉素属新一代大环内酯类抗生素,已有研究[4-5]表明,罗红霉素可以抑制哮喘气道重塑,但其机制并未完全阐明。本研究通过不同浓度罗红霉素干预离体哮喘ASMCs,电镜观察各组ASMCs caveolae表达情况、Western Blot法检测各组caveolin-1、P21的表达水平,探讨罗红霉素抑制离体哮喘大鼠ASMCs增殖的作用机制。
1 材料和方法
1.1 材料 慢性哮喘大鼠ASMCs来自于本实验室液氮罐中冻存的慢性哮喘大鼠ASMCs细胞株。主要试剂:兔源性caveolin-1多克隆抗体(美国Abcam公司),小鼠源性P21单克隆抗体(美国Santa Cruz公司),HRP标记的山羊抗小鼠IgG、HRP标记的山羊抗兔IgG(江苏碧云天生物技术研究所),罗红霉素粉剂(法国Usiphar公司)。
1.2 方法
1.2.1 复苏细胞:取出液氮罐中的冻存管,将其浸入40 ℃的水浴箱中迅速解冻,然后加入5倍体积的RPMI 1640培养基,吹打混匀移入离心管内,在离心机内1 000 r/min离心5 min,弃去上清,加入含20%胎牛血清的RPMI 1640培养液轻轻吹打均匀,调整细胞密度为(1~2)×105/mL接种于新的培养瓶中,置于37 ℃,5% CO2细胞培养箱中培养,取3~6代细胞进行实验。
1.2.2 CCK-8法检测ASMCs增殖情况:将哮喘ASMCs单细胞悬液按2×105/mL的密度接种于96孔板,每孔100 μL。随机分为A组、R10组、R25组、R50组、R100组,并设立空白组(只含培养基,不含细胞),每组设6个复孔。各组首先用含l0%胎牛血清的RPMI 1640培养基培养24 h,然后用不含血清的RPMI 1640饥饿24 h,使细胞同步于G0期,最后用含不同浓度罗红霉素(A组:只含0.1% DMSO;R10组:罗红霉素10 μg/mL+0.1% DMSO;R25组:罗红霉素25 μg/mL+ 0.1% DMSO;R50组:罗红霉素50 μg/mL+0.1% DMSO;R100组:罗红霉素100 μg/mL+0.1% DMSO)的10%胎牛血清的RPMI 1640培养基培养48 h。培养结束后,每孔加入10 μL的CCK-8试剂,混匀后继续置于37 ℃,5% CO2的细胞培养箱中培养1~4 h。使用酶联免疫检测仪在450 nm波长条件下测定各孔吸光度值。取6个复孔的平均值作为该组的代表值,重复5次。计算各组ASMCs增殖活性。细胞增殖活性(%)=[(As-Ab)/(Ac-Ab)]×100%,As为实验孔(含培养基、CCK-8、ASMCs、不同浓度罗红霉素)吸光度值;Ac为对照孔(含培养基、CCK-8、ASMCs)吸光度值;Ab为空白孔(含培养基、CCK-8)吸光度值。
1.2.3 透射电镜观察各组ASMCs caveolae变化:取不同浓度罗红霉素干预(干预浓度见1.2.2)的哮喘ASMCs制作电镜标本,透射电镜下观察caveolae的变化。
1.2.4 Western Blot法检测各组caveolin-1、P21的表达变化:提取各组ASMCs蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE凝胶电泳,转膜,含5%脱脂奶粉的TBST室温下摇床封闭1 h,TBST洗膜后孵一抗:caveolin-1兔抗大鼠多克隆抗体(1∶1 000)、P21小鼠抗大鼠单克隆抗体(1∶100),4 ℃孵育过夜。次日洗膜后孵二抗:HRP标记的山羊抗兔IgG(1∶2 500)或山羊抗小鼠IgG(1∶2 500),室温下摇床孵育1 h,洗膜后在暗室滴加发光剂、压片、显影、定影。Image Pro Plus6.0软件分析条带的光密度(OD)值,将目的条带OD值与内参条带OD值的比值作为该目的蛋白的相对含量。
1.3 统计学处理方法 应用SPSS15.0统计软件进行分析。所得数据以±s表示,正态分布资料的组间比较采用单因素方差分析,方差齐性者采用LSD法,方差不齐者采用Dunnett’s T3检验;非正态分布资料的组间差异比较采用Kruska-Wallis H检验,组间两两比较采用Nemenyi法检验;相关关系分析用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8法检测各组细胞增殖情况 CCK-8检测时,细胞增殖越多越快,颜色越深,所测A值越大。结果显示A组吸光度值为0.64±0.13,R10组为0.54±0.13,R25组为0.52±0.12,R50组为0.45± 0.13,R100组为0.38±0.12。由此可见,哮喘ASMCs的增殖随着罗红霉素浓度的增高而降低(见图1)。
2.2 透射电镜观察各组ASMCs caveolae变化 透射电镜下可观察到A组ASMCs caveolae的表达明显匮乏,caveolae结构无法辨认。罗红霉素干预后哮喘ASMCs caveolae表达增多(见图2)。
2.3 Western Blot法检测各组ASMCs caveolin-1、P21的蛋白表达情况 罗红霉素干预哮喘ASMCs后,caveolin-1、p21的蛋白表达较A组增高,且随罗红霉素浓度的增高而增高,R50组或R100组与A组、R10组相比差异有统计学意义(P<0.05),见表1。
2.4 相关分析结果 相关分析示,哮喘ASMCs增殖活性与caveolin-1蛋白表达呈负相关(r=-0.881,P<0.05),与P21蛋白表达呈负相关(r=-0.951,P<0.05);caveolin-1蛋白表达与p21蛋白表达呈正相关(r=0.957,P<0.01)。
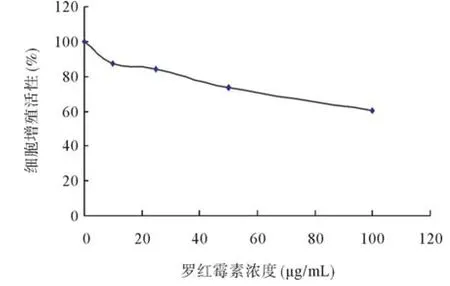
图1 罗红霉素对哮喘ASMCs增殖的影响

图2 透射电镜观察各组ASMCs caveolae变化
表1 各组ASMCs caveolin-1、P21的蛋白表达OD比值(n=4,±s)

表1 各组ASMCs caveolin-1、P21的蛋白表达OD比值(n=4,±s)
与A组比:aP<0.05;与R10组比:bP<0.05
?
3 讨论
罗红霉素除有抗菌活性外,还有免疫调节、抗炎和抗氧化活性[6]。研究发现罗红霉素可通过多种途径抑制哮喘ASMCs增殖[4-5]。本实验用不同浓度罗红霉素干预离体的哮喘ASMCs,CCK-8试剂盒检测各组细胞的增殖活性,结果显示随着罗红霉素干预浓度增高,各组细胞增殖活性逐渐下降。提示罗红霉素对离体哮喘ASMCs增殖具有抑制,与体外研究[7]结果一致,且抑制作用具有浓度依赖性。
caveolae是位于细胞质膜的烧瓶样结构,主要由寡聚化的微囊蛋白、胆固醇和鞘糖脂构成,直径约为50~100 nm。研究发现,该结构中存在多种信号分子,如P42/P44MAPK、一氧化氮合酶、c-Src等[3,8-9],故又称caveolae为细胞的“信号枢纽”。caveolin-1是caveolae的重要功能蛋白,它可以通过内部的“铰手架”区域与多种信号分子连接并调控这些信号分子的活性,从而参与细胞的信号转导。研究表明,生长因子受体及下游的信号分子与caveolin-1连接紧密,提示该蛋白参与了细胞的增殖过程[8]。Grossi等[10]研究发现,caveolin-1可通过负性调控多胺的吸收而抑制血管平滑肌细胞的增殖;Zeng等[11]发现姜黄素可通过上调caveolin-1的表达而抑制ASMCs的增殖。上述研究提示caveolin-1对平滑肌细胞细胞增殖有负性调控作用。笔者前期的在体研究[7]也证实:与正常组相比,哮喘组大鼠气道平滑肌层明显增厚,而caveolin-1表达下降,相关分析示气道平滑肌厚度与caveolin-1的表达呈显著负相关。本离体实验结果显示,哮喘组caveolae结构匮乏,罗红霉素干预后caveolae结构有逐渐增多趋势,caveolin-1的表达亦逐渐增加,而ASMCs的增殖活性逐渐下降,相关关系分析示哮喘ASMCs增殖活性与caveolin-1蛋白表达呈负相关,提示罗红霉素抑制离体哮喘ASMCs增殖的作用与其上调caveolae/caveolin-1的表达有关。
真核细胞的增殖需通过有丝分裂完成,在整个细胞周期中G1期/S期是细胞有丝分裂的“限制点”,是细胞增殖周期的关键。P21Waf1/Cip1是细胞周期重要的负性调节因子,属于细胞周期素依赖性激酶抑制剂(CDK inhibitor,CKI)家族。在哺乳动物中,P21蛋白可与细胞周期素、CDK组成复合体,调控细胞从G1期到S期的过渡;除此之外,P21蛋白还可以通过与DNA合成所必需的增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)结合,抑制DNA的合成与复制[12-13]。故P21可通过上述双重作用调控细胞周期“限制点”。有研究发现,P21与血管平滑肌细胞增殖密切相关[14-15];Zhang等[16]研究发现,小鼠间充质细胞过度表达caveolin-1可导致P53、P21的表达增加。本离体实验结果显示,随罗红霉素干预浓度的升高,哮喘ASMCs增殖活性逐渐下降,P21的表达逐渐增加,相关关系分析示P21蛋白表达与哮喘ASMCs增殖活性呈负相关,与caveolin-1蛋白表达呈正相关。提示罗红霉素可能通过通过上调caveolae/caveolin-1的表达,引起P21蛋白表达增加,从而抑制离体哮喘ASMCs的增殖。但caveolin-1与P21之间的相互作用机制仍需要进一步研究。
[1] SHIFREN A, WITT C, CHRISTIE C, et al. Mechanisms of remodeling in asthmatic sirways[J]. J Allergy (Cairo), 2012,2012: 316049. DOI: 10.1155/2012/316049.
[2] BLACK J L, PANETTIERI RA J R, BANERJEE A, et al. Airway smooth muscle in asthma: just a target for bronchodilation?[J]. Clin Chest Med, 2012, 33(3): 543-558.
[3] GOSENS R, STELMACK G L, DUECK G, et al. Role of caveolin-1 in p42/p44 MAP kinase activation and proliferation of human airway smooth muscle[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(3): L523-L534.
[4] 吴斌, 戴元荣, 翁海霞, 等. 罗红霉素对支气管哮喘大鼠气道平滑肌增殖及P27kip-1表达的影响[J]. 中华结核和呼吸杂志, 2008, 31(3): 228-229.
[5] 吴立琴, 戴元荣, 夏晓东, 等. 磷脂酰肌醇3-激酶途径对支气管哮喘大鼠气道平滑肌细胞增殖的影响及罗红霉素的干预作用[J]. 中华结核和呼吸杂志, 2009, 32(4): 304-306.
[6] ITO T, ITO N, HASHIZUME H, et al. Roxithromycin inhibits chemokine-induced chemotaxis of Th1 and Th2 cells but regulatory T cells[J]. J Dermatol Sci, 2009, 54(3): 185-191.
[7] 王瑞丽, 陈慧君, 戴元荣, 等. caveolin-1和p42/p44MAPK在哮喘大鼠气道重塑中的作用及罗红霉素对其表达的影响[J]. 温州医学院学报, 2013, 43(3): 166-170.
[8] PETERSON T E, GUICCIARDI M E, GULATI R, et al. Caveolin-1 can regulate vascular smooth muscle cell fate by switching platelet-derived growth factor signaling from a proliferative to an apoptotic pathway[J]. Arterioscler Thromb Vasc Biol, 2003, 23(9): 1521-1527.
[9] SOWA G. Caveolae, caveolins, cavins, and endothelial cell function: new insights[J]. Front Physiol, 2012, 2: 1-13.
[10] GROSSI M, RIPPE C, SATHANOORI R, et al. Vascular smooth muscle cell proliferation depends on caveolin-1-regulated polyamine uptake[J]. Biosci Rep, 2014, 34(6): 729-741.
[11] ZENG X, CHENG Y, QU Y, et al. Curcumin inhibits the proliferation of airway smooth muscle cells in vitro and in vivo[J]. Int J Mol Med, 2013, 32(3): 629-636.
[12] LI R, WAGA S, HANNON G J, et al. Differential effects by the p21 CDK inhibitor on PCNA-dependent DNA replication and repair[J]. Nature, 1994, 371(6497): 534-537.
[13] WAGA S, HANNON G J, BEACH D, et al. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA[J]. Nature, 1994, 369(6481): 574-578.
[14] ZHENG B, HAN M, SHU Y N, et al. HDAC2 phosphorylation-dependent Klf5 deacetylation and RARα acetylation induced by RAR agonist switch the transcription regulatory programs of p21 in VSMCs[J]. Cell Res, 2011, 21(10):1487-1508.
[15] LIN L, HONG T. Inhibitory effects of piperonylic acid on the excessive proliferation of vascular smooth muscle cells and luminal stenosis[J]. Bratisl Lek Listy, 2014, 115(12):761-765.
[16] ZHANG J, LAZARENKO O P, BLACKBURN M L, et al. Soy protein isolate down-regulates caveolin-1 expression to suppress osteoblastic cell senescence pathways[J]. FASEB J,2014, 28(7): 3134-3145.
(本文编辑:丁敏娇)
The role of caveolin-1 and P21 in the process of roxithromycin to inhibit the proliferation of asthmatic rats ASMCs in vitro
WANG Ruili1, DAI Wei1, DAI Yuanrong2. 1.Department of Critical Care, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Respiratory Medicine, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To explore the role of caveolae/caveolin-1 and P21 in the process of roxithromycin to inhibit the proliferation of asthmatic rats ASMCs in vitro. Methods: Recovery freeze-stored ASMCs of asthmatic rats were divided into five groups [group A (blank group), group R10 (roxithromycin 10 μg/mL), group R25 (roxithromycin 25 μg/mL), group R50 (roxithromycin 50 μg/mL) and group R100 (roxithromycin 100 μg/ mL)]. The proliferation of ASMCs induced by roxithromycin were tested by CCK-8. The changes of caveolae in ASMCs were observed by transmission electron microscope. The protein expressions of caveolin-1 and P21 were measured by Western blot. Results: Roxithromycin could inhibit the proliferation of asthmatic rats ASMCs in vitro and had concentration-dependent manner. With the increased of intervention concentration, the expression of caveolae increased and the protein expressions of caveolin-1, P21 increased. Besides, compared with group A or group R10, the expressions of caveolin-1 and P21 protein in group R50 or R100 showed significantly different (P<0.05). There was significantly negative correlation between the cell activity rate of asthmatic rats and the expressions of caveolin-1 and P21 protein (r=-0.881, r=-0.951, P<0.05). The expression caveolin-1 was positively correlated with P21 (r=0.957, P<0.01). Conclusion: Roxithromycin inhibits the proliferation of ASMCs from asthmatic rats in vitro may partly through promoting the expression of P21 protein which induced by increased the expression of caveolae/ caveolin-1.
asthma; airway smooth muscle cells; caveolae; caveolin-1; p21; roxithromycin
R56
A
10.3969/j.issn.2095-9400.2016.09.002
2015-10-23
浙江省自然科学基金资助项目(LY16H010007)。
王瑞丽(1987-),女,山西长治人,住院医师,硕士。
戴元荣,主任医师,教授,硕士生导师,Email:dai yr@126.com。
