CT间接淋巴造影诊断舌癌颈淋巴结早期转移
2016-10-31应海岳吴海涛
应海岳,吴海涛
(1.宁波市第二医院 耳鼻咽喉科,浙江 宁波 315010;2.复旦大学附属眼耳鼻咽喉科医院 耳鼻咽喉头颈外科,上海 200031)
CT间接淋巴造影诊断舌癌颈淋巴结早期转移
应海岳1,吴海涛2
(1.宁波市第二医院耳鼻咽喉科,浙江宁波315010;2.复旦大学附属眼耳鼻咽喉科医院耳鼻咽喉头颈外科,上海200031)
目的:探讨舌癌的早期转移颈淋巴结在CT间接淋巴造影中的特点。方法:健康成年新西兰白兔18只,随机法分成3组,颈淋巴结正常组、增生组及早期转移组各6只;分别于注射前及在舌腹黏膜下注射0.5 mL欧乃派克后1、5、15、20 min行轴位CT扫描,观察3组淋巴结在间接淋巴造影时的不同特点。结果:所有动物在造影整个过程中颌下淋巴结及颈浅淋巴结均未显影,而只有颈深淋巴结在所有动物中均显影,整个显影过程中未见有明显的血管显影。在CT上转移组淋巴结的平均直径为(0.73±0.08)cm,增生组为(0.75±0.10)cm,而正常组为(0.47±0.05)cm,正常组淋巴结大小分别与转移组和增生组淋巴结大小比较差异有统计学意义。转移组淋巴结内造影剂消退缓慢,而增生组及正常组淋巴结内造影剂消退较快;转移组淋巴结表现为充盈缺损、周边凹凸不平、质地不均、毛糙,而增生组及正常组淋巴结质地均匀,周边光滑,无充盈缺损。结论:CT间接淋巴造影对舌癌颈淋巴结早期转移的诊断有一定的特异性,这些特异性有可能作为诊断早期转移淋巴结的指标。
舌癌;VX2瘤;淋巴转移;计算机扫描;间接淋巴造影;兔
头颈部恶性肿瘤如出现颈淋巴结转移将明显影响患者的预后,如转移的颈淋巴结出现包膜外侵犯,则将进一步影响预后,因此对颈部淋巴结转移尽早做出诊断十分重要,能使临床治疗更加有针对性和有效性。有报道头颈部恶性肿瘤隐匿性颈淋巴结转移率达30%左右[1],这部分患者转移的颈淋巴结直径都较小,增强CT很难区分这些淋巴结的良恶性,有时也难以和炎性增生的淋巴结相区别。间接淋巴造影时,造影剂选择性地大部分进入淋巴管和淋巴结内,使淋巴结的形态结构清晰地显示在CT片上,使区分小淋巴结的良恶性成为可能。目前间接淋巴造影结合CT对乳腺及肺部等肿瘤的淋巴结转移研究尚处于动物实验或临床初期试验中[2-3],间接淋巴造影在头颈肿瘤颈淋巴结转移方面的研究报道较少。本实验分别建立兔正常淋巴结组,淋巴结反应增生组和颈淋巴结早期转移组模型行CT间接淋巴造影,探讨3组淋巴结之间的区别。
1 材料和方法
1.1 实验动物 健康成年新西兰白兔18只,雌雄不限,体质量2.0~3.0 kg,随机法分成3组:正常组、增生组和颈淋巴结早期转移组,各6只。
1.2 动物分组及模型建立 正常组:正常实验室饲养;增生组:根据既往实验结果于双侧颈部相当于下颌下肌内各注射鸡蛋黄乳胶(Egg-yolk emulsion,EYE)0.5 mL,4 d后再重复以上操作,第2次注射4 d后便建立EYE[4]刺激后颈淋巴结反应增生的模型,除以上操作外,余饲养条件同正常组;颈淋巴结转移组:根据前期实验结果[5],将0.3 mL的VX2瘤组织块悬液注射于舌腹左侧的浅层舌肌内或黏膜下,注射后14 d便形成颈淋巴结早期转移的模型,除以上操作外,余饲养条件同正常组。
1.3 间接淋巴造影及CT扫描
1.3.1 麻醉方法:先以5%盐酸氯安酮注射液(60 mg/kg)肌肉注射后,再以2%戊巴比妥钠(15 mg/kg)腹腔注射;2%戊巴比妥钠溶液由戊巴比妥钠粉末自行配制而成。
1.3.2 固定及体位:用自制的固定板,将动物仰卧于板上,四肢用绷带固定于两边的铁钉上,用细绳套住上列门齿并固定于头侧的铁钉,使其颈部尽量伸直,两边尽量对称。
1.3.3 扫描相关参数:所用的CT为德国西门子公司的SOMATOM Sensation 10,管电压120 kv,管电流150 mAs;准值10 mm×0.75 mm;床进5.6 mm/r,每圈用时0.75 s/r;矩阵512×512,视野(field of visual,FOV)为7~12 cm;层厚0.75或2 mm,层距0.75或2 mm;扫描范围从兔的舌体到胸骨柄前端,包括整个颈部,扫描层数在42~46层之间,扫描时间在10~13 s之间,采用轴位扫描。
1.3.4 CT扫描方法:在注射造影剂之前先行兔颈部CT轴位平扫,之后用皮试注射器于兔舌腹黏膜下双侧或单侧注射欧乃派克各0.5 mL。肿瘤组造影剂注射部位为近心侧的肿瘤周围黏膜下。注射时间约在1 min之内,注射完毕后不采用局部按摩,并于注射后1、5、15、20 min时轴位扫描。平扫和间接淋巴造影后的扫描参数相同。
1.4 间接淋巴造影的CT评价指标
1.4.1 淋巴结大小:轴位扫描时所扫到的为淋巴结的横截面,因此在CT图像上测量淋巴结不同层面上的横径值,并以最大横径层面所测得的值为淋巴结大小的指标。
1.4.2 淋巴结的形态结构:分别从淋巴结的二维和三维来评价其形态结构的特点,从淋巴结的边缘光滑度、有无充盈缺损、淋巴结内密度是否均一、有无造影剂残留现象及淋巴管的形态来比较3组淋巴结的区别。
1.4.3 淋巴结的时间-增强效应曲线:以兴趣区(regions of interest,ROI)法分别测量3组淋巴结于注射造影剂前及注射造影剂后1、5、15、20 min时的淋巴结的CT值,各组在不同时间点的CT值取平均值后按时间顺序建立曲线;以淋巴结造影后1 min时淋巴结CT值为对照,计算各组在淋巴结造影后5、15 min时淋巴结CT值的下降率,造影后5 min的淋巴结CT值下降率计算公式为DRHu5=(Hu5-Hu1)/ Hu1,造影后15 min的淋巴结CT值下降率计算公式为DRHu15=(Hu15-Hu1)/Hu1。Hu1、Hu5、Hu15分别代表1、5、15 min时淋巴结的CT值,DRHu5代表5 min时淋巴结CT值相对于1 min时淋巴结CT值的下降率,DRHu15代表15 min时淋巴结的CT值相对于1 min时淋巴结CT值的下降率,比较各组DRHu5、DRHu15的差异性。
1.5 组织病理学检查 实验动物在造影完成后于深麻醉下立即于耳缘静脉注射空气处死,解剖出双侧颈深淋巴结,投入中性甲醛溶液中固定,常规石蜡包埋,尽量连续切片,切片行HE染色,光镜观察淋巴结结构及肿瘤浸润坏死情况。
1.6 统计学处理方法 采用SPSS11.5软件进行统计学分析。用完全随机设计方差分析(One Way ANOVA)评价CT所测淋巴结横径在3组淋巴结之间的差异,以及标本实测所得的淋巴结横径在3组淋巴结之间的差异性。用One Way ANOVA评价3组淋巴结在间接淋巴造影后淋巴结内CT值随时间下降的差异性。P<0.05为差异有统计学意义。
2 结果
2.1 3组CT评价一般情况 所有动物在造影整个过程中颌下淋巴结及颈浅淋巴结均未显影,而只有颈深淋巴结显影。在CT上见颈深淋巴结位于喉旁的两侧,显示一个椭圆形的密度增高影;在三维重建上可见椭圆形的直径明显大于淋巴管的淋巴结位于颈椎腹面相当于喉旁的位置,自舌腹面而来的输入淋巴管直径明显小于淋巴结,淋巴管进入淋巴结后又有输出淋巴管出淋巴结,中间未见有其他淋巴结;整个过程中未见有明显的血管显影。
2.2 3组淋巴结大小比较 转移组和增生组颈淋巴结均大于正常组,差异有统计学意义(P<0.01);而增生组和转移组间淋巴结大小差异无统计学意义(P>0.05),见表1。
表1 3组淋巴结的大小(±s,cm)

表1 3组淋巴结的大小(±s,cm)
与增生组和转移组比:aP<0.01
组别CT所测大小标本实测大小正常组0.47±0.05a0.50±0.03a转移组0.75±0.10a0.78±0.09a增生组0.73±0.08a0.79±0.07a
2.3 3组淋巴结形态结构 正常淋巴结横径小,呈小椭圆形,造影剂均匀分布于淋巴结内,淋巴结周边光滑,淋巴结内不同区域的造影剂随时间的推移其消退呈一致性,局部未见残留,见图1a。在三维重建中用最大密度法(maximum intensity projection,MIP),未注射造影剂时见颅骨及颈椎结构,未见淋巴结,增强后,即可见体积较小而光滑的淋巴结,其淋巴结内的密度均匀一致,见图1b。
增生淋巴结横径大,亦呈椭圆形,结内造影剂均匀分布,充盈饱满,淋巴结边缘光滑,淋巴结内不同区域的造影剂随时间的推移其消退亦呈一致性,未见局部残留现象,见图2a。三维重建后可见输入及输出淋巴管,未见增粗现象及扭曲,与淋巴结衔接比较流畅。淋巴结周边光滑而干净,淋巴结内的密度均匀一致,见图2b。
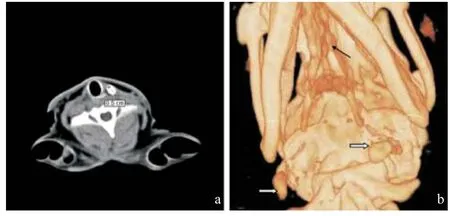
图1 正常组淋巴结形态
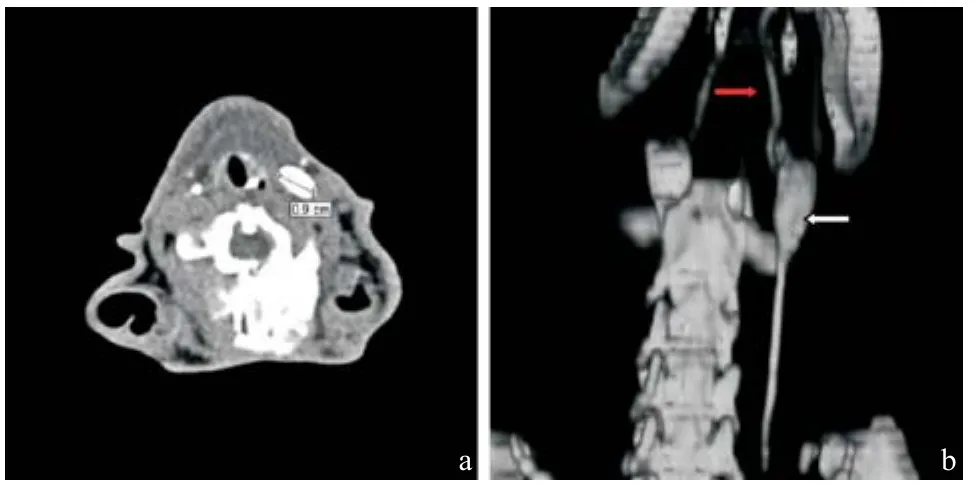
图2 增生组淋巴结形态
转移淋巴结横径比正常淋巴结大,与增生淋巴结相似,但其在二维结构上形态不规则,边缘不圆滑,呈凹凸状,见图3a;周边或淋巴结中心见充盈缺损,淋巴结内不同区域的造影剂随时间的推移其消退不相一致,见局部残留现象,见图3b。三维重建后显影淋巴结形态不规则,失去椭圆形,周边欠光整,且淋巴结内的密度不均匀,见图3c-e。
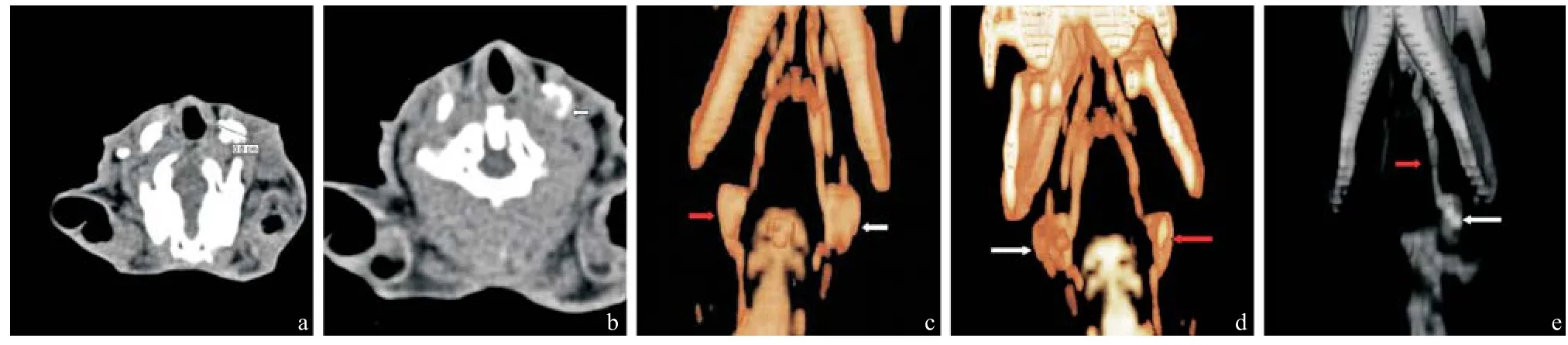
图3 转移组淋巴结形态
2.4 淋巴结内造影剂的时间-增强效应曲线 淋巴结内的CT值于注射造影剂后第1 min达到最高值,之后在第5、第15、第20 min逐渐下降,正常及增生的淋巴结于第15 min时淋巴结内的造影剂基本已经完全消退,看不到有残留造影剂,相对应的CT值也接近造影前的CT值,见图4a-c;而肿瘤转移组淋巴结在15 min时仍有较多的造影剂残留,即使在20 min时部分淋巴结也还有造影剂残留,见图5ac。3组兔子各6只分别测量造影前即0 min和造影后1、5、15 min时淋巴结的CT值,并计算各组各时段的CT值的平均值。正常及增生组中第20 min时,造影剂基已完全消退,有的甚至已无法定位淋巴结,因此后续的CT扫描都截止到15 min,见表2。
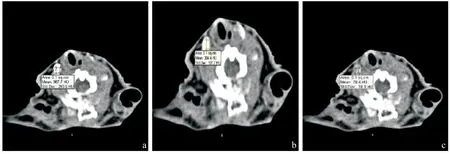
图4 增生淋巴结不同时间CT值测量
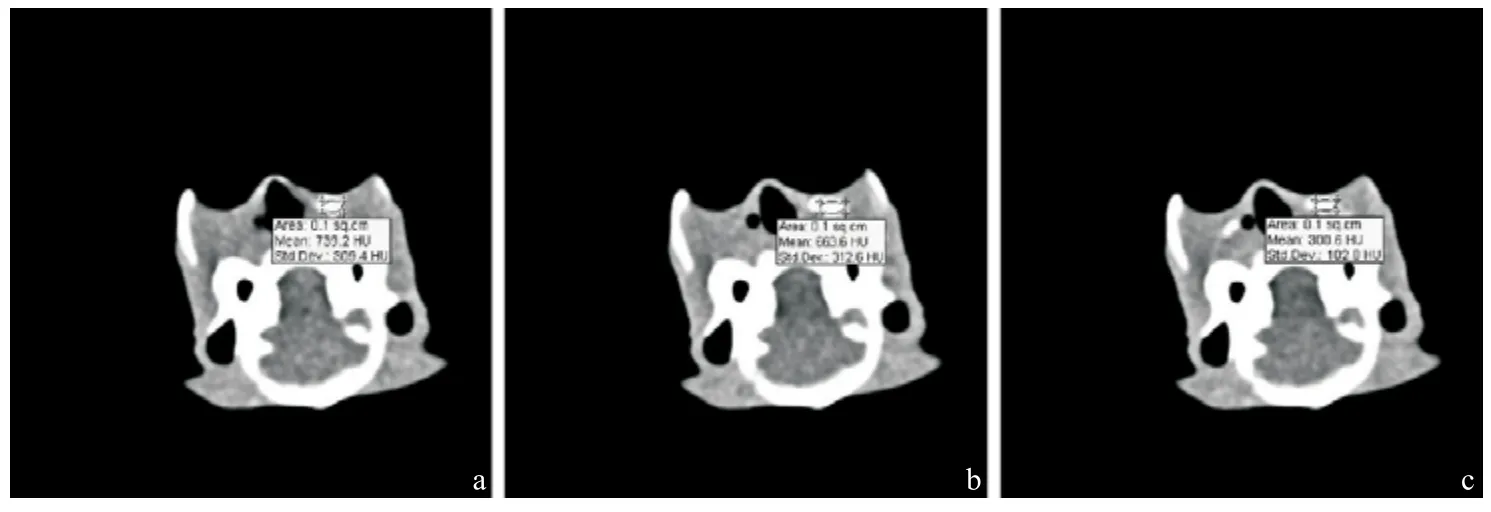
图5 转移淋巴结不同时间CT值测量
表2 3组淋巴结造影后不同时间的CT值(±s,Hu)
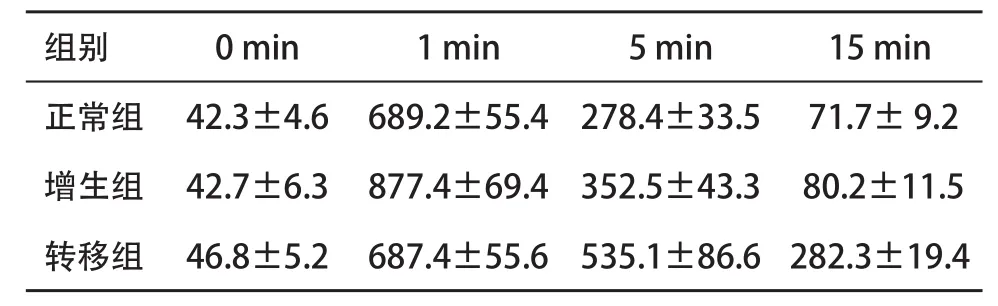
表2 3组淋巴结造影后不同时间的CT值(±s,Hu)
组别0 min1 min5 min15 min正常组42.3±4.6689.2±55.4278.4±33.5 71.7± 9.2增生组42.7±6.3877.4±69.4352.5±43.3 80.2±11.5转移组46.8±5.2687.4±55.6535.1±86.6282.3±19.4
根据表2绘制出淋巴造影后淋巴结的时间-增强效应曲线图,可以直观地看到舌腹黏膜下注射造影剂1 min后3组动物淋巴结内CT值都达到最大值,随后在5、15 min后逐渐下降;正常组和增生组两者下降的曲线相似,都比较陡直,即造影剂在淋巴结内滞留的时间较短,见图6。而肿瘤转移组的下降曲线较正常组和增生组平缓,即造影剂在转移淋巴结内滞留时间较正常组和增生组长。以造影后1 min时的淋巴结CT值为对照,分别计算各组在造影后5、15 min时淋巴结CT值的下降率即DRHu5、DRHu15,以随机方差法分别分析DRHu5、DRHu15时各组的差异性发现:在造影后5 min时,正常组和增生组CT值下降率差异无统计学意义(P>0.05),而转移组与正常组及增生组差异均有统计学意义,即转移组CT值下降率较正长组和增生组的CT值下降率都缓慢(P<0.05)。在造影后15 min的DRHu15比较中也是同样的统计结果,见表3。
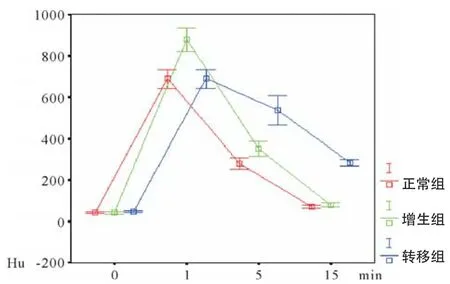
图6 各组淋巴结的时间-增强效应曲线图
表3 3组淋巴结造影后不同时间的CT值下降率(±s,%)

表3 3组淋巴结造影后不同时间的CT值下降率(±s,%)
与正常组和增生组比:aP<0.01
组别DRHu5DRHu15正常组0.59±0.060.90±0.01增生组0.60±0.040.91±0.01转移组0.22±0.08a0.59±0.02a
2.5 3组组织病理学结果 增生组和转移组的淋巴结均大于正常组,差异有统计学意义(P<0.01);增生组和转移组差异无统计学意义(P>0.05)。
正常组颈深淋巴结表面光滑,色泽为浅淡红色,呈长椭圆形,横径相对较短,长径与横径之比≥2∶1。增生组颈深淋巴结被膜紧张,表面光滑而略有突起,长径和横径都增大,长径与横径比>2∶1。早期转移组颈深淋巴结明显增大,被膜紧张,表面明显凹凸不平,可见淋巴结与周围肌肉粘连明显,但长径与横径比>2∶1。光镜检查正常颈深淋巴结皮质区见较多的次级淋巴小结,髓索含较多浆细胞,可见较多体积小、胞质少、核深染、正常圆形的淋巴细胞。增生的颈深淋巴结明显反应增生,可见大量圆形且核深染的淋巴细胞、体积较大核分叶的中性粒细胞和单核细胞浸润。转移组实验侧淋巴结光镜下均可见转移灶,转移淋巴结的淋巴组织中有大量排列成巢团状的低分化的癌组织,正常淋巴结结构被破坏,癌细胞较为单一,有核分裂现象。
3 讨论
1952年Kinmonth首先提出直接淋巴造影用于诊断人体疾病。淋巴造影可分为直视淋巴造影和放射淋巴造影,放射淋巴造影是在淋巴管内注入造影剂后,通过X线或CT、MRI显示淋巴管及淋巴结的一种影像学方法。放射淋巴造影的优点是在术前能了解人体深部的淋巴管及淋巴结的情况,可分为直接淋巴造影和间接淋巴造影,直接淋巴造影需解剖出淋巴干并插管,并将造影剂缓慢推注于淋巴干内,操作复杂,需一定的经验,且费时;间接淋巴造影是将造影剂注射于黏膜下或皮下,无需解剖淋巴干,操作简单,时间短。间接淋巴造影显示淋巴系统的疾病,最早由Thompson等提出,在80年代初期就有报道用于淋巴水肿及转移淋巴结的研究[6-7],其原理是在黏膜下或皮下注射造影剂后,通过造影剂的弥散作用经毛细淋巴管的内皮间隙进入淋巴管或通过巨噬细胞的吞噬作用滞留于淋巴结内,显示淋巴结的内部结构及淋巴管与淋巴结之间的关系。高分辨率的多排CT与间接淋巴造影相结合,使得淋巴管与淋巴结的显像更加清晰。目前间接造影的造影剂多用非离子型水溶性单聚体如碘必乐、欧乃派克等,具有分子量小,水溶性,较低的渗透压及低毒副作用等特点,注射于组织间隙后能通过终末毛细淋巴管的间隙高选择性地进入淋巴管,在短时间内使淋巴结内CT值达到最大值[8-11],而另一类亲淋巴的碘化纳米颗粒通过巨噬细胞的吞噬活动能使淋巴结内增强效果更强,且维持时间长[12-13],但其从注射造影剂到出现淋巴结增强效果的时间较长,一般需要12~24 h,且尚未被广泛地应用于临床,因此我们选择欧乃派克作为间接淋巴造影剂。
在整个造影过程中,均未见有血管增强现象,说明造影剂选择性地进入淋巴管,这可能与毛细淋巴管基膜的不连续性及内皮间的间隙有关,而毛细血管有较完整的基膜,使得造影剂不能大量进入。即使是在淋巴管及淋巴结内,造影剂的清除速度也是很快的。在实验中,正常淋巴结在注射造影剂后15 min已基本消退,造影剂在较短时间内消退,使不同时长的淋巴结增强效果可以作为一个比较的参数,这在一些不溶性的碘化纳米颗粒造影剂是很难做到的,因为用这些造影剂达到最大增强效果往往要等12 h以上,并在几周内才缓慢消退[14-15]。在本实验中,转移性淋巴结内造影剂消退明显较正常淋巴结缓慢,即使在注射后20 min仍有造影剂残留。在转移组5 min时CT值才下降了22%左右,在正常及增生组则下降了近60%,到15 min时转移组也才下降了60%左右,其他2组则接近造影前水平。造成这种现象的原因可能是肿瘤细胞在淋巴结的皮质窦或髓窦内生长,阻塞了部分窦腔,使结内淋巴液流量减少或流速减慢,从而使造影剂在转移淋巴结内的消退减慢。尽管造成这种现象的真正原因尚需进一步研究,但这种造影剂在淋巴结内消退的不同特点,使其可能成为区分淋巴结良恶性的一个指标。
最近几年,用碘必乐等水溶性非离子型造影剂行CT间接淋巴造影在肿瘤前哨淋巴结的研究越来越多,如乳腺癌、肺癌及食管癌[2-3,16],都能较好地定位出前哨淋巴结,使淋巴结活检更加有针对性,而在头颈部恶性肿瘤的手术中很少术前进行颈淋巴结的活检,主要靠术前的CT或MRI检查来判断,但CT和MRI只能凭淋巴结的大小来判断,如果转移淋巴结横径小于1 cm,或有炎性增生的淋巴结,都很难区分。在我们的实验中,良性反应增生的淋巴结横径与转移淋巴结的横径相近,且都在1 cm以内,无统计学差异,但反应增生的淋巴结和正常淋巴结造影后都表现为整个淋巴结在各个层面均匀一致的增强,切面淋巴结周边光滑,三维重建后淋巴结四周光整,淋巴结内密度均匀一致;而在转移淋巴结,虽然横径与增生淋巴结相近,但可以看到淋巴结切面不同程度的充盈缺损,皮质区不同程度扩大使得淋巴结周边凹凸不平,失去弧线型的圆滑外周,三维重建后淋巴结四周毛糙,淋巴结内密度不均匀。这些定性的现象很难在血管增强CT上表现出来而造成两者之间无法区分,在CT间接淋巴造影时,两者的区别很直观,转移淋巴结的这些特征有助于区分淋巴结的良恶性。转移淋巴结内肿瘤细胞对淋巴结内部结构的影响而导致造影剂在淋巴结内分布异常也许可以解释这种影像学的变化,但某一独特的影像学特点究竟相对应淋巴结内哪一种结构变化则需要进一步研究。有作者采用在活体淋巴结内直接注入肿瘤细胞而形成转移淋巴结模型再行CT间接淋巴造影[17],虽然也可以表现出充盈缺损的影像,但毕竟不是淋巴结转移的一个自然过程,无法全面地了解转移淋巴结在间接淋巴造影时所表现出来的独有特点,如果用此标准来进行临床试验可能会有一定出入。
综上所述,用欧乃派克行CT间接淋巴造影诊断颈淋巴结的早期转移有一定的可行性,其可以从造影剂的时间-增强效应的定量指标及淋巴结形态结构的定性指标来判断淋巴结是否有早期转移,比血管增强CT用单一的淋巴结横径指标来诊断效果更好,但仍需要进一步的双盲对照实验来证实间接淋巴造影有更高的准确率。且具体的造影剂用量需进一步研究,在本实验中淋巴结内的造影剂浓度似乎有点高,这可能影响对淋巴结内细小结构的观察,因为过高的密度将会掩盖一些微细结构。
[1] 贾深汕, 何红江, 项丞, 等. 喉癌T2-4临床N0颈淋巴结转移的临床病理研究[J]. 中华耳鼻咽喉科杂志, 2004, 39(1): 24-27.
[2] MASAKO M, CHIEKO H, MITSUNORI S, et al. 3-Dimensional computed tomography lymphography-guided identifi-cation of sentinel lymph nodes in breast cancer patients using subcutaneous injection of nonionic contrast medium: a clinical trial[J]. Comput Assist Tomogr, 2004, 28(1): 46-51.
[3] SUGI K, KITADA K, YOSHINO M, et al. New method of visualizing lymphatic in lung cancer patients by multidetector computed tomography[J]. J Comput Assist Tomogr,2005, 29(2): 210-214.
[4] WAGNER S. Benign lymph node hyperplasia and lymph node metastases in rabbits Animal models for magnetic resonance lymphography[J]. Invest Radiol, 1994, 29(3): 364-371.
[5] 应海岳, 吴海涛, 周梁. 兔VX2舌癌颈深淋巴结转移模型建立及其转移特性观察[J]. 中华耳鼻咽喉头颈外科杂志, 2008, 43(10): 778-781.
[6] PARTSCH H, URBANEK A, WENZEL-HOR A B. The dermal lymphatics in lymphoedema visualized by indirect lymphography[J]. Br J Dermatol, 1984, 110(4): 431-438.
[7] MUSUMECI R, TESOO-TESS J D, COSTA A, et al. Indirect lymphography of the breast with iotasul: a vanishing hope?[J]. Lymphology, 1984, 17(4): 118-123.
[8] SUGA K, YUAN Y, UEDA K, et al. Computed tomography lymphography with intrapulmonary injection of iopamidol for sentinel lymph node localization[J]. Invest Radiol, 2004,39: 313-324.
[9] LUBACH D, LUDEMANN W, BERENS V, et al. Recent findings on the angioarchitecture of the lymph vessel system of human skin[J]. Br J Dermatol, 1996, 135: 733-737.
[10] SCHMID-SCHONBEIN G W. Microlymphatics and lymph fl ow[J]. Physiol Rev. 1990,70: 987-1028.
[11] SUGA K, YAMAMOTO S, TANGOKU A et al. Breast sentinel lymph node navigation with three-dimensional interstitial multidetector-row computed tomographic lymphography[J]. Invest Radiol, 2005, 40(6): 336-342.
[12] WISNER E R, KATZBERG R W, LINK D P, et al. Indirect computed tomography lymphography using iodinated nanoparticles to detect cancerous lymph nodes in a cutaneous melanoma model[J]. Acad Radiol, 1996, 3(1): 40-48.
[13] MCINTIRE G L, BACON E R, TONER J L, et al. Pulmonary delivery of nanoparticles of insoluble, iodinated CT X-ray contrast agents to lung draining lymph nodes in dogs[J]. J Pharm Sci, 1998, 87(11): 1466-1470.
[14] WOLF G L, GAZELLE G S, MCINTIRE G L, et al. Percutaneous computed tomography lymphography in the rabbit by subcutaneously injected nanoparticulates[J]. Acad Radiol,1994, 1(4): 352-357.
[15] WISNER E R, KATZBERG R W, KOBLIK P D, et al. Indirect computed tomography lymphography of subdiaphragmatic lymph nodes using iodinated nanoparticles in normal dogs[J]. Acad Radiol, 1995, 2(5): 405-412.
[16] HAYASHI H, TANGOKU A, SUGA K, et al. CT lymphography-navigated sentinel lymph node biopsy in patients with superficial esophageal cancer[J]. Surgery, 2006, 139(2): 224-235.
[17] UEDA K, SUGA K, KANEDA Y, et al. Preoperative imaging of the lung sentinel lymphatic basin with computed tomographic lymphography: a preliminary study[J]. Ann Thorac Surg, 2004, 39: 313-314.
(本文编辑:吴彬)
Indirect computed tomography lymphography for diagnosis of early neck lymph node metastasis in tongue cancer
YING Haiyue1, WU Haitao2. 1.Department of Otorhinolaryngology, Ningbo No.2 Hospital, Ningbo,315010; 2.Department of Otolaryngology-Head and Neck Surgery, EENT Hospital of Fudan University, Shanghai,200031
Objective: Experimental evaluation of the potential utility of indirect computed tomography lymphography (CT-LG) for detecting early cervical lymph node metastasis in rabbits VX2 tongue cancer model. Methods: Eighteen New-Zealand rabbits were divided into 3 groups randomly, one group were injected egg-yolk emulsion in the neck, one group were transplanted with VX2 tumor tissue mass suspension in the tongue, and the last remained untreated. CT-LG with submucosal injection of 0.5 mL Iohexol in the tongue was performed, followed by postmortem examination of deep cervical lymph nodes. Results: Only deep cervical lymph nodes were enhanced in CT-LG, there was no noticeable enhancement in the blood vessels. The average diameter of metastaticlymph nodes were (0.73±0.08) cm in CT, the hyperplasic group were (0.75±0.10) cm and the normal group were (0.47±0.05) cm. The contrast in metastatic nodes reduced more slowly than normal and hyperplasic nodes with significant difference. Metastatic nodes’ manifestations in CT-LG included filling defect, rugosity in line and heterogeneous while the other two groups appear to be smooth and homogenous. Conclusion: Indirect CT-LG has some advantage in finding out the early neck lymph node metastasis in tongue cancer.
tongue cancer; VX2 cell; lymphatic metastasis; computed tomography; indirect lymphography;rabbits
R76
A
10.3969/j.issn.2095-9400.2016.09.009
2015-12-03
应海岳(1975-),男,浙江慈溪人,副主任医师,硕士。
