人参总皂苷对β-淀粉样蛋白25~35诱导的海马神经细胞毒性的保护作用
2016-10-31张国双王志涛寻知元
张国双 王志涛 赵 琦 寻知元
(天津市安定医院,天津 300222)
人参总皂苷对β-淀粉样蛋白25~35诱导的海马神经细胞毒性的保护作用
张国双王志涛1赵琦2寻知元
(天津市安定医院,天津300222)
目的探讨人参总皂苷对β-淀粉样蛋白(Aβ25~35)诱导的海马神经细胞毒性的保护作用。方法建立大鼠海马神经细胞Aβ25~35损伤模型。通过Neurofilament染色,测定细胞毒性以及乳酸脱氢酶(LDH)活性考察人参总皂苷对Aβ25~35诱导的海马神经细胞毒性的保护作用;利用Hoechst33258进行免疫荧光染色实验,观察细胞形态,检测细胞凋亡情况;通过Fluo-3AM荧光探针技术在共聚焦显微镜下测定细胞内钙离子浓度 (〔Ca2+〕i)的变化情况。结果1.5 μmol/L Aβ25~35为造成神经细胞毒性的最佳浓度。人参总皂苷50 mg/L,100 mg/L以及200 mg/L对Aβ25~35诱导的海马神经细胞具有良好保护作用,呈现出一定的剂量依赖性。人参总皂苷100 mg/L可显著降低Aβ25~35诱导的神经细胞凋亡,可明显抑制Aβ25~35诱导的海马神经细胞〔Ca2+〕i的升高。结论人参总皂苷可有效保护海马神经细胞免受Aβ25~35毒性损伤,其作用机制与降低〔Ca2+〕i有关。
人参总皂苷;β-淀粉样蛋白(Aβ)25~35;海马神经细胞;细胞内钙离子浓度〔Ca2+〕i
阿尔茨海默病(AD)主要表现为记忆力减退、认知功能障碍、分析判断能力的下降、意识模糊和智力逐渐丧失、甚至人格改变,最终导致生活不能自理〔1〕。在65岁以上人群中,AD是继心血管病、肿瘤、脑卒中之后的第4位死亡原因〔2,3〕。AD发病早期的关键性环节是β-淀粉样前体蛋白(APP)分解代谢和β-淀粉样蛋白(Aβ)的异常释放和沉积〔4〕。目前,获得批准治疗AD的药物主要是有益于记忆和思维的,并不能够针对疾病的病因来治疗〔5〕。因此寻找从发病机制上能改善AD的药物非常有现实意义。体外原代培养海马细胞,采用Aβ25~35损伤海马细胞,可一定程度上模拟在体AD的发生机制。本实验旨在探讨人参总皂苷对Aβ25~35诱导的海马神经细胞毒性的保护作用。
1 资料与方法
1.1实验试剂Aβ25~35购自Sigma(美国)人参总皂苷购买于成都普瑞法生物有限公司(成都,中国)。
1.2动物、给药及分组雌性SD大鼠,体重200~220 g,孕期18 d,由天津大学动物实验中心提供。海马细胞生长至第7天后,取出海马细胞进行分别处理:①正常组,不加任何处理因素,换上同体积的新鲜的无血清DMEM培养基;②模型组,在每孔中加入Aβ25~35终浓度为1.5 μmol/L无血清DMEM培养基;③人参总皂苷组(含Aβ25~351.5 μmol/L)。每小组药物均用无血清DMEM培养液配制。置于37℃,5% CO2培养箱中培养24 h。
1.3细胞活性以及乳酸脱氢酶(LDH)活性测定向96孔板的每孔加入20 μl MTT(3 mg/ml)继续培养,4 h后吸弃上清,加入150 μl二甲基亚砜,充分振荡至晶体完全溶解,于酶标仪490 nm波长下测各孔的光密度值(OD),并计算相对生存率。取各孔的细胞培养基,按照南京建成LDH试剂盒说明书操作,并在450 nm处测定各组吸光度值,计算各组培养基中LDH活性。
1.4Hoechst33258 染色方法培养海马神经细胞于第7天给药处理,分为正常组,模型组(Aβ25~351.5 μmol/L),人参总皂苷组(20 μmol/L)给药处理24 h后开始免疫染色。按章立等〔6〕等方法操作,冷PBS清洗,4%多聚甲醛固定1 h。PBS清洗3次后,加5 mg/L Hoechst33258染色液染色30 min,PBS液清洗,封片液封片,在倒置荧光显微镜下观察。细胞核固缩或碎片分裂视为凋亡。于64× 镜下每片玻璃片随机取5个不同视野,计算细胞凋亡率(凋亡细胞数/总细胞数)。
1.5激光共聚焦测定细胞内钙离子(〔Ca2+〕i)浓度根据报道的实验方法测定海马细胞内钙离子浓度〔6〕。采用Fluo-3 AM荧光染色钙离子,激发光波长为488 nm左右,发射波长为525~530 nm测定〔Ca2+〕i。激光共聚焦皿培养神经细胞7 d,弃去培养液,PBS洗两遍,加入终浓度为5 μmol/L Fluo-3AM与D-Hank(无Ca2+)的混合液,负载45 min后,测定F值;加入Ionomycin终浓度为5 μmol/L测定Fmax;加入MnCl2终浓度为2 mmol/L测定Fmin,计算〔Ca2+〕i浓度。
1.6统计学处理采用SPSS17.0软件包进行t检验。
2 结 果
2.1Aβ25~35造成海马神经细胞损伤海马神经细胞在加入1.5 μmol/L Aβ25~355 h后,利用MTT法检测细胞相对生存率为(78.9±6.3)%。综合细胞形态学观察结果(图1),选定Aβ25~351.5 μmol/L为神经细胞毒性模型的造模浓度。
2.2人参总皂苷对Aβ25~35诱导的海马神经细胞影响
2.2.1细胞形态学检测正常细胞核呈圆形或椭圆形;凋亡细胞核固缩或裂片。模型Aβ25~35组可见较多的细胞表现为核染色质凝集,致密浓染,细胞核染色质固缩或碎裂成2块以上。与模型组比较,人参皂苷保护组可以显著降低Aβ25~35处理后海马神经元的损伤,细胞形态有较好的恢复,呈现出与正常细胞类似的形态学(图2)。
2.2.2细胞凋亡率检测如图3所示:Hoechst33258荧光染色结果显示,正常细胞荧光着色浅;凋亡细胞呈强荧光反应。模型组可见荧光增强。与正常组细胞凋亡率〔(5.2±0.4)%〕及LDH活性〔(100.2±11.3)%〕相比,模型组细胞凋亡率〔(29.6±1.1)%〕以及LDH活性〔(259.3±19.2)%〕显著增加;由Aβ25~35所诱导的细胞凋亡以及LDH活性可显著地被100 mg/L人参总皂苷抑制。与模型组比较,人参总皂苷可以显著降低Aβ25~35处理后海马神经元的凋亡率〔(13.2±0.6)%〕和LDH活性〔(149.6±9.5)%〕。
2.2.3〔Ca2+〕i检测图4所示,与正常组比较〔(100.2±9.8)%〕1.5 μmol/L Aβ25~35使Fluo-3-Ca荧光显著增强〔(328.7±29.6)%〕,而人参总皂苷处理显著抑制了这种荧光增强〔(261.3±19.6)%〕。模型组对细胞损害较大,造成〔Ca2+〕i增高,而人参总皂苷能对Aβ25~35诱导神经细胞的损害具有较好的保护作用。

图1 Aβ25~35对海马神经细胞的损伤作用(Hoechst 33258染色,×64)
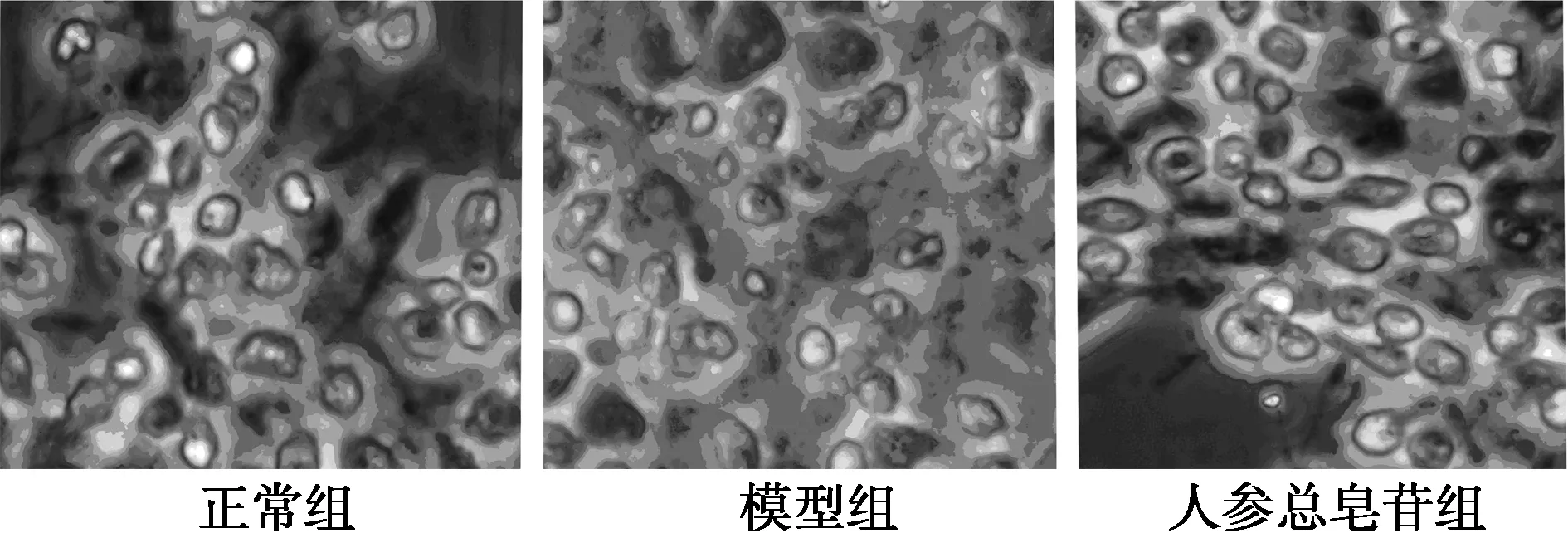
图2 人参总皂苷缓解Aβ25~35诱导的海马神经细胞损伤(Hoechst33258染色,×64)

图3 人参总皂苷对Aβ25~35诱导的海马神经细胞凋亡的影响(Hoechst 33258荧光染色,×64)

图4 人参总皂苷对Aβ25~35诱导的海马神经细胞〔Ca2+〕i的影响
3 讨 论
人参Panax ginseng C.A.Mey和西洋参P.quinquefolium L.是五加科人参属植物,具有“除邪气、补五脏、安精神、定魂魄、止惊悸、开心、益智”等功效〔7,8〕。人参总皂苷是人参、西洋参的主要活性提取组分,具有抗肿瘤、抗氧化、延缓衰老和治疗老年性疾病引起的认知功能障碍等作用〔4,9,10〕。
AD发病早期的关键性环节是APP分解代谢和Aβ的异常释放和沉积〔4〕。Aβ25~35可造成DNA损伤等凋亡特征,因此选择Aβ25~35造成海马细胞毒性具有重要意义。染色质染色剂Hoechst33258荧光染色证明,1.5 μmol/L 的Aβ25~35使培养的海马神经细胞出现凋亡特征。人参总皂苷能有效地减少由Aβ25~35毒性产生的DNA碎片发生,降低神经细胞的凋亡率,对神经细胞具有保护作用。本实验结果提示人参总皂苷可通过抑制海马神经细胞的凋亡而降低Aβ25~35对海马神经细胞的毒性作用。〔Ca2+〕i浓度的升高被认为是凋亡的重要信号,研究表明抑制〔Ca2+〕i浓度的升高一定程度上可以防止细胞凋亡〔11,12〕。本研究表明人参总皂苷可平衡神经细胞内〔Ca2+〕i浓度,降低Aβ25~35诱导的海马神经细胞凋亡。
1宋晓征,李成杰,张子寅,等.维生素E对阿尔茨海默病患者血清中CD8/CD28表达水平的影响〔J〕.中国实用神经疾病杂志,2013;16(20):48-9.
2Glenner GG,Wong CW.Alzheimer's disease and Down's syndrome:sharing of a unique cerebrovascular amyloid fibril protein〔J〕.Biochem Biophy Res Commun,1984;122(3):1131-5.
3Miller DL,Papayannopoulos IA,Styles J,etal.Peptide compositions of the cerebrovascular and senile plaque core amyloid deposits of Alzheimer's disease〔J〕.Arch Biochem Biophy,1993;301(1):41-52.
4苏心,张文治,吴剑娟.β-淀粉样蛋白对培养胎鼠大脑神经干细胞作用的研究〔J〕.中华老年心脑血管病杂志,2005;7(3):192-5.
5Wang JZ,Grundke-Iqbal I,Iqbal K.Glycosylation of microtubule-associated protein tau:an abnormal posttranslational modification in Alzheimer's disease〔J〕.Nature Med,1996;2(8):871-5.
6章立,李新荣,徐蘅,等.用Fluo3-AM测定2型糖尿病患者淋巴细胞内Ca2+浓度及药物对患者胞内Ca2+浓度的影响〔J〕.中国药科大学学报,1999;30(6):451-5.
7谭世强,张爱华,许永华,等.人参总皂苷对粘虫体内蛋白质含量及消化酶活性的影响〔J〕.中国中药杂志,2013;38(11):1692-6.
8魏建华,杨文志,刘强,等.人参饼干中人参总皂苷、人参单体皂苷Rb1及Re+Rg1含量测定及人参饼干中人参皂苷的定性鉴别〔J〕.人参研究,2013;(1):31-3.
9潘爱珍,易伟民,余晓娟,等.人参总皂苷对脾虚模型大鼠的保护作用研究〔J〕.中国药房,2013;24(39):3682-4.
10吕昕瞳,杨丹莉,邓江,等.人参总皂苷对血管紧张素Ⅱ所致乳大鼠心肌细胞肥大的抑制作用〔J〕.中国药理学与毒理学杂志,2013;27(4):641-5.
11Emilsson L,Saetre P,Jazin E.Alzheimer′s disease:mRNA expression profiles of multiple patients show alterations of genes involved with calcium signaling〔J〕.Neurobiol Dis,2006;21(3):618-25.
12Poon HF,Shepherd HM,Reed TT,etal.Proteomics analysis provides insight into caloric restriction mediated oxidation and expression of brain proteins associated with age-related impaired cellular processes:mitochondrial dysfunction,glutamate dysregulation and impaired protein synthesis〔J〕.Neurobiol Aging,2006;27(7):1020-34.
〔2014-12-29修回〕
(编辑赵慧玲/曹梦园)
张国双(1979-),男,副主任医师,主要从事精神医学临床研究。
R743
A
1005-9202(2016)18-4438-02;doi:10.3969/j.issn.1005-9202.2016.18.015
1天津医科大学总医院2天津市人民医院
