响应面法优化干花豆总黄酮提取工艺研究
2016-10-28梁志远甘秀海杨小生
梁志远, 甘秀海, 杨小生,吴 英, 黄 玉
( 1. 贵州师范学院 化学与生命科学学院, 贵阳 550018; 2. 贵州省、中国科学院天然产物化学重点实验室, 贵阳 550002 )
响应面法优化干花豆总黄酮提取工艺研究
梁志远1, 甘秀海1, 杨小生2*,吴英1, 黄玉1
( 1. 贵州师范学院 化学与生命科学学院, 贵阳 550018; 2. 贵州省、中国科学院天然产物化学重点实验室, 贵阳 550002 )
干花豆(Fordiacauliflora)的主要有效成分为黄酮类、生物碱、有机酸等,具有益智、抗衰老、抗炎等作用。目前的研究主要集中在化学成分及药理活性等方面,对总黄酮成分提取工艺优化报道较少。该研究以新鲜干花豆为材料,以总黄酮提取量为评价指标,在提取温度、料液比、乙醇浓度和提取时间单因素实验基础上,采用响应面法优化了干花豆总黄酮提取工艺,同时测定了总黄酮对1, 1-二苯基苦基苯肼自由基(DPPH·)和羟基自由基(·OH)清除能力。结果表明:干花豆总黄酮提取最佳工艺条件为提取温度78 ℃、料液比为1∶30(g·mL-1)、乙醇浓度71%和提取时间为187 min。在此条件下,总黄酮得率预测值为10.61 mg·g-1,实际为10.53 mg·g-1,理论值与预测值的相对误差为0.76%;干花豆总黄酮对DPPH和OH自由基清除能力IC50值分别为14.09和78.43 μg·mL-1,弱于Vc(8.11和67.95 μg·mL-1)。该提取工艺稳定合理,准确可靠,是提取干花豆总黄酮的可行方法。该研究结果为干花豆中总黄酮成分的进一步开发利用奠定了基础。
干花豆, 总黄酮, 响应面法, 抗氧化性
干花豆(Fordiacauliflora)为豆科蝶形花亚科干花豆属植物,又名水罗伞、玉郎伞、野京豆等,有很高药用价值,主要分布于两广和云南。广西的壮、瑶族用于风湿骨痛、跌打损伤、骨折、小儿痴呆、小儿疳积、肌痿症、体虚及产妇身体复元等症(广西卫生厅,1963;广西卫生局,1974)。近代药理研究表明,干花豆有抗衰老(韦奇智等,2003)、抗炎(汤祖青等,2003)、抗氧化(吴植强等,2004)等功效。干花豆中含有多种有效成分,已从中分离得到多个黄酮(戴斌等,2003;戴向东等,2003;梁志远等,2006)化合物,对其总黄酮提取方法有些报道(李光仪等,2006;黄锦威等,2008),但系统性研究目前尚未见。
为了充分利用我国的药用植物资源,本研究用乙醇回流法提取干花豆总黄酮,探讨了提取温度、料液比、乙醇浓度和提取时间等因素对总黄酮得率的影响,通过响应面分析(response surface methodology,RSM)进行提取条件优化,并测定总黄酮对1, 1-二苯基苦基苯肼自由基(DPPH·)和羟基自由基(·OH)的清除作用,旨在为干花豆总黄酮的开发利用提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 原料及处理方法干花豆采自云南西双版纳,经昆明植物研究所崔景云高级工程师鉴定。将新鲜干花豆切片自然风干,粉碎后过40 目筛,50 ℃恒温烘干4 h,干燥器中冷却待用。1.1.2 试剂与仪器芦丁对照品(>98%),贵州省迪大科技有限责任公司;1, 1-二苯基苦基苯肼(DPPH),美国SIGMA 公司;其余试剂均为分析纯。UV2450紫外-可见分光光度计,日本岛津公司;BSA124S电子天平,赛多利斯科学仪器公司;HJ-3数显恒温磁力搅拌器,金坛市荣华仪器制造有限公司。
1.2 方法
1.2.1 芦丁对照品溶液制备及测定波长选定参照孙春艳等(2006)的方法,稍有改动。精密称取经干燥恒重的芦丁标准品10.0 mg,用60%的乙醇溶解并定容至50 mL,摇匀,即得浓度为0.20 mg·mL-1芦丁对照品溶液。移取芦丁对照品溶液2 mL于25 mL容量瓶中,加入1.0 mL 5% NaNO2溶液,摇匀,静置6 min;再加入1.0 mL 10% Al(NO3)3溶液,摇匀,静置6 min;再加入5 mL 4%NaOH溶液,用60%乙醇定容至刻度,摇匀,静置15 min,变化波长在400~600 nm测定吸光度(A)。由于在504 mn时具有最大A值,所以确定504 mn为工作波长。
1.2.2 标准曲线的绘制分别精密移取芦丁对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL于6只25 mL容量瓶中,按“1.2.1”项下方法测定A。以A为纵坐标,芦丁质量浓度(C)为横坐标,绘制标准吸收曲线。回归方程式:A= 0.0101C+ 0.0383,相关系数r=0.9996,说明芦丁在0.004~0.040 mg·mL-1范围内具有良好的线性关系。
1.2.3 总黄酮提取及含量测定精确称取干花豆粉末1.00 g于100 mL具塞锥形瓶中,按一定的料液比、乙醇浓度,提取温度和提取时间下进行总黄酮提取,趁热过滤,定容至50 mL,即干花豆总黄酮提取液。精密移取1.0 mL干花豆总黄酮提取液,按“1.2.1”项下方法测定其吸光度,计算总黄酮含量。
1.2.4 单因素试验在保持其他条件不变的情况下,分别以不同的提取温度(50、60、70、80 ℃)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 )、乙醇浓度(50%、60%、70%、80%、90%)和提取时间(120、150、180、210、240 min)为单因素,考察各因素对干花豆总黄酮得率的影响。
1.2.5 总黄酮提取工艺的优化根据Box-Benhnken的中心组合试验设计原理(任雪峰等,2014),在单因素试验结果最优水平基础上,以提取温度、料液比、乙醇浓度和提取时间4个因子为自变量(分别以X1、X2、X3、X4表示),以总黄酮得率作为响应值,采用四因子三水平的响应面法进行试验。响应面因素和水平取值见表1。

表 1 响应面试验因素水平表
1.2.6 总黄酮对DPPH·清除率的测定参照陈建平等(2012)的方法,用无水乙醇配制一系列浓度的干花豆总黄酮溶液,精密移取干花豆总黄酮和0.2 mmol·L-1的DPPH·无水乙醇溶液各2 mL于10 mL比色管中,摇匀,室温下避光反应30 min,在517 nm处测其吸光值(Ai),用无水乙醇代替干花豆总黄酮溶液,测定其吸光值(Ao),用2 mL无水乙醇代替DPPH乙醇溶液,测定其吸光值(Aj)。用一系列浓度的Vc溶液代替干花豆总黄酮溶液。平行测定3次,取其平均值。计算公式:
DPPH·清除率(%) = [1-(Ai-Aj)/Ao]×100
1.2.7 总黄酮对·OH清除率的测定参考陈建平等(2012)的方法,稍有改动。10 mL比色管中加入pH 7.4磷酸盐缓冲溶液(PBS)2 mL、1.5 mmol·L-1邻二氮菲溶液1.5 mL和1 mL蒸馏水,混合均匀后加入7.5 mmol·L-1硫酸亚铁溶液1 mL,混匀后再加入0.01% H2O21 mL,用蒸馏水定容至刻度,于37 ℃下恒温反应60 min,在536 nm处测其吸光度Ao,以1 mL 蒸馏水代替H2O2重复上述操作,测得吸光度A1,以1 mL一系列浓度的干花豆总黄酮溶液代替1 mL蒸馏水,测得吸光值A2。取磷酸盐缓冲溶液2.0和8.0 mL蒸馏水于试管中,混匀作空白管。用一系列浓度的Vc溶液代替干花豆总黄酮溶液。平行测定3次,取其平均值。公式如下:
·OH清除率(%)=(A2-A0)/(A1-A0)×100
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对总黄酮得率的影响由图1可知,随着提取温度的升高,总黄酮得率随着增加,70 ℃时达到最大值。因此,选择70 ℃为提取温度。

图 1 提取温度对总黄酮得率的影响Fig. 1 Effects of extraction temperature on total flavonoid yield
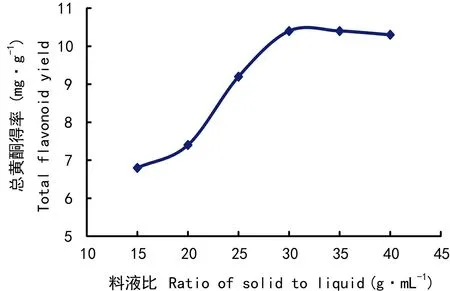
图 2 料液比对总黄酮得率的影响Fig. 2 Effects of solid to liquid ratio on total flavonoids yield
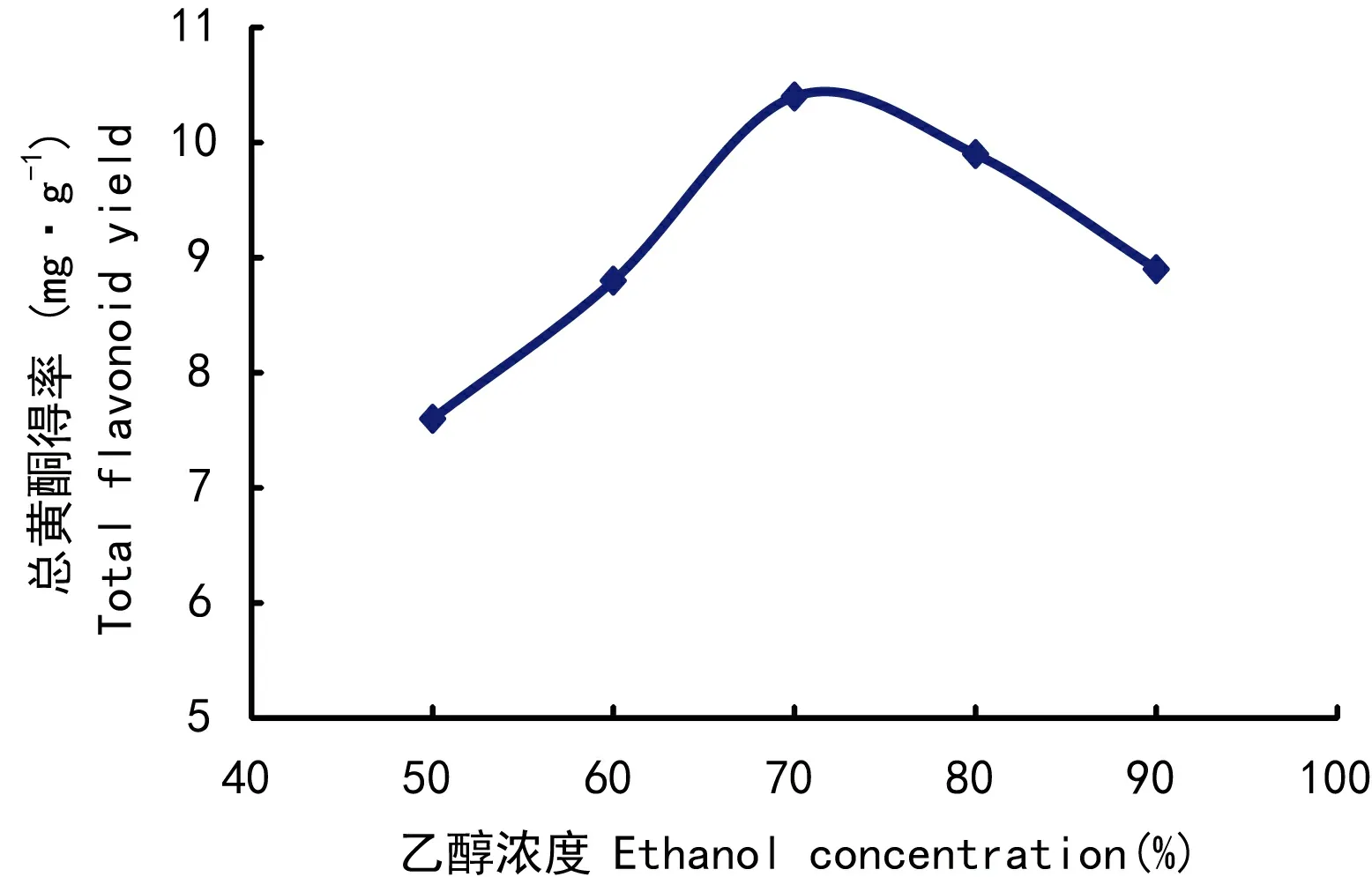
图 3 乙醇浓度对总黄酮得率的影响Fig. 3 Effects of ethanol concentrtation on total flavonoid yield

图 4 提取时间对总黄酮得率的影响Fig. 4 Effects of extraction time on total flavonoid yield
2.1.2 料液比对总黄酮得率的影响由图2可知,总黄酮得率随着料液比的升高而上升,在1∶30时达到最大值,再提高料液比对提高得率没有影响,选择料液比为1∶30(g·mL-1)。
2.1.3 乙醇浓度对总黄酮得率的影响由图3可知,随着乙醇浓度的提高,总黄酮得率也随着增加,在70%时达到最大值。因此,选择乙醇浓度为70%。
2.1.4 提取时间对总黄酮得率的影响由图4可知,随着提取时间的增加,总黄酮得率不断增加,在180 min时提取量达到最大值,再延长提取时间,得率反而下降。因此,提取时间选择180 min。
2.2 响应面优化设计与结果
2.2.1 响应面试验设计及结果按照Box-Benhnken的中心组合试验方案进行了四因子三水平共29个试验点的响应面分析试验,29个试验点分为24个析因点和5个零点对总黄酮的乙醇提取工艺进行优化。试验设计及结果见表2。
2.2.2 模型的建立及显著性检验利用Design-Expert 8.0.6统计软件对表2中数据进行二次多元回归拟合,得到总黄酮得率(Y)对因素X1、X2、X3及X4相应的二次方程模型:
Y=10.476-0.024A-0.093B+0.126C+0.537D-0.103AB-0.023AC+7.500AD+0.078BC+0.025BD-0.023CD-0.755A2-0.646B2-0.772C2-1.118D2
同时,对表2中的数据进行多元回归分析,其结果见表3。
由表3可知,该模型设计结果极显著(P<0.001),表明响应值与预测值之间有良好的拟合度,回归方程相关系数R2=0.9990,显示响应值的变化99.90%来源于X1(提取温度)、 X2(料液比)、 X3(乙醇浓度)和X4(提取时间)4个变量; 同时失拟检验P>0.05, 说明未知因素对实验结果影响较小。因此,该模型可用于预测干花豆总黄酮得率的实际情况。各因素中一次项X2、X3、X4及二次项X12、X22、X32、X42为极显著,一次X1为显著,交互项X2X3为极显著,由此可见,各具体试验因素对响应值的影响不是简单的线性关系。由表3还可知,所选因素对响应值影响强弱次序为X4>X3>X2>X1,即提取时间>乙醇浓度>料液比>提取温度。

表 2 响应面试验设计及结果
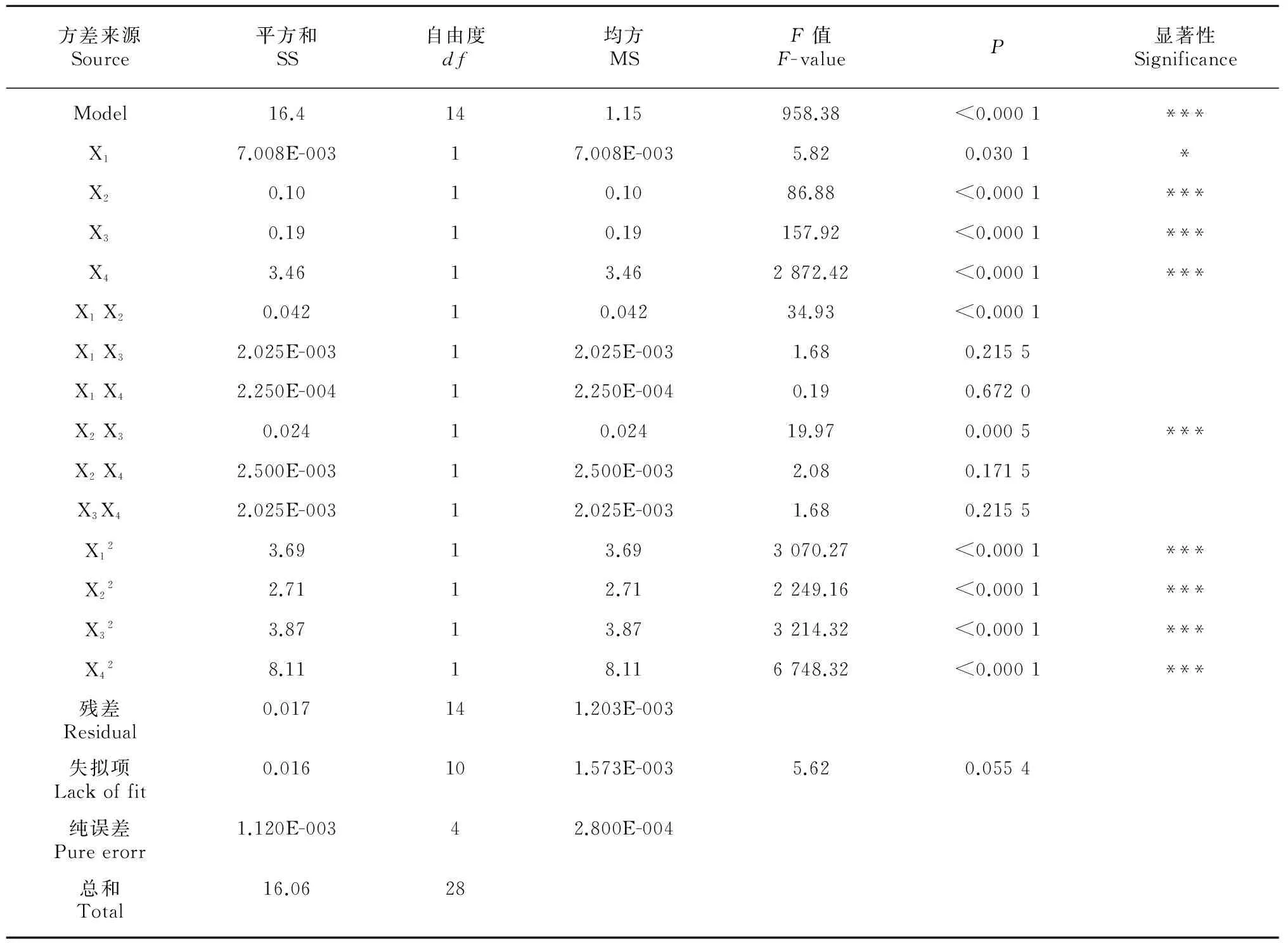
表 3 回归模型参数检验
注: ***差异极显著(P<0.001);**差异高度显著(P<0.01);*差异显著(P<0.05)。
Note: ***very significant differences(P<0.001);**highly significant differences(P<0.01);*significant differences(P<0.05).

图 5 提取温度(X1)和料液比(X2)交互作用对总黄酮得率(Y)的响应面图Fig. 5 Response surface plots showing the effects of extraction temperature (X1) and solid liquid ratio (X2) on total flavonoid yield (Y)
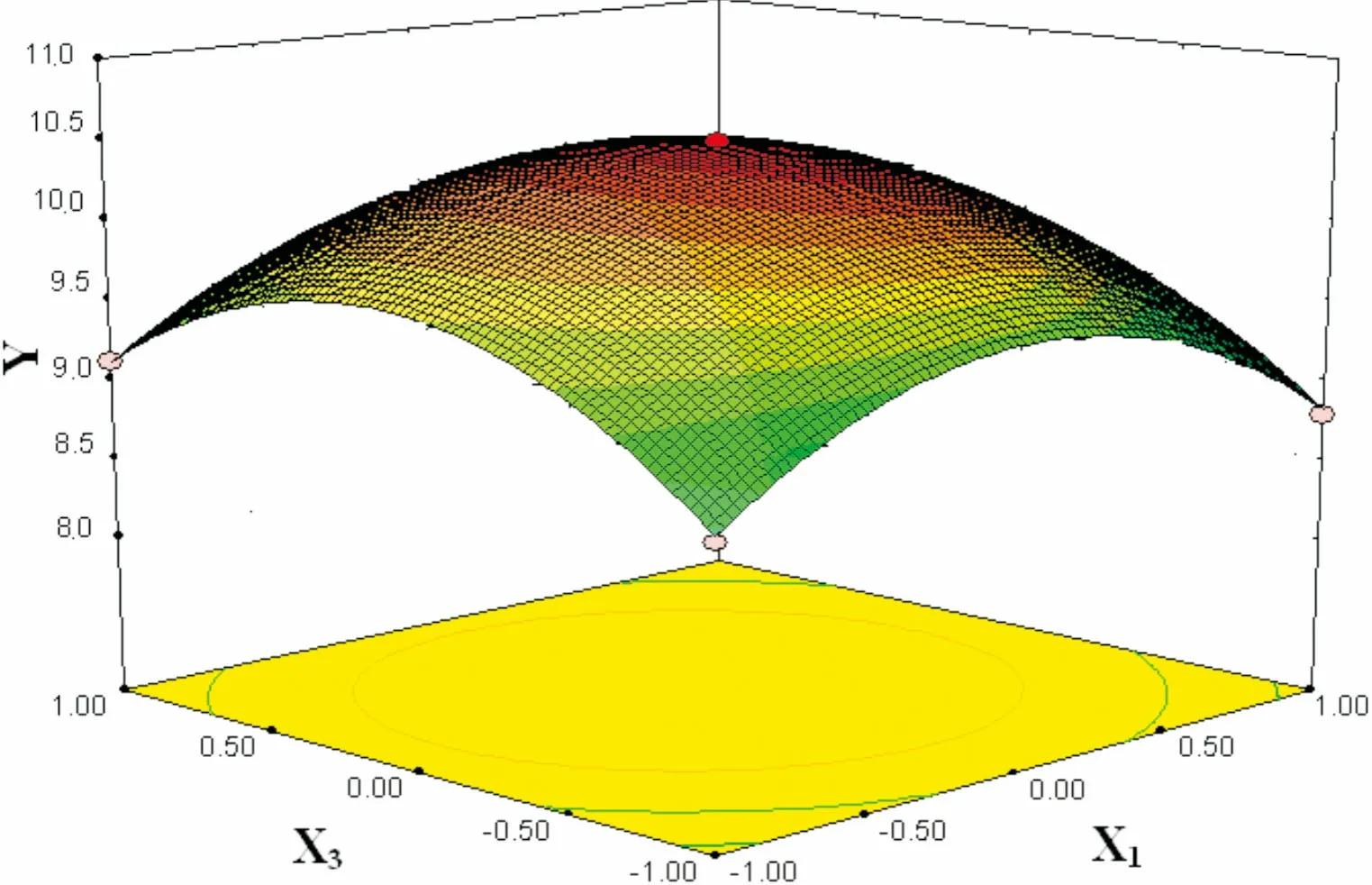
图 6 提取温度(X1)和乙醇浓度(X3)交互作用对总黄酮得率(Y)的响应面图Fig. 6 Response surface plots showing the effects of extraction temperature (X1) and ethanol concentration (X3) on total flavonoid yield (Y)
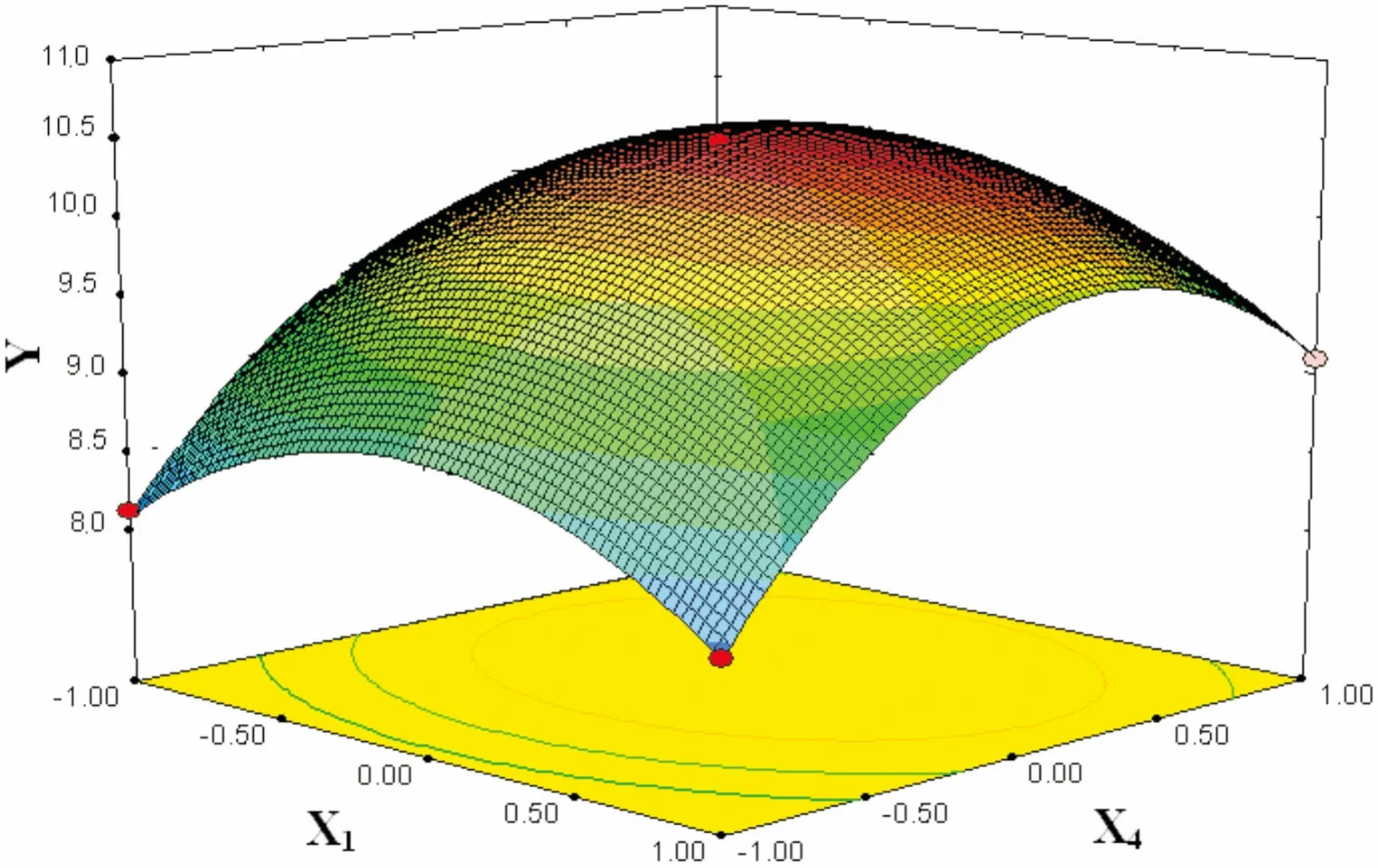
图 7 提取时间(X4)和提取温度(X1)交互作用对总黄酮得率(Y)的响应面图Fig. 7 Response surface plots showing the effects of extraction time (X4) and extraction temperature (X1) on total flavonoid yield (Y)
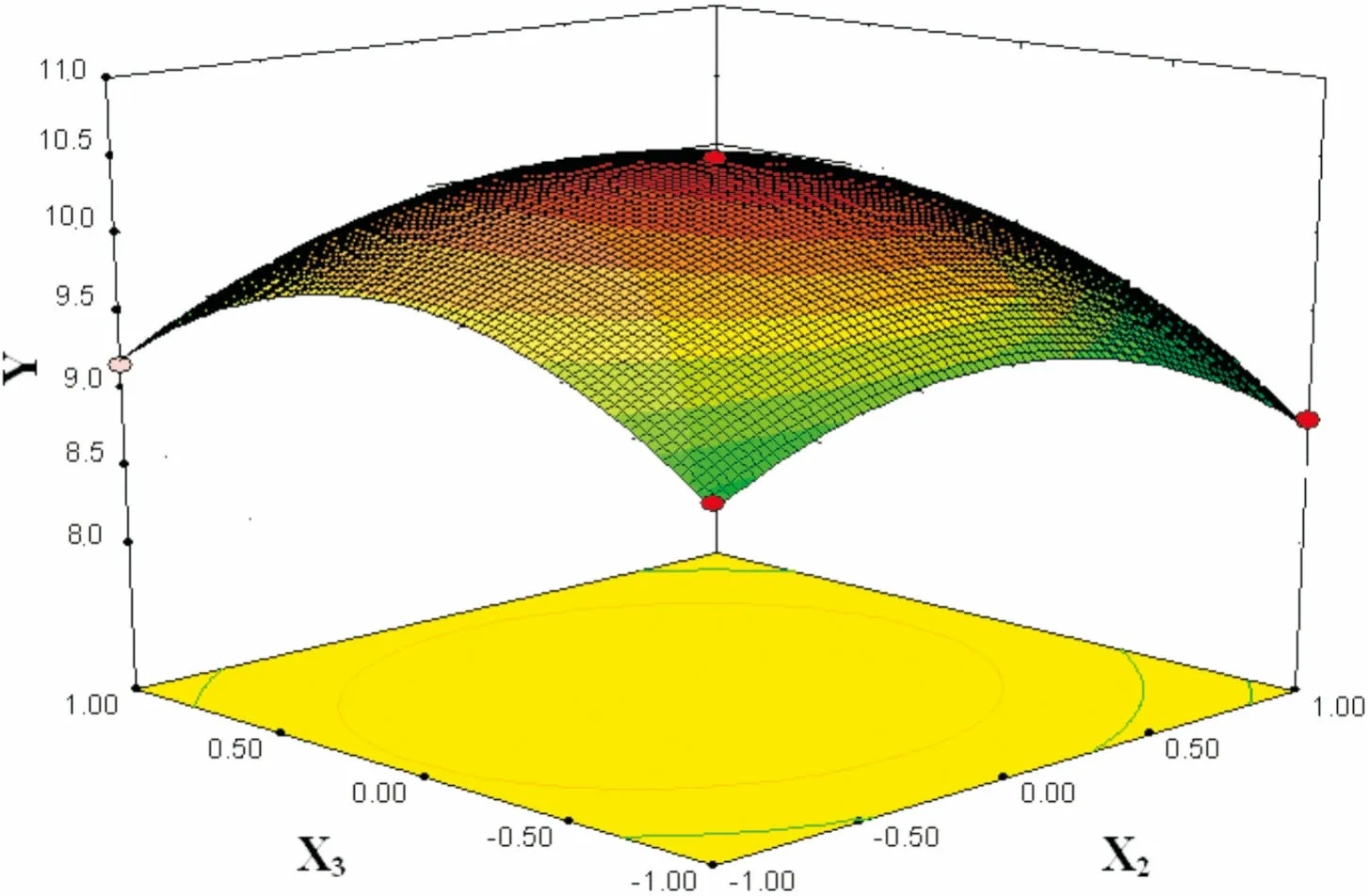
图 8 料液比(X2)和乙醇浓度(X3)交互作用对总黄酮得率(Y)的响应面图Fig. 8 Response surface plots showing the effects of solidto liquid ratio (X2) and ethanol concentration (X3) on total flavonoid yield (Y)

图 9 料液比(X2)和提取时间(X4)交互作用对总黄酮得率(Y)的响应面图Fig. 9 Response surface plots showing the effects of solidto liquid ratio (X2) and extraction time (X4) on total flavonoid yield (Y)
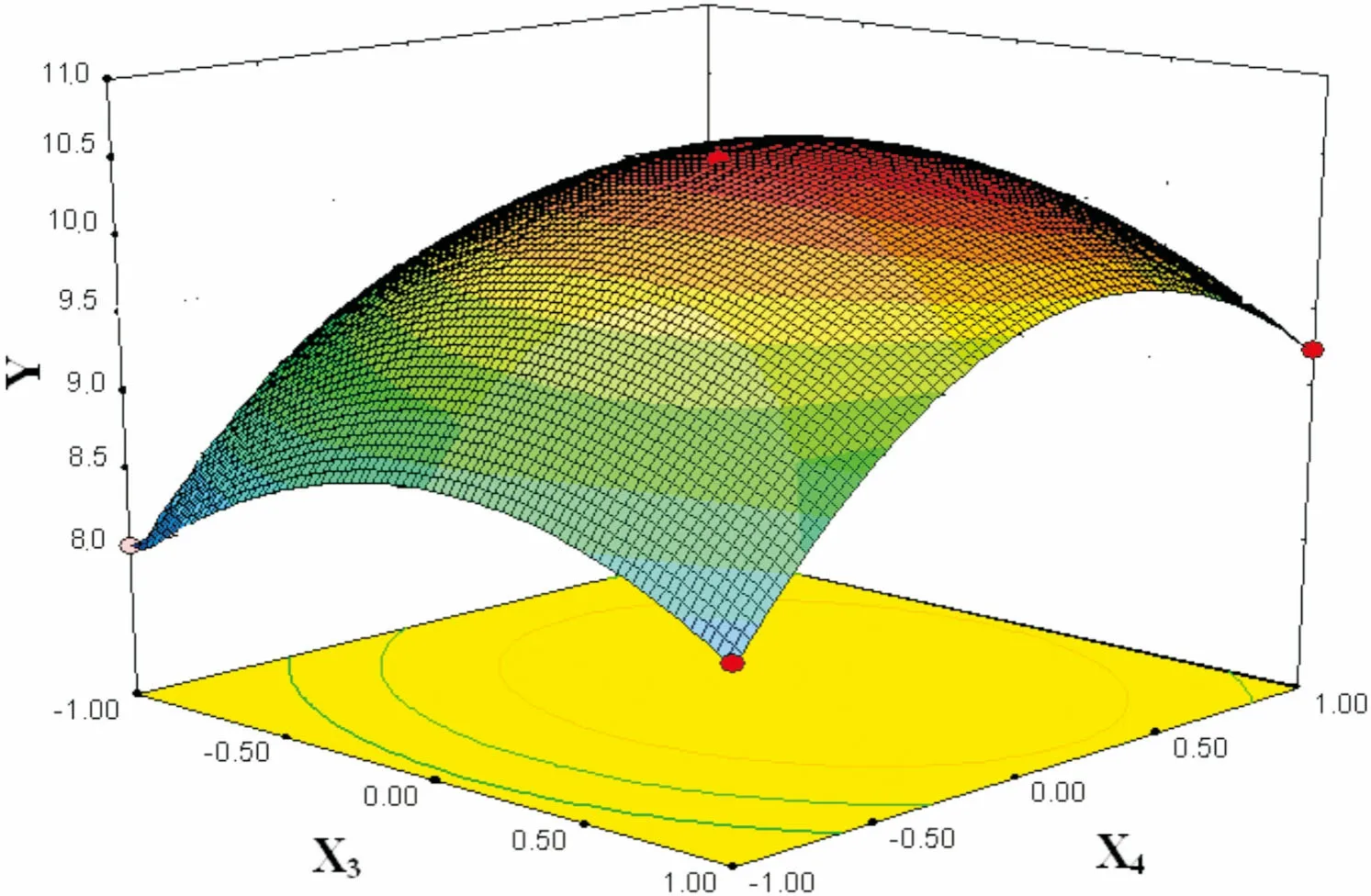
图 10 乙醇浓度(X3)和提取时间(X4)交互作用对总黄酮得率(Y)的响应面图Fig. 10 Response surface plots showing the effects of ethanol concentration (X3) and extraction time (X4) on total flavonoid yield (Y)
2.2.3 响应面分析及优化在其它因素为零水平上选择提取温度、料液比、乙醇浓度、提取时间四个变量中的两个交互因素对总黄酮得率的影响进行分析,回归优化响应面分别见图5-10。
由图5-10可知,此实验模型都能达到极值点。为确定最佳响应值的因素水平组合,利用Design-Expert 8.0.6软件对试验模型进行分析,得出优化条件为提取温度77.8 ℃,料液比1∶29.4(g·mL-1),乙醇浓度70.6%,提取时间187.2 min,考虑到实际操作性,将工艺参数修正为提取温度78 ℃,料液比1∶30(g·mL-1),乙醇浓度71%,提取时间187 min。
2.2.4 验证性试验采用修正后优化工艺参数条件按“1.2.3”项下方法,重复三次试验,干花豆总黄酮得率为10.53 mg·g-1,此条件下干花豆总黄酮的理论预测得率为10.61 mg·g-1,两者相比,相对误差为0.76%,说明响应面法优化结果可靠。
2.3 抗氧化能力的测定结果
根据1.2.6项和1.2.7项下的方法,测定不同浓度干花豆总黄酮样品对DPPH和OH自由基的消除能力,利用Origin软件处理数据得到样品消除DPPH和OH自由基的半数抑制率IC50值分别为14.09和78.43 μg·mL-1,弱于阳性对照Vc (8.11和67.95 μg·mL-1)。
3 结论
用乙醇提取干花豆总黄酮,在考察提取温度、料液比、乙醇浓度和提取时间对总黄酮提取量影响的基础上,通过响应面分析优化,得到最佳提取工艺条件为:提取温度78 ℃,料液比1∶30(g·mL-1),乙醇浓度71%,提取时间187 min。此条件下干花豆总黄酮得率为10.53 mg·g-1。该提取工艺稳定合理,准确可靠,是提取干花豆总黄酮的可行方法。同时,抗氧化活性测定结果显示,干花豆总黄酮对DPPH和OH自由基均有较好的清除能力。本研究为干花豆的进一步开发及天然抗氧化剂的应用提供了科学依据。
CHEN JP, SU JY, CHEN L, et al, 2012. Study on antioxidant activity of volatile oil from Mei Pian tree [J]. Sci Technol Food Ind, 33(05): 149-151. [陈建平, 苏健裕, 陈玲, 等, 2012. 梅片树叶挥发油的抗氧化活性研究 [J]. 食品工业科技, 33(05): 149-151.]
DAI B, QIU CC, DAI XD, et al, 2003. Chemical constituents ofFordiacaulifloraHemsl(Ⅰ) [J]. Chin Herb Med, 34(1): 21-22. [戴斌, 丘翠嫦, 戴向东, 等, 2003. 水罗伞的的化学成分(Ⅰ) [J]. 中草药, 34(1): 21-22.]
DAI XD, YANG DA, DAI B, et al, 2003. Chemical constituents ofFordiacaulifloraHemsl(Ⅱ) [J]. Chin Herb Med, 34(5): 401-402. [戴向东, 杨东爱, 戴斌, 等, 2003. 水罗伞的的化学成分(Ⅱ) [J]. 中草药, 34(5): 401-402.]
DAI B, DAI XD, YANG DA, et al, 2003. Chemical constituents ofFordiacaulifloraHemsl(Ⅲ) [J]. Chin Herb Med, 34(12): 1 063-1 065. [戴斌, 戴向东, 杨东爱, 等, 2003. 水罗伞的的化学成分(Ⅲ) [J]. 中草药, 34(12): 1 063-1 065.]
GUANGXI HEALTH DEPARTMENT, 1963. Records of Guangxi Chinese materia [M]. Nanning: Guangxi People’s Publising House: 227. [广西卫生厅, 1963. 广西中药志 [M]. 南宁: 广西人民出版社: 227.]
GUANGXI HEALTH DEPARTMENT, 1974. Selected works of Guangxi herbal [M]. Nanning: Guangxi People’s Publising House: 1 622. [广西卫生局, 1974. 广西本草选编 [M]. 南宁: 广西人民出版社: 1 622.]
HUANG JW,YANG DA,HUANG XP,et al, 2008. Microwave extraction and determinafion of total flavonoids inFordiacauliflora[J]. Chin J Inf TCM, 15(5): 46, 59. [黄锦威,杨东爱,黄小平,等, 2008. 水罗伞中总黄酮的微波提取与含量测定 [J]. 中国中医药信息杂志, 15(5): 46, 59.]
LI GY,YANG DA, 2006. Study on extraction of total flavonoids fromFordiacaulifloraHemsl by alcohol extraction and ultrasonic wave [J]. Lishizhen Med & Mat Med Res, 17(12): 2 537-2 538. [李光仪,杨东爱, 2006. 醇提法与超声波法提取水罗伞中总黄酮类化合物的研究 [J]. 时珍国医国药, 17(12): 2 537-2 538.]
LIANG ZY, YANG XS, ZHU HY, et al, 2006. Two new flavones fromFordiacauliflorain Yunnan [J]. Acta Pharm Sin, 41(6):533-535. [梁志远, 杨小生, 朱海燕, 等, 2006. 滇产干花豆中的二个新黄酮 [J]. 药学学报, 41(6):533-535.]
REN XF,WANG YS,DING XL,et al, 2014. Optimization of extraction technique of pigment from black potato by response surface methodology [J]. Guihaia,34(6): 859-864. [任雪峰,王永生,丁秀丽,等, 2014. 响应面法优化黑土豆色素提取工艺研究 [J]. 广西植物,34(6): 859-864.]
SUN CY,ZHAO BT,YU ZF,et al, 2006. Study on extraction technique of total flavonoids from stem and leaf ofAsparagus[J]. Sci Technol Food Ind,27(4); 141-145. [孙春艳,赵伯涛,郁志芳,等, 2006. 芦笋茎叶中黄酮类化合物的提取工艺研究 [J]. 食品工业科技,27(4); 141-145.]
TANG ZQ, CHEN BS, ZHOU Z, et al, 2003. Studies on the antiinflamation of the abstracts ofFordiacaulifloraHemsl [J]. Chin J Ethnomed Ethnopharm, 63: 223-225. [汤祖青, 陈邦树, 周智,等, 2003. 水罗伞多种提取物的抗炎作用研究 [J]. 中国民族民间医药杂志, 63: 223-225.]WU ZQ, ZHOU Z, WEI QZ, 2004. Protective effects of abstracts ofFordiacaulifloraHemsl on bromobenzene induced oxidative liver damage in mice and antioxidative capability in old mice [J]. Chin Pharmacol Bull, 20 (11): 1 221-1 223. [吴植强, 周智, 韦奇志, 2004. 水罗伞提取物对溴代苯小鼠肝损伤的保护作用和抗氧化作用 [J]. 中国药理学通报, 20 (11): 1 221-1 223.]WEI QZ, WU ZQ, ZHOU Z, et al, 2003. Researches on the acuity, toxicity and antisenility of the abstracts ofFordiacaulifloraHemsl [J]. J Guangxi Trad Chin Med Univ, 6(2): 37-40. [韦奇志, 吴植强,周智, 等, 2003. 水罗伞提取物的抗衰老作用及急性毒性研究 [J]. 广西中医学院学报, 6(2): 37-40.]
Optimization of extracting total flavonoids fromFordiacaulifloraby response surface methodology
LIANG Zhi-Yuan1, GAN Xiu-Hai1, YANG Xiao-Sheng2*, WU Ying1, HUANG Yu1
( 1.SchoolofChemistryandLifeSciences,GuizhouNormalCollege, Guiyang 550018, China; 2.KeyLaboratoryofChemistryforNaturalProductsofGuizhouProvinceandChineseAcademyofSciences, Guiyang 550002, China )
Fordiacauliflorais the genusFordiain the family Leguminosae, which contains flavonoids, alkaloids, organic acids and so on, possesses various activities such as beneficial wisdom, anti-aging, anti-inflammatory. The current research ofF.caulifloramainly focuses on the study of chemical constituents and pharmacological activities, there is little report about the optimization of extraction process of flavonoids. In order to determine the best extraction technology of total flavonoids fromF.caulifloraand evaluate their antioxidant activity, the extraction temperature, solid-liquid ratio, ethanol concentration and extraction time as single factor were tested and then the extraction process of the total flavonoids fromF.cauliflorawas optimized by response surface designs based on single factor experiments. In addition, the antioxidant activity of flavonoids fromF.cauliflorawas measured by using 1,1-diphenyl-2-picryhydrazyl radical (DPPH·) and hydroxyl radical (·OH) scavenging. The results showed that total flavonoids of optimum extraction conditions ofF.cauliflorawere as follows: extraction temperature 78 ℃, solid-to-liquid ratio of 1∶30(g·mL-1), the alcohol concentration for 71 %, extraction time 187 min. Under these conditions, an extraction rate of 10.53 mg·g-1for total flavonoids fromF.cauliflorawas obtained, compared with the predictive value of 10.61 mg·g-1, the relative error was 0.76% . The IC50values of scavenging DPPH and OH radical were 14.09 and 78.43 μg·mL-1, weaker than that of Vc(8.11 and 67.95 μg·mL-1). The extraction process was stable and reasonable, accurate and reliable, and it can be used to extract the total flavonoids fromF.cauliflora. The results will provide basis for the further development and utilization of flavonoids ofF.cauliflora.
Fordiacauliflora, flavone, response surface methodology, antioxidant activity
10.11931/guihaia.gxzw201502004
2015-02-03
2015-05-27
贵州省应用化学特色重点学科 (黔教科研发[2012]442号); 贵州省教育厅特色重点实验室项目 (黔科合KY[2012]005号)[Supported by the characteristic key discipline of applied chemistry in Guizhou Province (2012-442); the Characteristic Key Laboratory Project of Education Department in Guizhou Province (2012-005)]。
梁志远(1959-),女,福建南安人,教授,从事药用植物成分研究,(E-mail) gzwh24000@sina.com。
杨小生,博士,研究员,博士生导师,研究方向为天然药物有机化学,(E-mail) yang_xiaosheng@yahoo.com。
Q946; R284.2
A
1000-3142(2016)09-1119-07
梁志远, 甘秀海, 杨小生. 响应面法优化干花豆总黄酮提取工艺研究 [J]. 广西植物, 2016, 36(9):1119-1125
LIANG ZY, GAN XH, YANG XS, et al. Optimization of extracting total flavonoids fromFordiacaulifloraby response surface methodology [J]. Guihaia, 2016, 36(9):1119-1125
