载银壳聚糖接枝香草醛胶乳的制备及抗菌性
2016-10-28郭桂真罗青枝李雪艳王德松
安 静,郭桂真,罗青枝,李雪艳,殷 蓉,王德松
(河北科技大学理学院,河北石家庄 050018)
载银壳聚糖接枝香草醛胶乳的制备及抗菌性
安静,郭桂真,罗青枝,李雪艳,殷蓉,王德松
(河北科技大学理学院,河北石家庄050018)
为了增强壳聚糖的抗菌活性和拓展其应用领域,在其基体中引入了纳米银粒子,并对其进行了接枝改性。采用微波辐射法将香草醛与壳聚糖接枝,然后用香草醛还原硝酸银,得到均匀分散于壳聚糖香草醛接枝物(CS-g-VA)胶乳中的纳米银粒子,即Ag/CS-g-VA复合胶乳。探讨了制备Ag/CS-g-VA复合胶乳的影响因素,并采用SEM,TEM,FTIR,XRD,UV-vis和TG-DSC等对其进行了结构和热性能表征。结果表明合成Ag/CS-g-VA的较理想条件:香草醛的质量分数为6.0%,CS-g-VA的质量分数为4.0%,硝酸银的浓度为0.20 mol/L。通过抗菌测试研究了Ag/CS-g-VA对大肠杆菌和枯草杆菌的抑制作用,结果显示Ag/CS-g-VA复合胶乳具有比单一壳聚糖抗菌剂更高效的抗菌性能。
天然高分子化学;壳聚糖接枝香草醛;纳米银;复合胶乳;微波辐射;抗菌性能
壳聚糖(Chitosan)是唯一含有氨基的弱碱性天然多糖。壳聚糖不仅具有生物相容性、降解性、半刚性高分子骨架和优良的成膜能力[1-2],而且是无毒且活性较高的抑菌剂[3-5],因此在医药、食品、水资源处理、纺织等领域得到了广泛的应用[6-8]。壳聚糖分子中大量的—OH和—NH2可进行酰化、羟基化、烷基化、酯化等化学反应,得到多种壳聚糖衍生物,使其具有更多的特殊功能[9]。由于壳聚糖仅能溶解在部分酸中[10]且耐热性能不足,其应用范围受到限制。通过对壳聚糖进行化学改性,在增加其溶解性的同时还可增强其他性能,扩大其应用领域[11]。用香草醛[12]对壳聚糖进行接枝后,可以将直链结构的壳聚糖改性成具有支链结构的香草醛接枝壳聚糖(CS-g-VA)。接枝物除了具有天然壳聚糖良好的生物相容性、降解性和广谱抗菌性外,还可增强原始壳聚糖的热性能和力学性能。罗洁等[13]以壳聚糖和香草醛为原料,乙醇为溶剂,采用超声波辐射技术制备了CS-g-VA。
纳米银具有高效的抗氧化能力、催化能力、持久的杀菌能力[14-18],但是由于纳米粒子表面能高,如将其分散于聚合物中,可显著提高聚合物的稳定性[19-20]。采用有机和无机抑菌剂复配,可弥补壳聚糖耐热性能不足和易洗脱的缺陷,也有利于包埋无机抑菌剂的毒性,在复合体系中,有机和无机抑菌剂的固有抑菌活性也会显著提高[21]。
本课题采用微波辐射法制备CS-g-VA接枝聚合物,并以香草醛为还原剂,将硝酸银溶液中的Ag+还原为Ag0,制备载银壳聚糖接枝香草醛复合胶乳(Ag/CS-g-VA);然后,对其进行结构表征及性能测试。所得Ag/CS-g-VA复合胶乳不但能保留银和壳聚糖的优良性能,而且能通过纳米银与壳聚糖的协同作用更有效地抑制革兰氏菌的繁殖。
1 实验部分
1.1主要原料
壳聚糖(CS):脱乙酰度≥90.0%,中国医药(集团)上海化学试剂公司提供;香草醛(VA):分析纯,天津市光复精细化工研究所提供;硝酸银,分析纯,中国医药(集团)上海化学试剂公司提供。大肠杆菌(Escherichiacoli)(ATCC 44752)、枯草杆菌(Bacillussubtilis) (ATCC 63501)均由中国菌种保存中心(北京)提供。
1.2测试方法
通过S4800-I型场发射扫描电子显微镜(SEM,荷兰FEI公司提供)观察Ag/CS-g-VA 的形貌;紫外-可见漫反射光谱(UV-Vis DRS)用紫外可见分光光度仪(UV-2550 型,日本岛津公司提供)测定;傅里叶变换红外光谱(FTIR)用Raman 光谱仪(IR Prestige-21型,日本岛津公司提供)测定;用G2F20型场发射透射电子显微镜(TEM,荷兰Tecnai公司提供)测定银粒子分散情况;采用X 射线衍射分析(XRD,D/max-2500 型,日本Rigaku公司提供)对材料的晶粒尺寸进行测定;采用TG-204型热失重仪、MDSC-204型差热分析仪(TG-TDA,日本Rigaku公司提供)了解Ag/CS-g-VA的稳定性。

图1 微波辐射制备CS-g-VA接枝物的合成路线Fig.1 Synthetic route of the preparation of chitosan grafted vanillin by microwave radiation
1.3Ag/CS-g-VA复合胶乳的制备
称取3.0 g的壳聚糖置于250 mL 四口瓶中,随后倒入60 mL异丙醇浸泡1 h。将4.4 g 香草醛溶解于120 mL异丙醇和乙醇(V(异丙醇) ∶V(乙醇)=1∶1)的混合溶剂中,再将其置于壳聚糖的浸泡液中,搅拌,至壳聚糖和香草醛分散均匀,并在四口瓶外套一个水浴保护装置,置于微波炉(XH100B,北京祥鹄科技发展有限公司提供)中,在300 W,70 ℃下反应12 min。待冷却后,抽滤,将滤渣用1 mol/L的NaOH 溶液浸泡5~8 h,然后过滤,先后用去离子水和丙酮洗涤,干燥,得黄色粉末状产物。微波辐射制备CS-g-VA接枝物的合成路线如图1所示。
将一定量的CS-g-VA溶于质量分数为2%的乙酸溶液中,配成质量分数为3%的溶液,搅拌使之完全溶解;取20 mL的上述溶液,加入浓度为0.05~0.30 mol/L的 AgNO3水溶液2 mL,持续搅拌反应2 h,接枝产物中的羟基可还原硝酸银。
1.4Ag/CS-g-VA复合胶乳的抗菌性能研究
将直径1 cm的滤纸片灭菌后,在固体培养基表面滴加0.2 mL培养好的菌悬液并涂布均匀,用镊子夹取滤纸片贴在各含菌平皿的标号处;将CS和CS-g-VA分别分散于二次蒸馏水中得到悬浮液,然后分别在滤纸片上滴加0.01 mL乙酸溶液(空白对照)、CS乙酸溶液、CS-g-VA乙酸溶液和Ag/CS-g-VA胶乳溶液(质量浓度均为10 g/L);将放置好样品的平皿分别放在模拟太阳光和紫外灯下进行培养4 h,用显微镜观察细菌形态,并拍摄照片。
2 结果与讨论
2.1Ag/CS-g-VA 复合胶乳中纳米银粒径及其分布的影响因素
影响Ag/CS-g-VA复合胶乳制备的主要因素有CS浓度、AgNO3浓度、VA浓度等。采用紫外可见分光光度法(UV-vis)测定Ag/CS-g-VA复合胶乳中纳米银的粒径大小及粒度分布情况。按照1.3中Ag/CS-g-VA复合胶乳的制备方法,在一定范围内改变胶乳中主要组分CS-g-VA的质量分数(下同)为1.0%~6.0%;AgNO3的浓度为0.05~0.30 mol/L;VA质量分数(下同)为1.0%~7.0%。

图2 不同CS-g-VA浓度时Ag/CS-g-VA复合胶乳的UV-vis 吸收光谱Fig.2 UV-vis absorption spectra of Ag/CS-g-VA colloidal sol
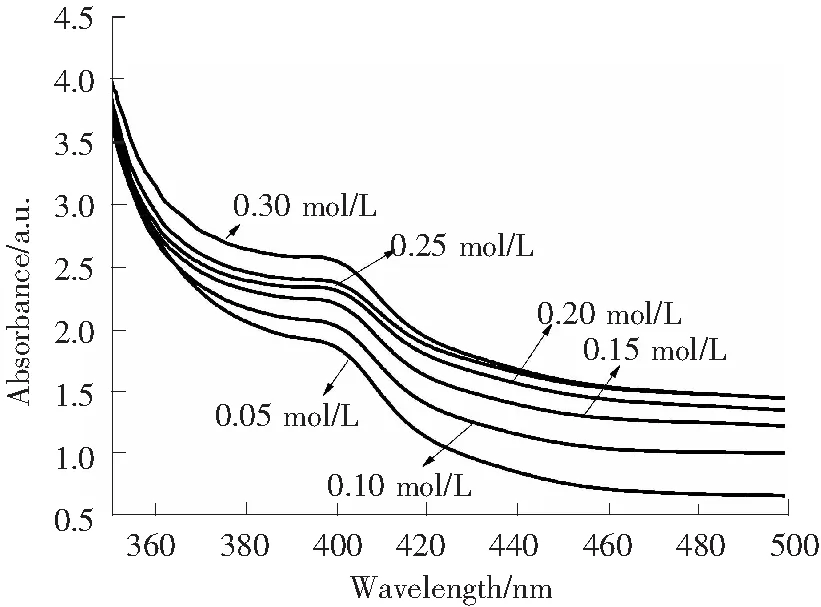
图3 不同AgNO3浓度时Ag/CS-g-VA复合胶乳的UV-vis 吸收光谱Fig.3 UV-vis absorption spectra of Ag/CS-g-VA colloidal sol
2.1.1接枝壳聚糖浓度的影响
固定AgNO3和VA的浓度分别为0.20 mol/L和6.0%,改变CS-g-VA的浓度制备Ag/CS-g-VA复合胶乳,测定相应的UV-vis 吸收光谱,如图2 所示。由图2可看出,380~420 nm 之间的响应峰是Ag/CS-g-VA胶乳中纳米级Ag粒子的等离子共振吸收峰[22]。随着体系中CS-g-VA浓度的升高,纳米Ag粒子的吸收峰逐渐增强,说明CS-g-VA浓度越高,生成的纳米级Ag粒子越多。这是因为CS-g-VA通过与Ag+螯合对Ag粒子起到保护作用,CS-g-VA的大分子网状结构显著改善了纳米银的团聚现象,低浓度的CS-g-VA无法形成完整的网状结构,因此Ag粒子会产生团聚而形成大尺寸的粒子。另外,纳米粒子尺寸越均匀则等离子共振吸收峰的峰形越窄。在CS-g-VA质量分数为5.0%和6.0%时纳米银共振峰最强,但峰形较宽,说明Ag粒子虽然数目较多,但尺寸不均匀。因此,反应选择较佳的CS-g-VA质量分数为4.0%。
2.1.2AgNO3浓度的影响
固定CS-g-VA和VA的质量分数分别为4.0%和6.0%,考察AgNO3浓度对Ag/CS-g-VA胶乳中纳米银粒径及粒度分布的影响规律,结果如图3所示。从图3可以看出,随着AgNO3溶液浓度的增加,复合胶乳中纳米银的共振吸收峰强度先增强后减弱,且在AgNO3的浓度为0.20 mol/L时,吸收峰强度最高,峰位置最小,表明此时胶乳中的纳米粒子含量最高,且平均粒径最小。在反应体系中一般纳米粒子的数目随着Ag+浓度的升高而增多,当Ag+的浓度过高时,体系中Ag晶体的生长速率就会明显高于其成核速率,则纳米粒子不断增大并缩短了粒子之间的距离,增加了它们之间的碰撞几率,从而导致生成较大的微米级粒子。因此,反应选择较佳的AgNO3溶液浓度为0.20 mol/L。

图4 不同香草醛浓度时Ag/CS-g-VA复合胶乳的UV-vis 吸收光谱Fig.4 UV-vis absorption spectra of Ag/CS-g-VA colloidal sol
2.1.3香草醛浓度的影响
固定CS-g-VA和AgNO3浓度分别为4.0%和0.20 mol/L,改变还原剂VA的浓度,制备Ag/CS-g-VA复合胶乳,其UV-vis吸收光谱如图4所示。 图4中Ag粒子的最大吸收峰位于380~420 nm之间,由于CS-g-VA中氨基与Ag的配位作用使纳米银吸收波长蓝移(为380~400 nm)。当香草醛质量分数为1.0%~5.0%时,吸收峰峰形较宽,表明Ag粒子的粒径不均匀。而当香草醛质量分数为6.0%时, 复合胶乳中纳米Ag的共振吸收较强,峰形较窄,表面纳米粒子数目较多且粒度分布均匀。当香草醛质量分数为7.0%时,吸收峰虽强,但是峰形变得很宽,纳米粒子粒径不均匀,易发生团聚。因此反应中香草醛的较佳质量分数为6.0%。
综上所述,制备Ag/CS-g-VA复合胶乳的较佳条件:CS-g-VA质量分数为4.0%,AgNO3溶液浓度为0.20 mol/L、香草醛质量分数为6.0%。
2.2扫描电镜(SEM)分析
图5分别是CS,CS-g-VA与Ag/CS-g-VA的SEM 照片,比较图5 a)、图5 b)和图5 c)可以发现, 加入Ag后,没有明显的银团聚现象。

图5 CS,CS-g-VA与Ag/CS-g-VA 的扫描电镜照片Fig.5 SEM images of CS,CS-g-VA与Ag/CS-g-VA colloidal sol
2.3透射电镜(TEM)分析
图6是Ag/CS-g-VA分别在低倍及高倍电镜下的TEM 照片,图6 a)显示纳米银在Ag/CS-g-VA 溶胶表面分散得比较均匀,无明显团聚现象,由图6 b)可知,银粒子的粒径为10~20 nm。

图6 Ag/CS-g-VA 的透射电镜照片Fig.6 TEM images of Ag/CS-g-VA colloidal sol
2.4X射线衍射(XRD)分析
图7为CS与Ag/CS-g-VA的XRD图。图中32.2°,46.1°,67.5°和79.0°处的衍射峰分别对应Ag/CS-g-VA复合胶乳中银晶的(111)、(200)、(220)和(311)晶面,这表明Ag/CS-g-VA复合胶乳中的纳米银晶型为面心立方[23]。根据最强衍射峰的半高宽运用Scherrer公式[24]计算出纳米Ag/CS-g-VA 复合胶乳中Ag粒子的平均粒径约为16.3 nm。
2.5红外光谱(FTIR)分析
图8为CS,CS-g-VA,Ag /CS-g-VA复合胶乳的红外光谱图。CS分子链中含有氨基、羟基和未脱酰的乙酰氨基。由图8可知,3 000~3 500 cm-1处的特征吸收峰是由O—H和N—H 的伸缩振动峰重叠而成,2 850~2 900 cm-1处的吸收峰是C—H的伸缩振动峰,1 068 cm-1为C—O振动吸收峰,1 410 cm-1为CS中C—N键的伸缩振动峰。1 513 cm-1处为香草醛分子中苯环特征峰,1 667 cm-1处为C=N希夫碱特征吸收峰;1 426 cm-1处则为O—CH3的吸收峰;665~895 cm-1处则为苯环中C—H吸收带,通过这些吸收峰可判断CS与VA发生了接枝反应生成了CS-g-VA接枝聚合物[25]。由于Ag/CS-g-VA复合胶乳中纳米银含量较少,银的存在对CS-g-VA接枝物的红外光谱影响不大。

图7 Ag/CS-g-VA与CS的X射线衍射谱对比图Fig.7 XRD patterns of Ag/CS-g-VA colloidal sol and CS

图8 CS,CS-g-VA和Ag/CS-g-VA的红外光谱图Fig.8 FTIR spectra of CS,CS-g-VA and Ag/CS-g-VA colloidal sol
2.6热失重(TG)和差热(DTA)分析
CS,CS-g-VA和Ag/CS-g-VA的TG和DTA曲线如图9所示,根据热失重梯度较大的TG曲线部分在相应的DTA曲线上对应出3种样品的玻璃化转变温度和分解温度。CS,CS-g-VA和Ag/CS-g-VA的玻璃态转变温度分别为272.7,311.5和318.7 ℃,它们的分解温度分别为548.9,560.8和574.6 ℃。壳聚糖与香草醛接枝后,形成致密的交联网状结构,聚合物的玻璃化转变温度和分解温度都明显提高[26],接枝物与纳米银复合后,由于分子内氧或氮与银的配位作用,使得聚合物的热性能更为稳定。

图9 CS,CS-g-VA和Ag/CS-g-VA的TG和DTA曲线Fig.9 TG and DTA spectra of CS,CS-g-VA and Ag/CS-g-VA
2.7Ag/CS-g-VA抗菌活性分析
从图10—图13中可以看出CS无论在可见光下还是紫外光下对大肠杆菌和枯草杆菌均无明显的抑制作用,CS-g-VA使2种菌发生弯曲变形和缩短,而Ag/CS-g-VA可大规模抑制2种菌的繁殖[27]。因此,在接枝物中载入纳米银后得到Ag/CS-g-VA复合物,其抑菌活性明显提高。比较可见光和紫外光下的抑菌效果发现,CS,CS-g-VA和Ag/CS-g-VA在紫外光下具有更强的抑菌性能。另外,对比图12和图13可知,紫外光下Ag/CS-g-VA复合物对枯草杆菌的抗菌效果显著优于大肠杆菌。

图10 可见光下CS,CS-g-VA和Ag/CS-g-VA对大肠杆菌的抑菌照片Fig.10 Bacteriostatic photos of CS,CS-g-VA and Ag/CS-g-VA in Escherichia coli under visible light

图11 可见光下CS,CS-g-VA和Ag/CS-g-VA对枯草杆菌的抑菌照片Fig.11 Bacteriostatic photos of CS and CS-g-VA and Ag/CS-g-VA in Bacillus subtilis under visible light

图12 紫外光下CS,CS-g-VA和Ag/CS-g-VA对大肠杆菌的抑菌照片Fig.12 Bacteriostatic photos of CS and CS-g-VA and Ag/CS-g-VA in Escherichia coli under ultraviolet light

图13 紫外光下CS,CS-g-VA和Ag/CS-g-VA对枯草杆菌的抑菌照片Fig.13 Bacteriostatic photos of CS and CS-g-VA and Ag/CS-g-VA in Bacillus subtilis under ultraviolet light
3 结 论
采用微波辐射法可使香草醛与壳聚糖迅速发生接枝反应而得到接枝聚合物CS-g-VA,再通过溶胶凝胶法使CS-g-VA与AgNO3复合得到Ag/CS-g-VA复合胶乳。制备Ag/CS-g-VA的较理想条件:CS-g-VA质量分数为4.0%,AgNO3溶液浓度为0.20 mol/L,香草醛质量分数为6.0%。TEM图显示纳米银在Ag/CS-g-VA溶胶表面分散得比较均匀,无明显团聚现象,Ag粒子的粒径为10~20 nm;XRD结果表明,壳聚糖是无定形晶型,被包埋的纳米银晶型为面心立方;红外光谱图显示了壳聚糖的氨基与香草醛发生反应;TG-DTA分析表明接枝物与纳米银复合后,使得聚合物的热性能更为稳定。抗菌实验表明,Ag/CS-g-VA在紫外光下对大肠杆菌和枯草杆菌的抗菌效果要优于可见光下的抗菌效果。
/
[1]PENG Yanfei, HAN Baoqin, LIU Wanshun, et al. Preparation and antimicrobial activity of hydroxypropyl chitosan[J]. Carbohydrate Research, 2005, 340: 1846-1851.
[2]VIMALA K,MURALI Y. Fabrication of porous chitosan films impregnated with silver nanoparticles:A facile approach for superior antibacterial application[J].Colloids and Surfaces B:Biointerfaces,2010,76(1): 248-258.
[3]FERNANDES M, FRANCESKO A, JUAN T. Effect of thiol-functionalisation on chitosan antibacterial activity:Interaction with a bacterial membrane model[J]. Reactive & Functional Polymers,2013,73:1384-1390.
[4]STROESCU M, STOICA A, ISOPENCU G,et al. Chitosan-vanillin composites with antimicrobial properties[J]. Food Hydrocolloids,2015,48: 62-71.
[5]AHMED M, HUSSEIN A, SAMAH M,et al. Mechanical and antibacterial properties of novel high performancechitosan/nanocomposite films[J]. International Journal of Biological Macromolecules,2015,76: 25-32.
[6]RABEA E, BADAWY M, STEURBAUT W, et al. In vitro assessment ofN-(benzyl) chitosan derivatives against some plant pathogenic bacteria and fungi[J]. European Polymer Journal, 2009, 45(1): 41-46.
[7]YOUNG I C, HONG K N,SAMUEL P M. Physicoehemical characteristics and functional properties of various commercial chitinand chitosan products[J]. Journal of Agricultural and Food Chemistry,1998,46(9):3839-3843.
[8]SINGH D K,RAY A R. Biomedical applications of chitin, chitosan, and their derivatives[J].Journal of Macromolecular Science(Part C):Polymer Reviews, 2000, 40(1): 69-83.
[9]LI Zhihan,YANG Fei, YANG Rendang. Synthesis and characterization of chitosan derivatives withdual-antibacterial functional groups[J]. International Journal of Biological Macromolecules, 2015, 75:378-387.
[10]RINAUDO M, PAVLOV G. Influence of acetic acid concentration on the solubilization of chitosan[J]. Polymer, 1999, 40: 7029-7032.
[11]ANAND D, AJAY K, SHIVANI B, et al. Stabilisation of silver and copper nanoparticles in a chemically modified chitosan matrix[J]. Carbohydrate Polymers, 2013, 92: 1402-1407.
[12]FACHE M, BOUTEVIN B, CAILLOL S. Vanillin, a key-intermediate of biobased polymers[J]. European Polymer Journal, 2015, 68: 488-502.
[13]罗洁, 陈建山, 王贵武,等. 香草醛接枝壳聚糖的制备及其吸附性能[J]. 应用化工, 2006, 35(12): 927-930.
LUO Jie, CHEN Jianshan, WANG Guiwu, et al. Preparation of chitosan grafted by vanillin and its adsorption property[J]. Applied Chemical Industry, 2006, 35(12): 927-930.
[14]JIANG Baojiang, TIAN Chungui, SONG Gang, et al. A green route to synthesize novel Ag/C antibacterial agent[J]. Materials Research Bulletin, 2012, 47: 458-463.
[15]LI Xiaoyun, GAO Guanhui, SUN Chengjun. Preparation and antibacterial performance testing of Ag nanoparticlesembedded biological materials[J]. Applied Surface Science, 2015, 330:237-244.
[16]RAI M, YADAV A, GADE A. Silver nanoparticles as a new generation of antimicrobials[J]. Biotechnology Advances, 2009, 27:76-83.
[17]安静, 罗青枝, 李雪艳, 等. 银/聚吡咯/二氧化钛复合纳米粒的制备与结构表征[J]. 河北科技大学学报, 2012, 33(3):210-214.
AN Jing, LUO Qingzhi, LI Xueyan,et al. Preparation and structure characterization of silver polypyrrole nanocomposites[J]. Journal of Hebei University of Science and Technology, 2012, 33(3):210-214.
[18]张立锁, 安静, 罗青枝,等. P(AA-co-HEA)/Ag复合溶胶的制备及抗菌活性研究[J]. 河北科技大学学报, 2012, 33(2):107-112.
ZHANG Lisuo, AN Jing, LUO Qingzhi, et al. Preparation of P(AA-co-HEA)/Ag nanocomposite sol and its antibacterial activity[J]. Journal of Hebei University of Science and Technology, 2012, 33(2):107-112.
[19]VIGNESHWARAN N, NACHANE R. A novel one-pot ‘green’ synthesis of stable silver nanoparticles using soluble starch[J]. Carbohydrate Research, 2006, 341: 2012-2018.
[20]YI Ying, WANG Yuting, LIU Hui. Preparation of new crosslinked chitosan with crown ether and their adsorption for silver ion for antibacterial activities[J]. Carbohydrate Polymers, 2003, 53: 425-430.
[21]RICARDO J B, PINTO A, SUSANA C M, et al. Antibacterial activity of optically transparent nanocomposite films based on chitosan or its derivatives and silver nanoparticles[J]. Carbohydrate Research, 2012, 348: 77-83.
[22]ROY K, SARKAR C K,GHOSH K. Photocatalytic activity of biogenic silver nanoparticles synthesized using potato (Solanum tuberosum) infusion[J]. Spectrochimica Acta(Part A): Molecular and Biomolecular Spectroscopy,2015, 146(5): 286-291.
[23]PETER L, SIVAGNANAM S, ABRAHAM J. Synthesis of silver nanoparticles using plants extract and analysis of their antimicrobial property[J]. Journal of Saudi Chemical Society,2015, 19(3): 311-317.
[24]SCHERRER P. Estimation of Size and Internal Structure of Colloidal Particles by Means of Rontgen[D].Gottingen:Georg-August-University of Gottingen, 1918.
[25]MARTA S, ANICUTA S, GABRIELA I,et al. Chitosan-vanillin composites with antimicrobial properties[J]. Food Hydrocolloids, 2015, 48: 62-71.
[26]WALKE S, GOPAL S, MILIND N, et al. Fabrication of chitosan microspheres using vanillin/TPP dual crosslinkers for protein antigens encapsulation[J]. Carbohydrate Polymers, 2015, 128: 188-198.
[27]CHANDNI K, ANJANA K, NIDHI A,et al. Antibacterial activity of silver: The role of hydrodynamic particle size at nanoscale[J]. Journal of Bilmedical Materials Research(Part A), 2014, 102(10): 3361-3368.
Preparation and the antibacterial activity of silver-loaded Chitosan-grafted-vanillin sol
AN Jing, GUO Guizhen, LUO Qingzhi, LI Xueyan, YIN Rong, WANG Desong
(School of Science, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
In order to enhance the antibacterial activity of chitosan and expand its application field, silver nanoparticles are introduced into the matrix, and the grafting modification is carried out. Chitosan grafted vanillin (CS-g-VA) is prepared with microwave-radiation method, and silver nitrate is reduced by vanillin, so that silver nanoparticles are separated evenly in CS-g-VA sol, which is Ag/CS-g-VA composite sol. The effects on the preparation of Ag/CS-g-VA composite sol are studied, and the structure and thermal property of the obtained composite sol are characterized by SEM, TEM, FTIR, XRD, UV-vis and TG-DSC. The experiment results show that the optimum conditions for the preparation of Ag/CS-g-VA are as following: Vanillin concentration of 6.0%, CS-g-VA concentration of 4.0%, and silver nitrate concentration of 0.20 mol/L. The inhibition of Ag/CS-g-VA composite sol againstEscherichiacoliandBacillussubtilisis investigated through antibacterial tests. The results show that the antibacterial activity of Ag/CS-g-VA composite sol is more efficient than that of single CS materials.
natural polymer chemistry; CS-g-VA; silver nanoparticles; composite sol; microwave-radiation; antibacterial activity
1008-1542(2016)04-0357-07
10.7535/hbkd.2016yx04007
2015-06-08;
2016-01-15;责任编辑:王海云
国家自然科学基金(51203042);河北省自然科学基金(E2016208030)
安静(1973—),女,河北巨鹿人,副教授,博士,主要从事纳米复合材料和抗菌材料方面的研究。
王德松教授。E-mail:dswang06@126.com
O636
A
安静,郭桂真,罗青枝,等.载银壳聚糖接枝香草醛胶乳的制备及抗菌性[J].河北科技大学学报,2016,37(4):357-363.
AN Jing, GUO Guizhen, LUO Qingzhi,et al.Preparation and the antibacterial activity of silver-loaded Chitosan-grafted-vanillin sol[J].Journal of Hebei University of Science and Technology,2016,37(4):357-363.
