云南省药品生产企业GMP认证检查缺陷项目统计分析
2016-10-28周玲谭文红
周玲,谭文红
(1.云南省食品药品监督管理局药品审评中心,云南昆明650106;2.云南中医学院,云南昆明650504)
云南省药品生产企业GMP认证检查缺陷项目统计分析
周玲1,谭文红2
(1.云南省食品药品监督管理局药品审评中心,云南昆明650106;2.云南中医学院,云南昆明650504)
目的分析云南省药品生产企业新版《药品生产质量管理规范》(GMP)认证现场检查缺陷项目情况,提出加快推进云南省药品生产企业实施新版GMP的对策和建议。方法对云南省2011年至2015年认证、飞行检查的176家药品生产企业缺陷项目进行汇总,分析缺陷情况,并总结、分类、归纳主要问题。结果与结论应加大培训力度,建立专职检查员队伍,软硬件并重,确保新版GMP得到正确贯彻实施。
药品生产质量管理规范;认证检查;缺陷项目;药品质量管理
2011年3月1日起实施的新版《药品生产质量管理规范》[1](GMP)吸收国际先进经验,结合我国国情,按软硬件并重的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织(WHO)药品GMP的一致性;对从药品生产的全过程到影响产品质量的诸多环节和因素均进行了技术性规范,是一个药品生产全过程、全环节的质量管理系统,是全面质量管理理念在药品生产领域的具体体现,也是制药企业取得准入资格的强制和必备条件[2]。笔者分析了云南省新版GMP认证检查工作中发现的缺陷项目,找出了企业在实施新版GMP过程中存在的主要问题,为今后的新版GMP认证检查提供了参考依据,并提出了相应的对策与建议。
1 检查工作基本情况
1.1检查企业数及生产剂型
云南省于2011年正式启动新版GMP认证检查工作,截至2015年12月,对省内176家生产企业组织实施了药品GMP认证及飞行检查261次,涉及无菌制剂(包括注射剂、冻干粉针剂等),非无菌制剂(包括片剂、胶囊剂、丸剂、滴丸剂、栓剂、颗粒剂、干混悬剂、散剂、气雾剂、凝胶剂、煎膏剂、软膏剂、乳膏剂、橡胶膏剂、滴眼剂、茶剂、搽剂、洗剂、口服溶液剂、合剂、酊剂、酒剂、糖浆剂等),原料药,中药饮片,医用氧等。生产剂型情况详见表1。

表1 被检查企业的生产剂型情况(n=301)
1.2检查结果
经认证中心对检查组现场检查报告及企业整改情况进行综合评定,176家药品生产企业中,170家符合新版GMP要求,6家不符合规定,合格率为96.59%。
1.3现场检查发现的缺陷项目
1.3.1缺陷项目数量
经对本省176家药品生产企业进行现场检查,共发现缺陷2 312项,其中严重缺陷0项,主要缺陷30项,一般缺陷2 282项,平均每次出现缺陷8.8项。单次检查发现一般缺陷最多者33项,最少者4项。
1.3.2缺陷项目频次分布
除总则外,GMP 12个章节中均发现缺陷项目。缺陷相对集中在设备、质量控制与质量保证、文件管理,其余依次为厂房与设施、物料与产品、生产管理、确认与验证、机构与人员及质量管理、自检、产品发运与召回、委托生产与委托检验。缺陷频次分布详见图1。
1.3.3各年度缺陷项目分布情况
各年度各章节缺陷率分布情况见图2。纵观2011至2015年的检查情况,质量管理、机构与人员、厂房与设施、物料与产品、确认与验证方面的缺陷率呈逐年递减趋势,表明企业的执行水平在逐年提高;而设备、生产管理、质量控制与质量保证等缺陷项目出现次数变化不大,表明企业在这些方面还有待继续改进。
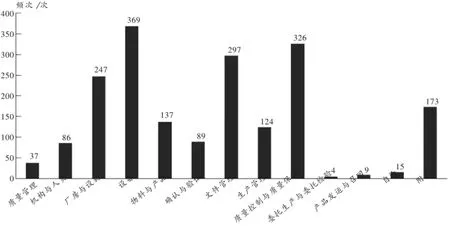
图1 2011年至2015年新版GMP认证各缺陷项目频次分布
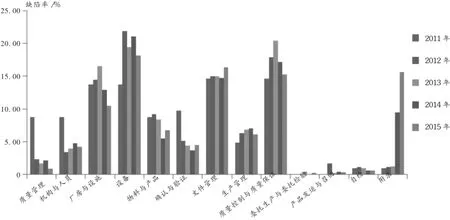
图2 2011年至2015年各年度各缺陷项目缺陷率分布
2 存在的主要问题及分析
2.1设备
由缺陷项目的分布可见,设备方面出现的缺陷频次(369次)最高,现场检查发现的缺陷项目主要表现在设备状态标识不规范,管道未标明内容物的名称和流向,空气净化系统运行记录不全,纯化水系统清洗、消毒、运行记录不全,部分主要设备无预防性维护计划,设备清洁不彻底,工器具存放间的容器具无清洁状态标识等。
与其他6省或自治区缺陷分布统计情况相比[3-12],我省的缺陷分布情况以设备方面较突出。新版GMP不仅要求生产企业根据产品特点配置相应的设施设备,还关注设施设备的日常维护和保养,并定期对设施设备进行确认或验证,从而确保设施设备始终处于验证状态,能生产出达到预期质量的产品[13]。由现场检查情况可见,人为因素造成的缺陷占大多数,说明员工的责任心和规范操作意识不强,仍须加强培训和管理。同时,企业对新版GMP设施设备的要求理解还不够深入,未认识到设备的管理才是GMP设备的核心。随着GMP质量管理的不断完善,设备方面的缺陷较新版GMP认证开始时有所改善,但仍要引起重视。
2.2厂房与设施
厂房与设施出现缺陷频率较高,现场检查发现,缺陷项目主要表现在制剂车间暂存间较小,原辅料暂存间与物流通道共用,车间操作平台影响气流组织,称量间、粉碎间等产尘房间无捕尘设施或捕尘效果不佳,仓贮区缺少防止昆虫、动物进入的设施等。
在厂房设计方面,由于前期较多企业采用原有厂房进行改造,改造原有厂房存在一定局限性,造成厂房设施方面缺陷项目数量较多。后期搬迁至新建厂房,厂房设计缺陷问题较少。表明我省厂房设计对新版GMP的认识在逐步提高。
2.3质量控制与质量保证
质量控制与质量保证在缺陷分布情况中出现频次(326次)仅次于设备,检查发现缺陷项目主要表现在原始检验记录中未体现对照品的来源及批号,原始数据不全和无计算过程,菌种未在规定时间内传代,pH计使用时采用的校正缓冲液范围不符合要求,未对对照品溶液的稳定性进行考察,取样规定内容不全,偏差调查不及时、原因分析不全面,未对主要偏差启动纠正预防措施,产品质量回顾缺少关键质量数据趋势分析等。
上述缺陷表明,质量控制人员的技术水平不高,操作不规范,需加强相关培训。企业对产品整体质量情况的分析和调查不深入或未分析,说明企业对质量控制及质量保证的认识还仅停留在质量控制及质量保证是当前产品合格放行的依据,而未意识到对产品质量的提高,乃至对生产过程控制改进能产生的长远利益。由现场检查情况可见,药品生产企业基本建立了质量控制和质量保证的管理框架,但在细节设置和执行方面仍存在缺陷,质量控制和质量保证系统的完整性和执行性亟待提高[14]。
2.4文件管理
文件管理方面出现的缺陷频次达297次,缺陷项目主要表现在质量标准变更时未及时对相关文件进行修订或未严格按照规定发放、收回、销毁文件,产品工艺规程内容与批生产记录要求不一致,批生产记录填写不规范,文件规定内容不完整及文字不清晰、难懂,且可操作性差,环境清洁、消毒等活动操作规程不全或缺少相关操作记录等。
以上问题是很多企业普遍存在的问题,企业在文件管理中,对文件管理的理解较形式化。应高度重视文件对生产的指导地位,清醒地认识到文件是整个质量管理体系的基础,结合实际对相关文件进行梳理,避免出现文件管理与操作不符的现象,真正做到“写我所做的”“做我所写的”“记我所做的”。需要企业强化文件管理,提高文件的可行性和可操作性。
2.5机构与人员
检查发现,机构与人员方面的缺陷项目主要表现在企业质量管理人员数量相对不足,培训内容针对性差且未对培训结果进行评估,人员资质不够,缺少中药显微鉴别试验能力。
机构与人员缺陷出现的频次不高,仅86次。由2011年至2015年各章节缺陷情况中可见,符合新版GMP相关要求的企业人员配置到位后,机构和人员缺陷项目频次明显降低。但中小企业技术人员的流动性较大,企业缺少技术人员的贮备和梯队建设,从而影响企业质量管理的连贯性。人员培训针对性不强,流于形式,这与企业主要负责人员质量意识淡薄有关。
3 对策与建议
由以上突出的共性缺陷分析可见,企业的质量管理制度与实际操作分离,很多企业未能结合自身品种及剂型的特点、管理模式、人员结构、现有生产条件及如何有效降低质量风险,客观地起草编写操作规程,而是更多地停留在表面,机械应用,导致制订的规程不具有操作的一致性和重复性,风险防控意识不强,未能从质量管理体系和风险管理体系高度上准确把握新版GMP精髓,应从以下几方面进行改进及加强。
充分发挥监督管理机构的作用,积极开展新版GMP培训工作:应充分发挥各级食品药品监督管理局的作用,开展针对企业和质量管理人员的新版GMP培训或技术交流活动,推动企业主动学习新版GMP的科学管理理念和风险意识,提高主人翁意识。
完善我省GMP认证管理体系,加强GMP检查员队伍建设:GMP是动态化发展的,是随着自然科学、管理科学及相关专业学科的发展而发展的。故检查员的业务水平如不与时俱进,必然会落伍。建议定期组织学习研讨班,了解药品生产和质量管理领域的前沿信息和最新动态,并要求检查员每年应有一定时间的深入实践,每年检查一定数量的企业。省食品药品监督管理局应认真履行对每个检查员业务水平的再考核再认定制度,实施动态化管理。
进一步加大对药品生产企业实施新版GMP的帮促指导力度,有效推动我省新版GMP的贯彻实施:应尽快制订医药设计领域的规范或指导原则,促进企业关键人员深入领会新版GMP精神,促进企业关键人员与GMP认证检查员对新版GMP的理解和认识的有机统一,从而使质量风险管理思想在企业管理的全过程中得以体现。
企业需加强对GMP的有效内审,提升执行力度:2011年至2015年,平均每次检查发现缺陷8.8项,而根据2016年1月至4月的最新数据,平均每次检查发现缺陷10.8项。这说明企业执行GMP水平提高的速度并未超过检查员水平提高的速度,企业要达到更高的水平任重而道远,需监管机构和企业的共同努力。
[1]中华人民共和国卫生部.药品生产质量管理规范[Z].中华人民共和国卫生部令第79号.
[2]沈丽莎,胡启飞,陈国庆.药品生产质量管理规范(GMP)在我国的实施与展望[J].重庆中草药研究,2010(1):33-37.
[3]王金伟,陈永飞.2013年度江苏省药品生产企业新版GMP认证检查缺陷项目分析[J].药学与临床研究,2014,22(6):574-577.
[4]韩莹,许丹.2013年山东省新修订药品GMP认证检查情况分析[J].药学研究,2014,33(2):121-124.
[5]胡士高,罗京京,窦颖辉,等.安徽省无菌药品生产企业新版GMP认证检查缺陷分析与对策研究[J].中国制药装备,2014(7):6-9.
[6]胡士高,罗京京,窦颖辉,等.安徽省新修订药品GMP认证检查缺陷项目分析[J].安徽医药,2013,17(9):1 643-1 644.
[7]韦广辉.广西区药品生产企业新版GMP认证检查情况分析[J].中国现代药物应用,2013,7(13):238-239.
[8]陈志歆.黑龙江省药品生产企业GMP认证缺陷项目分析[J].黑龙江医药,2015,28(4):779-782.
[9]李淼.黑龙江省药品生产企业GMP认证缺陷项目统计分析[J].黑龙江医药,2014,27(2):333-334.
[10]贾娜,李妮,赵红菊,等.辽宁省新修订药品GMP认证检查质量保证方面存在的缺陷及改进建议[J].中国药事,2015,29(7):721-724.
[11]张春蕾,刘智勇,田丽娟.辽宁省原料药生产企业新版GMP认证检查缺陷分析与对策[J].中国药房,2014,25(37):3 460-3 463.
[12]韩莹,柏建学.山东省新修订药品GMP认证检查情况分析[J].药学研究,2013,32(7):422-424.
[13]张珂良,李竹,刘知音.新版GMP认证中设施设备的缺陷汇总分析[J].中国制药装备,2013(4):13-14.
[14]李竹,刘知音.新版GMP认证现场检查中质量控制与质量保证所存缺陷的分析[J].中国制药装备,2014(4):11-13.
Stastical Analysis of GMP Certification Defective Items of Pharmaceutical Manufacturers in Yunnan Province
Zhou Ling1,Tan Wenhong2
(1.Yunnan GMP Certification Center for Food and Drug Inspection,Kunming,Yunnan,China650106;2.Yunnan Universiy of TCM,Kunming,Yunnan,China650504)
ObjectiveTo put forward counter measures and suggestions on accelerating pharmaceutical manufacturers to implement current GMP through analyzing the current defective items of GMP on-site certification inspection.Methods176 pharmaceutical manufacturers which were approved by the centre or passed the unannounced inspection from 2011 to 2015 were collected and their main defective items were analyzed,summerized,and classified.Results and ConclusionTo ensure correct and thorough implementation of the new version of GMP,we should increase training efforts,set up full-time inspector team and pay equal attention to both hardware and software.
GMP;certification inspetion;defective items;drug quality management
R954
A
1006-4931(2016)14-0016-04
周玲,大学本科,副主任药师,研究方向为药品生产经营企业质量体系(GMP、GSP)认证与药品质量控制评价,(电子信箱)450551409@qq.com;谭文红,大学本科,副主任药师,研究方向为中药质量标准控制与评价,(电子信箱)twh85087@126.com。
2016-05-18)
