首发精神分裂症患者治疗前后血清BDNF和GDNF水平的变化
2016-10-27肖文焕陈宽玉唐小伟李金张晓斌沙维伟
肖文焕,陈宽玉,唐小伟,李金,张晓斌,沙维伟
(扬州大学医学院附属五台山医院 临床心理科,江苏 扬州 225003)
·临床医学·
首发精神分裂症患者治疗前后血清BDNF和GDNF水平的变化
肖文焕,陈宽玉,唐小伟,李金,张晓斌,沙维伟
(扬州大学医学院附属五台山医院临床心理科,江苏扬州225003)
目的:探讨首发精神分裂症患者治疗前后血清脑源性神经营养因子(brain-derived neurotrophic factors,BDNF)和胶质源性神经营养因子(glial-derived neurotrophic factors,GDNF)水平变化的研究。 方法:采用酶联免疫吸附法,对60例正常人(正常组)和56例首发精神分裂症患者(患者组)在单一的喹硫平药物治疗前后进行血清BDNF、GDNF水平检测,研究药物对精神分裂症患者BDNF、GDNF水平的影响。 结果:服药前,患者组血清BDNF、GDNF水平低于正常组(P<0.05)。服药后,患者组血清BDNF、GDNF水平均升高,与服药前比较有统计学差异(P<0.05),与正常组无统计学差异(P>0.05)。 结论:精神分裂症患者可能存在血清BDNF、GDNF水平低下,抗精神病药物可以提高患者血清BDNF、GDNF水平。
精神分裂症;脑源性神经营养因子;胶质源性神经营养因子
精神分裂症是最常见、最严重的精神疾病之一,对于患者及其家庭乃至社会都是一个沉重的负担。目前精神分裂症的病因和病理生理机制尚不清楚。强有力的证据表明精神分裂症的发病与胚胎发育异常有关。神经营养因子在维护中枢和周边神经系统等方面有重要的作用。精神分裂症的神经营养因子假说认为神经可塑性及细胞再生能力的损伤可能是精神分裂症发病的病理生理基础之一。BDNF和GDNF是神经营养家族中的一员,当其减少或缺乏可能会增加精神分裂症的发病易感性。国外研究认为BDNF和GDNF与精神分裂症存在关联性[1-2],抗精神病药物可以提高神经营养因子的水平[3-4],但也有不一致的研究结果[5]。故本研究主要探讨抗精神病药物治疗对精神分裂症患者血清BDNF、GDNF水平的影响。
1 资料和方法
1.1对象患者组选自2013年10月~2014年10月江苏省扬州五台山医院的首发急性住院精神分裂症患者56例。符合中国精神疾病分类方案与诊断标准第3版(CCMD-3)精神分裂症诊断标准;男29例,女27例,年龄18~49岁,平均(25.9±10.1)岁,起病年龄16~35岁,平均(16.7±7.7)岁。患者精神症状阳性和阴性量表(PANSS)评分≥60分;无脑部疾病、严重躯体疾病、甲状腺疾病及其他精神疾病;无药物或酒精依赖。
正常组来自我院职工及其家属60例,男30名,女30名,年龄19~50岁,平均(26.0±13.3)岁。无精神疾病史及家族史;无严重脑部及躯体疾病;无药物或酒精依赖史。两组的年龄(t=0.95,P=0.29)、性别比例(χ2=0.17,P=0.78)差异无统计学意义。研究获扬州大学医学院附属五台山医院伦理委员会批准,入组者均自愿参与并签署知情同意书。
1.2方法患者组均选用喹硫平单一抗精神病药物治疗,且在2周内达到有效治疗剂量(600 mg/d)。治疗前和4周后采用PANSS进行精神症状评定,PANSS减分率=(治疗前评分-治疗后评分)/(治疗前评分-30)×100%,PANSS减分率≥75%表示临床痊愈;50%≤PANSS减分率<75%表示有效;25%≤PANSS减分率<50%表示部分有效;PANSS减分率<25%表示无效。
BDNF和GDNF浓度的检测:患者组均在治疗前、服药4周后和正常组抽取空腹静脉血5 mL,分离出血清,低温保存。购买Promega公司的血清BDNF和GDNF检测试剂盒,在免疫酶标仪上一次性检测所有标本。
采用SPSS 16.0软件包进行统计分析。数据中的定量资料采用均数±标准差表示,计量资料组间比较采用t检验或方差分析;治疗前后比较采用配对t检验,定性资料采用卡方检验,非变量间相关分析采用Spearman相关分析。
2 结果
2.1患者组与正常组血清BDNF、GDNF水平比较治疗前,患者组血清BDNF、GDNF水平均低于正常组,差异有统计学意义(P<0.05)。治疗后患者组血清BDNF、GDNF水平升高,与治疗前比较差异有统计学意义(P<0.05),与正常组比较无统计学差异(P>0.05),见表1。
2.2药物治疗前后患者组PANSS评分比较患者组治疗后PANSS总分及各因子分均较治疗前降低,差异均有统计学意义(P<0.01),见表2。
2.3PANSS减分率与治疗后BDNF、GDNF水平的相关性分析对PANSS减分率与治疗后血清BDNF、GDNF水平进行相关分析发现,PANSS减分率与BDNF(rs=0.523)、GDNF(rs=0.601)水平均呈正相关,差异均有统计学意义(P<0.05),见表3。
表1患者组治疗前后和正常组血清BDNF、GDNF浓度比较
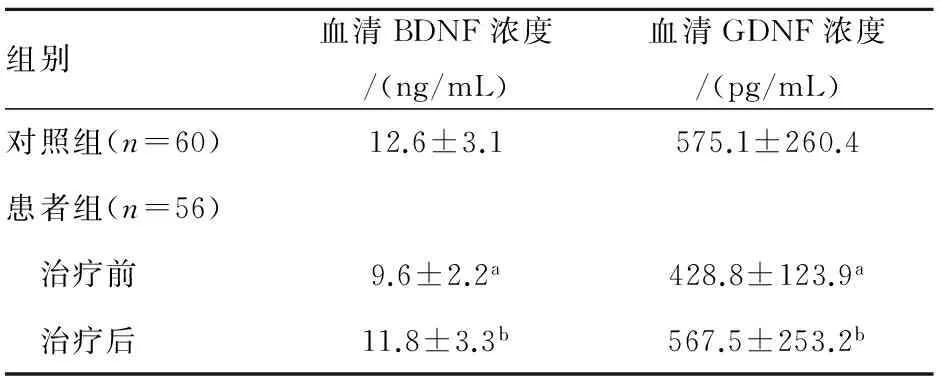
组别血清BDNF浓度/(ng/mL)血清GDNF浓度/(pg/mL)对照组(n=60)12.6±3.1575.1±260.4患者组(n=56) 治疗前9.6±2.2a428.8±123.9a 治疗后11.8±3.3b567.5±253.2b
注:与对照组比较,aP<0.05;与治疗前比较,bP<0.05。
表2患者组治疗前后PANSS评分比较

项目治疗前治疗后d±sd配对t值P值PANSS阳性分27.5±7.318.3±6.19.3±5.612.371P<0.01PANSS阴性分22.3±6.116.0±5.66.3±5.39.028P<0.01一般精神病理分29.4±6.220.2±6.79.2±5.412.654P<0.01总分79.2±9.654.4±13.224.8±11.216.646P<0.01
表3患者临床疗效与血清BDNF、GDNF水平的相关分析

临床疗效例数血清BDNF水平/(ng/mL)血清GDNF水平/(pg/mL)痊愈1212.7±5.1582.7±298.2有效2611.8±3.5565.4±204.3部分有效1010.8±3.3531.8±199.1无效89.9±2.6497.7±195.8
3 讨论
神经营养因子对中枢及周围神经系统神经元的生长和发育具有促进作用,能够防止神经元的凋亡,并且在多巴胺(DA)、5-羟色胺(5-HT)和谷氨酸能突触可塑性中起重要作用。BDNF和TrkB mRNA表达对海马网络结构和功能的完整性及对神经营养再生有重要的作用[6],BDNF和GDNF能增加DA、5-HT的表达,并能促进抑郁样行为小鼠额叶皮层5-HT2A受体基因的表达[7]。BDNF和GDNF在精神分裂症患者的海马、皮质、杏仁核区域表达[8]。动物研究显示,抗精神病治疗对大鼠海马和齿状回有神经发生作用,并能上调精神分裂症患者的BDNF mRNA和TrkB mRNA[9],亦有研究显示在不同的大脑疾病中抗神经精神疾病药物通过星形细胞和小胶质细胞上调GDNF是限制神经元丢失的保护机制[10],这进一步说明BDNF、GDNF可能参与精神分裂症的病理过程。
本研究发现,药物治疗前精神分裂症患者血清BDNF、GDNF水平显著低于正常对照组,经过4周抗精神病药物治疗后,患者PANSS量表评分降低,精神症状改善,患者血清BDNF、GDNF水平显著增高,恢复到正常水平,这和国外的研究相一致[3-4,11-12]。推测抗精神病药物可能是通过提高外周BDNF、GDNF蛋白质表达水平而起作用。但是也有不一致的研究[5],出现这些分歧的原因可能是样本不同,实验方法不同等。本研究还发现PANSS减分率即疗效与治疗后血清BDNF、GDNF水平有显著正相关,这说明患者的血清BDNF、GDNF水平越高,相应的患者治疗效果越好,推测BDNF可能参与了精神分裂症的发生、发展过程,可作为判断患者临床预后的观察指标。
众所周知,外周BDNF水平可以反映大脑中枢的水平,但是GDNF较难通过血-脑屏障,故血清GDNF水平不能反映大脑的状态。很多研究表明内在易受氧化应激可能是精神分裂症的病理生理学的基础[13]。精神分裂症病人存在应激水平增高,抗氧化能力降低,使抗氧化防御系统和氧化应激之间失去平衡。但是BDNF、GDNF能增加锰超氧化物歧化酶其受体表达并且还可释放具有抗氧化作用的还原型谷胱甘肽,抑制患者外周淋巴细胞的凋亡以及氧化应激引起的细胞死亡,保护神经细胞免受自由基的损伤,从而发挥抗精神病的作用[14]。因此,我们推测BDNF、GDNF浓度的增加是一个神经损伤自适应和代偿反应,可以通过其抗氧化性能调节树棘突重组和目标神经元突触发生。
总而言之,这些结果表明BDNF、GDNF水平下降,可能会加重精神分裂症患者氧化应激引起的细胞死亡,而这可能是精神分裂症患者免疫功能不全的机制之一。本研究结果证明抗精神病药物治疗能够恢复精神分裂症患者血清的BDNF、GDNF水平,也可能通过提高血清BDNF、GDNF水平使精神分裂症患者的临床症状得到改善。以后可以扩大样本量研究不同的抗精神病药物对非首发患者血清神经营养因子的影响。
[1]NIITSU T,SHIRAYAMA Y,MATSUZAWA D,etal.Association between serum levels of glial cell-line derived neurotrophic factor and attention deficits in schizophrenia[J].Neurosci Lett,2014,575:37-41.
[2]NIITSU T,SHIRAYAMA Y,MATSUZAWA D,etal.Associations of serum brain-derived neurotrophic factor with cognitive impairments and negative symptoms in schizophrenia[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(8):1836-1840.
[3]LUONI A,BERRY A,CALABRESE F,etal.Delayed BDNF alterations in the prefrontal cortex of rats exposed to prenatal stress:Preventive effect of lurasidone treatment during adolescence[J].European Neuropsychopharmacology,2014,24(6):986-995.
[4]DE AZUA SR,MATUTE C,STERTZ L,etal.Plasma brain-derived neurotrophic factor levels,learning capacity and cognition in patients with first episode psychosis[J].Bmc Psychiatry,2013,13:27.
[5]AJAMI A,HOSSEINI SH,TAGHIPOUR M,etal.Changes in serum levels of Brain Derived Neurotrophic Factor and Nerve Growth Factor-beta in schizophrenic patients before and after treatment[J].Scand J Immunol,2014,80(1):36-42.
[6]PANDYA CD,KUTIYANAWALLA A,PILLAI A.BDNF-TrkB signaling and neuroprotection in schizophrenia[J].Asian J Psychiatr,2013,6(1):22-28.
[7]TSYBKO AS,IL′CHIBAEVA TV,KONDAUROVA EM,etal.Effect of central administration of the neurotrophic factors BDNF and GDNF on the functional activity and expression of 5-HT2A serotonin receptors in mice genetically predisposed to depressive-like behavior[J].Molecular Biology,2014,48(6):864-869.
[8]MASSUDA R,PANIZZUTTI BS,SODRE L,etal.Brain Derived Neurotrophic Factor is Positively Correlated with Amygdala Volume in Patients with Schizophrenia[J].Biological Psychiatry,2014,75(9):250S-250S.
[9]RAY MT,WEICKERT CS,WEBSTER MJ.Decreased BDNF and TrkB mRNA expression in multiple cortical areas of patients with schizophrenia and mood disorders[J].Translational Psychiatry,2014,4:e389.
[10] BERNSTEIN H,STEINER J,GUEST PC,etal.Glial cells as key players in schizophrenia pathology:recent insights and concepts of therapy[J].Schizophr Res,2015,161(1):4-18.
[11] TUNCA Z,KIVIRCIK AKDEDE B,OZERDEM A,etal.Diverse glial cell line-derived neurotrophic factor (GDNF) support between mania and schizophrenia:A comparative study in four major psychiatric disorders[J].Eur Psychiatry,2015,30(2):198-204.
[12] FERNANDES BS,BERK M,TURCK CW,etal.Decreased peripheral brain-derived neurotrophic factor levels are a biomarker of disease activity in major psychiatric disorders:a comparative meta-analysis[J].Molecular Psychiatry,2014,19(7):749-751.
[13] EMILIANI FE,SEDLAK TW,SAWA A.Oxidative stress and schizophrenia:recent breakthroughs from an old story[J].Curr Opin Psychiatry,2014,27(3):185-190.
[14] ZHANG XY,CHEN DC,TAN YL,etal.The interplay between BDNF and oxidative stress in chronic schizophrenia[J].Psychoneuroendocrinology,2015,51:201-208.
Level changes of serum brain-derived and glial-derived neurotrophic factors in first-episode schizophrenic patients before and after treatment
XIAO Wenhuan,CHEN Kuanyu,TANG Xiaowei,LI Jin,ZHANG Xiaobin,SHA Weiwei
Department of Clinical Psychology,Wutaishan Hospital of Medical College of Yangzhou University,Yangzhou 225003,China
Objective:To determine the level changes of serum brain-derived neurotrophic factor(BDNF) and glial-derived neurotrophic factor(GDNF) in first-episode schizophrenic patients before and following treatment.Methods:The serum BDNF and GDNF levels were measured by enzyme-linked immunosorbent assay in 56 schizophrenia patients (patient group) before and following medication with quetiapine and in another 60 normal controls (normal group).Results:The patient group had lower serum BDNF and GDNF levels before medication,and significantly higher levels of the two factors after therapy as compared with the controls(P<0.05).However,the serum BDNF and GDNF levels remained no significant difference after medication compared to the normal group (P>0.05).Conclusion:Lower serum BDNF and GDNF levels were observed in the first-episode schizophrenic patients,suggesting that antipsychotic drugs may increase concentrations of these two factors.
schizophrenia;brain derived neurotrophic factor;glial derived neurotrophic factor
1002-0217(2016)05-0464-03
2015-12-07
肖文焕(1985-),女,住院医师,硕士,(电话)13665235815,(电子信箱)931610937@qq.com;
.3
A
10.3969/j.issn.1002-0217.2016.05.017
沙维伟,男,主任医师,硕士生导师,(电子信箱) sww63723@sohu.com,通信作者.
