糖尿病肾病4~5期未透析患者矿物质与骨代谢情况
2016-10-27吴育慧张道友汪裕伟杨沿浪叶寅寅
吴育慧,张道友,汪裕伟,杨沿浪,叶寅寅
(皖南医学院第一附属医院 弋矶山医院 肾内科,安徽 芜湖 241001)
·临床医学·
糖尿病肾病4~5期未透析患者矿物质与骨代谢情况
吴育慧,张道友,汪裕伟,杨沿浪,叶寅寅
(皖南医学院第一附属医院 弋矶山医院肾内科,安徽芜湖241001)
目的:探讨糖尿病肾病与非糖尿病肾病4~5期未透析患者矿物质与骨代谢的血清生化指标差异。方法:收集2014年6月~2015年6月本院肾内科慢性肾脏病4~5期未透析患者的病例资料,其中原发病确诊为糖尿病肾病组39例,非糖尿病肾病组40例,并收集同期院内健康对照组40例。分别测定3组研究对象血钙(Ca)、磷(P)、全段甲状旁腺激素(iPTH)、血清白蛋白(ALB)、碱性磷酸酶(ALP)及血红蛋白(HGB)等生化指标,进行统计分析。结果:3组研究对象年龄、男女比例、体质量、体质量指数(BMI)比较差异无统计学意义(P>0.05),两肾病组估算肾小球滤过率(eGFR)比较差异无统计学意义(P>0.05)。与对照组比较,两肾病组血清iPTH、磷、ALP升高,钙、ALB、HGB降低,差异有统计学意义(P<0.05)。两肾病组之间比较,糖尿病肾病组血清iPTH、ALB、HGB均低于非糖尿病肾病组,而血清钙高于非糖尿病肾病组,差异有统计学意义(P<0.05)。结论:糖尿病肾病患者更易并发低转运性骨病,尤其是无动力性骨病,临床工作中应早期监测糖尿病肾病矿物质与骨代谢水平。
糖尿病肾病;甲状旁腺激素;骨与骨组织;胰岛素抵抗
慢性肾脏病(chronic kidney disease,CKD)患者中广泛存在矿物质代谢紊乱和骨代谢异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)。近年来研究表明,CKD-MBD已成为慢性肾病患者生活质量低、生存期短、病死率高的重要原因。Schwartz 等[1-2]研究发现,2型糖尿病是发生骨折的独立危险因素。在糖尿病患者中,持续形成的终末期糖代谢产物(AGEs)在骨质中蓄积,增加骨密度孔隙,降低骨质,增加糖尿病肾病患者骨折风险。AGEs还可降低骨形成率[3],随着骨矿化活动减低,加之钙结合蛋白的减少,血清游离钙水平增高,可抑制iPTH的分泌,从而使糖尿病肾病患者更易发生低转运性骨病。本研究将糖尿病肾病与非糖尿病肾病患者矿物质及骨代谢血清指标进行对比分析,以了解糖尿病及高糖状态对矿物质及骨代谢的影响。
1 资料与方法
1.1一般资料根据2002年美国肾脏基金会制定的《慢性肾脏病临床实践指南》进行CKD分期,选取2014年6月~2015年6月肾内科CKD 4~5期未透析住院患者79例。糖尿病肾病组39例,男21例,女18例,依据为中国2014年版《糖尿病肾病防治专家共识》;非糖尿病肾病组40例(排除原发病是糖尿病和血糖升高者),男23例,女17例,慢性肾小球肾炎26例,高血压肾病12例,梗阻性肾病1例,多囊肾患者1例。收集同期在我院健康体检者设为对照组,共40例,男20例,女20例。样本排除标准:已行血液透析、腹膜透析和肾移植者;曾服用或正在使用糖皮质激素者;有胃肠切除术病史者;肿瘤及其他疾病累及骨病者;病历资料不完善者。
1.2标本收集方法收集所有患者一般情况,包括年龄、性别、体质量、身高等。依据估算肾小球滤过率(eGFR)进行CKD分期。抽取患者空腹全血,采用全自动生化分析仪测定血钙(Ca)、血磷(P)、碱性磷酸酶(ALP)、白蛋白(ALB)、血红蛋白(HGB);采用免疫化学发光法检测血清全段甲状旁腺激素(iPTH)。血钙应用白蛋白进行矫正,修正总血钙值(mg/dL)=总血钙(测量值mg/dL)+0.8×[4.0-血中白蛋白浓度(g/dL)]。体质量指数(BMI)=体质量(kg)/身高(m2)。eGFR通过简化MDRD 公式计算。
1.3统计学处理计数资料采用χ2检验。计量资料两组间比较采用F检验及q检验,P<0.05为差异有统计学意义。
2 结果
2.13组基本临床资料3组研究对象年龄、体质量、BMI比较差异无统计学意义。见表1。
表13组基本情况比较
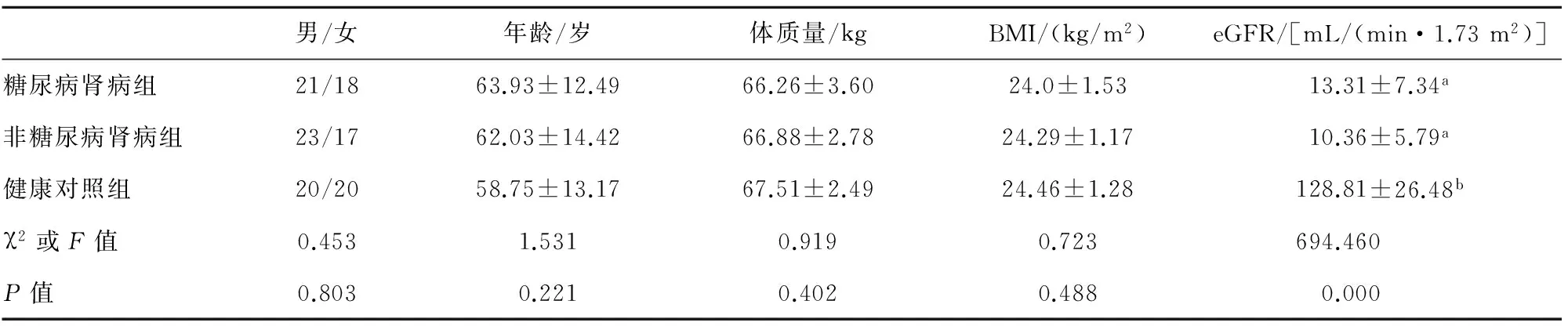
男/女年龄/岁体质量/kgBMI/(kg/m2)eGFR/[mL/(min·1.73m2)]糖尿病肾病组21/1863.93±12.4966.26±3.6024.0±1.5313.31±7.34a非糖尿病肾病组23/1762.03±14.4266.88±2.7824.29±1.1710.36±5.79a健康对照组20/2058.75±13.1767.51±2.4924.46±1.28128.81±26.48bχ2或F值0.4531.5310.9190.723694.460P值0.8030.2210.4020.4880.000
注:两两比较采用q检验,两组间字母相同表示P>0.05,两组间字母不同表示P<0.05。
2.23组矿物质与骨代谢指标分析两肾病组与对照组比较,iPTH、P、ALP升高,Ca、HGB、ALB降低,差异有统计学意义(P<0.05)。糖尿病肾病组与非糖尿病肾病组比较,血清Ca较高,iPTH、HGB、ALB较低,差异有统计学意义(P<0.05),见表2。
表23组矿物质与骨代谢指标比较

甲状旁腺激素/(pg/mL)钙/(mmol/L)磷/(mmol/L)碱性磷酸酶/(U/L)白蛋白/(g/L)血红蛋白/(g/L)糖尿病肾病组289.28±262.52a8.66±6.15a1.45±0.43a96.35±59.73a31.35±6.15a87.47±15.67a非糖尿病肾病组412.08±255.26b5.69±4.32b1.53±0.38a86.43±27.84a34.31±4.32b77.35±16.78b健康对照组39.95±6.66c0.02±2.26c0.97±0.16b73.88±16.72b39.98±2.26c127.20±16.72cF值32.16825.19630.9453.29437.531112.236P值0.0000.0000.0000.0410.0000.000
注:两两比较采用q检验,两组间字母相同表示P>0.05,两组间字母不同表示P<0.05。
3 讨论
流行病学统计发现[4],随着我国经济生活水平的提高,糖尿病的发病率逐年升高,糖尿病肾病的发病率也呈升高趋势。在糖尿病患者体内,持续高糖状态及其终末期代谢产物(AGEs)蓄积是诱发加重矿物质代谢与骨代谢紊乱的重要原因[5]。本研究结果显示,糖尿病肾病组iPTH、ALB、HGB明显低于非糖尿病肾病组,而Ca高于非糖尿病肾病组,差异有统计学意义。众所周知,临床糖尿病肾病期患者通常有大量蛋白尿,蛋白丢失增多,同时由于胰岛素抵抗及分泌不足,影响肝细胞合成蛋白能力,最终可导致血清白蛋白、血红蛋白水平下降。Wahl P等[6]研究发现,CKD患者血磷、PTH水平与24 h尿蛋白呈正相关,而活性维生素D[1,25(OH)2D3]与24 h尿蛋白呈负相关,他们认为糖尿病是导致CKD患者血磷、PTH、1,25(OH)2D3水平发生异常的重要预警。随着CKD的病情进展,肾功能渐进衰竭,肾脏排磷减少,血磷升高,钙磷沉积增多,最终可导致血清低钙。由于健存肾单位数量减少,1-α羟化酶缺乏,不能合成1,25(OH)2D3,后者可通过影响肠道钙的吸收导致血清低钙水平,但糖尿病肾病患者由于大量蛋白的丢失,血清钙结合蛋白减少,最终使得糖尿病肾病患者血清钙水平较非糖尿病肾病患者高,这与本研究结果相符。
近年来,随着对CKD-MBD发病机制、危险因素的不断探索,肾性骨病也受到越来越多的关注。无动力性骨病是一种低转运性骨病,在组织学上以成骨细胞、破骨细胞活性均下降为特征,骨质矿化和骨胶原蛋白合成能力呈等同水平下降。Carnevale V等[5,7]认为,糖尿病肾病患者更易发生无动力性骨病,他们通过分析大量文献,发现糖尿病肾病患者PTH水平较低,而PTH是一种影响骨骼重建与骨转运的重要激素,与骨特异性碱性磷酸酶(BAP)及骨组织形态学有较高的相关性[8],所以,血清PTH水平的检测可用来反映是否存在无动力性骨病。糖尿病肾病患者体内难以控制的高糖水平及胰岛素抵抗可能是其易并发无动力性骨病的原因。糖尿病肾病患者持续高糖水平,最终使得机体内糖基化终末产物(AGEs)蓄积,戊糖素[9]就是最主要的一种糖基化产物。AGEs通过干扰骨细胞分化,损害成骨细胞功能,降低骨形成率[2];同时,骨形成率的降低增加了血清钙浓度,抑制甲状旁腺组织释放PTH;而且,低骨形成率可刺激骨细胞分泌FGF23因子,后者可直接或间接抑制PTH的表达[10],最终使糖尿病肾病患者出现低iPTH水平,导致无动力性骨病的发生。此外,在2型糖尿病患者中,由于胰岛素抵抗,患者血清胰岛素水平可升高,有研究认为[11],胰岛素抵抗导致的高胰岛素状态起初对骨有保护作用,但随着病情发展,骨组织对胰岛素的敏感性降低,持续无效的胰岛素作用与AGEs的蓄积,最终结局是使大量AGEs蓄积在各种骨蛋白中,这些物质的蓄积,增加了骨密度的孔隙,但骨矿化水平下降,钙磷沉积减少,骨骼脆性增加,最终增加糖尿病肾病患者发生骨折的风险。
综上所述,由于糖尿病发病机制的复杂性,参与CKD-MBD发生发展的机制相互影响,使糖尿病肾病患者出现较低iPTH水平,但均值仍比健康成人水平高,持续高糖状态及相对低水平甲状旁腺激素的诱导作用,最终使糖尿病肾病患者发生无动力性骨病的概率增高。因此,在临床工作中,应尽早对糖尿病肾病患者矿物质与骨代谢血生化指标进行监测,以避免治疗过量而给患者带来骨折风险。
[1]SCHWARTZ AV,VITTINGHOF E,BAUER DC,etal.Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes[J].J Am Med Assoc,2011,305:2184-2192.
[2]LESLIE WD,RUBIN MR,SCHWARTZ AV,etal.Type 2 diabetes and bone[J].J Bone Min Res,2012,27:2231-2237.
[3]DIAZ VA,MAINOUS AG,CAREK PI,etal.The association of vitamin D deficiency and insufficiency with diabetic nephropathy implications for health disparities[J].Jam Board Faro Med,2009,22(5):521-527.
[4]YANG W,LU J,WENG J,etal.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362:1090-1101.
[5]CARNEVALE V,ROMAGNOLI E.Bone damage in type 2 diabetes mellitus[J].Nutrition,Metabolism & Cardiovascular Diseases,2014,24:1151-1157.
[6]WAHL P,XIE H,SCIALLA J,etal.Earlier onset and greater severity of disordered mineral metabolism in diabetic patients with chronic kidney disease[J].Diabetes Care,2012,35(5):994-1001.
[7]LOZANO D,FERNANDEZ-DE-CASTRO L,PORTAL-NUNEZ S,etal.The C-terminal fragment of parathyroid hormone-related peptide promotes bone formation in diabetic mice with low-turnover osteopaenia[J].British Journal of Pharmacology,2011,162:1424-1438.
[8]朱旅云,杨轶文.糖尿病肾病与骨代谢关系及其影响因素[J/CD].中华临床医师杂志,2015,9(4):538-542.
[9]SAITO M,MARUMO K.Collagen cross-links as a determinant of bone quality:a possible explanation of bone fragility in aging,osteoporosis,and diabetes mellitus[J].Osteoporos Int,2010,21:195e214.
[10] BEN-DOV IZ,GALITZER H,LAVI-MOSHAYOFF V,etal.The parathyroid is a target organ for FGF23 in rats[J].Clin Invest,2007,117:4003-4008.
[11] MERLOTTI D,GENNARI L,DOTTA F,etal.Mechanisms of impaird bone strength in type 1 and 2 diabetes[J].Nutr Metab Cardiovasc Dis,2010,20:683-690.
Biochemical indexes of bone metabolism and bone mineral density in patients with diabetic nephropathy at stage 4-5 without dialysis
WU Yuhui,ZHANG Daoyou,WANG Yuwei,YANG Yanlang,YE Yinyin
Department of Nephrology,The First Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
Objective: To investigate the difference of biochemical indexes of bone metabolism and bone mineral density in diabetics with chronic kidney disease(CKD,stage 4-5) free of dialysis and patients of nephropathy without diabetes mellitus.Methods:Seventy-nine CKD patients(stage 4-5) admitted to our department between June of 2014 and 2015 were included.Of the 79 cases,39 were diabetic nephropathy and 40,non-diabetic nephropathy.Another 40 healthy inpatients at the corresponding periods were recruited as controls.Patients in the three groups received biochemical determination,including serum calcium(Ca),phosphorus(P),intact paraphyroid hormone(iPTH),serum albumin(ALB),alkaline phosphatase (ALP) and hemoglobin(HGB),and results were analyzed.Results:The difference was not significant in the three groups regarding the age,gender ratio,weight and body mass index(BMI)(P>0.05),and between two groups of nephropathy concerning the estimated glomerular filtration rate(eGFR) (P>0.05).As compared with the controls,two groups of patients with nephropathy had elevated iPTH,P and ALP,yet decreased Ca,ALB and HGB(P<0.05).Patients with diabetic hephropathy had lower iPTH,ALB and HGB and higher Ca level than those without diabetes mellitus.The difference was significant(P<0.05).Conclusion:Patients with diabetic nephropathy tend to be complicated with low transport osteopathy,particularly adynamic bone disease,for which such patients are recommended to receive early determination of bone metabolism and bone mineral density.
diabetic nephropathy;parathyroid hormone;bone and bone tissue;insulin resistance
1002-0217(2016)05-0429-03
2015-11-26
吴育慧(1990-),女,2013级硕士研究生,(电话)18375333358,(电子信箱)541988853@qq.com;
.2;R 692
A
10.3969/j.issn.1002-0217.2016.05.006
张道友,男,主任医师,硕士生导师,(电子信箱)yjszhangdaoyou@sina.com,通信作者.
