His标签的水稻硅转运蛋白表达载体的构建及在巴斯德毕赤酵母中的表达
2016-10-26林红梅方长旬林瑞余何建宇林伟伟李颖哲林文雄
林红梅, 方长旬, 林瑞余, 何建宇, 林伟伟, 李颖哲, 林文雄
(1.福建农林大学生命科学学院;2.福建农林大学作物科学学院;3.福建省农业生态过程与安全监控重点实验室,福建 福州 350002)
His标签的水稻硅转运蛋白表达载体的构建及在巴斯德毕赤酵母中的表达
林红梅1,3, 方长旬1,3, 林瑞余1,3, 何建宇2,3, 林伟伟1,3, 李颖哲1,3, 林文雄1,3
(1.福建农林大学生命科学学院;2.福建农林大学作物科学学院;3.福建省农业生态过程与安全监控重点实验室,福建 福州 350002)
以水稻根系cDNA为模板,PCR扩增含His标签的Lsi1基因开放阅读框,并将该基因克隆到巴斯德毕赤酵母表达载体pPIC9k中,PCR及测序验证重组质粒pPIC9k-Lsi1目的基因序列.将验证正确的重组质粒pPIC9k-Lsi1通过SacⅠ酶切线性化,电转到毕赤酵母GS115感受态细胞中,通过MD/MM板筛选出甲醇利用快型的酵母转化子,再通过不同浓度梯度的G418平板筛选多拷贝转化菌株.提取酵母基因组,PCR验证正确的菌株即为工程菌(GS115/pPIC9k-Lsi1).用1%甲醇诱导该工程菌72 h后,收集上清,经SDS-PAGE检测到位于32.8 ku处的目的蛋白即为Si转运蛋白(OsLsi1).
巴斯德毕赤酵母; Si转运蛋白; pPIC9k; 异源表达
自1926年Sommer提出硅是水稻良好生长所需要的元素后[1],越来越多的证据表明,Si对许多作物的正常生长都是有益的,尤其是表现在减轻作物生物胁迫(病害、虫害)和非生物胁迫(营养缺乏,重金属毒害、干旱和盐胁迫)方面[2-5].高等植物吸收硅的能力与硅转运蛋白紧密相关.目前,编码硅转运蛋白的两个控制硅吸收的基因(Lsi1、Lsi2)已被识别[6-7],其中控制硅吸收基因(Lsi1)定位在水稻2号染色体上,编码的硅转运蛋白OsLsi1属于一类水通道蛋白,位于根部外皮细胞及内皮细胞两侧的质膜(凯氏带分布的位置)上.Ma等将Si转运蛋白的cDNA克隆到酵母表达载体pYES2上,进而研究Si转运蛋白在调节亚砷酸盐转运上的机制[8].外源基因整合到表达系统中进行体外表达,是研究基因功能的有利策略.目前,Lsi1在巴斯德毕赤酵母中的表达尚未报道,而且,毕赤酵母表达系统具有可诱导的强启动子(AOX1),启动外源基因高效表达,并能正确翻译和翻译后加工.此外,还具有遗传操作简单,生长迅速的特点.外源基因在巴斯德毕赤酵母表达系统中具有胞内表达和分泌表达两种方式.分泌型表达系统能对许多蛋白质产物进行分泌,便于产物提纯,在实际应用中颇受欢迎.分泌表达载体主要有:pPIC9、pPIC9k、pHIL-S1、pPICZα A,pYAM75P等.表达载体上游信号肽可以应用酵母自身信号肽, 也可以用外源蛋白的信号肽进行控制产物分泌.因此,本实验采用毕赤酵母分泌表达系统表达Si转运蛋白,并且在C端添加6个His标签用于蛋白纯化,这对于研究Si转运蛋白的功能以及Si提高高等植物的抗性等方面具有重要的意义.
1 材料与方法
1.1菌株与质粒
大肠杆菌(E.coli)Top 10感受态细胞购自TransGen Biotech公司,巴斯德毕赤酵母菌株(P.pastoris)GS115和表达载体pPIC9K由福建农林大学农业生态研究所保存.
1.2试剂及培养基
限制性内切酶EcoRⅠ、NotⅠ、SacⅠ购自Thermo Fisher Scientific公司,T4 DNA连接酶、高保真DNA聚合酶购自TransGen Biotech公司,酵母提取物,胰蛋白胨购自英国Oxoid公司,无氨基酵母氮源YNB,生物素购自美国Difco公司、G418购自北京索莱宝科技有限公司, RDB平板、MD平板、MM平板、BMGY、BMMY及YPD培养基配方参照毕赤酵母表达实验手册(Invitrogen公司).
1.3引物设计及合成
结合硅转运蛋白基因Lsi1及真核表达载体pPIC9k碱基序列,设计一对特异引物,上游引物5′-CGGAATTCATGGCCAGCAACAACTCGAGAA-3′ (EcoRⅠ),下游引物5′-TTGCGGCCGCTTAATGATGATGATGATGATGCACTTGGATGTTCTCCATCTCG-3′(NotⅠ).上游引物添加EcoRⅠ酶切位点,下游引物添加NotⅠ酶切位点及6×His标签.pPIC9k质粒通用引物5′AOX1:5′-GACTGGTTCCAATTGACAAGC-3′;3′AOX1:5′-GCAAATGGCATTCTGACATCC-3′,以上引物均由上海生工合成.
1.4方法
1.4.1重组表达载体pPIC9k-Lsi1的构建提取水稻根系总RNA,逆转录为cDNA,并以cDNA为模板,上下游引物为扩增引物,通过PCR扩增含His标签的目的基因片段.同时,从含有pPIC9k的大肠杆菌E.coliTop10菌液中提质粒pPIC9k.PCR产物及质粒pPIC9k经EcoRⅠ和NotⅠ双酶切后,通过琼脂糖凝胶电泳分离,胶回收试剂盒回收,再用T4 DNA连接酶16 ℃连接过夜.连接产物转化到大肠杆菌E.coliTop 10感受态细胞中,涂布到含kan抗生素的LB平板上,37 ℃倒置培养过夜.挑取单菌落,接种于含kan抗生素的LB液体培养基中培养,抽提质粒用于PCR及双酶切鉴定,再将PCR鉴定的阳性菌落进一步的测序验证.
1.4.2电击转化毕赤酵母GS115及重组酵母的表型鉴定利用无内毒素质粒大提试剂盒大量提取重组pPIC9k-Lsi1质粒,经SacⅠ酶切线性化后与新鲜制备的毕赤酵母感受态细胞混合,转移到预冷的电击杯进行电击转化,电击结束后加入1 mL预冷的山梨醇,混匀,吸取200 μL菌液涂布到RDB平板,30 ℃倒置培养3~5 d.同时,以线性化pPIC9k空载转化毕赤酵母作为对照.利用无菌牙签挑取RDB平板单菌落影印到MM板及MD板,30 ℃培养2~3 d,筛选出MM板生长较快的菌落接种于YPD培养基中用于重组酵母阳性转化子的鉴定.
1.4.3重组酵母的鉴定及G418筛选高拷贝酵母菌将MM板生长快型的转化子影印到含有不同G418浓度梯度的YPD平板上,依次为:0、0.5、1、2、3、4 mg·mL-1.提取MM板生长快型的重组酵母基因组DNA,以其为模板,利用上下游引物进行目的基因的扩增,经PCR验证、G418筛选的高拷贝的阳性菌株即为毕赤酵母工程菌(GS115/pPIC9k-Lsi1),即可用于目的蛋白诱导表达.
1.4.4重组毕赤酵母工程菌的诱导表达将已构建的毕赤酵母工程菌接种于5 mLYPD液体培养基,30 ℃培养24 h.再以1%接种量接种到250 mL含50 mL BMGY培养基的三角瓶中,30 ℃震荡培养至D600 nm=2~6.离心,收集菌体,再用BMMY培养基重悬菌体至D600 nm=1.0,每24 h添加甲醇到终浓度为1%进行诱导表达,诱导至72 h,离心,收集上清.
1.4.5SDS-PAGE检测重组酵母表达将已收集到的酵母上清,通过TCA-丙酮沉淀法进行蛋白浓缩,采用5%浓缩胶,12%聚丙烯酰胺凝胶进行SDS-PAGE检测.
2 结果与分析
2.1PCR扩增含His标签的Lsi1目的片段
以水稻根系cDNA为模板,通过PCR扩增一条带有His标签及EcoRⅠ和NotⅠ双酶切位点的目的片段,琼脂糖凝胶电泳检测到一条位于约915 bp的条带(图1),与预期片段大小一致.
2.2重组pPIC9k-Lsi1表达载体构建
目的基因及质粒pPIC9k经EcoRⅠ和NotⅠ双酶切、纯化后,16 ℃连接,转化到大肠杆菌E.coliTOP10,挑取抗生素平板上的单菌落进行阳性重组子筛选及鉴定.PCR结果显示,在915 bp左右的位置具有一条明显的特异条带(图2),EcoRⅠ与NotⅠ双酶切鉴定结果显示两条带,其中目的DNA片段大小为915 bp(图3),DNA测序结果显示,目的基因按照预先设计好的阅读框架插入pPIC9k载体中,未发生移码及突变,表明重组pPIC9k-Lsi1表达载体构建成功.

M:DL5000 DNA Marker;1:pPIC9k-Lsi1 digested with EcoRⅠ and NotⅠ.图3 重组质粒pPIC9k-Lsi1双酶切鉴定Fig.3 Identification of recombinant pPIC9k-Lsi1 via digestion with restriction enzymes
2.3重组毕赤酵母表达菌株的筛选与鉴定
重组质粒pPIC9k-Lsi1(5-20 μg)经SacⅠ单酶切线性化后,电转到新鲜制备的毕赤酵母感受态细胞中,涂布到RDB平板上.挑取RDB平板上单菌落影印到MM板及MD板,观察转化子生长情况,在MD板生长正常, MM板上生长较快的菌落即为甲醇利用快型(Mut+)(图4).不同浓度梯度的G418筛选结果显示,随着G418浓度的升高,重组菌落的个数越来越少,仅筛选到一个在4 g·L-1G418平板上快速生长的单菌落(图5),提取重组酵母基因组DNA,PCR扩增出的条带位于915 bp(图6),而酵母pPIC9k空载质粒基因组DNA未检测到此条带,说明目的序列已整合到毕赤酵母基因组DNA中.
2.4重组毕赤酵母工程菌的诱导表达及鉴定
将抗4 g·L-1G418阳性重组酵母菌株GS115/pPIC9k-Lsi1及GS115-pPIC9k空载菌株接种到YPD培养基,培养过夜.再转接到BMGY液体培养基,250 r·min-1,30 ℃,培养至D600 nm=2~6,离心收集菌体,重悬于BMMY培养基至D600 nm=1.0,30 ℃,250 r·min-1开始诱导表达,每隔24 h,添加100%甲醇至终浓度为1%,培养至72 h,收集上清,并用TCA-丙酮沉淀法浓缩蛋白,进行SDS-PAGE检测,电泳图片分析显示,在25~35 ku之间32.8 ku处,重组酵母菌株GS115/pPIC9k-Lsi1检测到一条带,而重组空载菌株GS115/pPIC9k未检测到相同位置的条带(图7),说明OsLsi1在毕赤酵母中成功分泌表达.
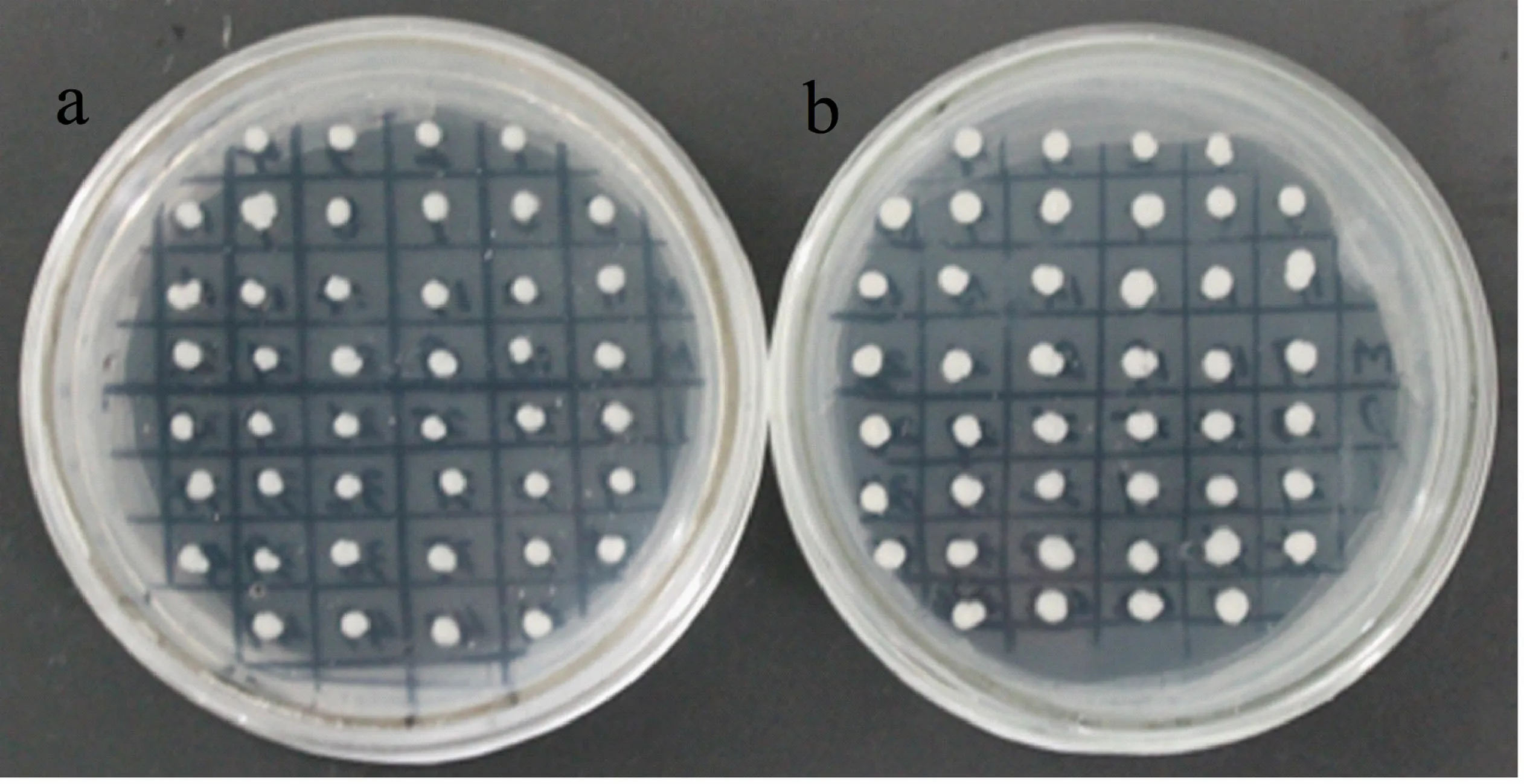
a:MM;b:MD.

a:0 g·L-1;b:0.5 g·L-1;c:1 g·L-1;

M:DL5000 DNA Marker;1:PCR product of GS115/pPIC9K-Lsi1;2
3 讨论
硅是地壳中仅次于氧的第二大元素[9],高等植物地上部硅累积量可达0.1%~10%,水稻Si累积量可达地上部干重的10%[10],高效的硅吸收累积对抵抗逆境胁迫具有重要的意义.植物根系对Si的吸收属于Si转运蛋白调节的过程[11],研究显示,Si转运蛋白(Lsi1编码的类水通道蛋白)(aquaporins)是一种膜蛋白[12],其氨基酸序列中含有6个跨膜功能域(跨膜蛋白).这种镶嵌于膜脂的独特蛋白结构,可介导细胞对水稻根中硅的转运,发挥细胞重要的生物学功能,但是由于膜蛋白本身的特性,主要是低丰度,疏水性等原因,使得膜蛋白的研究面临着巨大的挑战.
膜蛋白体外表达是研究其蛋白功能的良好手段之一.在各种表达系统中,大肠杆菌表达系统是由于遗传背景清楚,操作简单等特点,表达重组蛋白方面显示出较大的优势[13],但由于真核基因在原核表达系统中表达无法进行翻译后加工修饰,表达的重组蛋白易遭受核酸酶或蛋白酶降解,甚至在大肠杆菌系统中都无法获得表达等问题,限制了高等真核生物蛋白功能的研究,因此,基于真核表达系统表达外源基因是比较理想的选择.近年来,以酵母作为工程菌表达外源蛋白日益引起重视.酵母是低等的真核生物,不仅具有原核生物遗传背景清楚,操作简单,成本低等优点,同时又具有蛋白翻译后加工修饰等功能,表达的外源蛋白活性接近于天然蛋白质[14].而巴斯德毕赤酵母表达系统被认为是目前基因工程研究领域应用广泛的酵母表达系统,除了具有一般酵母所具有的特点外,还具有易于高密度发酵,表达基因稳定整合在宿主基因组中,能使产物有效分泌并适当糖基化,载体携带的乙醇氧化酶AOX1基因启动子,则有利于控制外源基因的表达[15].
无可置疑,利用巴斯德毕赤酵母表达系统成功表达Si转运蛋白是研究其功能的重要一步,目前,Si增强植物抵抗重金属的毒害能力已被众多学者证实[16],部分研究者将Si缓解重金属毒害的功能都归咎于Si在植物组织中的物理屏障作用.然而,Si转运蛋白不仅控制Si的吸收,同时也参与Si提高植物抗性的过程,Zhao等指出,水稻根系在接触砷酸盐时,Si转运蛋白参与调节亚砷酸盐向根外排出[17],从而缓解植物遭受重金属的毒害.由此可见,Si转运蛋白的表达有利于揭示Si提高植物抗性机制及了解植物的代谢调控规律.本实验利用毕赤酵母表达C端携带His标签(序列为6个组氨酸)的Si转运蛋白,大大便于重组蛋白的纯化.因为His标签分子量小,基本不改变蛋白质的生物结构及溶解性,而且便于纯化该重组蛋白,因为组氨酸可以特异性的结合镍离子,带有组氨酸标签的重组蛋白可以被镍柱吸附,从而达到纯化的目的[18].
尽管巴斯德毕赤酵母表达系统具有其他系统无可比拟的优点,但是在实际操作中,重组蛋白的表达仍受到各种因素的影响.毕赤酵母属于甲醇营养型酵母,能在以甲醇为唯一碳源的培养基中快速生长.其中毕赤酵母表达载体携带的乙醇氧化酶AOX(甲醇代谢途径的关键酶)基因启动子具有明显的调控功能,可调控外源基因的表达.外源基因在甲醇以外的碳源中处于非表达状态,而在培养液中加入甲醇后,外源基因即被诱导表达.不同的重组蛋白诱导表达时间各异,通过不同时间取样,SDS-PAGE检测显示,毕赤酵母表达Si转运蛋白在甲醇诱导72 h后,表达量达到最高峰.同样,甲醇添加量也是影响外源蛋白表达的重要因素之一,太高或太低,均不利于重组蛋白的表达,本实验通过不同甲醇浓度比较发现,1%甲醇浓度是最佳的诱导浓度.pH值及大规模发酵参数的确定都是诱导前必须考虑的因素之一.
本研究通过毕赤酵母表达系统将Si跨膜蛋白的基因成功克隆到pPIC9k分泌型表达载体,并在GS115酵母菌株中获得表达,笔者将进一步优化发酵条件获取大量目的蛋白,通过镍柱纯化后,用于后续Si转运蛋白(膜蛋白)功能的研究,比如,逆境胁迫下,Si转运蛋白(跨膜蛋白)与其他蛋白的相互作用,这对于研究膜蛋白间的相互作用机制,阐明Si对植物的调控机理具有重要的意义.
[1] SAVANT N K, KORND R G, DATNOFF L E, et al. Silicon nutrition and sugarcane production: A review[J]. Journal of Plant Nutrition, 1999,22(12):1 853-1 903.
[2] CAI K, GAO D, LUO S, et al. Physiological and cytological mechanisms of silicon-induced resistance in rice against blast disease[J]. Physiol Plantarum, 2008,134(2):324-333.
[3] YANG G, HU W, ZHU Z, et al. Effects of foliar spraying of silicon and phosphorus on rice (Oryzasativa) plants and their resistance to the white-backed planthopper,Sogatellafurcifera(Hemiptera: Delphacidae)[J]. Acta Entomologica Sinica, 2014,57(8):927-934.
[4] 李萍.硅提高水稻抗镉毒害的生理和分子机制[D].北京:中国农业科学院,2012.
[5] CHEN W, YAO X Q, CAI K Z, et al. Silicon alleviates drought stress of rice plants by improving plant water status, photosynthesis and mineral nutrient[J]. Absorption Biological Trace Element Research, 2011,142(1):67-76.
[6] MA J F, TAMAI K, YAMAJI N, et al. A silicon transporter in rice[J]. Nature, 2006,440,7084:688-691.
[7] MA J F, YAMAJI N, MITANI N, et al. An efflux transporter of silicon in rice[J]. Nature, 2007,448,7150:209-212.
[8] MA J F, YAMAJI N, MITANI N, et al. Transporters of arsenite in rice and their role in arsenic accumulation in rice grain[J]. Proceedings of the National Academy of Sciences, 2008,105(29):9 931-9 935.
[9] EPSTEIN E. Silicon[J]. Annual Review of Plant Biology, 1999,50(1):641-664.
[10] 梁永超,张永春,马同生.植物的硅素营养[J].土壤学进展,1993,21(3):7-14.
[11] TAMAI K, MA J F. Characterization of silicon uptake by rice roots[J]. New Phytologist, 2003,158(3):431-436.
[12] LUU D T, MAUREL C. Aquaporins in a challenging environment: molecular gears for adjusting plant water status[J]. Plant Cell Environment, 2005,28:85-96.
[13] 孙柏欣,刘长远,陈彦,等.基因表达系统研究进展[J].现代农业科技,2008(2):205-207.
[14] 郭广君,吕素芳,王荣富.外源基因表达系统的研究进展[J].科学技术与工程,2006,6(5):582-587.
[15] 魏凡华,曹瑞兵,吴润,等.巴斯德毕赤酵母表达系统研究进展[J].农业科学研究,2007,28(1):68-71.
[16] LIANG Y, SUN W, ZHU Y G, et al. Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants: a review[J]. Environmental Pollution, 2007,147(2):422-428.
[17] ZHAO F J, AGO Y, MITANI N, et al.The role of the rice aquaporin Lsi1 in arsenite efflux from roots[J]. New Phytologist, 2010,186(2):392-399.
[18] 易巧.His标签的人白细胞介素-2突变体在巴斯德毕赤酵母中的表达及纯化研究[D].重庆: 西南大学,2008.
(责任编辑:吴显达)
校园景色:
Construction of eukaryotic expression vector of OsLsi1 with His-tag and its expression inPichiapastoris
LIN Hongmei1,3, FANG Changxun1,3, LIN Ruiyu1,3, HE Jianyu2,3,LIN Weiwei1,3, LI Yingzhe1,3, LIN Wenxiong1,3
(1.College of Life Sciences, Fujian Agriculture and Forestry University; 2.College of Crop Sciences, Fujian Agriculture and Forestry University; 3.Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring,Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
To investigate the mechanism of silicon (Si) on improving stress resistance of rice, open reading frame (ORF) ofLsi1 with His-tag was amplified from cDNA of rice root, and followed by being cloned into vector pPIC9k expressed byPichiapastoris. Then the recombinant plasmid of pPIC9k-Lsi1 was verified by PCR and DNA sequencing, among which the correct recombinant plasmid was digested with restriction enzymeSacⅠ, and transformed into competent cells fromP.pastorisGS115 by electroporation. Mut+transformants were obtained by MD/MM plates, and followed by being screened with different concentrations of G418 plates to obtain transformants with multiple copies. Genome of transformants was further extracted and amplified by PCR. The results confirmed that the positive transformant was the target strain GS115/pPIC9k-Lsi1. Lastly, 1% methanol was used to induce Si transporter (OsLsi1) expression, and after 72 h the supernatant was collected and detected by SDS-PAGE. The result showed the Si transporter (OsLsi1) was detected at the molecular weight of 32.8 ku.
Pichiapastoris; OsLsi1; pPIC9k; heterogenous expression

2015-11-15
2016-06-25
国家自然科学基金项目(31271670,31300336);教育部博士点基金项目(20133515130001).
林红梅(1983-),女,博士研究生.研究方向:作物生理与分子生态.Email:linhm_2013@sina.com.通讯作者林文雄(1957-),男,教授,博士生导师,博士.研究方向:作物生理与分子生态.Email:wenxiong181@163.com.
Q945.79
A
1671-5470(2016)05-0561-06
10.13323/j.cnki.j.fafu(nat.sci.).2016.05.014
