壳聚糖精制蹄叶橐吾叶多糖及抗氧化活性研究
2016-10-26尤婷婷姜燕于润美张海悦周玲君
尤婷婷,姜燕,于润美,张海悦,周玲君
(长春工业大学化学与生命科学学院,吉林长春130012)
壳聚糖精制蹄叶橐吾叶多糖及抗氧化活性研究
尤婷婷,姜燕*,于润美,张海悦,周玲君
(长春工业大学化学与生命科学学院,吉林长春130012)
利用壳聚糖絮凝纯化作用精制蹄叶橐吾叶多糖,以多糖损失率,蛋白质去除率及脱色率为指标,通过单因素及正交试验确定最佳工艺参数:在50mL粗多糖溶液(浓度为20 mg/mL)中加入2%壳聚糖溶液1 mL,絮凝温度30℃下处理60 min,得到的精制蹄叶橐吾叶多糖(DPLF)多糖损失率为42.81%,蛋白质脱除率为85.03%,脱色率为81.74%。DPLF抗氧化活性结果表明:DPLF总抗氧化能力和还原力均随浓度增加呈上升趋势,清除DPPH自由基能力、清除超氧阴离子能力和清除羟基自由基能力的IC50值分别为0.0351、1.4591mg/mL和0.1548mg/mL。
蹄叶橐吾叶多糖;壳聚糖法;絮凝作用;抗氧化活性
蹄叶橐吾叶是吉林省延边市居民常食的一种山野菜,俗名马蹄叶[1],属菊科橐吾属植物。马蹄叶具药用价值,有祛痰、镇痛[2]和排毒[3]等功效。此外,还含有硒、锰、锌等微量元素,通过协同作用,有助于防止心血管疾病等。通过水提醇沉法得到的蹄叶橐吾叶多糖(PLF)呈深褐色,并含有大量的蛋白质等杂质,需精制。传统方法采用Sevage法[4]或三氯乙酸法[5],前者通过Sevage试剂(正己烷∶氯仿=1∶4)处理,剧烈震摇,静置分层除杂,此法需要反复操作数次;而后者反应剧烈,可能会造成多糖大量损失。
壳聚糖具有来源广泛,安全无毒副作用等特点[6],作为一种天然高分子絮凝剂[7],广泛应用于化学工业、环境处理、食品加工和医药等行业中,主要通过电中和作用[8]及吸附架桥作用[9]产生絮凝效果,进而达到澄清、除杂和纯化等目的。由于壳聚糖的脱乙酰度[10]较高时,溶解性好,发挥絮凝作用明显,本试验选用脱乙酰度为90%的壳聚糖絮凝纯化PLF,探讨最优工艺,并研究其抗氧化活性。
1材料与方法
1.1主要材料
蹄叶橐吾叶多糖(PLF):采用水提醇沉法大批量提取。取10 g溶于500 mL蒸馏水中,充分混匀,静置待用。
壳聚糖母液:准确称取2 g壳聚糖溶于100 mL 2%的冰醋酸溶液中配成2%壳聚糖溶液,现用现配。
Sevage试剂配制:按正己烷∶氯仿=1∶4(mL/mL)比例配制,混匀静置,避光保存,现用现配。
1.2主要试剂与仪器
壳聚糖(脱乙酰度为90%):南通兴成生物制品厂;二苯代苦肼自由基(DPPH):长春兰德尔科技有限公司;冰醋酸、邻二氮菲、硫酸亚铁、磷酸二氢钾、磷酸氢二钠、三氯乙酸:天津光复精细化工研究所;总抗氧化能力(T-AOC)试剂盒:南京建成生物科技有限公司。
集热式磁力搅拌器(DF-101S):金坛市科技仪器有限公司;紫外可见分光光度计(201304084):上海佑科仪器仪表有限公司;台式高速离心机(TG15GT):湖南凯达科学仪器有限公司。
1.3壳聚糖法纯化蹄叶橐吾叶多糖(PLF)
1.3.1壳聚糖法絮凝纯化蹄叶橐吾叶多糖(PLF)的单因素试验
分别对壳聚糖用量、絮凝温度及絮凝时间3个因素进行单因素试验,考察多糖损失率、蛋白质去除率及脱色率。量取50 mL PLF溶液,分别加入壳聚糖母液(1、2、3、4 mL),在一定温度下(30、40、50、60、70℃)絮凝一定时间(60、90、120、150 min和180 min),离心(5 000 r/min)10 min,取上清液加入4倍体积95%乙醇,隔夜离心,挥干乙醇并定容至100 mL,采用紫外分光光度计于490 nm处测定多糖吸光度值,于595 nm波长下测蛋白质的吸光度值,于660 nm波长下测多糖溶液的透光率,每组试验重复3次。计算蹄叶橐吾叶多糖损失率、蛋白质去除率及脱色率。

式中:N1,N2分别为壳聚糖处理前后蹄叶橐吾叶多糖的含量值,μg/mL;C1,C2分别为壳聚糖处理前后蛋白质的含量值,mg/mL;A1,A2分别为壳聚糖处理前后于660 nm处的透光率值。
1.3.2壳聚糖法絮凝纯化蹄叶橐吾叶多糖(PLF)的正交试验
根据单因素试验,以多糖的损失率、蛋白质去除率为指标,考察壳聚糖用量、絮凝时间、絮凝温度的影响。选取L9(34)正交表设计试验(表1),确定最佳试验参数。
1.3.3葡萄糖标准曲线的绘制
采用苯酚硫酸法测定多糖含量。配制浓度为1.0 mg/mL葡萄糖标准贮备液,稀释10倍制得葡萄糖标准溶液。精密移取葡标液0.1、0.2、0.4、0.6、0.8 mL和1.0 mL于10 mL具塞比色管中,加蒸馏水补至2 mL,再分别加入6%苯酚溶液1.0 mL和浓硫酸5 mL,振摇,静置5 min,沸水浴中加热15 min,取出冷却至室温,空白管调零,于490 nm处测定吸光度,绘制标准曲线(图1)。

表1 正交试验因素水平表Table 1Orthogonal test factors table

图1 葡萄糖标准曲线Fig.1Glucose standard curve
1.3.4蛋白质标准曲线的绘制
采用考马斯亮蓝法测定蛋白质含量。精密移取100 μg/mL牛血清蛋白溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL和0.7 mL于试管中,加入蒸馏水至1.0 mL,再依次加入考马斯亮蓝G-250溶液5.0 mL,摇匀,放置2 min后,蒸馏水调零,于595 nm下测定吸光度值,绘制标准曲线(图2)。

图2 蛋白质标准曲线Fig.2Protein standard curve
1.4Sevage法精制蹄叶橐吾叶多糖(PLF)的工艺流程
将Sevage试剂与PLF按4∶1(mL/mL)比例混匀,剧烈震摇1.5 h,使其充分接触,然后将其置于分液漏斗中,阴暗处静置1 h,产生明显分层后除去已变性蛋白质,收集多糖溶液,离心(4 000 r/min,10 min~15 min),冻干,得到精制蹄叶橐吾叶多糖(DPLF)。
1.5蹄叶橐吾叶多糖抗氧化活性研究
1.5.1DPPH自由基清除试验
吸取不同浓度的样品溶液2 mL,加入60 μmol/L的二苯代苦肼自由基(DPPH)甲醇溶液3mL,摇匀,阴暗处室温放置30 min,采用紫外可见分光光度计在517nm处测定吸光度值,测A2值。步骤同上,样品与甲醇混匀,测A0值;DPPH甲醇溶液与甲醇混匀,测A1值。

1.5.2超氧阴离子清除试验
采用邻苯三酚自氧化法[11]测定DPLF对超氧阴离子的清除能力。
1.5.3羟基自由基清除试验
采用邻二氮菲法[12]测定DPLF对羟基自由基的清除能力。
1.5.4还原力测定
采用铁氰化钾法[13]测定DPLF的还原能力。
1.5.5总抗氧化能力测定
采用总抗氧化能力(T-AOC)试剂盒法,按照操作说明书测定DPLF的总抗氧化能力。
2结果与分析
2.1壳聚糖法絮凝纯化蹄叶橐吾多糖的单因素试验结果分析
通过单因素试验考察壳聚糖用量、絮凝时间及絮凝温度对PLF中多糖损失率、蛋白质去除率及脱色率的影响趋势。结果见图3。

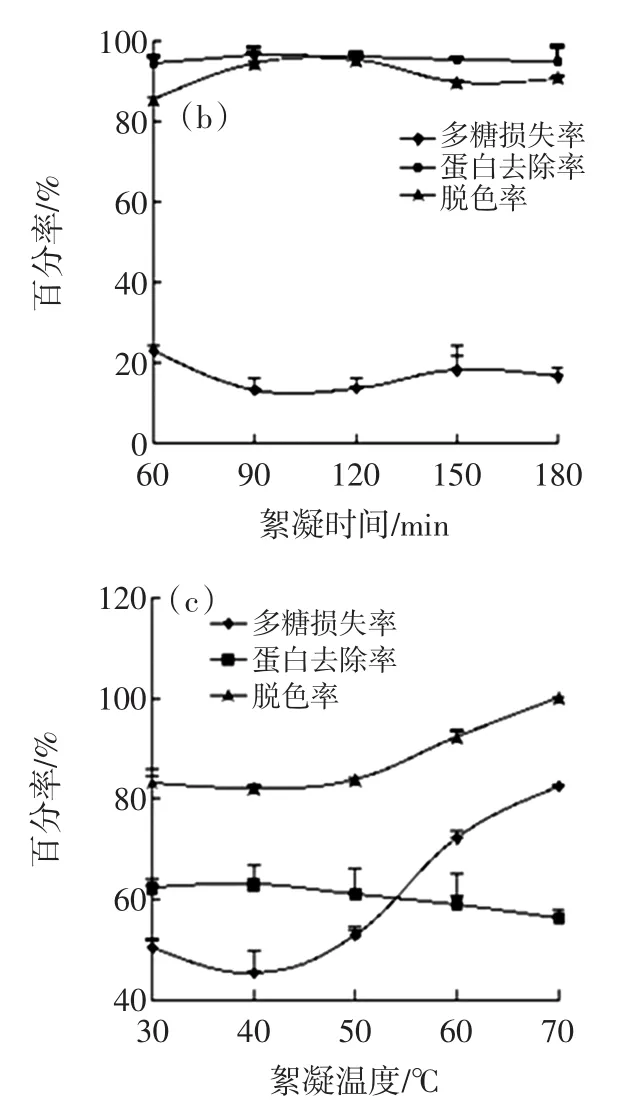
图3 壳聚糖用量(a)、絮凝时间(b)及絮凝温度(c)对PLF多糖损失率、蛋白质去除率及脱色率的影响Fig3.Effect of chitosan addition(a),flocculation duration(b)and flocculation temperature(c)on polysaccharide loss rate,removal rate of protein and decolorization rate of PLF
如图3(a)所示,壳聚糖添加量逐渐增加,PLF的多糖损失率不断增加,当添加量为2 mL时,多糖损失率已超过80%,进一步增加壳聚糖用量,PLF中蛋白质去除率及脱色率也呈现缓慢下降趋势,这可能是由于壳聚糖的增加使溶液达到过饱和状态,阻碍絮凝作用[14]。絮凝时间对三者的影响见图3(b),絮凝时间的增加,PLF中的多糖损失率、蛋白质脱除率及脱色率均在小范围内波动,影响不大。絮凝温度对三者影响的趋势图(图3(c))表明絮凝温度的改变对PLF中蛋白质去除率影响较小,当温度超过40℃时,脱色率及多糖损失率均呈上升趋势。
2.2壳聚糖法絮凝纯化蹄叶橐吾多糖的正交试验结果分析
壳聚糖絮凝纯化蹄叶橐吾叶片多糖的正交试验结果见表2。

表2 壳聚糖絮凝纯化蹄叶橐吾叶片多糖的正交试验结果Table 2Orthogonal test results of purifying PLF by chitosan flocculation method
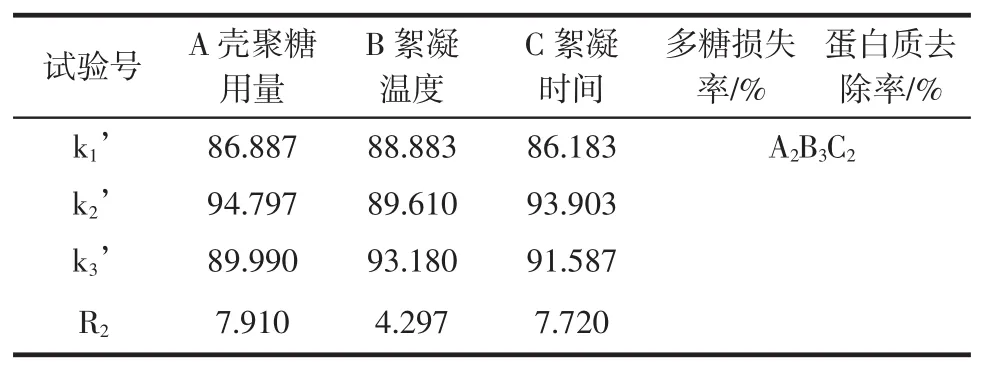
续表2壳聚糖絮凝纯化蹄叶橐吾叶片多糖的正交试验结果Continue table 2Orthogonal test results of purifying PLF by chitosan flocculation method
通过正交试验优化得到A1B1C1(以多糖损失率为考察指标)和A2B3C2(以蛋白质去除率为考察指标)两组最优组合,其中壳聚糖用量为主要影响因素。从正交试验数据可知A2B3C2条件下蛋白质去除率最高,但本试验中主要目标物质为多糖成分,应在多糖损失率处于一定范围内时综合考察最优参数。故选择A1B1C1组和A2B3C2组进行验证试验,每组平行3次。验证试验结果见表3。
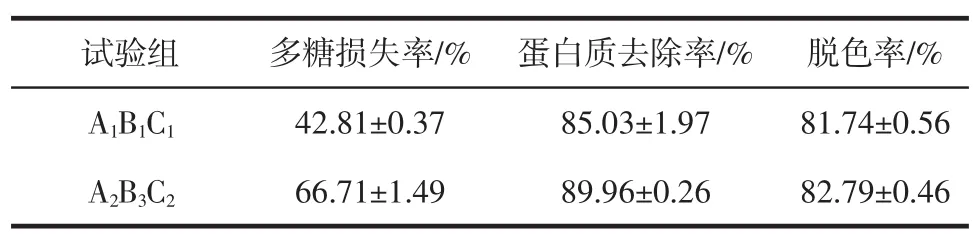
表3 验证试验Table 3Verification test
通过验证试验,两种条件下蛋白质去除率变化4.93%,脱色率变化1.05%,A2B3C2组多糖损失率较高,较A1B1C1组增加23.90%,综合3个指标评价,确定试验组A1B1C1为最优工艺参数:在50 mL粗多糖溶液(c=20 mg/mL)中,加入2%壳聚糖溶液1 mL,絮凝温度30℃下处理60 min,得到DPLF,多糖损失率为42.81%,蛋白质脱除率为85.03%,脱色率为81.74%。
2.3壳聚糖法与Sevage法精制效果对比
壳聚糖法与Sevage法对PLF精制效果对比如表4所示。

表4 壳聚糖法和Sevage法精制效果对比Table 4Comparison chitosan method with Sevage method for refining effect
由表4可知,Sevage法处理后的多糖损失率较壳聚糖法略小,而脱除蛋白质和色素的比例相较于壳聚糖法分别低了30.80%和46.49%,综合考察,当操作次数为1次,壳聚糖法优于Sevage法。
2.4抗氧化试验结果分析
考察DPLF对DPPH自由基,超氧阴离子和羟基自由基的清除能力如图4~图6所示。

图4 DPLF对DPPH自由基的清除能力曲线图Fig.4Scavenging activity of DPLF on DPPH free radicals

图5 DPLF对超氧阴离子的清除能力曲线图Fig.5Scavenging activity of DPLF on superoxide anion radicals

图6 DPLF对羟基自由基的清除能力曲线图Fig.6Scavenging activity of DPLF on hydroxyl free radicals
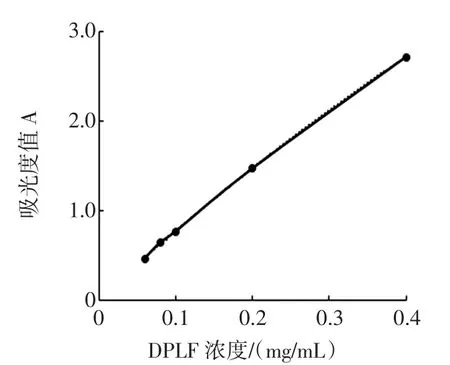
图7 DPLF还原能力曲线图Fig.7Curves of DPLF on reducing power
DPPH是一种比较稳定的脂性自由基,DPLF浓度升高,对DPPH自由基的清除能力不断增强(图4),当浓度为0.06 mg/mL时,清除率为78.94%,由二次多项式拟合得到IC50值约为0.035 1 mg/mL。由图5可以看出DPLF对超氧阴离子自由基清除率趋势,当DPLF浓度小于1.5 mg/mL时,曲线呈缓慢上升趋势,继续增加浓度,对超氧阴离子自由基清除率的增加趋势明显,由二次多项式拟合得到IC50值约为1.459 1 mg/mL。DPLF对羟基自由基的清除能力见图6,当浓度为0.1 mg/mL时,DPLF对其清除能力达到33.06%,由二次多项式拟合得到IC50值约为0.154 8 mg/mL。通过DPLF还原能力曲线图可以看出,随着浓度的增加,还原能力逐渐增强,浓度为0.4 mg/mL时,DPLF的吸光度值为2.719,DPLF具有较强的还原能力。
采用总抗氧化能力试剂盒法研究了不同浓度DPLF溶液总抗氧化能力,结果如图8所示。

图8 DPLF与抗坏血酸总抗氧化能力曲线图Fig.8Curves of DPLF and ascorbic acid on antioxidant capacity
DPLF浓度5 mg/mL~10 mg/mL范围时,曲线呈明显上升趋势,当DPLF浓度为5 mg/mL时,其抗氧化能力为29.97 mL,弱于同等条件下的抗坏血酸溶液,当浓度为10 mg/mL时,其抗氧化能力达到64.63单位/mL,较浓度为5 mg/mL时提高了53.6%,进一步增加浓度,其抗氧化能力提高18.8%。李恃圻等[15]采用相同方法在相同浓度下测得的薏仁多糖总抗氧化能力仅为3.1单位/mL。
3结论
本文通过单因素试验结合正交试验优化了壳聚糖法絮凝纯化蹄叶橐吾叶多糖(PLF)的工艺,确定了最佳条件为在浓度为20 mg/mL的PLF溶液50 mL中,加入2%壳聚糖溶液1 mL,在30℃条件下絮凝60 min,此条件下处理的PLF损失率为42.81%,蛋白质脱除率为85.03%,脱色率为81.74%。对处理后PLF的抗氧化活性予以研究,随着浓度的增加,DPLF对DPPH自由基、超氧阴离子自由基、羟基自由基、还原力和总抗氧化能力均呈上升趋势,采用二次多项式拟合得到DPLF清除DPPH自由基能力、清除超氧阴离子自由基能力和清除羟基自由基能力的IC50值分别为0.035 1、 1.459 1 mg/mL和0.154 8 mg/mL,为其他多糖的抗氧化活性对比分析及其生物活性进一步研究提供参考。机体的抗氧化能力可能会直接或间接影响身体各项机能调节,因此选择抗氧化活性较高的生物活性成分并应用于食品和医药领域中具有更大价值。
[1]秘效媛.蹄叶橐吾化学成分与抗氧化作用研究[D].延边:延边大学,2010:2-4
[2]李茁,樊变兰,袁文学,等.山紫菀与紫苑镇咳祛痰作用的实验研究[J].沈阳药学院学报,1987,4(2):136
[3]Yu K H,Lee S Y,Yang H M,et al.Effects of fermented aqueous extracts from leaves of Ligularia fischeri on hepatotoxicity in D-galactosamine-induced rats[J].The FASEB Journal,2014,28(1):647-673
[4]Yang W F,Wang Y,Li X P,et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J].Carbohydrate Polymer,2015,117:1021-1027
[5]Xu Y,Cao H,Gu S S,et al.Extraction Process Optimization of Endo-Polysaccharides from Phellinus igniarius[J].Advanced Materials Research,2014,881-883:347-350
[6]Yang Z,Li H.J,Yan H,et al.Evaluation of a novel chitosan-based flocculant with high flocculation performance,low toxicity and good floc properties[J].Journal of Hazardous Materials,2014,276:480-488
[7]Nilsen-Nygaard J,Strand S.P,Vårum K.M,et al.Chitosan:Gels and Interfacial Properties[J].Polymers,2015,7(3):552-579
[8]Qin L,Liu J,Li G S,et al.Removal of Tannic Acid by Chitosan and N-Hydroxypropyl Trimethyl Ammonium Chloride Chitosan:Flocculation Mechanism and Performance[J].Journal of Dispersion Science and Technology,2015,36(5):695-702.
[9]Li J,Song X.Y,Pan J F,et al.Adsorption and flocculation of bentonite by chitosan with varying degree of deacetylation and molecular weight[J].International Journal of Biological Macromolecules,2013,62:4-12
[10]Zeng D F.Mechanism Study on Flocculating Organnic Pollutants by Chitosan with Different Molecular in Wastewater[J].American Journal of Engineering Research,2013,2(5):91-95
[11]王文侠,李馥邑,徐伟丽,等.挤压处理提高玉米麸皮水溶性多糖含量及其抗氧化活性研究[J].食品工业科技,2014,35(11):107-111,116
[12]许春平,赵珊珊,杨琛琛,等.烤烟多糖的硫酸化修饰及抗氧化活性[J].烟草科技,2015,48(7):41-45
[13]Sukito A,Tachibana S.Isolation of Hyperoside and Isoquercitrin from Camellia sasanqua as Antioxidant Agents[J].Pakistan Journal of Biological Sciences,2014,17(8):999-1006
[14]姜燕,尤婷婷,柳佳齐,等.壳聚糖絮凝作用在中药和果酒澄清的应用[J].食品工业,2015,36(2):228-231
[15]李恃圻,赵晓蕾,张思强,等.薏苡多糖的提取及其抗氧化性[J].食品研究与开发,2012(11):84-86
Flocculation and Purification of the Polysaccharide of Ligularia fischeri Leaves and Its Antioxide Activity
YOU Ting-ting,JIANG Yan*,YU Run-mei,ZHANG Hai-yue,ZHOU Ling-jun
(College of Chemical and Life Science,Changchun University of Technology,Changchun130012,Jilin,China)
The polysaccharide of Ligularia fischeri(PLF)were purified using chitosan method.Indicates for polysaccharide loss rate,removal rate of protein and decolorization rate,the optimum parameter were determined that chitosan solution(concentration of 2%)of 1 mL was added,and pured 60 min under the temperature of 30℃in PLF solution of 50 mL(concentration of 20 mg/mL)to obtain the DPLF.Polysaccharide loss rate was 42.81%,removal rate of protein was 85.03%and decolorization rate was 81.74%.Antioxide activity of DPLF showed that total antioxide activity and reducing power appeared the trend of rising with concentration increasing.IC50values of scavenging activity of DPLF on DPPH free radicals,superoxide anion radicals and hydroxyl free radicals is 0.035 1,1.459 1 mg/mL and 0.154 8 mg/mL,respectively.
polysaccharide of Ligularia fischeri;chitosan method;flocculation;antioxide activity
10.3969/j.issn.1005-6521.2016.19.007
2015-11-24
尤婷婷(1989—),女(汉),硕士研究生,研究方向:天然产物研发。
姜燕(1983—),女(汉),讲师,博士研究生,研究方向:食品新资源开发与利用。
